Криоаблация опухоли предстательной железы
Говоров А.В 1 ., Шадеркин И. А 2 .
Введение.
Криотерапия представляет собой аблацию ткани путём локального воздействия очень низкой температуры. Более полное определение этого термина предложено B.Patel и соавт., которые считают криоаблацию процессом локального замораживания и девитализации тканей, позволяющим прицельно создать зону некроза необходимой формы и размера для деструкции поражённой ткани и прилежащих по краю здоровых клеток.
В 1996 г. Американская ассоциация урологов признала криоаблацию простаты методом терапии локализованного рака предстательной железы (РПЖ) и перестала считать данную методику экспериментальной. В Guidelines Европейской ассоциации урологов 2009 года криоаблация простаты также отнесена к альтернативным методам лечения злокачественной опухоли предстательной железы. В настоящее время криоаблация простаты представляет собой минимально инвазивный, высоко эффективный способ лечения РПЖ. Лечение проводится стационарно и амбулаторно, сопровождается небольшим количеством осложнений и позволяет добиться высокой безрецидивной выживаемости.
Первая криоаблация простаты была проведена в 1966 г. M.Gonder и соавт. с использованием одного трансуретрального датчика (иглы) 26 Fr для лечения инфравезикальной обструкции, вызванной увеличением предстательной железы. В 1974 г. M.Megalli и соавт. впервые применили введение криоиглы через прокол кожи промежности.
Криобиология.
Основными факторами, обеспечивающими действие на ткань низкой температуры, являются механический и осмотический эффекты, а также клеточная гипоксия. При криоаблации происходят денатурация белка вследствие дегидратации, переход внутриклеточной воды в экстрацеллюлярное пространство и разрыв клеточных мембран из-за образования кристаллов льда. Создаётся токсическая концентрация внутриклеточных компонентов; после быстрого замораживания и медленного оттаивания наступают термальный шок, сосудистый стаз, усиливается апоптоз.
Основными параметрами, коррелирующими с вероятностью гибели опухолевых клеток, являются быстрота замораживания ткани и достигнутая минимальная температура (табл. 1).
Таблица 1. Факторы, влияющие на гибель опухолевых клеток при криотерапии.
- Длительность замораживания
- Минимальная достигнутая температура
- Число циклов замораживания и оттаивания
- Скорость замораживания
- Скорость оттаивания
Оборудование, используемое для криоаблации простаты.
Для проведения криоаблации простаты необходимо наличие бипланового ректального ультразвукового датчика, обеспечивающего визуализацию предстательной железы как в продольной, так и в поперечной проекциях, а также пошагового стабилизирующего устройства. В аппаратах для криотерапии в качестве криогена используется аргон (под очень высоким давлением). Гелий применяется для размораживания ткани.
Рисунок 1. Иглы для криоаблации простаты; сверху вниз – 1-го, 2-го и 3-го поколений. Самая нижняя – игла для биопсии простаты 18 G.
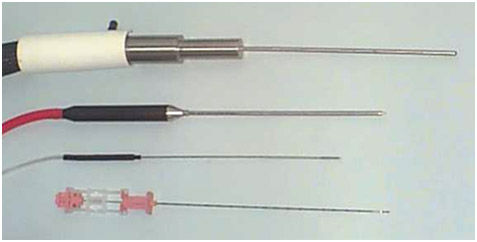
Для предохранения слизистой оболочки мочеиспускательного канала и наружного сфинктера от замораживания используется катетер, согревающий уретру. При помощи водяной помпы по двойному внутреннему просвету катетера в ходе всей операции циркулирует физиологический раствор, подогретый до +38-43°С со скоростью около 550 мл/мин.
Отбор пациентов для криотерапии.
Криоаблация простаты применяется как в виде первичного лечения, так и в качестве сальважной терапии.
Криотерапия простаты показана больным с локализованным РПЖ высокой степени злокачественности и / или опухолью большого объёма в том случае, если пациенты не заинтересованы в сохранении эректильной функции.
Также довольно часто криоблация используется в следующих случаях:
- у больных с клинически местнораспространённым раком (стадия Т3);
- у больных с такой стадией заболевания или степенью злокачественности опухоли, которые с высокой вероятностью будут прогрессировать без лечения (сумма баллов по Глисону ≥6, стадия >Т1а);
- у больных, не являющихся кандидатами для выполнения радикальной простатэктомии (страдающих болезнью Крона, язвенным колитом, выраженной кардиальной патологией, ожирением (вес более 150 кг));
- у больных неметастатическим раком простаты с ожидаемой продолжительностью жизни более 10 лет, которые, ознакомившись со всеми существующими методами лечения, предпочли именно криотерапию.
При помощи криоаблации предстательной железы также возможно лечение рецидива рака после лучевой терапии (дистанционной или внутритканевой).
Описано также применение криоаблации простаты при лечении местных рецидивов опухоли после радикальной простатэктомии, а также у больных местнораспространённым раком, получающих гормональную терапию, для предупреждения инфравезикальной обструкции или геморрагических осложнений.
Если объём предстательной железы превышает 50 см3, пациентам нередко назначается неоадъювантная гормонотерапия. По данным M.Ghafar и соавт., трехмесячная неоадъювантная андрогенная депривация приводит к увеличению расстояния между основанием простаты и стенкой прямой кишки, что важно для минимизации числа осложнений лечения.
Оптимальный срок для криоаблации простаты у больных с ростом уровня ПСА после лучевой терапии до конца не определён. Как правило, криотерапия не проводится раньше, чем через 18 месяцев после лучевой терапии, а решение о её начале принимается после выполнения контрольной биопсии предстательной железы.
Противопоказания к криоаблации простаты.
Относительные противопоказания к проведению криодеструкции предстательной железы аналогичны таковым при брахитерапии и включают:
- предшествующую трансуретральную резекцию (ТУР) простаты с наличием выраженного ТУР-дефекта ткани;
- наличие выраженной инфравезикальной обструкции;
- большой объём простаты;
- брюшно-промежностную резекцию прямой кишки по поводу рака в анамнезе, ректальный стеноз или другие серьёзные заболевания прямой кишки.
Перенесенная трансуретральная резекция простаты значительно повышает риск образования струпа слизистой уретры и острой задержки мочи. Инфравезикальная обструкция значительной степени выраженности также крайне затрудняет восстановление мочеиспускания после криотерапии.
Особенности техники проведения криоаблации простаты.
Перед лечением проводятся бритьё промежности и подготовка кишечника путём приёма слабительных или выполнения очистительной клизмы. Под общей или спинальной анестезией пациент укладывается в положение для операций на промежности. В мочевой пузырь по уретре устанавливается катетер Фоли, который пережимают. При помощи пошагового стабилизирующего устройства фиксируется насадка для проведения игл, после чего биплановый ультразвуковой датчик вводится в прямую кишку.
Для минимизации риска формирования в последующем уретроректальной фистулы возможно введение путём инъекции 15-30 мл физиологического раствора между стенкой прямой кишки и задней поверхностью простаты.
После определения размеров простаты криоиглы 17 G вводятся в ткань предстательной железы под ультразвуковым контролем – всего 12-20 игл на расстоянии 1 см одна от другой и от уретры (рис. 2, 3). Иглы располагаются в три или четыре горизонтальных ряда, в зависимости от высоты простаты при поперечном сканировании.
Далее в зависимости от опыта и техники врача вводятся до 5 температурных датчиков: в зону наружного сфинктера, сосудисто-нервных пучков, в средний отдел простаты и зону фасции Денонвилье.
Рисунок 2. Схематическое изображение размещения игл в простате в поперечной проекции.
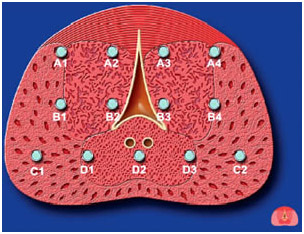
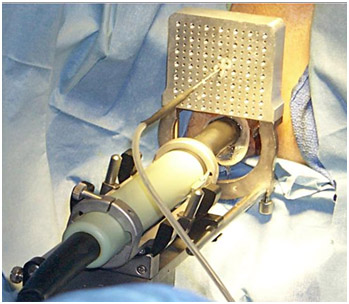
Рисунок 3. В прямую кишку введен ректальный ультразвуковой датчик, через насадку введена одна криоигла.
Температурные сенсоры в зоне наружного сфинктера и фасции Денонвилье используются для снижения риска недержания мочи или формирования уретроректальной фистулы, в то время как датчики в зоне обоих сосудисто-нервных пучков и в среднем отделе простаты позволяют контролировать адекватное замораживание ткани и достижение температуры -40°С. При этом температура в зоне наружного сфинктера, как правило, не опускается ниже 15 °С.
После введения всех игл выполняется фиброцистоскопия, чтобы убедиться, что нет перфорации стенки уретры. При необходимости осуществляется репозиция игл. Через рабочий канал фиброскопа в мочевой пузырь устанавливают проводник-струну, по которому проводится специальный катетер, согревающий уретру.
После завершения циклов замораживания и оттаивания простаты, катетер, согревающий уретру, оставляется в мочеиспускательном канале ещё на 5 минут. После извлечения криоигл осуществляется механическое давление на промежность в течение 2-5 минут, а затем накладывается повязка и устанавливается катетер Фоли.
В послеоперационном периоде назначаются пероральные фторхинолоны, обезболивающие препараты и альфа-блокаторы (не менее, чем на 1 месяц). Удаление уретрального катетера проводится через 7 дней. Если у пациента имеется цистостомическая дренажная трубка, начинают её пережимать также через 5-7 дней и удаляют после восстановления самостоятельного мочеиспускания при небольшом количестве остаточной мочи.
Дальнейшее наблюдение за пациентами осуществляется путём определения уровня общего ПСА крови каждые 3 месяца. Сразу после лечения уровень ПСА значительно возрастает вследствие клеточного некроза и поступления в кровь интрацеллюлярного ПСА.
Считается, что для достижения надира ПСА требуется 3 месяца. Вместе с тем, нет единого мнения об оптимальном надире ПСА после криотерапии. Наиболее часто используется пороговое значение 0,4 нг/мл.
Некоторые авторы выполняют трансректальную биопсию простаты всем пациентам через 6-12 месяцев после криоаблации простаты.
Осложнения криоаблации простаты.
В табл. 2 представлены осложнения криоаблации простаты при использовании оборудования 2 и 3 поколения. Очевидно, что за последние годы морбидность криотерапии значительно снизилась, особенно в сравнении с результатами лечения на оборудовании 1 поколения.
Таблица 2. Осложнения криоаблации простаты в зависимости от вида лечения (первичное или сальважное) и используемого оборудования.
Осложнения
Оборудование
2 поколения
(%)
Оборудование
3 поколения
(%)
Оборудование
2 поколения
(%)
Оборудование
3 поколения
(%)
Отхождение струпа уретры
*Включая ургентное недержание мочи при использовании оборудования 3 поколения.
По данным B.Donnelly, через 3 года после криодеструкции простаты у 47% пациентов эректильная функция восстанавливается (из них у 13% - без специального лечения). Авторы предположили, что данный феномен обусловлен постепенной регенерацией нервов, которые при криоаблации не пересекаются. Несмотря на эти наблюдения, считается, что криоаблация простаты не показана пациентам, заинтересованным в сохранении эректильной функции.
Отхождение струпа слизистой уретры встречается в 3,8% - 23% наблюдений. Лечение данного осложнения заключается в антибиотикотерапии и обеспечении адекватного отведения мочи. Иногда катетеризация способствует спонтанному отхождению некротических тканей, но в ряде случаев с этой целью применяется ТУРП.
Стриктура уретры или стеноз шейки мочевого пузыря редко формируются после криоаблации простаты при правильном использовании согревающего уретру катетера. При их образовании рекомендуется трансуретральная инцизия шейки мочевого пузыря и/или простаты, а также баллонная дилатация.
Ректоуретральная фистула ранее чаще имела место у больных с рецидивом рака после лучевой терапии (0 – 3%), тогда как за последние 4 – 5 лет данное осложнение практически не встречается, что обусловлено высоким качеством изображения современных ультразвуковых аппаратов, а также рутинным размещением температурных датчиков в области передней стенки прямой кишки. Диагностика уретроректальной фистулы помимо характерной клинической картины (пневматурия или выделение мочи из прямой кишки) включает в себя микционную уретрографию и компьютерную томографию, позволяющую определить локализацию свища.
Заключение.
16-19 марта 2010 года в ФГУ НИИ урологии Росмедтехнологий (Москва) и на кафедре урологии МГМСУ (на базе ГКБ № 50 г. Москвы) проведены первые в России операции криоаблации при раке предстательной железы и опухолях почек. Все операции прошли успешно, без осложнений. Теперь в двух ведущих клиниках России появилась еще одна возможность предложить своим пациентам малоинвазивный и высокотехнологичный метод лечения рака предстательной железы.
Криоаблация простаты – важная информация:
Криотерапия не уступает радикальному удалению простаты в эффективности, но имеет меньший риск осложнений
Криотерапия рекомендована пациентам с серьезными сопутствующими (сердечными, неврологическими) заболеваниями. При низком или умеренном онкологическом риске). В случае повторного возникновения после удаления опухоли другим способом.
В сравнении с простатэктомией в шесть раз меньше риск недержания мочи
Эффективность криоаблации при низком онкологическом риске достигает 90%, при среднем – 75%, при высоком – 60%.
- большой объем предстательной железы (>50 см3);
- затрудненное мочеиспускание (при урофлоуметрии максимальная скорость мочеиспускания Q max импотенцию , она не рекомендована мужчинам, заинтересованным в сохранении эректильной функции.
Опухоль замораживают до состояния ледяного шара, происходит криодеструкция – разрушение опухолевой ткани
Сначала опухолевый очаг охлаждают Аргоном до -40-60 °C, затем восстанавливают естественную температуру Гелием. В результате смены температур происходит разрыв мембран раковых клеток. Газ вводят через криозонды – специальные иглы диаметром с вязальную спицу. Ультразвуковой контроль помогает сформировать ледяной шар без вреда прилегающим органам.
В течение полуторачасовой операции заморозку выполняют дважды. В завершение устанавливают уретральный катетер, который удаляют на 5 день. На следующий день после восстановления мочеиспускания пациента выписывают домой без ограничений в физической нагрузке.
Операция минимально инвазивная, занимает меньше времени, чем традиционное пособие и легче переносится пациентами.
Развитие технологии отражает общую тенденцию: современная хирургия все меньше использует скальпель. Поле битвы с болезнью смещается на клеточный уровень.
Суть технологии заключается в разрыве клеточной мембраны опухолевой клетки путем резкой смены температур. Первоначально в опухолевый очаг вводится аргон, который охлаждает опухоль до -40-60 градусов по Цельсию. И затем вторым этапом в опухолевый очаг вводится газ Гелий, который восстанавливает температуру до естественных цифр.
На сегодняшний день криоабляцию возможно выполнять при открытой и лапаросокпической операции, выделив опухолевый узел. И наименее инвазивно - чрескожным доступом. Говоря о чрескожной криоабляции, чаще всего эта операция выполняется с помощью КТ-навигации. Также возможно выполнение под контролем МРТ. Мы в клинике урологии Первого МГМУ используем наиболее технически простой, доступный, не сопровождающийся лучевой нагрузкой метод, это метод ультразвуковой навигации.
Важно отметить два момента. Первый - это визуализация. Второй - локализация. Не любая опухоль может быть подвержена чрескожной криоабляции. Опухоли среднего и нижнего сегмента почки, располагающиеся по задней или латеральной поверхности.
Криоабалация относится к высокотехнологичным операциям, поэтому несколько слов о техническом обеспечении. Мы используем для ультразвуковой навигации аппарат экспертного класса BK medical Flex Focus 800. Непосредственно криомашина третьего поколения The SeedNet Gold. На рынке уже представлены криомашины четвертого поколения, однако этот аппарат полностью отвечает всем предъявляемым к нему требованиям. Сами газы - аргон и гелий. И криозонды. В настоящее время на российском рынке представлено два вида зондов, с помощью которых газ вводится в опухолевый очаг. Это - IceSeed и IceRod. Их отличие друг от друга только в диаметре формирования ледяного шара.
Наше исследование было выполнено в 2015 году, это наш первый опыт. За этот период было прооперировано 8 пациентов. Семь пациентов были со стадией Т1а, размер опухоли около 3 см. Одна пациентка - со стадией Т1б, размер опухоли составлял около 4,5 см. Пять операций были выполнены под спинальной анестезией, три крайне - под местной анестезией.
Всем пациентам на доопреационном этапе выполняли ультразвуковое исследование почек в сочетании с допплерографией. Хорошо визуализировали опухолевый узел. Также выполняли мультиспиральую томографию почек с констатированием. Все образования активно накапливали контрастный препарат. Градиент накопления составлял около 200 ед Хамсвильда.
Всем пациентам выполняли компьютерное 3D-моделирование патологического процесса. Определяли распространение опухолевого процесса, соотношение внутренней поверхности опухолевого узла к элементам чашечной-лоханочной системы.
Сама операция включала в себя несколько этапов. Первый этап - это ультразвуковая навигация и планирование. Второй этап - пункционная биопсия. Отмечу, что в этом вопросе нет единого мнения среди мировых специалистов. В ряде центров биопсию предпочитают выполнять заранее, недели за две-три до предполагаемой операции. И идти на нее уже морфологически верифицированным диагнозом. Иные доверяют заключениям лучевых методик и выполняют биопсию интраоперационно.
Тестирование зондов - это стандартная процедура, предусмотренная протоколом. Прежде чем ввести зонд в опухолевый очаг, мы должны быть уверены в его функционировании. исправности.
Непосредственно сам этап проведения зонда. Здесь мы видим очень хорошую визуализацию, установку зондов. В среднем, на установку одного зонда уходит от 5 до 8 минут.
Далее ультразвуковой мониторинг повторно. Проверка установки криозондов. На схеме представлено каким образом зоны должны быть установлены, чтобы полностью покрывать опухоль зоной ледяного шара. И дальше следует два процесса. Сам процесс абляции, он включает два цикла заморозки, которые следуют друг за другом. Каждый по 10 минут. Заключаются они в подаче Аргона в опухолевый очаг. Далее следуют два цикла пассивной разморозки. Каждый по 6 минут, заключающиеся в том, что мы перестаем подавать Аргон и выжидаем. И два цикла активной разморозки. Они идут по две минуты и заключаются в том, что мы начинаем подавать Гелий в опухолевый очаг.
Все операции прошли без особенностей. Послеоперационный период тоже был спокойным. пациентов, которых оперировали под местной анестезией, мы отпускали на следующий день. А пациентов, которые были прооперированы под спинальной анестезией, спустя 2-3 дня после операции, учитывая особенности анестизиолгоического пособия.
Всем пациентам спустя 6 месяцев после операции мы выполняли контрольную мультиспиральную компьютерную томографию почек с контрастированием. У 7 пациентов со стадией Т1а с размером опухоли 3 см, мы отмечали в зоне первоначального расположения опухоли трубцовые изменения, в этой зоне отсутствовало накопление контрастного вещества либо градиент не превышал его 10 ед Хамсфильда. У одной пациентки со стадией Т1б и размером опухоли 4,5 см произошло уменьшение опухоли на 8 мм. Однако в опухоли оставался очаг до 1,5 см, который активно накапливал контрастный препарат. Этой пациентке в дальнейшем мы выполнили лапароскопическую резекцию, которая прошла у нас без каких-либо технических особенностей.
Подводя итог нашему исследования, мы пришли к выводу, что чрескожная криоабляция - это безопасный и эффективный метод лечения больных с опухолью почки размером до 3 см, с локализацией в среднем или нижнем сегменте почке по задней или латеральной поверхности.
Уважаемые коллеги, наша современная наука достигла высоте волшебства. С детства мы помним замечательную историю Кая - мальчика с ледяным сердцем. Однако в нашем случае наука - добрая фея, а процесс замораживания позволяет предотвратить прогрессирование онкологии и продлить человеку жизнь.
Я уверен, что за малоинвазимными методикам, они безусловно являются трендом современной медицины, путь их освоения непростой, но безусловно за ними будущее.
Стоимость криоабляции в Москве – бесплатно по федеральной квоте
Сложностей с получением квоты, обычно, не возникает. Наши врачи помогут заполнить необходимые документы. Цена криоабляции рака простаты по каналу платных медицинских услуг, в том числе для иностранных граждан, составит 400 тыс рублей.
Криоабляция простаты доступна в двух медицинских центрах России
В нашей клинике криотерапию выполняет кандидат медицинских наук Дмитрий Еникеев . Он прошел стажировку в клинике Барзилай (Израиль) под руководством одного из основателей метода профессора Шмуэля Цитрона.
Криоабляция простаты – это локальное замораживание участка предстательной железы, пораженного раковой опухолью. В результате уничтожаются злокачественные образования и тонкий слой прилежащих здоровых клеток. Это позволяет предупредить рецидивы и дальнейшее распространение онкопроцесса.
При криотерапии под воздействием охлаждающего газа аргона образуется лед сначала в межклеточном пространстве, а затем и внутри клеток. Дальнейшая подача восстанавливающего нормальную температуру гелия вызывает резкое колебание температуры внутри тканей. При этом нарушается поступление питательных веществ, разрываются клеточные мембраны. В результате возникает необратимое повреждение и смерть раковых клеток.
Криоабляция является альтернативным и малоинвазивным методом терапии рака простаты. Эффективно помогает при лечении пациентов, у которых:
- риск развития метастазов низкий;
- противопоказано полное удаление простаты;
- обнаружена нечувствительность к лучевой и брахитерапии при имплантации радиоактивных элементов;
- возникли побочные эффекты радиоционной терапии;
- в молодом возрасте развилось раковое новообразование небольшого размера и дискретного типа, то есть состоящее из нескольких фрагментов.
Риск появления временной или постоянной импотенции составляет не менее 80%. Поэтому такой метод лечения является приоритетным для пациентов, не заинтересованных в сохранении сексуальной функции.
Криоабляцию опухоли предстательной железы выполняют в стационаре или поликлинике. Процедура длится полтора часа. С целью предупреждения переохлаждения мочеиспускательного канала и мочевого пузыря перед началом устанавливают уретральный катетер. Во время процедуры обеспечивают постоянную циркуляцию теплого физраствора.

Задайте вопрос врачу-урологу!

Под общим или регионарным обезболиванием аргон и гелий поочередно подают по специальным зондам, введенным через промежность. Трансректальный ультразвуковой контроль используют для прицельного создания ледяного шара. Также он позволяет предупредить повреждение прилежащих органов и наблюдать за изменениями в тканях. Воздействие низких температур проводят несколько раз. После окончания воздействия катетер оставляют в уретре на срок от 5 дней до 3 недель. Это обеспечивает своевременное выделение мочи даже в случае развития отека простаты.
Если у вас остались вопросы, задайте их в комментариях (это абсолютно анонимно и бесплатно). По возможности, я или другие посетители сайта помогут вам.

Криоаблация
Криоаблация — представляет собой аблацию ткани путём локального воздействия очень низкой температуры. Это технология прицельного замораживания опухолевых тканей при раке предстательной железы, следствием чего является гибель злокачественных образований. Криоаблация по эффективности сравнима с хирургическим вмешательством, однако является менее инвазивной и травматичной, имеет малое количество противопоказаний и осложнений.
Рак предстательной железы
Как проходит процедура:
Обычно криоаблация предстательной железы проводится под общей или спинномозговой анестезией .

введение специального ультразвукового датчика в прямую кишку с последующей установкой крио-игл в предстательную железу

замораживание пораженного участка

некроз — гибель опухоли
- Подходит для пожилых больных, и больных с тяжелой сопутствующей патологией
- Возможно повторное проведение криоаблации простаты
- Малоинвазивная методика
- Минимальное количество побочных эффектов
- Минимум болевых ощущений после операции
- Короткий послеоперационный период реабилитации
- Отсутствие разрезов
Рак почки

Процедура может проводиться как под общей, так и под местной анестезией.
Под ультразвуковым контролем в опухоль почки вводится крио-иглы, через которые подается охлаждающий газ (аргон), который замораживает опухоль до -40С.
Длительность каждого из двух циклов замораживания составляет 5 минут.
Кровообращение в этом участке прекращается.
Далее происходит процесс оттаивания, который может быть пассивным (10 мин.) или активным — с помощью гелия (3-5 мин). Резкий перепад температуры вызывает внутри клеток разрыв мембран.
Следствием этого становится коагуляционный некроз.

- Размер опухоли не более 4 см
- Отсутствие региональных и отдаленных метастазов
- Множественные опухоли почек
- Рецидив опухоли почки
- Единственная почка или снижение функции почек
- Двустороннее поражение
Также криоабляции могут подлежать пациенты с высоким риском хирургического вмешательства, либо пациенты, которые временно воздерживаются от открытого оперативного вмешательства.
Криоабляция может рассматриваться в качестве паллиативного, циторедуктивного лечения при метастатических опухолях почек.

-
Содержимое:
- Что такое криотерапия рака простаты
- Как делают криогенную операцию при раке простаты
- Тотальная криотерапия
- Сальважная криодеструкция
- Фокальная криоабляция
- Чего ожидать после криотерапии
- Какие осложнения после криодеструкции возможны
- Где в России делают криохирургию рака простаты
Среди современных способов лечения онкологии выгодно выделяется криоабляция рака простаты. Криотерапия была разработана в конце 90-хх годов прошлого столетия. Результаты исследований показали, что эффективность лечения холодом, по своей эффективности немногим уступает радиотерапии, при этом организму пациента наносится гораздо меньший вред, чем при облучении.
Что такое криотерапия рака простаты
Криодеструкция изначально использовалась в косметических целях. Способ позволял практически безболезненно удалить бородавки, папилломы и наросты. Высокая эффективность криогенного метода привела к тому, что его стали использовать в смежных направлениях: гинекологии, дерматологии. В конце двадцатого века прошли первые испытания криотерапии рака предстательной железы.
Суть криотерапии или лечения холодом заключается в том, что на поврежденный участок подается хладагент: жидкий азот или газообразный аргон. Злокачественная опухоль разрушается от резкого охлаждения. Метод малоинвазивный, не требует долгого восстановления пациента и имеет незначительные побочные эффекты.
Стоимость криотерапии зависит от места проведения манипуляции. В Израиле процедура обойдется порядка 10000-15000$. В РФ выполнить криоабляцию можно за 300000-600000 руб.
Как делают криогенную операцию при онкологии простаты

Все существующие методы криотерапии имеют общий принцип выполнения. Место развития злокачественной опухоли резко охлаждают. Методики подведения хладагента и результаты воздействия на ткани отличаются.
Перед проведением процедуры определяют степень агрессивности раковой опухоли. Проводятся гистологические тесты по Глисону. Показание к криогенной операции – начальные стадии злокачественного новообразования с максимальной оценкой не более 6 баллов, степень Т1 и Т2.
Абсолютные противопоказания: большой объем предстательной железы, метастазирование в соседние органы и ткани. На поздних стадиях рака криодеструкция малоэффективна.
На данный момент, в зависимости от оказываемого эффекта, методы криотерапии делят на три класса:
- Тотальную.
- Сальважную (спасительную).
- Фокальную.
Каждый метод имеет показания к применению.
Криохирургический метод лечения рака предстательной железы с глобальным замораживанием тканей. Максимально агрессивный способ. Используется для мультифокальных образований в тех случаях, когда онкология не имеет строгой локализации.
Тотальная криогенная заморозка выполняется через криозонд. Контроль над манипуляциями выполняется с помощью ТРУЗИ. Датчик вводят через анальное отверстие. Криотерапия тотальным методом используется редко.
Наиболее бережный способ проведения криогенной операции. Заморозка локализирована. Глубина промерзания несколько мм. При заморозке не затрагиваются здоровые ткани, как в случае с тотальной криотерапией.
Сальважная криодеструкция требует использования высокотехнологичного криохирургического оборудования, а также высокой квалификации хирурга. Процедура проводится при первых признаках онкологического заболевания.
Чаще всего при раке предстательной железы применяется фокальная криоабляция. Метод заключается в ведении в место пораженной ткани нескольких игл, соединенных с криозондом. По трубкам циркулирует хладагент, что приводит к резкому охлаждению стержней. Происходит охлаждение тканей, с которыми контактируют иглы.
Фокальная криогенная абляция при раке предстательной железы, общепринятая операция с использованием заморозки тканей. Процедура подходит для локализованного рака, без наличия метастаз. Все манипуляции занимают около 2 часов.
Чего ожидать после криотерапии
После проведения криодеструкции наблюдаются существенные улучшения в самочувствии пациента. Нормализуется мочеиспускание и эректильная дисфункция. По степени эффективности, криотерапию классифицируют как средне положительную.
Высокая эффективность заморозки раковых клеток наблюдается при удалении небольших опухолевых образований со строгой локализацией процесса. Отдаленные результаты криотерапии зависят от стадии ракового заболевания и степени его агрессивности. Рецидив опухолевого процесса возможен через 1-5 лет после проведения операции.

Как и любая другая операция на предстательной железе, криохирургия имеет свои недостатки и ожидаемые осложнения. Перед проведением процедуры, лечащий врач обсудит с пациентом вероятные побочные эффекты:
- Отечность тканей в области введения игл.
- Гематурия – носит временный характер и обычно проходит через 2-3 дня.
- Недержание мочи – наблюдается не чаще чем в 5-8% случаев.
- Нарушение потенции – восстановление эректильной функции длится от нескольких месяцев до полугода.
- Ослабление иммунитета – ткани после заморозки удаляются естественным способом, во время мочеиспускания. Некоторые фрагменты попадают в кровь, что приводит к общему сепсису организма. После криотерапии обязательно назначается иммунотерапия, направленная на быстрое восстановление пациента и предотвращение заражения по причине инфекционного фактора.
Как и после хирургической абляции, возможно прогрессирование рака простаты после криотерапии. Как правило, рецидив наблюдается при запущенных стадиях заболевания или наличии необнаруженных метастаз.

Отзывы о криохирургии рака простаты показывают эффективность данного малоинвазивного метода в лечении небольших злокачественных образований. Пациент быстро восстанавливается, что немаловажно при терапии онкологии.
Недостаток криохирургии, обуславливающий небольшое распространение в отечественных условиях, высокая стоимость операции и используемого оборудования. Ожидать повсеместного внедрения метода в ближайшем будущем не стоит.
Читайте также:

