Костные саркомы клинические рекомендации
СМОТРЕТЬ ДРУГИЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Год утверждения 2020
Профессиональные ассоциации
- Общероссийский национальный союз "Ассоциация онкологов России"
- Автономная некоммерческая организация "Восточно-Европейская группа по изучению сарком"
- Общероссийская общественная организация "Российское общество клинической онкологии"
Одобрено Научно-практическим Советом Минздрава РФ
Оглавление
1. Краткая информация
- опухоль неэпителиального происхождения;
- развивается из клеток производных мезодермы.
- лучевая терапия,
- иммунодефицит,
- болезнь Педжета,
- болезнь Олье,
- доброкачественные опухоли кости.
У большинства пациентов этиологические факторы не выявляются.
Первичные ЗНО костей 0,001 % от всех впервые выявленных ЗНО.
В РФ заболеваемость 1,03 случая на 100 тыс. населения, как в других странах.
Злокачественное новообразование костей и суставных хрящей (C40):
C40.0 – лопатки и длинных костей верхней конечности;
C40.1 – коротких костей верхней конечности;
C40.2 – длинных костей нижней конечности;
C40.3 – коротких костей нижней конечности;
C40.8 – поражение костей и суставных хрящей конечностей, выходящее за пределы одной и более вышеуказанных локализаций;
C40.9 – костей и суставных хрящей конечности неуточненной локализации.
Злокачественное новообразование костей и суставных хрящей других и неуточненных локализаций (C41):
C41.0 – костей черепа и лица;
C41.1 – нижней челюсти;
C41.2 – позвоночного столба;
C41.3 – ребер, грудины и ключицы;
C41.4 – костей таза, крестца и копчика;
C41.8 – поражение костей и суставных хрящей, выходящее за пределы одной и более вышеуказанных локализаций;
C41.9 – костей и суставных хрящей неуточненное.
Стадирование
По TNM AJCC/UICC 7-го пересмотра (2010 г.) (TNM AJCC/UICC 8-го пересмотра (2019 г.)
Клиника определенной стадийности и зависит от локализации опухоли.
Первый симптом - боль.
Возможна субфебрильная температура.
Быстрая прогрессия - через 2–3 месяца припухлость и гиперемия кожи.
Нарушение функции при локализации вблизи сустава.
Без лечения через 5–7 месяцев - выраженная прогрессирующая интоксикация:
- слабость,
- резкое похудание,
- повышение температуры тела,
- лейкоцитоз,
- увеличенная СОЭ.
2. Диагностика
- доброкачественные опухоли,
- метастатические опухоли костей,
- остеомиелит,
- артрит,
- дегенеративно-дистрофические изменения суставов.
Критерии установления диагноза:
- анализ жалоб пациента,
- осмотр,
- данные инструментальных и лабораторных исследований,
- морфологическая верификация.
Сбор анамнеза, в том числе наследственного и онкологического.
У пациентов старше 40 лет необходимо исключить метастатическое поражение костей.
- начало развития заболевания,
- наличие болевого синдрома,
- изменения функции.
Оценить влияние клиники на качество жизни пациента.
- Оценить состояние области пораженной кости.
- Проверить функцию сустава.
- Исключить риск патологического перелома.
- Пальпация периферических лимфоузлов.
- общий̆ (клинический) мочи,
- общий̆ (клинический) крови,
- общетерапевтический биохимический крови,
- коагулограмма.
Рентгенография пораженной области и близлежащего сустава в двух проекциях с линейкой.
МРТ пораженного отдела скелета.
КТ органов грудной клетки.
При подозрении на диссеминацию:
- сцинтиграфия с 99Tc,
- УЗИ брюшной полости, забрюшинного пространства, периферических лимфоузлов.
При саркоме Юинга - биопсия костного мозга с миелограммой.
Для верификации - биопсия опухоли.
Стандарты биопсии опухоли:
1. Под контролем сертифицированного онкоортопеда или радиолога.
2. Морфологическая верификация проводится в крупных онкологических ЛПУ.
3. Предпочтительна толстоигольная биопсия.
4. Открытый доступ возможен:
1) при анатомически трудной локализации;
2) при отрицательной трепанобиопсии, скудности и малой информативности материала.
5. При открытом доступе выбирается стандартный оперативный̆ доступ.
6. Тактика разрабатывается совместно с хирургом-онкоортопедом, химиотерапевтом и, при необходимости, лучевым терапевтом.
7. Неправильный выбор места биопсии или нарушение техники ограничивает выбор способа мышечной пластики, повышает риск рецидива.
- биопсийного материала с целью верификации;
- операционного материала с целью оценки краев резекции, лечебного патоморфоза.
3. Лечение
1. Паростальная (юкстакортикальная) остеосаркома – только радикальное хирургическое лечение.
2. Периостальная остеосаркома:
- радикальное хирургическое лечение,
- консервативного лечения для перевода в резектабельное состояние.
3. Остеосаркома высокой степени злокачественности – комбинированное лечение:
- блок неоадъювантной терапии,
- радикальное хирургическое лечение,
- блок адъювантной терапии.
Органосохранные операции:
- при возможности отступа не менее 3–5 см,
- при условии отсутствия опухоли в костномозговом канале оставшейся части кости.
Главное условие операбельности - радикальность и абластичность удаления опухоли.
Ампутация или экзартикуляция конечности:
- обширное первично-множественное распространение,
- вовлечение магистрального сосудисто-нервного пучка, исключающее реконструктивно -пластический этап,
- прогрессирование на фоне предоперационной̆ терапии,
- отказ пациента от органосохранной операции,
- жизненные показания к экстренной хирургии – распад, кровотечение.
Использование модульных систем эндопротезирования.
Виды реконструктивных операций в объеме эндопротезирования:
1) стандартные первичные операции у взрослых;
2) стандартные первичные операции у детей̆ и подростков;
3) эндопротезирование редких анатомических зон;
4) ревизионное эндопротезирование.
Требования к эндопротезу для взрослых:
1) модульность конструкции;
2) максимальная надежность и ремонтопригодность;
3) универсальность компонентов;
4) максимальный срок службы;
5) стабильная фиксация;
6) хороший̆ функциональный̆ результат;
7) короткий̆ срок изготовления.
Особенности эндопротеза для детей̆ и подростков:
1) бесцементный способ фиксации;
2) раздвижной̆ механизм (инвазивный̆ и неинвазивный).
Реэндопротезирование проводят в медорганизациях с подготовленной командой онкологов, травматологов-ортопедов и хирургов с практическим опытом.
Индивидуальные системы протезирования, персонализированный инструментарий, прототипы операций при опухоли:
- костей таза,
- позвоночника,
- других сложных анатомических локализаций.
При использовании онкологических эндопротезов применяют длительные режимы профилактической антибиотикотерапии:
1) цефалоспорины 3 поколения + клиндомицин или ванкомицин 10 - 14 дней в стационаре,
2) пероральные в последующие 4 недели.
Факторы риска инфицирования:
- высокая злокачественность,
- глубокое расположение опухоли,
- иммунносупрессия от неоадъювантной ХТ,
- предшествующая ЛТ,
- неадекватная антибиотикопрофилактика,
- прием кортикостероидов,
- большая раневая поверхность,
- продолжительная операция (более 3 часов),
- кровопотеря более 0,5 объема циркулирующей крови,
- вторичное заживление раны,
- некрозы кожи,
- дополнительные хирургические манипуляции,
- сопутствующие заболевания (анемия, сахарный диабет и т.д.)
Калечащие операции (ампутации, экзартикуляции и др.):
- при технической невозможности радикальности R0 (R1),
- по витальным показаниям.
Хирургическая тактика не имеет принципиальных различий.
Комбинированное лечение при локализованной форме:
- предоперационная ХТ,
- операция,
- послеоперационная ХТ.
Предоперационная ХТ:
- улучшает результаты лечения;
- позволяет оценку in vivoактивности химиопрепаратов;
- облегчает выполнение операции;
- 3–4 цикла;
- при некрозе опухоли от 90% вероятность увеличения безрецидивной и общей̆ выживаемости.
При локализованной опухоли - 4 цикла AP:
- Доксорубицин 90 мг/м2 в/в, 96-часовая инфузия;
- Цисплатин 120 мг/м 2 в/в или в/а инфузия 1 день каждые 4 недели.
Послеоперационная ХТ - режим определяется по степени лекарственного патоморфоза:
- при III–IV степени - повторение АР, также 4 цикла,
- при меньшей степени некроза - 12 месяцев альтернирующих схем:
- 4 цикла HDI: ифосфамид 2 г/м 2 (с месной) в/в инфузия 1–7 дни, через 3 недели, КСФ 8–16 дни;
- через 3 недели – HD MTX: метотрексат 12 г/м 2 в/в (с кальция фолинатом), 4 введения с интервалом в 14 дней только для молодых пациентов.
- при явной низкой эффективности 2 курсов - смена на 2 курса высокодозного ифосфамида или высокие дозы метотрексата с кальция фолинатом;
- при крайне низкой степени лечебного патоморфоза возможны 2 курса гемцитабин 900мг/м 2 в 1, 8 дни + доцетаксел 100мг/м 2 8 день, филграстим 5 мкг/кг п/к 9-19 дни.
При нерезектабельной остеосаркоме 2-я и последующие линии ХТ:
- GemTax - Гемцитабин 900мг/м 2 в 1, 8 дни + Доцетаксел 100мг/м 2 в/в 8 день + филграстим 5мкг/кг п/к 9-19 дни, 2 цикла
- Сорафениб 400 мг х 2 раза в день, 3 месяца
Протонная терапия:
- самостоятельный метод при саркомах костей черепа, позвоночника, орбиты,
- после хирургического лечения при R1 и R2 краях резекции.
- не отличается от общепринятой̆ классификации для первичных опухолей̆ костей̆,
- при внекостной форме - как опухоли мягких тканей̆.
Радикальная операция - наилучший локальный контроль.
Локальное лечение из-за высокой̆ частоты метастазирования в кости и костный̆ мозг дополняется комбинированной̆ ХТ:
- 4 - 6 циклов индукционной̆ ХТ за 12–24 недель,
- после локального лечения 12 месяцев 6-10 циклов ХТ с 3-недельным интервалом.
Комбинация из 4-6 наиболее активных цитостатиков:
- доксорубицин,
- циклофосфамид,
- ифосфамид,
- винкристин,
- дактиномицин,
- этопозид.
Лучевая терапия:
- при невозможности радикального оперативного вмешательства,
- при недостаточном лечебном патоморфозе (более 10 % жизнеспособных клеток).
- СОД 40–45 Гр при микроскопических остаточных опухолях,
- СОД 50–60 Гр при макроскопических изменениях,
- дистанционная 3-D и интенсивно модулированная (IMRT) РОД = 2–2,5 Гр, СОД = 60 Гр с ХТ при отказе или нерадикальной операции,
- при метастазах в легкие – крупнопольная РОД = 2 Гр, СОД = 20 Гр.
ХТ - чередование режимов IE и VAC каждые 3–4 недели:
- IE:
- этопозид 100 мг/м 2 в/в 1–5 дни;
- ифосфамид 1,8 г/м 2 в/в инфузия 1–5 дни с месной.
- VAC:
- винкристин 2 мг/м 2 в/в 1 день;
- доксорубицин 75 мг/м 2 в/в 1 день;
- циклофосфамид 1200 мг/м 2 в/в 1 день.
При раннем прогрессировании - менее 1 года после завершения комбинированного лечения ХТ:
- циклофосфамид 250 мг/м 2 в/в 1–5 дни; топотекан 0,75 мг/м 2 в/в 1–5 дни; каждые 3–4 недели;
- этопозид 100 мг/м 2 в/в 1–5 дни; топотекан 0,75 мг/м 2 в/в 1–5 дни; каждые 3–4 недели;
- иринотекан 250 мг/м 2 в/в 6 день; темозоломид 150 мг/м 2 внутрь или в/в 1–5 дни; каждые 4 недели;
- GemTax: гемцитабин 900 мг/м 2 1, 8 дни 90-минутная инфузия; доцетаксел 100 мг/м 2 8день; КСФ п/к 9–19 дни.
Рекомендуется комбинированная ХТ в сочетании с возможным оперативным лечением.
Выбор 2-й линии ХТ зависит от первичного лечения:
- высокие дозы метотрексата, ифосфамид,
- не доказана эффективность этопозида,
- при метастазах через 6 месяцев после лечения, возможно повторение режима химиотерапии.
При метастатическом поражении легких возможно оперативное вмешательство с ХТ:
- метастазэктомия,
- повторная торакотомия.
ХТ при метастазах в легких:
- те же режимы в такой же последовательности, как при лечении первичной опухоли,
- 3-я и более линий терапии - сорафениб (нексавар) 400 мг 2 раза в сутки ежедневно.
При рецидиве саркомы Юинга - паллиативная терапия, за исключением ограниченного рецидива после длительного свободного периода.
Единственный прогностический фактор при рецидиве - время его возникновения, лучшие результаты при свободном периоде больше 2 лет.
- такая же стандартизированная ХТ, как при локализованной саркоме,
- остеогенной саркомы в легкие повышение выживаемости после резекции остаточных метастазов только после эффективной̆ ХТ и тотальной ЛТ легкого,
- в кости или костный̆ мозг 5-летняя выживаемость менее 20%,
- в кости показана ЛТ,
- интенсивные и высокодозные режимы ХТ с аутотрансплантацией костного мозга оправданы у отдельных пациентов,
- при местно-распространенной и/или метастатической гигантоклеточной опухоли кости таргетная терапия деносумабом 120мг п/к 1, 8, 15 и 28 дни, далее через 28 дней.
Остеосаркома — это злокачественная опухоль, произрастающая из клеток костной ткани. Это очень редкий вид новообразования, большинство видов которого характеризуется быстрым ростом и агрессивным течением. Остеосаркому не надо путать с метастазами в кости, поскольку те являются результатом распространения новообразований, первично развившихся в других органах.
Главной особенностью остеосаркомы является то, что ее клетки способны производить костную ткань, но она является незрелой. Из нее не может образовываться основное костное вещество, и в ней не происходит кальцинирования. Эта черта отличает остеосаркомы от других злокачественных и доброкачественных опухолей костей.
- Причины возникновения
- Симптомы
- Диагностика
- Лечение
- Осложнения
- Прогноз при остеосаркомах
- Профилактика
Что касается эпидемиологии, то частота заболеваемости составляет 10-26 случаев на 1 млн человек в год. Чаще страдает мужское население. Соотношение мужчин и женщин 1,36/1. Имеется два пика подъема заболеваемости. Первый приходится на возраст 10-14 лет, а второй на возраст старше 40 лет. Очень редко новообразование регистрируется у детей младше 5 лет.
Остеосаркомы плоских костей чаще наблюдаются у людей старшей возрастной группы. При этом, в основном страдает кость нижней челюсти и кости таза. Могут поражаться и позвонки.
Причины возникновения
Причины возникновения саркомы костей пока изучены недостаточно. Раньше считалось, что спровоцировать развитие опухоли могут травмы, но на сегодняшний день многие врачи склоняются к мнению, что травма только способствует скорейшему росту уже образованной остеосаркомы, но не ее возникновению.
Возможными предрасполагающими факторами являются:
- Воздействие ионизирующего излучения. Например, прохождение лучевой терапии. В этом случае остеосаркомы могут развиваться через несколько лет от момента завершения терапии.
- Наличие инородных тел в кости — импланты, ортопедические конструкции.
- Есть данные, что риски развития остеосаркомы выше у детей, у которых масса тела при рождении превышала 4046г, а также у людей с ростом выше среднего.
- Наличие генетических синдромов — врожденная ретинобластома, синдром Ротмунда-Томпсона, синдром Ли-Фраумени и др.
- Наличие доброкачественных новообразований костей — фиброзная дисплазия, костные кисты.
Однако чаще всего опухоль возникает de novo, без каких-либо предрасполагающих факторов.
Симптомы
Нарастание симптоматики при саркоме происходит постепенно. Сначала пациенты отмечают боль в области локализации опухоли. Она может быть сходна с болью при артритах, миозитах и миалгиях, усиливается по ночам или после физических нагрузок. Но в отличие от вышеперечисленных заболеваний, она со временем не ослабевает, а наоборот, усиливается.
Постепенно размеры новообразования увеличиваются, и в процесс вовлекаются мягкие ткани. Над местом поражения возникает припухлость. Кожа в этой области может быть покрасневшей, с усиленным венозным рисунком. В запущенных стадиях на ней образуются изъязвления.
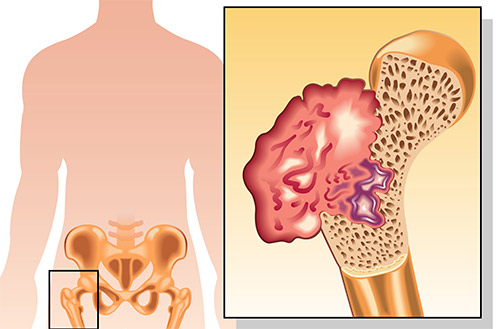
При возрастании объема поражения, развиваются ограничения объема движения в пораженном сегменте скелета. Кроме того, может образовываться внутрисуставной выпот, патологические переломы (которые возникают без существенных нагрузок). На последних стадиях заболевания присоединяется потеря массы тела, вплоть до кахексии.
Диагностика
Для диагностики остеосаркомы используются следующие методы обследования:
- Клинический осмотр и сбор анамнеза.
- Рентгенологические исследования.
- Лабораторные исследования.
Во время осмотра доктор обращает внимание на локализацию боли, на изменения конфигурации пораженного сегмента, кожной гиперемии и венозного рисунка. Также отмечают наличие или отсутствие ограничений движения в пораженных конечностях.
Далее пациента направляют на рентгенологическое исследование. Это может быть простой рентген или компьютерная томография. В пользу остеосаркомы говорят следующие признаки:
С помощью компьютерной томографии более точно оценивают размеры новообразования, место его локализации и вовлеченность соседних мягких тканей (мышц, сухожилий, синовиальных оболочек). Также с ее помощью можно обнаружить скип-метастазы — близкорасположенные или прыгающие метастазы. С помощью МРТ оценивается вовлеченность в процесс костного мозга.

Для окончательной постановки диагноза и определения вида остеосаркомы, необходимо провести морфологическое исследование. Для этого с помощью биопсии берут небольшой фрагмент новообразования и направляют его в лабораторию для специального исследования.
Также в рамках диагностики осуществляют поиск отдаленных метастазов. Как правило, ограничиваются костями, легкими и головным мозгом, поскольку изолированное метастазирвание в другие органы встречается крайне редко. Для обследования легких и головного мозга проводят спиральную КТ. Для поиска метастазов в других костях скелета применяют сцинтиграфию или ПЭТ.
Лечение
Как правило, остеосаркома требует комплексного подхода в лечении, и с этой целью применяется хирургия, химиотерапия и лучевая терапия. Хирургия, как самостоятельный метод лечения, применяется только при низкозлокачественных остеосаркомах, например, при хондросаркоме. Если же опухоль высокозлокачественная, помимо операции потребуется длительный курс химиотерапии, чтобы уничтожить возможные метастазы и предотвратить их возникновение.
Как мы уже говорили, операция является краеугольным камнем в лечении большинства видов остеосарком. Стандартом является радикальное иссечение опухоли в пределах здоровых тканей. С этой целью проводят вмешательства в следующих объемах:
- Ампутации — полное удаление пораженной конечности или фрагмента скелета.
- Экзартикуляция — вычленение пораженного сегмента по линии суставной щели. При этом опиливание костей не производится.
- Органосохраняющие вмешательства.
На сегодняшний день, по возможности, стараются провести органосохраняющее лечение, например, удаление пораженного фрагмента кости с последующей костной пластикой или эндопротезированием сустава. В качестве костной пластики используются либо синтетические материалы, либо собственные костные ткани пациента, взятые из другого отдела скелета. При лечении детей используют растущие эндопротезы.
К сожалению, органосохраняющее лечение удается провести не всегда. Противопоказанием к нему служат:
- Наличие патологических переломов с сильным болевым синдромом.
- Обширное вовлечение в процесс мягких тканей, в частности мышц.
- Распад опухоли.
- Вовлечение в процесс кровеносных сосудов и нервных стволов на большом протяжении.
- Кровотечение из вовлеченных кровеносных сосудов.
- Наличие инфекционных осложнений со стороны опухоли.
- Наличие массивного обсеменения злокачественными клетками костных тканей.
- Выраженные симптомы интоксикации.
При обнаружении одиночных метастазов, также проводят их хирургическое удаление. Если имеются одиночные очаги в легких, проводят торакотомию, однако во время операции требуется тщательная пальпация обоих легких, поскольку есть высокая вероятность обнаружения большего количества метастазов, чем те, которые были выявлены лучевыми методами диагностики.
Некоторые остеосаркомы (саркома Юинга) являются радиочувствительными. При их лечении можно избежать операции и ограничиться облучением и химиотерапией. Но большинство костных опухолей резистентны к лучевому воздействию, поэтому данное лечение применяется только на распространенных стадиях для уменьшения болевого синдрома.
Химиотерапия имеет большое значение при лечении высокозлокачественных остеосарком. Ее назначают в неоадъювантных и адъювантных режимах, и у большинства пациентов продолжительность лечения может достигать 12 месяцев.
Неоадъювантная химиотерапия проводится в течение нескольких недель перед операцией. Ее целью является уменьшение размеров опухоли, создание условий для радикальной операции и определение индивидуальной химиочувствительности остеосаркомы. Последний момент является очень важным для определения прогноза заболевания.
Послеоперационная химиотерапия проводится в течение нескольких месяцев после удаления опухоли. Используются полихимиотерапевтические схемы, включающие в себя адриамицин, метотрексат в высоких дозах совместно с фолиевой кислотой, цисплатин и фосфамид. При выборе схемы послеоперационной ХТ основываются на ответе опухоли на неоадъювантную химиотерапию. Если ответ был неудовлетворительным, используют особые схемы лечения, которые называют постоперационной терапией спасения.
Осложнения
Остеосаркома может привести к развитию следующих осложнений:
- Патологические переломы — это переломы, которые возникают без воздействия травмирующего фактора. Дело в том, что остеосаркома приводит к нарушению остеогенеза, в месте локализации опухоли костная ткань не является достаточно прочной и не может выдержать обычную нагрузку, что приводит к образованию перелома от малейшего воздействия.
- При поражении ростовой пластинки трубчатых костей может нарушаться синхронный рост конечностей.
- При лечении заболевания может потребоваться обширная операция или ампутация конечностей, что приводит к инвалидизации пациента.
Прогноз при остеосаркомах
Прогноз заболевания будет зависеть от многих факторов, например:
- Место локализации опухоли. Наиболее неблагоприятно протекает остеосаркома, локализующаяся в области метафиза трубчатых костей, а, например, остеосаркома, которая располагается в области свода черепа, отличается более медленным течением и редко дает метастазы, даже если это высокозлокачественный тип опухоли.
- Размер первичного очага. Чем больше новообразование, тем хуже прогноз.
- Возраст и общее состояние пациента. Более благоприятно протекает остеосаркома у детей. Хуже обстоят дела у людей пожилого и старческого возраста ввиду изначально ослабленного здоровья и ограничений в проведении агрессивных курсов химиотерапии.
- Чувствительность новообразования к проводимому химиотерапевтическому лечению.
- Возможность проведения радикальной операции.
Раньше остеосаркома считалась агрессивной опухолью, и результаты ее лечения были неудовлетворительными даже после проведения обширных радикальных операций. Пятилетний рубеж переживало около 10% больных. На сегодняшний день с введением новых химиотерапевтических схем результаты лечения стали намного лучше. Пятилетняя выживаемость при локализованной опухоли составляет более 70%, а при хорошей химиочувствительности — 80%.
Профилактика
На сегодняшний день эффективных методов профилактики остеосаркомы нет, тем не менее может быть рекомендовано соблюдение общих принципов здорового питания и физической активности, борьба с вредными привычками.
- Отдел общей онкологии
Саркома костей встречаются редко; среди всех онкологических заболеваний у взрослых составляют менее 1%; у детей – до 2%. Но это самое распространенное злокачественное поражение костной ткани.
Остеосаркома часто возникает в период интенсивного роста, в возрасте от 10 до 23 лет, но может диагностироваться в любом возрасте, в том числе и у пожилых (старше 60 лет).
Опухоль обычно развивается на концах длинных трубчатых костей (кости нижних и верхних конечностей), рядом с зонами роста, чаще всего в области коленных суставов. Но саркома может развиться и в верхней трети плечевой кости, в костях таза или челюсти.
С ростом опухоли процесс затрагивает окружающие кость ткани, прежде всего мышцы и сухожилия, а также кровеносные сосуды. С током крови злокачественные клетки разносятся по организму (метастазируют) и образуют новые очаги поражения (чаще всего в легких, и других костях).
В последние два десятилетия достигнут большой прогресс в лечении этих заболеваний. Благодаря современной химиотерапии, совершенствованию методов визуализации опухолей костей и успехам онкологической ортопедии в настоящее время большинство пациентов могут быть излечены, при этом конечность удается сохранить более чем в 80% случаев.
Точные причины не установлены. Известны некоторые факторы риска возникновения этого заболевания.
- Опухоль чаще возникает в подростковом возрасте, в период интенсивного роста.
- Перенесенная ранее, особенно в молодом возрасте, лучевая терапия с высокой общей дозой облучения.
- При болезни Педжета вероятность развития остеосаркомы значительно возрастает, особенно при тяжелом течении этого предопухолевого заболевания.
- Различные наследственные опухолевые синдромы, множественные остеохондромы, ретинобластомы также повышают риск развития остеосаркомы.
Довольно длительное время рост опухоли не сопровождается никакими жалобами. Небольшие боли часто расценивают как последствия травм, особенно у детей и подростков, которые ведут активный образ жизни. В начале заболевания боли возникают эпизодически, усиливаются по ночам или после физической нагрузки. Если саркома расположена на нижних конечностях, то может возникать хромота. Видимая припухлость появляется значительно позже, через несколько месяцев.
Именно поэтому во многих случаях диагноз ставится поздно.
Врач может заподозрить саркому на основании результатов опроса и осмотра пациента, принимая во внимание возраст, боли, локализация припухлости, наличие заболеваний в семье, при пальпации - горячая, твердая опухоль. К сожалению, очень часто на самые первые признаки заболевания (эпизодически возникающие боли в конечностях) внимания почти не обращают.
Рентгенография — наиболее распространенный и доступный метод визуализации сарком костей, в специализированных онкологических клиниках точность установления диагноза и стадии процесса превышает 80%.
Компьютерная томография позволяет более точно оценить степень повреждения кости и окружающих тканей. Для выявления отдаленных метастазов проводят КТ органов грудной клетки дает представление о наличии метастазов в легких и лимфатических узлах средостения.
МРТ оценивает распространение опухоли внутри кости.
Сцинтиграфия дает возможность определить распространенность опухоли по длине кости, а также выявляет отдаленные костные метастазы.
ПЭТ/КТ выявляет отдаленные метастазы небольшого размера, прежде всего в легких и костях.
Для того, чтобы точно поставить диагноз и установить вид саркомы, в специализированном лечебном учреждении выполняют биопсию. Лучше всего, если эту процедуру проводят тот же хирург-ортопед, который будет в последствие выполнять операцию.
Саркомы костей - большая группа опухолей, развивающихся из разных клеток костей. Установить, из каких именно, очень важно, так как от этого во многом будет зависеть выбор методов лечения.
Наиболее распространенной классификацией сарком костей в настоящее время считается классификация ВОЗ пересмотра 2002 года. Выделяют злокачественные опухоли из костеобразующих тканей (включая агрессивную злокачественную остеобластому, внутрикостную, классическую и поверхностную остеосаркомы), злокачественные хрящеобразующие опухоли (хондросаркомы разных видов), фиброзно-кистозные опухоли (злокачественная фиброзная гистиоцитома кости, фибросаркома кости); гигантоклеточные опухоли костей; саркома Юинга, примитивная нейро-эктодермальная опухоль(PNET).
Для того, чтобы установить стадию, нужно определить степень ее злокачественности, распространенность опухоли в окружающих тканях и наличия отдаленных метастазов.
Скорость роста и вероятность раннего метастазирования зависят от степени злокачественности саркомы. В зависимости от вида и свойств клеток опухоли выделяют остеосаркомы высокой, промежуточной и низкой степени злокачественности. Саркомы костей высокой степени злокачественности метастазируют преимущественно гематогенно. Чаще всего метастазами поражаются легкие (более 80%), причем уже на ранних стадиях развития заболевания и, к сожалению, во многих случаях еще до начала лечения. Костные метастазы наблюдаются редко (до 10%), особенно при запущенных опухолях. Метастатические поражения регионарных лимфатических узлов встречается в 7—10% случаев.
Широкое распространение среди специалистов получила классификация, разработанная в начале 80-х годов прошлого века американским исследователем W. Enneking. Впоследствии она была одобрена американским и европейским обществами по изучению костно-мышечных опухолей в качестве рабочей классификации. При определении стадии учитывают следующие критерии: степень злокачественности, местная распространенность (опухоль находится в пределах кости или выходит за ее границы), наличие отдаленных метастазов.
Классическую остеосаркому сразу относят ко II-ой стадии, из-за высокой степени злокачественности опухоли.
Используется также классификация по системе TNM (где Т – это размер и распространение первичной опухоли, N – вовлечение регионарных лимфоузлов, а М – наличие отдаленных метастазов). При этом оценивают и злокачественность саркомы, определяя ее по степени дифференцировки клеток (чем она ниже, тем злокачественнее опухоль).
Лечение остеосарком
План терапии составляют после полного обследования больного. Учитывают вид и стадию опухоли, общее состояние здоровья пациента. Все лечение нужно проводить только в специализированных медицинских учреждениях, врачи которых имеют опыт ведения пациентов с остеосаркомами.
Химиотерапия используется на пред- и послеоперационном этапе. Предоперационная химиотерапия проводится, как правило, в течение 3-4 месяцев перед оперативным лечением. Назначают сложные схемы введения различных противоопухолевых препаратов, включая высокие дозы метотрексата, доксорубицин, препараты платины (цисплатин, карбоплатин), этопозид, ифосфамид, циклофосфамид. В отдельных случаях с успехом применяют метод регионарной химиотерапии, которая позволяет получить более высокую концентрацию препарата в зоне опухоли, при этом концентрация в крови такая же, что и при обычном внутривенном введении, т. е. достаточна для воздействия на метастазы. Ответ опухоли на предоперационную химиотерапию проявляется в уменьшении или исчезновении болевого синдрома, улучшении функции конечности, а также в уменьшении размера опухоли по данным рентгенографии, КТ, МРТ и ангиографии.
Затем проводят оперативное вмешательство. При проведении операции очень важно удалить опухоль радикально, чтобы не допустить повторный рост саркомы в этом же месте. Объем операции зависит от вида и стадии опухоли, от эффективности предоперационной химиотерапии. В настоящее время чаще всего конечность удается сохранить (до 80% случаев). Но иногда приходиться прибегать к ампутации, особенно при опухолях большого размера, с поражением окружающих тканей, сосудов и нервов, а также при угрозе распада опухоли.
Прямо в ходе операции образовавшийся дефект кости замещают с помощью металлических эндопротезов или костными трансплантатами. Результат такой пластики существенно улучшается при пересадке трансплантантов с применением микрохирургической техники и внеочаговой фиксации аппаратом Илизарова. Проведение такого протезирования не влияет на прогноз, но существенно улучшает качество жизни пациента.
После удаления опухоли проводят послеоперационную химиотерапию. Выбор препаратов и продолжительность определяется успехом предоперационного лечения. Для этого исследуют клетки удаленной опухоли. Если саркома чувствительна к препаратам пред и послеоперационной химиотерапии, то в 50-80% случаев удается достигнуть полного излечения.
Лучевая терапия используется только в сочетании с химиотерапией или в качестве предоперационной подготовки при ряде радиочувствительных сарком. Методика облучения, доза и источник зависят от возраста больного, локализации и размеров опухоли и характера планируемой операции.
Дальнейший прогресс в лечении сарком костей ожидается в результате появления новых данных в области фармакологии, клеточной биологии, иммунологии и молекулярной генетики. Наряду с повышением эффективности, лечение будет более индивидуализированным и менее токсичным. Большие надежды возложены на таргетную терапию, иммуномодуляторы и препараты, регулирующие функции факторов роста и их рецепторов. Для оценки эффективности химиотерапии на предоперационном этапе изучаются такие методы как КТ, МРТ с контрастным усилением, планарная и динамическая сцинтиграфия, ангиография, ПЭТ и др.
За последние десятилетия значительно повысилась эффективность лечения остеосарком: при выявлении на ранней стадии 5-летняя выживаемость пациентов превышает 70%, а если опухоль чувствительна к химиотерапии – то достигает 80-90%.
Читайте также:

