Количество базофилов при онкологии
Содержание статьи



- Как по общему анализу крови определить онкологию
- Как определить рак
- Как сдают анализ на рак
Изменения в показателях крови
Наступает момент, когда иммунная система распознает инородные клетки и начинает с ними бороться, но нейтрализовать онкологический процесс иммунитету уже не под силу. Во время нарастающего противостояния иммунитета и онкологии начинают изменяться показатели крови – нарастает количество лейкоцитов. Такое явление наблюдается и при воспалительных заболеваниях, объясняется оно тем, что именно лейкоциты являются клетками, обеспечивающими защиту организма от всего инородного. При борьбе с опухолевыми процессами их количество возрастает выше 12*10 в 9 степени на литр.

Онкологические процессы ведут к изменениям в анализе крови уровня гемоглобина, он резко снижается. Норма гемоглобина - 120-160 г/л, при злокачественных опухолях показатель не превышает отметку 80 г/л, запущенные процессы снижают концентрацию гемоглобина до 40 г/л.
Раковые заболевания ведут к повышению скорости оседания эритроцитов. В норме СОЭ у женщины до 15 мм/ч, у мужчин до 10 мм/ч, при онкологии показатели резко возрастают, может наблюдаться 30-50 мм/ч. Этот показатель изменяется, потому что при защитной реакции организма в крови изменяется баланс белков, поэтому разделение крови на плазму и эритроциты происходит значительно быстрее.
Онкология кроветворной системы
При развитии лейкоза (народное название – белокровие), наблюдается резкое изменение показателя содержания тромбоцитов. Количество этих клеток крови уменьшается, т.к. они образуются костным мозгом, который при лейкозе не может функционировать должным образом. Уровень тромбоцитов в крови снижается до 20*10 в 9 степени на литр и ниже.
В общем анализе при развитии лейкоза появляются измененные миелобластные клетки – это крупные атипичные клетки, которые не наблюдаются в крови здорового человека. При развитии онкологии кроветворной системы в общем анализе крови изменяется лейкоцитарная формула - растет количество незрелых эозинофилов, а также базофилов, уменьшается количество нейтрофилов. Эти изменения происходят потому, что иммунная система старается справиться с возникшим заболеванием, но происходит лишь сбой в выработке фракций лейкоцитов.
Диагностика раковых опухолей – комплексное обследование с использованием специфических инструментальных и лабораторных методов. Проводится она по показаниям, среди которых находятся и выявленные стандартным клиническим анализом крови нарушения.
Злокачественные новообразования растут очень интенсивно, потребляя при этом витамины и микроэлементы, а также выделяя в кровь продукты своей жизнедеятельности, приводят к значительной интоксикации организма. Питательные вещества берутся из крови, туда же попадают продукты их переработки, что и влияет на ее состав. Поэтому зачастую именно в ходе плановых осмотров и лабораторных исследований обнаруживаются признаки опасного заболевания.
- 1 Какие анализы крови показывают онкологию
- 1.1 Можно ли по общему анализу крови определить онкологию (рак)
- 1.2 Биохимическое исследование
- 1.3 Основной анализ
- 1.4 Может ли при раке быть хороший анализ крови
- 1.5 Какие показатели крови показывают онкологию у женщин
- 2 Когда необходим анализ на онкомаркеры?
- 3 Как подготовиться к сдаче анализа на онкомаркеры
Какие анализы крови показывают онкологию
Заподозрить рак можно по результатам стандартных и специальных исследований. При патологических процессах в организме изменения состава и свойств крови отражаются в:
- общем анализе крови;
- биохимическом исследовании;
- анализе на онкомаркеры.
Однако достоверно определить рак по анализу крови нельзя. Отклонения любых показателей могут вызываться заболеваниями, с онкологией никак не связанными. Даже специфический и наиболее информативный анализ на онкомаркеры не дает 100% гарантию наличия или отсутствия заболевания и нуждается в подтверждении.
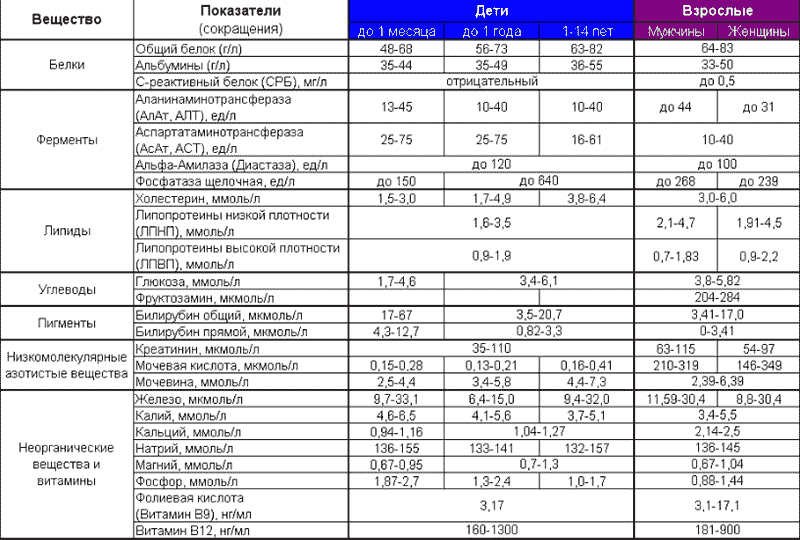
Этот вид лабораторного исследования дает представление о количестве основных форменных элементов, которые отвечают за функции крови. Уменьшение или увеличение каких-либо показателей – сигнал о неблагополучии, в том числе и о наличии новообразований. Берется проба из пальца (иногда из вены) в первой половине дня, натощак. В таблице ниже представлены основные категории общего или клинического анализа крови и их нормальные значения.
При трактовке анализов необходимо учитывать, что в зависимости от пола и возраста показатели могут различаться, также существуют физиологические причины повышения или снижения значений.
Практически все эти показатели крови при онкологии изменяются в сторону уменьшения или увеличения. На что именно обращает внимание врач при изучении результатов анализа:
- СОЭ. Скорость оседания в плазме эритроцитов выше нормы. Физиологически это может объясняться менструацией у женщин, повышенной физической активностью, стрессами и т.д. Однако, если превышение значительное и сопровождается симптомами общей слабости и субфебрильной температурой, можно заподозрить рак.
- Нейтрофилы. Их количество увеличено. Особенно опасно появление новых, незрелых клеток (миелоцитов и метамиелоцитов) в периферической крови, характерное для нейробластом и других онкозаболеваний.
- Лимфоциты. Эти показатели ОАК при онкологии выше нормы, поскольку именно этот элемент крови отвечает за иммунитет и борется с раковыми клетками.
- Гемоглобин. Уменьшается, если имеются опухолевые процессы внутренних органов. Объясняется это тем, что продукты жизнедеятельности клеток опухоли повреждают эритроциты, снижая их количество.
- Лейкоциты. Численность белых кровяных телец, как показывают анализы при онкологии всегда снижается, если метастазами поражен костный мозг. Лейкоцитарная формула при этом сдвигается влево. Новообразования другой локализации приводят к повышению.
Следует учитывать, что снижение гемоглобина и количество эритроцитов характерно для обычной анемии, вызванной недостатком железа. Повышение СОЭ наблюдается при воспалительных процессах. Поэтому такие признаки онкологии по анализу крови считаются косвенными и нуждаются в подтверждении.
Назначение этого анализа, проводимого ежегодно – получение информации об обмене веществ, работе различных внутренних органов, балансе витаминов и микроэлементов. Биохимический анализ крови при онкологии тоже информативен, поскольку изменение определенных значений позволяет делать выводы о наличии раковых опухолей. Из таблицы можно узнать, какие показатели должны быть в норме.
Заподозрить рак биохимический анализ крови возможно в том случае, когда следующие значения не соответствуют норме:
- Альбумин и общий белок. Они характеризуют общее количество протеинов в сыворотке крови и содержание основного из них. Развивающееся новообразование активно потребляет белок, поэтому данный показатель существенно снижается. Если поражена печень, то даже при полноценном питании наблюдается дефицит.
- Глюкоза. Рак репродуктивной (особенно женской) системы, печени, легких влияет на синтез инсулина, тормозя его. В результате появляются симптомы сахарного диабета, что и отражает биохимический анализ крови при раке (уровень сахара растет).
- Щелочная фосфатаза. Повышается, прежде всего, при опухолях костей или метастазах в них. Может также свидетельствовать об онкологии желчного пузыря, печени.
- Мочевина. Этот критерий позволяет оценить работу почек, и если он повышен – имеется патология органа либо идет интенсивный распад белка в организме. Последнее явление характерно для опухолевой интоксикации.
- Билирубин и аланинаминотрансфераза (АлАТ). Повышение количества этих соединений информирует о поражении печени, в том числе раковой опухолью.
Если есть подозрение на рак, биохимический анализ крови не может использоваться как подтверждение диагноза. Даже если наблюдаются совпадения по всем пунктам, потребуется сделать дополнительные лабораторные исследования. Что касается непосредственно сдачи крови, то берется она из вены с утра, а есть и пить (разрешено употреблять кипяченую воду) нельзя уже с предыдущего вечера.
Если биохимический и общий анализ крови при онкологии дают только общее представление о наличии патологического процесса, то исследование на онкомаркеры позволяет даже определить местоположение злокачественного новообразования. Именно так называется анализ крови на рак, при котором выявляются специфические соединения, вырабатываемые самой опухолью или организмом в ответ на ее присутствие.
Всего известно около 200 онкомаркеров, но для диагностики используется чуть больше двадцати. Некоторые из них являются специфичными, то есть свидетельствуют о поражении конкретного органа, а другие могут выявляться при разных видах рака. Например, альфа-фетопротеин – это общий онкомаркер на онкологию, он обнаруживается почти у 70% больных. То же относится и к РЭА (раково-эмбриональному антигену). Поэтому для определения разновидности опухоли кровь исследуется на комбинации общих и специфичных онкомаркеров:
- Белок S-100, НСЕ – мозг;
- СА-15-3, СА-72-4, РЭА – поражена молочная железа;
- SCC, альфа-фетопротеин – шейка матки;
- АФП, СА-125, ХГЧ – яичники;
- CYFRA 21–1, РЭА, НСЕ, SCC – легкие;
- АФП, СА 19-9, СА-125 – печень;
- СА 19-9, РЭА, СА 242 – желудок и поджелудочная;
- СА-72-4, РЭА – кишечник;
- PSA – предстательная железа;
- ХГЧ, АФП – яички;
- Белок S-100 – кожа.
Но при всей точности и информативности, диагностика онкологии по анализу крови на онкомаркеры носит предварительный характер. Наличие антигенов может быть признаком воспалительных процессов и других заболеваний, а РЭА всегда повышен у курильщиков. Поэтому без подтверждения инструментальными исследованиями диагноз не ставится.
Этот вопрос закономерен. Если плохие результаты не являются подтверждением онкологии, то может ли быть наоборот? Да, это возможно. На результат анализа может повлиять малый размер опухоли или прием лекарственных средств (учитывая, что для каждого онкомаркера существует специфический перечень препаратов, прием которых может привести к получению ложноположительных или ложноотрицательных результатов, лечащий врач и сотрудники лаборатории должны быть уведомлены о препаратах, принимаемых пациентом).
Даже если анализы крови хорошие и инструментальная диагностика результата не дала, но есть субъективные жалобы на боли, речь может идти о внеорганной опухоли. Например, ее забрюшинная разновидность выявляется уже на 4 стадии, до этого практически никак не давая знать о себе. Возрастной фактор тоже имеет значение, поскольку метаболизм с годами замедляется, и в кровь антигены поступают тоже медленно.
Опасность заболеть раком приблизительно одинакова у обоих полов, но у прекрасной половины человечества есть дополнительное уязвимое место. Женская репродуктивная система подвергается высокому риску онкозаболеваний, особенно молочные железы, что выводит рак груди на 2 место по частоте встречаемости, среди всех злокачественных новообразований. Эпителий шейки матки тоже склонен к злокачественному перерождению, поэтому женщины должны ответственно относиться к обследованиям и обращать внимание на следующие результаты анализов:
- ОАК при онкологии показывает снижение уровня эритроцитов и гемоглобина, а также повышении СОЭ.
- Биохимический анализ – здесь поводом для беспокойства является увеличение количества глюкозы. Такие симптомы сахарного диабета особенно опасны для женщин, поскольку нередко становятся предвестниками рака молочных желез и матки.
- При исследовании на онкомаркеры одновременное присутствие антигенов SCC и альфа-фетопротеина свидетельствует о риске поражения шейки матки. Гликопротеин СА 125 – угроза рака эндометрия, АФП, СА-125, ХГЧ – яичников, а комбинация СА-15-3, СА-72-4, РЭА говорит о том, что опухоль может быть локализована в молочных железах.
Если что-то настораживает в анализах и имеются характерные признаки онкологии в начальной стадии, визит к врачу откладывать нельзя. Кроме того, гинеколога посещать надо не реже раза в год, а грудь регулярно обследовать самостоятельно. Эти простые меры профилактики часто помогают выявить рак на ранних стадиях.
Когда необходим анализ на онкомаркеры?
Пройти обследование следует при продолжительном ухудшении самочувствия в виде слабости, постоянной невысокой температуры, утомляемости, потере веса, анемии неясного генеза, увеличении лимфатических узлов, появлении уплотнений в молочных железах, изменении цвета и размера родинок , нарушениях работы ЖКТ, сопровождающихся отхождением крови после дефекации, навязчивом кашле без признаков инфекции и т.д.
Дополнительным причинами являются:
- возраст за 40;
- онкология в семейном анамнезе;
- выход за пределы нормы показателей биохимического анализа и ОАК;
- боли или продолжительное нарушение функций каких-либо органов или систем даже в незначительной степени.
Анализ не занимает много времени, помогая при этом вовремя выявить угрожающее жизни заболевание и вылечить его наименее травматичными способами. Кроме того, такие обследования должны стать регулярными (не реже раза в год) для тех, кто имеет родственников с онкологией или перешагнул сорокалетний возрастной рубеж.
Как подготовиться к сдаче анализа на онкомаркеры
Кровь для исследований на антигены сдается из вены, утром. Результаты выдаются в течение 1-3 дней, а чтобы они получились достоверными, необходимо выполнить определенные рекомендации:
- не завтракать;
- не принимать накануне какие-либо медикаменты и витамины;
- за трое суток до того, как делать диагностику рака по анализу крови, исключить алкоголь;
- не принимать накануне жирную и жареную пищу;
- за сутки до исследования исключить тяжелые физические нагрузки;
- в день сдачи не курить с утра (курение повышает РЭА);
- чтобы сторонние факторы не исказили показатели, сначала вылечить все инфекции.
После получения результатов на руки не следует делать какие-либо самостоятельные выводы и ставить диагнозы. Стопроцентной достоверностью этот анализ крови при раке не обладает и требует инструментального подтверждения.
Предположение о том, что базофильная инфильтрация может играть роль в резистентности к росту опухоли, возникло еще в середине 40-х годов XX ст. — период, когда оставались неизвестными как причины миграции базофилов в опухолевую ткань, так и механизмы их возможного позитивного влияния, которое наблюдалось при их инфильтрации.
Практически первые прямые доказательства участия базофилов в противоопухолевой защите были получены A. Dvorak при электронно-микроскопическом исследовании.
Удалось выявить, что базофилы способны непосредственно контактировать с опухолевой клеткой.
При этом обратили внимание на то, что лизис последних не был значительным, однако факт регрессии опухоли при наличии базофилов был очевиден. Отмеченный эффект авторы связывают с выделением вазоактивных аминов.
Связывание IgE с Fc-рецепторами клеток базофильной лейкемии приводило к дегрануляции, которая происходила с включением различных процессов на молекулярном уровне (активация протеинкиназ и последовательное тирозинфосфорилирование клеточных белков).
Исследование клеток линии IL-3-зависимых базофильных тучных клеток (линия РТ-18(А17)) и клеток базофильной лейкемии крыс (RBL-2H3) показало, что после связывания IgE-антител с FceRI базофильные клетки увеличивают естественную цитотоксичность, выделяют цитотоксический фактор, селективно лизируют мишени, нечувствительные к лизису ЕК (WEHI-764), но не лизируют мишени, чувствительные к действию ЕК (YAC-1, RLM-1, RBL-5); нормальные фибро-бласты эмбриона также не лизировались этими клетками, а выделение ими указанного фактора сочеталось с выделением других медиаторов после активации FceRI.
Базофилы в регрессии опухоли
О причастности базофилов к регрессии опухоли позволяют говорить и результаты терапии фибросаркомы с использованием трансфекции гена IL-7 в опухолевые клетки. Несмотря на то что противоопухолевый эффект авторы связывают с CD4+- и СD8+Т-лимфоцитами, замедление роста опухоли, ее регрессия сочетались и с увеличением количества базофилов и эозинофилов.
Имеются также данные о том, что базофилы могут оказывать и опосредованное влияние на лизис опухолевых мишеней, что подтверждается результатами влияния супернатантов базофилов, стимулированных IgE-антителами (супернатанты содержали гистамин, LTB4 и LTC4). Такие супернатанты усиливали цитотоксичность эозинофилов и нейтрофилов (клетками-мишенями были шистосомулы).
На основании фракционирования супернатантов было установлено их дифференцированное влияние на цитотоксичность эозинофилов и нейтрофилов in vitro: нейтрофилы активировались фракцией, содержащей LTB4 (эта фракция минимально эффективно влияла на цитотоксичность эозинофилов), а эозинофилы в основном активировались гистамином.
Оценивая представленные данные, нельзя не отметить их немногочисленность и фрагментарность.
Тем не менее в большинстве случаев имеющиеся данные дают возможность констатации факта, согласно которому в ряде случаев инфильтрация базофилами сочетается с благоприятным течением процесса, а механизм их противоопухолевого действия связан с выделением разнообразных медиаторов.
Уже более 30 лет тому назад сформулировались подходы к направлению, которое могло бы оказаться весьма продуктивным для понимания противоопухолевой защиты базофилов. В 1974 г. A. Dvorak впервые высказал предположение, что антигенная стимуляция лейкоцитов приводит к продукции различных субстанций, в частности HRF, который, как известно, индуцирует выделение гистамина и вызывает их дегрануляцию.
В связи с этим возник вопрос: а продуцируются ли подобные субстанции в ответ на раковые антигены? Было установлено, что лейкоциты, в том числе и базофилы, в ответ на культивирование с опухолевыми клетками продуцируют HRF. Дальнейшие эксперименты показали, что в процесс торможения роста опухоли включается именно продукт гранул — HRF.
В середине 1980-х годов внимание было обращено на то, что мононуклеарные клетки периферической крови после активации стреп-токиназой продуцируют фактор, который индуцирует выделение гистамина из базофилов и тучных клеток. Уже тогда авторы высказали мысль о том, что HRF может быть связующим звеном между клеточным иммунитетом и гиперчувствительностью немедленного типа.
Несколько позже было отмечено, что этот фактор выделяют нейтрофилы и тромбоциты, а также клетки базофильной лейкемии крыс. При этом отмечалось, что выделение HRF из клеток базофильной лейкемии не было IgE-зависимым в отличие от его выделения нейтрофилами, что предполагало наличие различных форм фактора.
Предположение о том, что существуют различные изоформы HRF было подтверждено тем, что рекомбинантный IL-1 и TNF также индуцируют его секрецию мононуклеарами, однако HRF, выделяемый под влиянием цитокинов, представлен другими формами.
Интенсивные исследования в этом направлении, в частности выполненные A. Kaplan, С. Dinarello, М. White, L. Lichtenstein и другими исследователями, привели к заключению о том, что HRF — цитокино-подобная молекула, отличающаяся гетерогенностью, продуцируемая различными клетками под влиянием многих стимулов, среди которых в первую очередь — IL-la, IL-1в, IL-3, GM-CSF, МСР-1; HRF, выделяемый в ответ на различные стимулы, отличается по активности и индуцирует продукцию различных количеств гистамина.
Не менее важно, что мононуклеары выделяют и фактор ингибиции высвобождения гистамина (HR1F) — свидетельство существования системы регуляции выделения гистамина. Более того, была показана высокая специфичность этого ингибитора, так как его антагонистом является только HRF.
Нельзя не отметить, что все эти исследования проводили преимущественно на базофилах больных аллергическими заболеваниями, а также здоровых лиц, так как основной научный интерес большинства исследователей, связанных с изучением этого вопроса, относился к аллергии.
Получены и доказательства того, что источником продукции HRF служат и сами базофилы, которые выделяют его после стимуляции IL-3 и/или анти-HRF-антителами. Супернатанты таких базофилов стимулируют другие базофилы к секреции гистамина, что свидетельствует о наличии аутокринной регуляции выделения HRF. В связи с этими данными интересны и факты, которые их дополняют: HRF способен взаимодействовать с собственным С-терминальным участком, и такая уникальная способность, очевидно, связана с его биологическими особенностями.
Многообразие клеток, которые оказались способными к продукции HRF, и гетерогенность его форм привели к формулировке положения о том, что изучение структуры этих молекул и их взаимодействия — путь не только к пониманию механизмов аллергических реакций, но и других хронических заболеваний.
Постепенно представления о HRF расширились и стало известно, что подобной активностью обладают соединительнотканный активационный пептид III, пептид II активации нейтрофилов и IL-3. Изучение аминокислотной последовательности HRF показало, что у человека она соответствует р23, у мышей — р21 и оба белка индуцируют выделение гистамина из базофилов IgE-зависимым путем.
После почти 20-летнего изучения HRF человека была получена его рекомбинантная форма — Hr-HRF, стало известно, что это новый цитокин, не имеющий какой-либо аналогии с известными цитокинами или молекулами, который стимулирует выделение гистамина и IL-4 из базофилов.
В настоящее время HRF известен не только как р23, а и как ТСТР (translationally controled tumor protein — опухолевый белок, контролируемый на уровне транслокации). Поэтому, в литературе встречаются различные определения этого фактора или его комплексное название — HRF/p23/TCTP.
ТСТР — белок, регулирующий рост на уровне трансляции, находится у млекопитающих, высших растений, грибов и др.
Интересно, что его обнаружили в злокачественных и нормальных клетках, включая эритроциты, гепатоциты, макрофаги, тромбоциты, кератиноциты, клетки эритролейкемии, глиомы, меланомы, гепатобластомы и лимфомы, но не обнаружили в клетках нормальной почки и карциномы почки.
С помощью моноклональных антител установлено, что существует три изоформы ТСТР, а высокий уровень его гомологии у различных видов и экспрессия клетками многих тканей предполагает, что он может выполнять функции контроля за внутриклеточным гомеостазом.
Способность Hr-HRF влиять на различные процессы на уровне трансляции значительно усилила интерес к его изучению. Было показано, что наряду с его свойством усиливать секрецию гистамина, IL-4, IL-13 базофилами и эозинофилами после их активации в спектр его влияний включаются также Т-лимфоциты человека и В-лимфоциты мышей.
Под влиянием Hr-HRF возможна и частичная ингибиция продукции IL-2, например клетками линии Jurkat.
Ключевым моментом в изучении ТСТР стало открытие гена, который его кодирует — TPTL, установлена его высокая консервативность, что объясняется особенностями филогенетического становления. ТСТР относится к семейству белков-шаперонов (chaperone proteins), он Са2+-зависимый, связан с микротубулярным аппаратом, экспрессия регулируется на транскрипциональном и трансляционном уровнях, способен индуцировать широкий круг сигналов.
Такие способности ТСТР делают понятным его участие в важнейших клеточных процессах: клеточном росте, прогрессии клеточного цикла, злокачественной трансформации, защите клетки от различных стрессовых влияний, апоптозе и др.
Это свидетельствует о том, почему в настоящее время ТСТР рассматривается как молекула, которая выполняет экстрацеллюлярные цитокиноподобные функции и может принимать участие практически во всех процессах на клеточном уровне.
Роль HRF в регуляции гомеостаза представлена на рис. 51.

Рис. 51. Фактор, индуцирующий выделение гистамина (HRF) и его роль в регуляции гомеостаза
Выяснению роли HRF в опухолевом процессе посвящено весьма немного исследований, они преимущественно начали проводиться уже в текущем столетии. Однако первая из работ этого направления была выполнена значительно раньше, но содержала факты, которые представляют интерес и сегодня.
При исследовании клеток аденокарциномы желудка, астроцитомы и миелоидной лейкемии (К-562) было показано, что их культивирование с лейкоцитами периферической крови здоровых лиц приводит к выделению HRF, а также IFNa и IFNy.
Бесспорно интересным фактом, который отметили авторы этой работы, являются различия в способности опухолевых клеток отдельных линий индуцировать выделение HRF и TNFa — клетки астроцитомы и К562 были более активными индукторами продукции этих цитокинов, чем клетки аденокарциномы.
Причина этих различий остается неизвестной, но уже тогда было высказано предположение, что антигены опухолевой клетки могут приводить к дегрануляции базофилов, инфильтрирующих опухоль.
Не менее существенен и тот факт, что в супернатантах культивируемых опухолевых клеток с базофилами был обнаружен HRF с различной молекулярной массой, и такие различия наблюдали не только при культивировании с опухолевыми клетками, но и при воздействии других стимулов (митогена, стафилококкового энтеротоксина В и др.).
К более ранним данным следует отнести и работу, авторы которой в асцитной жидкости мышей (модель карциномы Эрлиха) обнаружили белок р23.
ТСТР в опухолевом процессе
Несомненным достижением в понимании роли ТСТР в опухолевом процессе являются факты, свидетельствующие о том, что ген, кодирующий ТСТР, относится к генам, которые участвуют в опухолевой реверсии и по-разному влияет на клетки различных опухолевых линий. Например, снижение реверсии клетками линии U937 и повышение клетками SIAH-1.
Далее, изучение особенностей протеома клеток колоректального рака (Сасо-2) в процессе дифференцировки показало, что на ее различных этапах обнаруживаются разнообразные белки, содержание которых коррелирует с уровнем дифференцировки.
К этим белкам относится и ТСТР, который, как правило, появляется одновременно с экспрессией некоторых других белков (три формы энолазы, креатининкиназа-В, колфилин-1 и др.) и некоторые из них, в том числе и ТСТР, не выявляли до начала процесса дифференцировки клеток. Авторы подчеркивают, что указанные изменения особенностей протеома, выявленные in vitro, наблюдали и в процессе развития карциномы кишечника in vivo.
При исследовании клеток рака молочной железы MCF-7 установлено, что под влиянием фактора роста фибробластов, который, как известно, является активным регулятором роста клеток рака молочной железы, изменяется экспрессия различных белков, а также отмечено, что этот фактор стимулирует экспрессию белков теплового шока, ядерного антигена пролиферации и ТСТР; уровень экспрессии всех отмеченных белков был постоянно повышен после трансфекции гена ras в клетки молочной железы.
Согласно заключению авторов, перечисленные белки участвуют в усилении клеточной пролиферации, а анализ протеома клетки может быть достаточно надежным методом идентификации соответствующих маркеров и выявления возможных терапевтических мишеней.
Весь путь изучения HRF от фактора, который индуцирует выделение гистамина из тучных клеток, базофилов и поэтому вначале рассматривался как один из центральных компонентов развития аллергических заболеваний, до регуляторного белка, который экспрессируется клетками практически всех тканей и может регулировать рост опухолевых клеток, является наглядным примером последовательной трансформации наших знаний.
Именно такое понимание роли HRF/p23/TCTP, во-первых, делает весьма перспективным изучение его роли в опухолевом процессе, а во-вторых, очень наглядно иллюстрирует связь между регуляцией аллергического процесса и ростом опухоли. Сегодня можно констатировать, что имеющиеся данные о роли ТСТР в опухолевом процессе ставят очень много вопросов, на которые практически пока нет ответа.
Одним из основных является вопрос: каким образом, в каких клетках и при каких условиях экспрессия гена ТСТР (TPTL) может влиять на дифференцировку опухолевых клеток? Не менее существенен и вопрос о широте биологических эффектов ТСТР с учетом того, что выделение ТСТР из базофилов тормозит опухолевый рост, а его экспрессия опухолевыми клетками связана с усилением их дифференцировки.
Возможно, что ответ на последний вопрос, а также на другие лежат в плоскости регуляции на уровне генов, так как в настоящее время предполагается существование нескольких TPTL генов и только один из них экспрессируется клетками всех тканей.
При рассмотрении вопроса о механизмах цитотоксического действия базофилов становится очевидным, что основным из них является выделение многообразных продуктов гранул, в которые входит HRF, продукты метаболизма кислорода и др. Основным индуктором выделения продуктов гранул, а следовательно, и индукции цитотоксичности, является высокоаффинный FceRI. Этим цитотоксичность базофилов отличается от цитотоксичности других гранулоцитов.
В настоящее время не удалось получить какую-либо информацию о перфорин- и гранзимзависимой цитотоксичности базофилов. В равной степени это относится и к Fas/FasL-зависимой цитотоксичности.
Однако следует отметить, что базофилы лишь только после стимуляции FceRI начинают продуцировать незначительное количество FasL, а добавление анти-FasL-антител не влияет на IgE-индуцированную активность базофилов. Исходя из этого, есть основания полагать, что система Fas/FasL не играет существенной роли в цитотоксичности базофилов.
На рис. 52 представлены сведения о возможных механизмах цитотоксичности эозинофилов.
Известные к настоящему времени свойства базофилов, в частности их роль во врожденном и приобретенном иммунитете (антибактериальный, антигельминтный), позволили сформулировать концепцию об их участии в обеспечении здоровья и протекания болезней.

Рис. 52. Механизмы цитотоксичности базофилов
К сожалению, эта концепция в основном остается на теоретическом уровне и нуждается в серьезном развитии. Новые методы выделения и очистки базофилов предоставляют и возможности более детально их изучить.
Если роль этих клеток в патологии (гельминтные инфекции и аллергия) во многом выяснена и продолжает изучаться, то их роль в здоровом организме остается "невидимой" (obsure). Еще менее изучены возможности их участия в противоопухолевой защите.
Тем не менее, если соединить имеющуюся, к сожалению, фрагментарную информацию о роли базофилов в поддержании нормального гомеостаза и противоопухолевой защите, то не остается сомнений, что базофилы располагают цитотоксическим потенциалом, благодаря которому они могут осуществлять свою противоопухолевую роль как прямо, так и опосредованно, влияя на другие клетки с цитотоксической активностью.
Читайте также:

