Клинический случай рак легкого
А.П. Казанцев, А.В. Хижников, П.А. Керимов, М.А. Рубанский
Рак легкого у ребенка 13 лет: случай из практики
Представляем редкое клиническое наблюдение — случай рака легкого (аденокарциномы) с множественными метастазами в костях, плевре и регионарных лимфатических узлах у мальчика 13 лет. Случай представляет интерес в связи с нетипичным для данной патологии возрастом и характером метастазирования опухоли.
Ключевые слова: детская онкология, рак легкого, метастазы, аденокарцинома.
A.P. Kazantsev, A.V. Khizhnikov, P.A. Kerimov, M.A. Rubansky
N.N. Blokhin Institute of Pediatric Oncology and Hematology
Moscow, Russian Federation
13-years-old child with Lung cancer: case report
Present a rare clinical case report – the case of lung cancer (Adenocarcinoma) with multiple bone metastases, pleural and regional lymph nodes of 13 years old boy. The case is interesting in connection with atypical for this age and the nature of the pathology of tumor metastasis.
Key words: pediatric oncology, lung cancer, metastatic adenocarcinoma.
ВВЕДЕНИЕ
В индустриально развитых странах рак легкого — одно из наиболее распространенных злокачественных новообразований. Он становится причиной смерти от злокачественных новообразований у каждого третьего мужчины и каждой пятой женщины. Большинство больных заболевают в возрасте от 35 до 75 лет, максимальные показатели приходятся на 55-75 лет. В большинстве западных стран заболеваемость раком легкого достигает 90-95 на 100000 населения. До 80% заболевших умирают в течение первого года с момента выявления и лишь 10% больных имеют шанс прожить более 5 лет [1]. Рак легкого чаще встречается в правом легком (51.4%). Чаще поражаются верхние его доли (60%) [1].
В настоящее время принято условно разделять рак легкого на 2 гистологических подтипа: Немелкоклеточная (НМРЛ) и Мелкоклеточная (МРЛ) формы рака легкого, встречаются они в 80-85% и 10-15% случаев, соответственно. Мелкоклеточный рак легкого отличается быстрым течением, коротким анамнезом заболевания, ранним и обширным метастазированием. Немелкоклеточный рак легкого морфологически неоднороден, включает в себя плоскоклеточный рак (70–75 %), аденокарциному (20–25 %) различной степени дифференцировки и другие, более редкие формы. Наиболее часто (70–80 %) НМРЛ выявляется при значительном местнорегионарном распространении и наличии отдалённых метастазов, 40% больных находятся в стадии IB–IIIA, пятилетняя выживаемость их составляет 9–38 % [2].
Отдаленные метастазы достоверно чаще выявляются при периферической форме рака легкого и аденокарциноме, особенно при низкодифференцированных формах. Наиболее часто выявляется метастатическое поражение печени – 30–40 %, противоположного легкого –26,2%, почек и надпочечников – 10–20 %, головного мозга – 10 %. Частота метастазирования рака легкого в кости колеблется в пределах от 6,3 до 57 %. [3].
В литературе мы не нашли описания случая рака легкого у ребенка, в связи с чем, хотим представить настоящее описание к рассмотрению.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Первично в НИИ ДОГ РОНЦ выполнены: компьютерная томография грудной полости и радиоизотопное исследование костной системы. По данным КТ у пациента отмечается объемное образование нижней доли правого легкого размерами 10,8х8,4х15,2 см, множество метастатических узлов на костальной плевре и наличие вторичных изменений в костях в исследованной области (Рис. 1, 2).
Рис. 1,2. Первичная многосрезовая компьютерная томография (МСКТ) органов грудной полости
По данным РИД костной системы, на момент исследования, отмечались признаки множественного опухолевого поражения скелета в области грудины, Th9 позвонка, костей таза, проксимального и дистального отделов правой бедренной кости.
Учитывая данные комплексного обследования, установлен клинический диагноз: Центральный рак правого легкого с Мтс в кости, плевру, регионарные л/узлы, IV стадия (T3N1M1), гистологически – Аденокарцинома.
Опухоль была признана неоперабельной, в связи с чем, было решено начать лечение по схеме: Кризотиниб (ингибитор протеинтирозинкиназы, назначен учитывая наличие экспрессии ALK) 1 таб 250 мг per os через день – длительно, Зомета 4 мг 1 раз в 28 дней. С 26.05.2014г. по 08.07.2014г. пациент получал лечение по вышеуказанной схеме. По данным контрольного обследования в июне 2014г. была отмечена стабилизация процесса. (Рис. 3,4).
Рис. 3,4. МСКТ органов грудной полости: стабилизация процесса на фоне проводимого лечения
Адрес: 115478, Москва, Каширское шоссе, д. 24, E-mail: oncoanat@mail.ru
Адрес: 115478, Москва, Каширское шоссе, д. 24, E-mail: sasha88amoral@mail.ru
Адрес: 115478, Москва, Каширское шоссе, д. 24, E-mail: polad73@mail.ru
Диагнозы
Материалы
Клинический случай отчеты и комментарии
Может ли ингибитор EGFR (рецепторов эпидермального фактора роста) увеличить иммуномодулирующий эффект стандартизированных растительных экстрактов (лектина омелы и арабиноксилана) с клинической пользой? Клинический случай лечения пациентки с аденокарциномой легких
Tibor Hajto*, Anna Horvath, Lilla Baranyai, Monika Kuzma and Pal Perjesi
Институт фармацевтической химии, медицинский университет г. Печ, Венгрия.
Аннотация
Справочная информация: хорошо известно, что раковые клетки характеризуются утратой или снижением регуляции молекул HLA-класс-I, которые необратимы и непоправимы. Это приводит к полной невозможности T-клеток лизировать клетки опухоли. Следовательно, большее внимание нужно уделять эффекторным клеткам врожденной иммунной системы, которые способны убить опухолевые клетки, лишенные комплексов MHC . Однако параллельно с ростом опухоли возрастает и ингибирование опухолью клеток Типа 1, в результате чего активность клеток врожденного иммунитета снижается. Среди других причин опухоль-ассоциированной дисрегуляции в этом также могут играть важную роль сигнальные EGF.
Материалы и методы: У 74-летней пациентки с неоперабельной аденокарциномой легких было отмечено прогрессирование заболевания после четырех циклов Карбоплатина и Паклитаксела. Вторая линия лечения включала 75 мг/сут Эрлотиниб (Terceva) и проводилась в течение семи месяцев. Терапия этим ингибитором тирозинкиназы рецептора эпидермального фактора роста (EGFR) проводилась в сочетании с лечением два раза в неделю стандартизированными растительными иммуномодуляторами – 0.75 НГ/кг лектина омелы и 0,45 мг/кг арабиноксилана, содержащими молекулярные структуры ПАМП (Патоген-Ассоциированные Молекулярные Паттерны), которые способны стимулировать клетки врожденной иммунной системы Тип-1.
Результаты: После курса химиотерапии до начала второй линии терапии пациентка находилась в терминальной фазе болезни, требующей интенсивного лечения. У нее были выявлены множественные метастазы в печени, лимфатических узлах и плевре. После лечения Эрлотинибом и иммуномодуляторами в течение семи месяцев была достигнута почти полная ремиссия (complect remission, CR), зафиксированная на КТ, и качество ее жизни было отличным.
Вывод: Данный клинический случай может поддерживать гипотезу о том, что с помощью синергического действия ингибиторов EGFR и иммуномодуляторов, активирующих клетки иммунной системы Тип 1, можно подавлять рост опухоли. Чтобы окончательно прояснить этот вопрос, необходимы дальнейшие клинические исследования.
Введение
Поскольку в течение длительного периода времени часто отмечалось повышение естественной цитотоксичности в периферической крови пациентов с опухолями, это может быть одним из факторов, способствующих снижению риска заболеваний [1].
Способность раковых клеток уклоняться от иммунобиологического контроля, осуществляемого высокоспецифичными Т-лимфоцитами, указывает на опухоль (онкоген)- клеточную индуцированную дизрегуляцию.
Действительно, было обнаружено, что в ректальных опухолях отмечается выраженное снижение экспрессии молекул HLA-класс-I , которое ассоциировалось с ухудшением общей выживаемости и выживаемости без прогрессирования болезни [2].
Также документально подтверждено, что раковые клетки различных других человеческих опухолей характеризуются утратой или снижением экспрессии молекул HLA-класс-I [3].
Различные эпигенетические изменения (например, дизрегуляция экспрессии генома в процессе записи, стирания или чтения) могут быть ответственны за это изменение [4].
Несмотря на то, что инфильтрирующие опухоль лимфоциты (TIL) являются, в основном, цитотоксическими Т-лимфоцитами, только малая доля злокачественных клеток реагирует на CD8+ Т клетки, так как они могут разрушить только HLA-класс-I-позитивные опухолевые клетки, экспрессирующие специфические опухоль-ассоциированные антигены.
Эти генетические нарушения регуляции, связанные с количественным и качественным изменения класса антигенов HLA-I, необратимы. Поэтому клетки опухоли не способны восстанавливать экспрессию HLA-I антигенов, и в последствии они могут полностью избежать лизиса Т –клетками [4].
Отсутствие самораспознавания делает раковые клетки нечувствительными к Т-эффекторам и переносит упор на механизмы врожденной иммунной системы, способные убивать опухолевые клетки, лишенные комплексов MHC и имеющие более обратимые механизмы уклонения по сравнению с адаптивной системой. В опухоль-ассоциированной регуляции нарушенный баланс врожденной иммунной системы может играть важную роль.
Как известно, эффекторные клетки врожденной иммунной системы дифференцируются в двух направлениях. Макрофаги Тип-1 (М1) и происходящие из моноцитов Тип-1 дендритные клетки (СО1) продуцируют провоспалительные цитокины, IL-12 и активируют цитотоксические клетки-эффекторы (такие как НК и НКТ), которые являются мощными ингибиторами опухолевого роста. Тем не менее, они неполноценны в опухоли пациента.
Доступная информация позволяет предположить, что опухоль-ассоциированные макрофаги относятся к прототипам популяции М2 [5,6]. М2- макрофаги и предшественники плазмоцитов, происходящие из дендритных DC2 клеток, вырабатывают IL-4 и IL-10, которые облегчают выработку TH2-клеток и ингибируют TH1-клетки и клетки естественной иммунной системы Тип-1 [6].
М2 макрофаги и CD2 дендритные клеток индуцируют воспаление, что приводит к повышению пролиферации клеток и выработке клеток роста, но не клеток-убийц иммунной системы.
Большего внимания заслуживает то обстоятельство, что содержание моноцитов М2 в периферической крови онкобольного может быть увеличено до 40% и более, в то время как у здоровых людей их содержится в среднем только 10% [6].
Как уже отмечалось, доминирование M2 и CD2 клеток в опухоли пациента может привести к повышенному продуцированию факторов роста, которые также способствуют регулировке клеток естественного иммунитета Тип-1.
Действительно, было показано, что EGF способен ингибировать цитотоксичность НК в отношении раковых клеток, снижая экспрессию NKG2D-лиганд: UL-16 связывающих белков (ULBP1 и ULBP2) или MICA и MICB на мембранах клеточных опухолей [7,8].
В данной статье представлен клинический случай, позволяющий предположить синергетический эффект на стимуляцию клеток естественного иммунитета Тип-1 при использовании комбинации ингибитора РEGF (Тарцева) и стандартизированных растительных иммуномодуляторов (арабиноксилана в форме BioBran и лектина омелы в форме экстрактп омелы). Достижение полной ремиссии у больной с аденокарциномой легких может открыть новые перспективы комбинационного лечения в терапии опухолей.
Материал и методы
IscadorRis – это ферментированный водный растительный экстракт омелы, изготавливаемый и поставляемый компанией Weleda AG (СН-4144 Арлесхайм, Швейцария).
Сахар-связывающая активность лектинов доступного в продаже экстракта омелы (IscadorR М spec 5 мг) оценивалась в научно-исследовательской лаборатории фармацевтико-химического факультета Медицинского университета города Печ.
Определение уровня связывания сахаров лектинами из экстракта омелы (ML) проводилось по оптимизированной методике ELLA, опубликованной ранее [9]. Стандартизированные ME представлены в виде колоколообразной кривой отношения доза-ответ, при этом с помощью здоровых добровольцев была установлена наиболее эффективная доза гликопротеидов – 0.5 - 1.0 НГ/кг. Для иммунологически оптимального эффекта подкожные инъекции проводились дважды в неделю.
Второй используемый в комплексном лечении больных иммуномодулирующий препарат – BioBran/MGN-3, изготавливаемый и поставляемый фармацевтической компанией Daiwa Pharmaceutical Co, Ltd, Токио, Япония. BioBran/MGN-3, состоит из денатурированной гемицеллюлозы. Его получают из гемицеллюлозы рисовых отрубей в процессе реакции с несколькими углеводно-гидролизующими ферментами грибов шиитаке.
BioBran/MGN-3 стандартизирован по основному химическому компоненту: арабиноксилану с сахарами ксилозой (в основной цепи) и полимером арабинозы (в боковой цепи). Представленным в отчете пациентам BioBran/MGN-3 давали перорально в дозах 45мг/кг два раза в неделю параллельно с терапией оптимизированными дозами лектинов экстракта омелы.
Эрлотиниб (Тарцева) является ингибитором тирозинкиназы РEGF. Таблетки с пленочным покрытием Тарцева обычно применяются в суточной дозе 150 мг. Опыт клинического применения в большинстве случаев связан с лечением пациентов с распространенным НМРЛ. Из-за появления некоторых побочных эффектов пациентке давали лекарство в суточной дозе 75 мг пять раз в неделю.
Комитет по этике
Комитет по этике предложил вести наблюдение и публиковать личные отчеты пациентки, пролеченной экстрактом омелы (ME), стандартизированным по уровню активности лектина. Пациентка дала информированное согласие на обработку и публикацию ее данных. По мнению комитета по этике, этот клинический случай может стимулировать интерес и для других исследовательских групп.
Результаты
У 74-летней пациентки (женщины) аденокарцинома средней и нижней доли правого легкого была впервые диагностирована в феврале 2015 года. В марте 2015 года была проведена торакотомия и найдено неоперабельное распространение. В это же время на КТ и при гистологическом исследовании были обнаружены метастазы в печени, лимфатических узлах и плевре (T4N2M1) . С апреля 2015 года по июнь 2015 проведено лечение, включавшее четыре цикла Карбоплатина (110 мг/м2) и Паклитаксела (90 мг/м2). В июле 2015 года с помощью КТ было установлено дальнейшее прогрессирование, пациентка находилась в терминальной стадии заболевания, и ее состояние требовало интенсивной медицинской помощи.
Молекулярно-генетические исследования клеток ее опухоли показали в 19-ом экзоне гена EGFR 47-S752 del мутации в соотношении 23%. Поэтому в июле 2015 года химиотерапии была прекращена и начата терапия второй линии эрлотинибом (Тарцева). Из-за серьезных побочных эффектов (сыпь и понос), таблетки Тарцева пациентке давали в ограниченных дозах – 75 мг/день пять раз в неделю.
Помимо лечения Эрлотинибом проводилась иммуномодулирующая терапия с использованием стандартизированных растительных экстрактов. Больная 2 раза в неделю получала 0.75 НГ/кг лектина омелы в форме стандартизированного экстракта омелы и 45 мг/ кг арабиноксилана в форме стандартизированного препарата BioBran/МГН-3.
Начало этой комбинационной терапии сопровождалось появлением аномального побочного эффекта:
Без Тарцева при приеме иммуномодуляторов обычно отмечалось лишь незначительное повышение температуры тела.
При комбинации экстрактов растений с Эрлотинибом у больной была отмечен подъем температуры до 39.5°C, что, предположительно, произошло вследствие синергетического действия препаратов на клетки иммунной системы Тип-1.
Поэтому в дальнейшем в дни иммуномодулирующей терапии (два раза в неделю) Эрлотиниб пациентке не давали.
В октябре 2015 года после семи месяцев лечения по результатам КТ была установлена почти полная ремиссия (complect remission, CR) первичной опухоли и полная ремиссия (CR) всех метастазов (рис. 1 и 2). Качество жизни пациентки сейчас отличное, трудоспособность 100%.
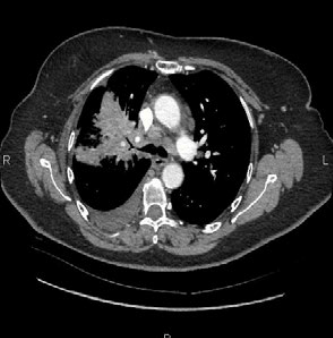
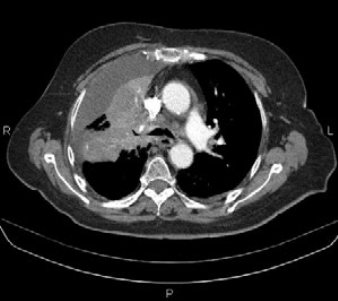
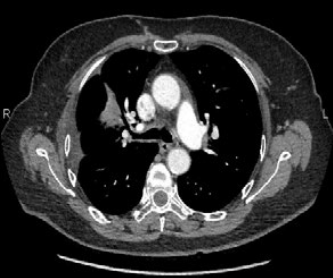
Рис. 1. Исследования КТ легких у пациентки с неоперабельной аденокарциномой на границе средней и нижней правой долей, которые сопровождались обширными ателектазами: 1/А. перед курсом химиотерапии; 1/B. после четырех циклов Карбоплатина (110 мг/м2) и Паклитаксела (90 мг/м2); 1/С. Через семь месяцев после комбинированного лечения Эрлотинибом (75 мг пять раз в неделю) и стандартизированными растительными иммуномодуляторами, получаемыми в форме 0.75 НГ/кг лектина омелы и 45 мг/кг арабиноксилана.
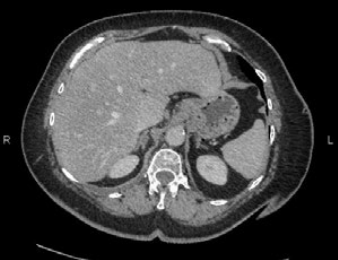
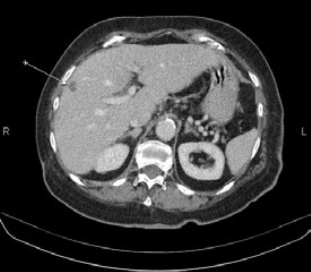
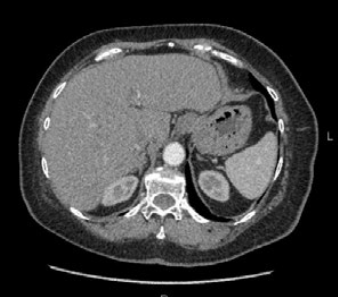
Рис. 2. КТ-Исследование метастазов печени у пациентки с неоперабельной аденокарциномой: 2/ А. перед курсом химиотерапии; 2/B. после четырех циклов Карбоплатина (110мг/м2) и Паклитаксела (90 мг/м2); 2/С. Через семь месяцев после комплексного лечения Эрлотинибом (75 мг пять раз в неделю) и стандартизированными растительными иммуномодуляторами, получаемыми в форме 0.75НГ/кг лектина омелы и 45 мг/кг арабиноксилана.
Обсуждение
Экспрессия EGFR при раке легких отмечается в 40% - 80%, что делает его привлекательной мишенью для молекулярного вмешательства при этом заболевании. Эрлотиниб принадлежит к первым селективным агентам тирозинкиназы в EGFR.
Клинические исследования пациентов с распространенным немелкоклеточным раком легких (НМРЛ), которые ранее прошли курс химиотерапии, обнаружили скорость реакции на ингибитор тирозинкиназы EGFR от 8% до 15% [10,11]. Этот показатель был выше, если исследовались выборки пациентов с мутацией EGFR или другие эффектами.
В больших рандомизированных исследованиях пациентов с распространенным НМРЛ терапия Эрлотинибом была связана со значительно большей продолжительностью выживаемости без прогрессирования (2.2 и 1.8 месяцев) и общей выживаемости (6.7 и 4.7 месяца) [11,12].
Интересно, что в крупномасштабном исследовании, при котором медианы выживаемости 1466 пациентов сравнивались после химиотерапии (75 мг/м2 Docetxel каждые 3 недели) и после лечения ингибиторами РEGF (250 мг/день Гефитиниб), никаких существенных различий не было обнаружено [13].
Таким образом, полезное сочетание ингибиторов EGF со стандартизированными растительными иммуномодуляторами, имеющими патоген-ассоциированные молекулярные паттерны (ПАМП), может открыть новые перспективы в исследовании EGF.
Стандартизированные растительные экстракты вносят в клиническую практику много плюсов: они не вызывают каких-либо побочных эффектов, они хорошо переносятся, при их приеме не наблюдается серьезных нежелательных явлений [14,15].
МГН-3/BioBran® является модифицированным препаратом арабиноксилана, полученным из рисовых отрубей. Было установлено, что он может стимулировать клетки естественной иммунной системы Тип-1, и это с большой вероятностью происходит благодаря ПАМП-подобным свойствам компонентов арабиноксилана 17. Постоянно растущее количество доказательств поддерживает предположения об опухоль-ингибирующем действии MGN3/BioBran 20. Трехлетнее рандомизированное клиническое исследование показало значительное увеличение выживаемости пациентов с гепатоцеллюлярной карциномой после сочетания химиотерапии с арабиноксиланом по сравнению с проведением только курса химиотерапии [18].
До сих пор стандартизированные по лектину препараты экстракта омелы не были исследованы в проспективных, рандомизированных и контролируемых клинических испытаниях. Однако заслуживают внимания предыдущие клинические случаи[19,20], касающиеся лечения пациентов с саркомой или с метастазами в печень, показавшие удивительную ремиссию под действием иммуномодулирующего лечения с применением растительных экстрактов, которые были стандартизированы по уровню содержания лектина омелы (МЛ).
Как сообщалось ранее [9], ML, экстрагированный из листьев и стеблей экстракт омелы, и арабиноксилан, мягко экстрагированный из рисовых отрубей, могут выступать в качестве патоген-ассоциированных молекулярных паттернов (ПАМП-структур), которые способны связываться с соответствующими паттерн-распознающими рецепторами (ПРР) (в случае лектина - это ганглиозиды с окончаниями Neu5Ac Альфа-2-бета-6Gal 1-4GlcNAc-остатками, в случае арабиноксилана – лиганды пектинов) на мембранах фагоцитирующих клеток Типа-1 (например, макрофагов М1 или CD1 дендритных клеток).
Как известно, ПАМП-ПРР комплексы на мембранах фагоцитирующих клеток Типа-1 генерируют провоспалительные цитокины и IL-12, активируя цитотоксические эффекторные клетки, такие как натуральные киллеры (NK) и NK-T клетки, которые являются мощными ингибиторами опухолевого роста [5,6,21-24].
Поскольку NK-клетки постоянно присутствуют в периферической крови, они очень подходят для контроля уровня активации клеточных каскадов Тип-1 в иммунной системе. Контроль NK клеток в периферической крови показал, что эффективность лектина омелы синергетически возрастает при его сочетании с арабиноксиланом [25].
EGF-сигнализация часто дизрегулируется при различных формах рака. Онкогенные сигнальные белки репрограммируют метаболизм раковых клеток, чтобы увеличить выработку метаболитов гликолиза, способствующих росту опухоли. Было показано, что сигнальные EGF способствуют усилению гликолиза, что приводит к накоплению метаболических интермедиатов [26]. Один из этих полупродуктов, фруктоза 1.6 бифосфат, непосредственно связывается с EGFR и усиливает его активность.
Даный клинический случай свидетельствует о том, что улучшение регуляции EGFR-активируемой сигнализации и параллельное улучшение дизрегуляции в иммунной системе может открыть новые перспективы исследования опухолей. Могут ли полярность иммунной системы и полярность нейроэндокринной системы быть связаны друг с другом сильнее, чем это предполагалось до сих пор? Мы должны научиться модулировать объединенные регуляторные оси этих систем.
Благодарности
Авторы выражают благодарность г-жа Корнелия Ван ден Берг (ее гранты использованы для поддержки данного исследования).
Заявление о раскрытии информации
Авторы заявляют, что нет конкурирующих или других противоречащих интересов в отношении этого исследования.

Скрытое течение
Максим Руденко: Если брать всех вообще, кто умер от онкологических заболеваний, то среди мужчин рак лёгких как причина смерти стоит на первом месте (среди женщин – рак молочной железы). Этот вид рака вообще больше распространён среди мужчин, поскольку среди них больше курящих.
- То есть курение – фактор риска?
- Начнём с того, что рак лёгкого – собирательное понятие, на самом же деле его видов немало. Так вот, возникновение плоскоклеточного рака лёгкого, растущего из бронхов (его отличительная особенность в том, что он наименее поддаётся лекарственному лечению), обусловлено табакокурением. То есть это не просто фактор риска, это причина заболевания.
Среди всех пациентов, у кого выявлен рак лёгкого, один год переживает всего 50%. У более чем 70% пациентов злокачественное новообразование лёгкого выявляется на третьей и четвёртой стадиях. Тогда как самая высокая выживаемость (от 75 до 90%) регистрируется среди людей, у которых заболевание выявлено на первой стадии, но доля этих пациентов в среднем по России всего 11–12%. Плюс 14% - это вторая стадия, при которой 50% пациентов на фоне лечения переживают пятилетний рубеж.
- Печальная статистика. С чем это связано? С тем, что рак лёгких долго не выдаёт себя очевидными симптомами?
- Совершенно верно, для этого вида рака характерно скрытое течение, на ранней стадии заболевание не имеет выраженных клинических симптомов. Кроме того, это довольно агрессивная опухоль, которая выявляется тогда, когда уже есть либо метастазы, либо распространение в другие органы.

Кроме того, наш диспансер участвует в пилотном проекте по скринингу злокачественных новообразований лёгкого. Кто участвует в скрининге? Группа риска – это, прежде всего, курящие мужчины в возрасте от 45-50 лет или те, которые бросили курить ранее 15 лет назад.
Но выявление выявлением, а всё же лучше всего начать с профилактики рака лёгкого.

А смысл?

- Однозначно – в отказе от курения! Причем не только активного, но и пассивного.
- Ну да, при этом бросив курить, 15 лет человек всё равно будет числиться в группе риска. В чём тогда смысл?
- Смотрите, после отказа от курения в течение 20 минут происходит снижение артериального давления и частоты сердечных сокращений. В течение 12 часов – снижение уровня оксида углерода в крови до нормального значения. В течение 48 часов восстанавливаются нервные окончания, ощущения запаха и вкуса. Трёх месяцев достаточно для улучшения кровообращения и функции лёгких. Если человек продержался без курения год, риск возникновения ишемической болезни сердца снижается вдвое; если пять лет, риск возникновения инсульта снижается до уровня некурящих людей, плюс значительное снижение риска развития некоторых видов рака (ротовой полости, глотки, мочевого пузыря, шейки матки). За десять лет вдвое снижается риск смерти от рака лёгкого, наблюдается значительное снижение развития рака гортани и поджелудочной железы. А за 15 – риск развития ишемической болезни сердца и обструктивной болезни лёгких. Как видите, причины отказа от курения весьма убедительны. И в этом отношении российское законодательство справедливо ограничивает нас от табачного дыма во многих общественных местах.
- Отказ от курения – единственная мера профилактики рака лёгких?
- Главная, но не единственная. Другими мерами профилактики также не следует пренебрегать. Скажем, стоит стараться избегать воздействия на организм канцерогенов, придерживаться рационального питания: употребление достаточного количества витаминов, бета-каротина, антиоксидантов, витамина Е также снижает риск возникновения рака лёгкого. Но! На фоне отказа от курения. Замечу, что до эпохи массового производства сигарет и их широкой доступности рак лёгкого был казуистикой.

- Таких исследований пока нет, думаю, судить о воздействии вейпов на организм можно будет позже, когда в поле зрения учёных попадут люди, имеющие многолетний опыт нового на сегодняшний день увлечения. То есть нынешняя молодежь. О результатах будущих исследований сегодня судить сложно, но есть ли смысл рисковать? Бог не дал нам, людям, дымохода, так зачем нам дымить?
- Какие методы лечения рака лёгких сегодня применяются?
- На сегодняшний день самый эффективный метод лечения – это хирургический (он применяется на первой стадии заболевания). Кроме того, используется химеотерапия, лучевые методы лечения и их комбинация.
Хирургическое лечение подразумевает удаление поражённой части лёгкого или всего лёгкого. Понятно, что при удалении доли лёгкого качество жизни не так страдает, как при удалении целого органа – в этом случае, бывает, люди погибают не от развития рака, а от осложнений со стороны сердечно-сосудистой системы, поскольку сердцу сложно работать с одним лёгким. Но мы в отделении торакальной хирургии Свердловского областного онкологического диспансера идём по пути органосохраняющих операций, делаем их всё больше и больше, тем более что сегодня в России и в нашем диспансере активно развивается малоинвазивная хирургия.
- Вернёмся к началу разговора. Я правильно понимаю, что рак лёгких на ранней стадии у человека – это, как правило, случайная находка?
- Совершенно верно. Люди, например, идут делать операцию на глаза или на сердце, и у них выявляется рак лёгкого.

- Специфических симптомов у рака лёгкого нет, они все схожи с симптомами любых лёгочных заболеваний. Допустим, кровохарканье может быть и при туберкулёзе, и при пневмонии (особенно вирусной), и при раке лёгкого. Одышка, повышение температуры также могут быть при банальной пневмонии. Но должна быть онкологическая настороженность. То есть, если пациент входит в группу риска, на эти симптомы следует обратить внимание с точки зрения онкологии. Но это больше касается медиков. А людям при любом длительном кашле следует идти к врачу, который выслушает и сопоставит жалобы, направит на флюорографию.
- Специалисты первичного звена здравоохранения, то есть врачи в поликлиниках, имеют настороженность по отношению к раку?
- Я не могу сказать за каждого конкретного человека. Но мы со своей стороны делаем всё возможное для повышения этой настороженности. Специалисты онкологического диспансера регулярно проводят лекции для первичного звена здравоохранения (есть даже клинические рекомендации по выявлению рака лёгкого для первичного звена), активно используют возможности телемедицины.
- Какие индивидуальные особенности влияют на то, что у одних курящих людей возникает рак лёгкого, а у других нет?

Понимаете, мы не говорим, что если человек курит, то он обязательно заболеет раком лёгкого. Но те, кто болеет, все курят. Думаю, больше половины пациентов не оказались бы в нашем отделении, если бы не курили.
- Мы всё больше говорим про мужчин, а есть ли среди ваших пациентов женщины?
- Конечно. Более того, в последнее время женщин, у которых диагностирован рак лёгких, становится всё больше. Простой пример. Двадцать лет назад, когда я только начинал работать, у нас была одна женская палата, потом появилась необходимость открыть ещё одну, потом ещё…
- Сколько лет было самому молодому вашему пациенту?
Читайте также:


