Клеточная линия острого лейкоза
Здесь мы описываем установление и характеристику первой клеточной линии острой лейкемии с смешанным фенотипом (JIH-5). Линия клеток JIH-5 была установлена из клеток лейкемии с B-лимфоидным / миелоидным фенотипом у женщин-пациентов с острой лейкемией из смешанного фенотипа. Ячейки JIH-5 демонстрируют иммунофенотип, состоящий из миелоидных и В-лимфоидных антигенов. Секвенирование целых экзонов выявило соматические мутации у девяти генов в клетках JIH-5. Транскрипционное секвенирование клеток JIH-5 идентифицировало транскрипцию транскрипции EP300-ZNF384, которая является рецидивирующим изменением в остром лимфобластном лейкемии В-клеток. Наши результаты показывают, что клеточная линия JIH-5 может служить инструментом для изучения острого лейкоза смешанного фенотипа или EP300-ZNF384.
У меньшинства пациентов с острой лейкемией трудно определить происхождение линии из-за экспрессии как лимфоидных, так и миелоидных специфических для линии антигенов 4. В классификации Всемирной организации здравоохранения (ВОЗ) 2008 года было введено новое обозначение для этого лица, острый лейкоз смешанного фенотипа (MPAL) [6]. Опухолевые клетки характеризуются различными биомаркерами, такими как цитогенетические, молекулярно-генетические или эпигенетические аберрации 10. Однако патогенез и оптимальная терапия пациентов с MPAL остаются в значительной степени неопределенными. Хотя несколько клеточных линий лейкемии были однажды сообщены как клеточные линии BAL 12, ни один из них не соответствует критериям ВОЗ 2008 для MPAL. До сих пор ни одна клеточная линия, установленная у пациентов с MPAL, не сообщалась. Недавно мы создали первую линию клеток MPAL человека, JIH-5. Здесь мы представляем фенотипические, генетические и функциональные свойства клеток JIH-5. Мы применили технологию секвенирования следующего поколения (NGS) для распутывания транскриптома клеток JIH-5.
21-летняя женщина с MPAL была госпитализирована в нашу больницу в декабре 2008 года. Образец костного мозга был получен от пациента с информированным согласием в декабре 2009 года во время второго рецидива. Мононуклеарные клетки культивировали в модифицированной средой Дульбекко Искове с 20% фетальной телячьей сывороткой. Лейкозные клетки проявляли постепенную пролиферацию клеток через 2 месяца после начала первичной культуры. Линию клеток обозначили JIH-5. Ячейки JIH-5 были толерантными к замораживанию в определенной среде, хранению в жидком азоте, оттаиванию и последующему расширению. Ячейки JIH-5 растут как отдельные клетки в суспензионной культуре.
Ячейки JIH-5 проявляют сфероидальные морфологии среднего размера и крупные круглые ядра с тонким ядерным хроматином (рис.1а). Иммунопрофили клеток JIH-5 суммированы в таблице 1. Ячейки JIH-5 экспрессируют типичные антигены миелоидных линий (CD13, CD15, CD33 и cMPO), а также антигены лимфоидных линий B (CD10, CD19, CD22, CD23 и cCD79a) (фиг.1b). Отрицательная полимеразная цепная реакция (ПЦР) с EBV и микоплазменными специфическими праймерами исключает загрязнение EBV и микоплазмы. Скорость образования колоний клеток JIH-5 составляла 1,41% по полутвердому клоногенному методу метилцеллюлозы. Опухолевые массы были обнаружены у одной из шести мышей, которым вводили клетки JIH-5 через 83 дня. Генетическую идентичность клеток JIH-5 сравнивали с образцом клеток BM у пациента с использованием короткой повторной ПЦР с повторением тандема. Результаты анализа аутентификации показали, что клетки JIH-5 оставались генетически идентичными исходным опухолевым клеткам. 1 Морфологический и иммунофенотипический анализ JIH-5. а. Морфология клеток SHI-1 при окраске Райта под световой микроскопией (первоначальное увеличение × 1000). б. Иммунофенотипические особенности клеток JIH-5
Иммунофенотипическая характеристика клеток JIH-5 и клеток первичного лейкоза
Комбинированный G-диапазон и спектральный кариотип (SKY) дали следующий кариотип для JIH-5: 46, XX, del (2) (q33) t (2; 2) (p22; q37), t (4; 5) (q35 ; Q35), т (5; 8) (q32; q22), дер (6) дель (6) (p21p22) т (6; 10) (p23; q23), т (7; 21) (p15; q21) , дер (9) дель (9) (р21) дель (9) (q34.2), дер (10) T (6; 10), т (12; 22) (p13; q13), дер (17) т (17; 17) (p13; q22), del (19) (q13) (фиг.2a, b). A-CGH обнаружил в общей сложности десять изменений количества копий (CNA). Как флуоресценция in situ гибридизации (FISH), так и a-CGH-анализ показали микроделецию, влияющую на ген ETV6 (фиг.2c, d). Никаких мутаций не было обнаружено у 15 острых лейкозных генов путем прямого секвенирования продуктов ПЦР в клетках JIH-5. Глобальный профиль экспрессии JIH-5 сравнивали с лейкозными взрывными клетками у пациента и диапазон клеточных линий, представляющих острый лимфобластный лейкоз B и T-клеток (T-ALL). Результаты показывают, что транскрипционные клетки JIH-5 более близко напоминают клеточные линии B, а не T-ALL. 2 Цитогенетический анализ JIH-5. Анализ SKY (a) и G-banding (b) выявил сложный псевдодиплоидный кариотип, в котором хромосомы 15/46 показали видимые перегруппировки (стрелки). Анализ FISH с использованием клонов золотого пути генов в точках ближнего следования идентифицировал микроделецию, влияющую на область 12p13, охватывающую BAC-клон RP11-94N22, который несет ген ETV6 (c). d Изображение показывает анализ массива CGH (244 K) в клетках JIH-5 выявил 0,15-Mb делецию (11.80-11.95 Mb) в гене ETV6. Цитогенетическую сборку, маркировку и флуоресцентную микроскопию проводили, как описано ранее
Мы захватили и секвенировали экзоты из парного образца клеток JIH-5 и контрольного образца в ремиссии. Мы обнаружили соматические опухолевые специфические мутации в общей сложности из девяти генов (восемь missense и одна бессмысленная мутация), включая ABCA8, BCHE, CALCA, CSTF2, FPR1, KCNJ8, MAFB, STMN1 и TAAR8; все были гетерозиготными в клетках JIH-5. Биоинформационная оценка данных секвенирования транскрипции и проверки RT-PCR выявила шесть новых слияний, включающих три действия в качестве транслокаций: EP300 (при 22q13) как с соседними ZNF384, так и с CHD4 (12p13), MSH2 (2p21) с NLK (17q11) и три микроделеции, HACL1-COLQ (3p25), HDAC8-CITED1 (Xq13) и POLA2-CDC42EP2 (11q13). Интересно, что ген EP300 обнаружил, что он сливается одновременно с двумя генами партнеров, расположенными в 12p13, CHD4 и ZNF384 (фиг.3a). Дальнейший анализ FISH с клонами BAC и fosmid, фланкирующими EP300, CHD4 и ZNF384, подтвердил точки останова в CHD4 и EP300 из-за сложной, по-видимому, инсерционной перегруппировки с участием 12p13 и 22q13 (фиг.3b). Мутации EP300 были обнаружены при синдроме Рубинштейна-Тайби и некоторых твердых опухолях 19. Было установлено, что EP300 слит с MLL у пациента AML, укрывающего t (11; 22) (q23; q13) [23]. CHD4 кодирует каталитическую субъединицу комплекса NuRD и играет важную роль в регуляции транскрипции, сборе хроматина и восстановлении повреждений ДНК [24]. Ген ZNF384 наблюдался рецидививно слитый с EWSR1, TAF15 или E2A при острой лейкемии [25, 26]. Недавно EP300-ZNF384 идентифицировали как рецидивирующую аберрацию при острой лимфобластной лейкемии В-клеток (B-ALL) [27]. Генетические аномалии, обнаруженные в клетках JIH-5, приведены в таблице 2. Рис. 3Fusion EP300 (расположен на 22q13) с CHD4 и ZNF384 (при 12p13). данные секвенирования Sanger подтвердили два новых транскрипта слияния, включающих ген EP300, включая CHD4 (экзон 2) с EP300 (экзон 2) и EP300 (экзон 6) с ZNF384 (экзон 3). b Слияние EP300 (расположенное на 22q13) с CHD4 и ZNF384 (при 12p13), по-видимому, было результатом сложной серии геномных перегруппировок, как показано хромосомной картиной (левые гомологи) и FISH (справа) с использованием клонов BAC и fosmid tilepath ( верхняя панель). Обратите внимание на наличие двух дискретных областей chr. 12-производный материал на der (22), подразумевающий сложное, возможно, инсерционное событие. Эта картина поддерживается FISH, показывающей интеркремент chr. 12- и 22-производные BAC-клоны около 9 MBp от 12p13 (нижняя панель). FISH выявила точки останова в RP11-1137p19 и 1078o11 с участием областей ZNF384 / CHD4 и EP300, участвующих в событиях слияния
Сводка данных по клеточной линии JIH-5
Таким образом, мы создали новую линию клеток MPAL, JIH-5, и полностью описали ее биологический фон, чтобы показать новый онкогеномный генный синтез вместе с ассоциированным кластером мутаций. Наши результаты показали, что клеточная линия JIH-5 может служить инструментом для изучения MPAL или EP300-ZNF384.
В-клеточный острый лимфобластный лейкоз
флуоресценция in situ гибридизации
митоксантрон, цитозин-арабинозид, виндезин и дексаметазон
острый лейкоз смешанного фенотипа
последовательность следующего поколения
ремоделирование нуклеосом и деацетилаза
полимеразной цепной реакции
Т-клеточный острый лимфобластный лейкоз
Нана Пин Хуйин Цю и Цянь Ван внесли вклад в эту работу.
Авторы заявляют, что у них нет конкурирующих интересов.
Главным исследователем был СК. NP, HQ и QW выполнили большую часть экспериментов. SE, CR и RM проводили анализ матрицы цитогенетического анализа и экспрессии генов. SC, HD и RM написал рукопись. Все авторы прочитали и утвердили окончательную рукопись.
Эта работа была поддержана грантами от национальных ключевых научных проектов Китая (2011CB933501), Программы приоритетных академических программ высших учебных заведений Цзянсу, Фонда естественных наук Китая (81070416, 81270617), Специальной программы медицинской науки провинции Цзянсу ( BL2012005), ключевой медицинский центр провинции Цзянсу (ZX201102), Национальный фонд научных исследований общественного здравоохранения (No.201202017) и Фонд естественных наук провинции Цзянсу для выдающихся молодых ученых (BK2012006).
Общие сведения о острых лейкозах
Острые лейкозы (ОЛ) - опухолевые клональные заболевания гемопоэтической ткани, при котором лейкемическая трансформация генетического аппарата происходит на уровне мультилинейной стволовой или коммитированной клетки-предшественницы.
Для них характерно первичное поражение костного мозга (КМ) морфологически незрелыми кроветворными (бластными) клетками с вытеснением ими нормальных элементов и инфильтрацией различных органов и тканей.
Принадлежность бластных клеток к той или иной линии кроветворения, степень их дифференцировки обуславливают клиническое течение острого лейкоза, проводимую терапию, эффективность лечения и прогноз.
Диагностика острых лейкозов включает исследование периферической крови, КМ и в отдельных случаях - проведение трепанобиопсии. Анемия, нейтропения и тромбоцитопения обычно присутствуют у большинства больных ОЛ. Морфологическая оценка состава пунктата костного мозга является базовой при диагностике острых лейкозов.
Без подсчета миелограммы нельзя интерпретировать данные других методов исследования. Характерным признаком ОЛ является бластная метаплазия. Для установления диагноза острый лейкоз число бластов в миелограмме должно превышать 20%, независимо от их наличия или отсутствия в периферической крови.
Современный алгоритм диагностики и дифференциальной диагностики вариантов острых лейкозов включает следующие методы исследования:
- морфологический,
- цитохимический,
- иммунофенотипический,
- цитогенетический.
К морфологическим критериям характеристики бластов относятся:
- размер клеток (макро, мезо, микрогенерации),
- форма ядер (округлая, складчатая, моноцитоидная),
- наличие зернистости и/или палочек Ауэра в цитоплазме,
- ядерно-цитоплазматическое соотношение (высокое, умеренное, низкое).
Именно на основании морфологических признаков в случаях уточнения вариантов острого миелоидного лейкоза (ОМЛ) лейкемические миелобласты и монобласты разделяются на клетки с наличием или отсутствием признаков созревания.
Основой современной диагностики острых лейкозов послужила FAB-классификация, предложенная в 1976 г. После ее пересмотра в 1991 г. установлены критерии выделения 8 типов - М0-М7-острых миелоидных и трех типов Л1-Л3, В- и Т-острых лимфобластных лейкозов (ОЛЛ).
Классификация
Классификация ОЛ (1997г.) базируется на данных морфологического, цитохимического, иммунологического и цитогенетического исследований.
Общепринятым является выделение следующих вариантов ОЛ:
М0 - миелобластный с минимальной дифференцировкой,
М1 - миелобластный без созревания,
М2 - миелобластный с созреванием,
М2 баз. - базофильно-клеточный,
М3 - промиелоцитарный,
М4 - миеломонобластный,
М5а - монобластный без созревания,
М5в - монобластный с созреванием,
М6 - эритромиелоз,
М7 - мегакариобластный,
Л1 - В- и Т-линейный,
Л2 - В- и Т-линейный,
Л3 - В-линейный типа лимфомы Беркитта.
В 2008 году Всемирная организация здравоохранения (ВОЗ) приняла новую систему классификации миелоидных и лимфоидных новообразований. Основные принципы этой системы состояли в том, чтобы при классификации использовать не только морфологические характеристики, но и дополнительную информацию, включая клинические, генетические, иммунофенотипические и молекулярно-биологические данные для определения специфических нозологических форм заболеваний.
Подобно классификации FAB, система ВОЗ основывается на морфологических, цитохимических и иммунофенотипических характеристиках неопластических клеток, принадлежащих к определенной клеточной линии, находящейся на определенной стадии дифференцировки.
Однако имеются и некоторые отличия. Определение процента бластов с учетом степени их зрелости и диспластических аномалий рекомендуется проводить путем дифференцированного подсчета 200 нейтрофильных лейкоцитов периферической крови и 500 клеток миелоидного ростка в препаратах костного мозга.
В число бластов периферической крови и КМ не включены клетки, экспрессирующие антиген CD34; хотя все гемопоэтические клетки CD34+ являются бластами, но не все бласты экспрессируют антиген CD34.
Цитохимическая диагностика (миелопероксидаза, неспецифические эстеразы и др.) и/или иммунофенотипирование (определение миелоидных антигенов, таких как CD13, CD33, CD 117 и др.) могут иметь значение в определении принадлежности бластных клеток к одной или нескольким миелоидным линиям, что дополняет специфические морфологические данные (например, наличие палочек Ауэра).
Хотя FAB-классификация дает возможность распознавания морфологической гетерогенности ОМЛ, она не отражает генетической или клинической разнородности заболевания.
Некоторые исследователи считают, что в ОМЛ целесообразно выделение двух подгрупп в зависимости от наличия или отсутствия миелодиспластического синдрома:
- острый миелоидный лейкоз, которому предшествует МДС или который имеет признаки МДС,
- ОМЛ, который возникает de novo без признаков миелодисплазии.
Характеристики, связанные с этими двумя подгруппами, показывают, что имеются два фундаментально различных механизма лейкомогенеза. МДС-обусловленный ОМЛ связан с мультилинейной дисплазией, цитогенетическими данными за неблагоприятный прогноз, что часто включает потерю цитогенетического материала, и плохим ответом на проводимую терапию.
При ОМЛ de novo мультилинейная дисплазия отсутствует, часто имеется наличие генетических аномалий группы благоприятного прогноза, в частности - наличие инверсий и обратимых хромосомных транслокаций, с хорошим ответом на терапию, с длительной безрецидивной и общей выживаемостью.
Этот тип острого миелоидного лейкоза стабильно проявляется в любой возрастной группе, но чаще встречается в детском и молодом возрасте. Возможно, что специфические геномные изменения, ассоциированные с этим вариантом лейкоза, с частым вовлечением в процесс факторов транскрипции, играют большую роль в его патогенезе.
Показано, что пациенты с количеством бластов от 20 до 29% в крови или КМ часто имеют сходные клинические данные, а также сходный ответ на терапию и имеют одинаковую продолжительность жизни в сравнении с пациентами, которые имеют 30% или более бластов.
Согласно FAB-классификации, пациентов с количеством бластов 20-29% относят к группе рефрактерной анемии с избытком бластов в стадии бласттрансформации (РАИБТ). По классификации ВОЗ, у большинства пациентов с 20-29% бластов заболевание классифицируют как ОМЛ с мультилинейной дисплазией - подгруппа включает пациентов как с предшествующим МДС, так и пациентов с первичным ОМЛ и дисплазией множественных клеточных линий. ОМЛ с мультилинейной дисплазией рассматривается как более выраженное проявление МДС.
Миелоидные клетки при РАИБТ и ОМЛ с предшествующим МДС имеют идентичные профили пролиферации и апоптоза, что отличает их от клеток при рефрактерной анемии (РА), рефрактерной анемии с кольцевыми сидеробластами (РАКС) и рефрактерной анемии с избытком бластов (РАИБ). При этом часто повышена экспрессия протеина множественной лекарственной устойчивости (МЛУ).
Основные различия между классификацией ВОЗ и FAB-классификацией:
- снижение процента бластов в периферической крови или костном мозге с 30 до 20%,
- распределение ОМЛ по клиническим и биологическим подгруппам,
- при наличии клональных обратимых цитогенетических аномалий: t (8; 21) (q22; q22), inv (16) (p13; q22), t (16; 16) (p13; q22), t (15; 17) (q22; q12) диагноз ОМЛ выставляется независимо от процента бластов в периферической крови и/или костном мозге;
- пациенты с 20-29% бластов и мультилинейной дисплазией отнесены к группе ОМЛ с мультилинейной дисплазией - эта подгруппа включает как пациентов с предшествующим МДС, так и пациентов с первичным ОМЛ и дисплазией нескольких клеточных линий.
Острые миелоидные лейкозы, опухоли из клеток-предшественников и острые лейкозы неопределенных клеточных линий (классификация ВОЗ, 2008 г.):
• острый миелоидный лейкоз с повторяющимися генетическими аномалиями:
- острый миелоидный лейкоз с t (8; 21) (q22; q22); RUNX1-RUNX1T1,
- острый миелоидный лейкоз с inv (16) (p13,1; q22) or t (16; 16) (p13,1; q22); CBF-MYH11,
- острый промиелоцитарный лейкоз с t (15; 17) (q22; q12); PML-RARA,
- острый миелоидный лейкоз с t (9; 11) (p22; q23); MLLT3-MLL,
- острый миелоидный лейкоз с t (6; 9) (p23; q34); DEK-NUP214,
- острый миелоидный лейкоз с inv (3) (q21; q26,2) или t (3; 3) (q21; q26,2); RPN1-EVI1,
- острый (мегакариобластный) лейкоз с t (1; 22) (p13; q13); RBMT15-MKL1,
- условная подгруппа: острый миелоидный лейкоз с мутантной NPM1,
- условная подгруппа: острый миелоидный лейкоз с мутантной СЕВРА,
• острый миелоидный лейкоз с изменениями, связанными с миелодисплазией,
• миелоидные неоплазии, ассоциированные с предшествующей терапией,
• другие варианты острого миелоидного лейкоза, неспецифицированные:
- острый миелоидный лейкоз с минимальной дифференцировкой,
- острый миелоидный лейкоз без созревания,
- острый миелоидный лейкоз с созреванием,
- острый миеломоноцитарный лейкоз,
- острый монобластный/острый моноцитарный лейкоз,
- острый эритролейкоз:
♦ чистый эритролейкоз,
♦ эритролейкоз, эритроидно/миелоидный,
- острый мегакариобластный лейкоз,
- острый базофильный лейкоз,
- острый панмиелоз с миелофиброзом,
Миелоидная пролиферация, относящаяся к синдрому Дауна:
- транзиторный аномальный миелопоэз,
- миелоидный лейкоз, ассоциированный с синдромом Дауна,
- властное новообразование из плазмоцитоидных дендритических клеток.
Острый лейкоз неопределенных линий:
- острый недифференцируемый лейкоз,
- острый лейкоз смешанного фенотипа с t (9; 22) (q34; q11,2); BCR-ABL1,
- острый лейкоз смешанного фенотипа с t (v; 11q23); и peaранжировкой MLL,
- острый лейкоз смешанного типа, В/миелоидный неспецифицированный,
- острый лейкоз смешанного фенотипа, Т/миелоидный неспецифицированный,
- условная подгруппа: лимфобластный лейкоз/лимфома из NK-клеток.
В-лимфобластный лейкоз/лимфома
В-лимфобластный лейкоз/лимфома, неспецифицированный
В-лимфобластный лейкоз/лимфома с повторяющимися генетическими аномалиями
В-лимфобластный лейкоз/лимфома с t (9:22) (q34; q11,2); BCR-ABL1
В-лимфобластный лейкоз/лимфома с t (v; 11q23); реаранжировка MLL
В-лимфобластный лейкоз/лимфома с t (12; 21) (p13; q22); TEL-AML1 (ETV6-RUNX1)
В-лимфобластный лейкоз/лимфома с гипердиплоидией
В-лимфобластный лейкоз/лимфома с гиподиплоидией
В-лимфобластный лейкоз/лимфома с t (5; 14) (q31; q32); IL3-IGH
В-лимфобластный лейкоз/лимфома с t (1; 19) (q23; p13,); E2A-PBX1 (TCF3-PBX1)
Виды лейкозов - острые и хронические
Анатомия и физиология костного мозга
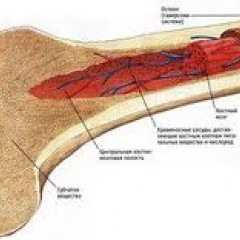
Костный мозг – это ткань находящаяся внутри костей, преимущественно в костях таза. Это самый главный орган, участвующий в процессе кроветворения (рождение новых клеток крови: эритроцитов, лейкоцитов, тромбоцитов). Этот процесс необходим организму, для того чтобы, заменить погибающие клетки крови, новыми. Костный мозг состоит из фиброзной ткани (она образует основу) и кроветворной ткани (клетки крови на разных этапах созревания). Кроветворная ткань включает 3 клеточные линии (эритроцитарный, лейкоцитарный и тромбоцитарный), по которым образуются соответственно 3 группы клеток (эритроциты, лейкоциты и тромбоциты). Общим предком этих клеток, является стволовая клетка, которая запускает процесс кроветворения. Если нарушается процесс образования стволовых клеток или их мутация, то нарушается процесс образования клеток по всем 3 клеточным линиям.
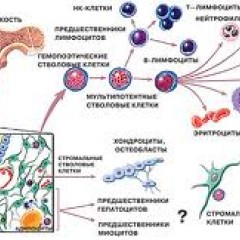
Эритроциты – это красные кровяные клетки, содержат гемоглобин, на нём фиксируется кислород, при помощи которого питаются клетки организма. При недостатке эритроцитов происходит недостаточное насыщение клеток и тканей организма кислородом, в результате чего проявляется различными клиническими симптомами.
Лейкоциты к ним относятся: лимфоциты, моноциты, нейтрофилы, эозинофилы, базофилы. Представляют собой белые клетки крови, они играют роль в защите организма и выработке иммунитета. Их недостаток вызывает снижение иммунитета и развитие различных инфекционных заболеваний.
Тромбоциты – это кровяные пластинки, которые участвуют в образовании тромба. Недостаток тромбоцитов приводит к различным кровотечениям.
Подробнее о видах кровяных клеток читайте в отдельной статье пройдя по ссылке.
Причины лейкоза, факторы риска
Симптомы различных видов лейкозов
- При острых лейкозахотмечаются 4 клинических синдрома:
- Анемический синдром: развивается из-за недостатка выработки эритроцитов, могут присутствовать множество симптомов или некоторые из них. Проявляется в виде усталости, бледности кожи и склер, головокружение, тошнота, быстрое сердцебиение, ломкость ногтей, выпадение волос, патологическое восприятие запаха;
- Геморрагический синдром: развивается в результате недостатка тромбоцитов. Проявляется следующими симптомами: вначале кровотечения из десен, образование синяков, кровоизлияния в слизистые оболочки (язык и другие) или в кожу, в виде мелких точек или пятен. В дальнейшем при прогрессировании лейкоза, развиваются и массивные кровотечения, в результате ДВС синдрома (диссеминированное внутрисосудистое свёртывания крови);
- Синдром инфекционных осложнений с симптомами интоксикации: развивается в результате недостатка лейкоцитов и с последующим снижением иммунитета, повышение температуры тела до 39 0 С, тошнота, рвота, потеря аппетита, резкое снижение веса, головная боль, общая слабость. У больного присоединяются различные инфекции: грипп, пневмония, пиелонефрит, абсцессы, и другие;
- Метастазы - по току крови или лимфы опухолевые клетки попадают в здоровые органы, нарушая их структуру, функции и увеличивая их в размере. В первую очередь метастазы попадают в лимфатические узлы, селезёнку, печень, а потом и в другие органы.
Эритробластный острый лейкоз, поражаются клетки предшественницы, из которых в дальнейшем должны развиться эритроциты. Чаще встречается в пожилом возрасте, характеризуется выраженным анемическим синдромом, не наблюдается увеличение селезёнки, лимфатических узлов. В периферической крови снижено количество эритроцитов, лейкоцитов и тромбоцитов, наличие молодых клеток (эритробластов).
Монобластный острый лейкоз, нарушается выработка лимфоцитов и моноцитов, соответственно они будут снижены в периферической крови. Клинически, проявляется, повышением температуры и присоединением различных инфекций.
Мегакариобластный острый лейкоз, нарушается выработка тромбоцитов. В костном мозге при электронной микроскопии обнаруживают мегакариобласты (молодые клетки, из которых образуются тромбоциты) и увеличенное содержание тромбоцитов. Редкий вариант, но чаще встречается в детском возрасте и обладает неблагоприятным прогнозом.
Хронический миелолейкоз, усиленное образование миелоидных клеток, из которых образуются лейкоциты (нейтрофилы, эозинофилы, базофилы), в результате чего, уровень этих групп клеток будет повышен. Долгое время может протекать бессимптомно. Позже появляются симптомы интоксикации (повышение температуры, общая слабость, головокружение, тошнота), и присоединение симптомов анемии, увеличение селезёнки и печени.
Хронический лимфолейкоз, усиленное образование клеток - предшественниц лимфоцитов, в результате уровень лимфоцитов в крови повышается. Такие лимфоциты не могут выполнять свою функцию (выработка иммунитета), поэтому у больных присоединяются различные виды инфекций, с симптомами интоксикации.
Диагностика лейкоза
- Повышение уровня лактатдегидрогеназы (норма 250 Ед/л);
- Высокий АСАТ (норма до 39 Ед/л);
- Высокая мочевина (норма 7,5 ммоль/л);
- Повышение мочевой кислоты (норма до 400 мкмоль/л);
- Повышение билирубина ˃20мкмоль/л;
- Снижение фибриногена 30%;
- Низкий уровень эритроцитов, лейкоцитов, тромбоцитов.
- Трепанобиопсия (гистологическое исследование биоптата из повздошной кости): не позволяет точно поставить диагноз, а лишь определяет разрастание опухолевых клеток, с вытеснением нормальных клеток.
- Цитохимическое исследование пунктата костного мозга: выявляет специфические ферменты бластов (реакция на пероксидазу, липиды, гликоген, неспецифическую эстеразу), определяет вариант острого лейкоза.
- Иммунологический метод исследования: выявляет специфические поверхностные антигены на клетках, определяет вариант острого лейкоза.
- УЗИ внутренних органов: неспецифический метод, выявляет увеличенные печень, селезёнку и другие внутренние органы с метастазами опухолевых клеток.
- Рентген грудной клетки: является, неспецифическим метом, обнаруживает наличие воспаления в лёгких при присоединении инфекции и увеличенные лимфатические узлы.
Лечение лейкозов
- Полихимиотерапия, применяется с целью противоопухолевого действия:
- Трансфузионная терапия: эритроцитарная масса, тромбоцитарная масса, изотонические растворы, с целью коррекции выраженного анемического синдрома, геморагического синдрома и дезинтоксикации;
- Общеукрепляющая терапия:
- применяется с целью укрепления иммунитета. Дуовит по 1 таблетке 1 раз в день.
- Препараты железа, для коррекции недостатка железа. Сорбифер по 1 таблетке 2 раза в день.
- Иммуномодуляторы повышают реактивность организма. Тималин, внутримышечно по 10-20 мг 1 раз в день, 5 дней, Т-активин, внутримышечно по 100 мкг 1 раз в день, 5 дней;
- Гормонотерапия: Преднизолон в дозе по 50 г в день.
- Антибиотики широкого спектра действия назначаются для лечения присоединяющих инфекций. Имипенем по 1-2 г в сутки.
- Радиотерапия применяется для лечения хронического лейкоза. Облучение увеличенной селезёнки, лимфатических узлов.
Использование солевых повязок с 10% солевым раствором (100 г соли на 1 литр воды). Намочить льняную ткань в горячем растворе, ткань немного сжимать, сложить в четверо, и накладывать на больное место или опухоль, закрепить лейкопластырем.
Настой из измельчённых игл сосны, сухая кожа лука, плоды шиповника, все ингредиенты смешать, залить водой, и довести до кипения. Настоять сутки, процедить и пить вместо воды.
Употреблять соки из красной свеклы, граната, моркови. Кушать тыкву.
Настой из цветков каштана: взять 1 столовую ложку цветков каштана, залить в них 200 г воды, вскипятить и оставить настаиваться на несколько часов. Пить по одному глотку на один приём, необходимо выпить 1 литр в день.
Хорошо помогает в укреплении организма, отвар из листьев и плодов черники. Кипятком примерно 1 литр, залить 5 ложек листьев и плодов черники, настоять несколько часов, выпивать всё за один день, принимать около 3 месяцев.
Острый лимфобластный лейкоз у взрослых
Точные причины заболевания ученым до сих пор неизвестны.
Но существуют определенные факторы риска, в числе которых:
- возраст;
- половая принадлежность (у мужчин заболевание встречается чаще, чем у женщин);
- принадлежность к белой расе, (темнокожие меньше подвержены этому заболеванию);
- пройденное ранее лечение онкологических заболеваний и облучение;
- наличие генетических нарушений (Синдром Дауна).
Симптомы
Ранние симптомы лимфолейкоза характеризуются признаками, которые могут быть похожими на грипп, любые другие инфекционные заболевания и гематологические заболевания. Необходимо проконсультироваться с врачом, если любой из нижеперечисленных симптомов у вас проявляется часто:
- быстрая утомляемость, слабость и сонливость в течение дня;
- извращение вкуса (тяга к продуктам, которые раньше не нравились), отсутствие аппетита;
- резкая и беспричинная на первый взгляд потеря веса;
- одышка;
- неестественная бледность;
- повышенная температура;
- боли в суставах, в животе;
- множественные гематомы, появляющиеся спонтанно, частые кровотечения;
- чувство распирания в зоне ниже ребер;
- увеличивающиеся лимфоузлы на шее, подмышках, животе или в паху.
Хронический лимфобластный лейкоз характеризуется длительным отсутствием признаков качественного изменения в поведении опухолевых клеток при проводимом лечении. Хроническая форма этого недуга относится к одному из наиболее распространенных онкогематологических заболеваний. Также это наиболее частый вариант рака крови среди представителей европеоидной расы. Не совсем обычным клиническим проявлением этого заболевания может быть гиперреактивность человека в ответ на укусы насекомых.
Т-клеточный острый лимфобластный лейкоз
Хронический лимфолейкоз, представленный Т-лимфоцитами, встречается примерно в 5% случаев.
Это опухоль из лимфоцитов CD4, вызванная Т-лимфотропным вирусом человека типа 1 (HTLV-I). Заболевание проявляется генерализованным (распространяющимся по всему организму) увеличением лимфоузлов и поражением кожи. Из-за иммунодефицита очень высока частота вторичных инфекций.
Мужчины болеют чаще, чем женщины. Для лечения применяют различные комбинации противоопухолевых средств.
Лечение
На сегодняшний день существует несколько способов лечения острого лейкоза:
- химиотерапия – терапия сильнодействующими химиопрепаратами. Лекарства могут приниматься перорально (в виде таблеток, капсул) или же больному вводятся внутривенные или внутримышечные инъекции;
- лучевая терапия – способ лечения рака, при котором врач использует рентгеновское излучение или другие виды радиационных излучений;
- трансплантация стволовых клеток, которая применяется для замещения патологических кровообразующих клеток полноценными.
Все эти способы с успехом применяются в международном медицинском центре ОН КЛИНИК, где за годы работы высококвалифицированные врачи спасли тысячи жизней больных лимфобластным лейкозом.
Прогноз
Без лечения лимфолейкоз может привести к гибели больного в течение нескольких месяцев или даже недель. При своевременном обращении примерно у 40-50% взрослых больных удается достичь стойкой ремиссии – то есть отсутствия рецидивов онкологического заболевания в течение пяти и более лет, после чего человека можно считать здоровым.
Читайте также:

