Классификация 8 пересмотр онкология

Общепринятая система TNM (от англ. The Tumor, Node, Metastasis – опухоль, узел, метастазы), разработанная и принятая Американским объединенным комитетом по исследованию рака AJCC и Международным союзом по борьбе с раком UICC, базируется на ключевых и доступных характеристиках опухоли, которые в свою очередь лежат в основе стадирования рака. Точная оценка стадии заболевания позволяет четко определить степень распространения опухоли и прогноз заболевания, а также предсказать ответ на различные способы лечения. В большинстве случаев основной целью стадирования рака на основании классификации TNM является анатомическое описание опухоли и ее метастазов, на базе которого принимаются решения о дальнейшей терапевтической тактике. В клинической практике стадирование в соответствии с системой TNM сочетается с индивидуальными клиническими характеристиками пациента и иногда с молекулярными особенностями самой опухоли. В некоторых случаях гистологические и молекулярные особенности опухоли включены в классификацию.
С 1 января 2017 года рекомендована к использованию классификация TNM 8 пересмотра, опубликованная в октябре 2016 года [1] и пришедшая на смену 7-й классификации 2007 года [2].
В отличие от предыдущих изданий классификаций рака легкого по системе TNM, в работе над последней, 8-й принимал участие широкий круг мультидисциплинарных специалистов в области хирургической, радиационной, медицинской онкологии, анатомической и молекулярно-лучевой патологии, визуализации, биостатистики и других направлений [1] . Всего участвовало 420 экспертов из 181 учреждения, которые работают в 21 стране мира. Их деятельность координировал главный редактор.
Основные корректировки к седьмому изданию были сделаны с целью улучшения прогностической ценности стадирования. В их рамках было выделено несколько общих правил стадирования, гистологическая классификация и система градации, система гистологических кодов WHO/IARS.
Следует отметить, что работа над восьмым изданием классификации TNM еще окончательно не завершена: в настоящее время изучается возможность включения дополнительных правил стадирования рака при использовании софта для электронных историй болезни с целью тотальной систематизации информации для дальнейшего наблюдения и проведения исследований [1].
Классификация TNM рака легкого базируется на оценке трех параметров:
- Т – размер и локализация первичной опухоли,
- N – вовлечение лимфатических узлов средостения,
- М – наличие отдаленных метастазов в другие органы, в том числе и в другое легкое.
Основные изменения в 8-м издании классификации в отношении стадирования первичной опухоли включают [3]:
- Изменения Т1: в новой редакции опухоли разделяются на Т1 и Т1а (≤1 см), T1b (>1…≤2 см) и T1c (>2…≤3 см)
- Изменения Т2: согласно новой редакции для опухолей Т2 установлен пограничный размер в 5 см (в предыдущем издании – 7 см). Вовлечение в процесс основного бронха, независимо от расстояния от киля трахеи, скорее Т2, чем Т3. И частичный, и общий ателектаз/пневмонит в редакции 2017 года – это Т2
- Изменения Т3 и Т4: опухоли, превышающие 5 см и менее или равные 7 см, характеризуются как Т3 (а не Т2). Опухоли размером более 7 см объединяются в новую группу Т4А. Инвазия в диафрагму теперь Т4, а не Т3
Новая стадия была разработана и для Т3 и Т4 опухолей, которые, согласно редакции 2017 года, классифицируются как стадия IIIC, если они сопровождаются вовлечением контрлатерального лимфатического узла N3.
Изменения в стадировании первичной опухоли в 8-м издании классификации TNM были введены на основе анализа данных 33115 пациентов согласно новой клинической или патологической классификации, размеру опухоли, информации о ее распространении с учетом степени метастазирования. Анализ позволил сделать следующие выводы [4]:
- Увеличение опухоли на каждый сантиметр коррелировало с явным снижением выживаемости, что свидетельствует о необходимости создания новой Т-системы с большим числом делений на стадии в зависимости от размера
- Опухоли более 5, но равные или менее 7 см ассоциировались с лучшим прогнозом, если они относились категории Т3, а не T2b, а выживаемость при опухолях более 7 см была сопоставимой с выживаемостью опухолей категории Т4. Эти данные обосновали необходимость установления новых размеров для опухолей Т3 и Т4
- Инвазия в бронх менее чем 2 см от киля, относимая в прошлой редакции к Т3, имела лучший прогноз, чем предполагалось ранее, когда была отнесена к категории Т2
Таблица 1. Классификация первичной опухоли
в соответствии с TNM 8-го пересмотра [3].
В классификации 7-го издания градация в соответствии с вовлечением региональных лимфатических узлов довольно последовательно предсказывала прогноз. Она же была взята за основу и в издании 2016 года, однако ее было предложено дополнить подклассификацией, базирующейся на количестве вовлеченных групп лимфоузлов или отдельных узлов [5].
pN1 – вовлечение ипсилатеральных внутрилегочных, перибронхиальных или грудных лимфатических улов:
- pN1a – метастазы в одной группе,
- pN1b – метастазы в нескольких группах.
pN2 – вовлечение ипсилатеральных медиастинальных или бифуркационных лимфоузлов:
- pN2a1 – одна группа N2 без сопутствующего вовлечения группы N1,
- pN2a2 – одна группа N2 с одновременным вовлечением группы N1.
pN2b – метастазы во множестве групп N2.
Следует отметить, что региональные лимфатические узлы подразделяются на группы по стороне поражения (справа или слева) и локализации. Группы лимфатических узлов обозначены цифрами от 1 до 14 в соответствии с международной схемой (рис. 1) [5].

Рисунок 1. Карта лимфатических узлов для стадирования рака легких.
Подклассификация вовлечения региональных лимфатических узлов при раке легкого была принята на основании данных анализа клинического (с) и патологического (p) статуса лифмоузлов (N) 38 910 и 31 426 пациентов с НМРЛ соответственно [5]. Его результаты показали, что пятилетняя выживаемость в зависимости от статуса cN и pN составляла 60% и 75% (N0), 37% и 49% (N1), 23% и 36% (N2) и 9% и 20% (N3) соответственно.
На основании данных дополнительного анализа было выяснено, что при патологическом стадировании выживаемость коррелирует с числом отдельных лимфатических узлов, вовлеченных в группах N1 и N2. Эта находка стала основанием для создания новых подгрупп в 8-м издании классификации.
Условные обозначения подклассификации, принятой в 8-м издании, не определяют варианты лечения. Скорее, их следует рассматривать в комбинации с индивидуальными характеристиками пациента.
Таблица 2. Классификация рака легкого в зависимости
от вовлеченных лимфоузлов по системе TNM 8 пересмотра.
| NX | Региональные лимфоузлы невозможно оценить |
| N0 | Метастазы в региональных лимфатических узлах отсутствуют |
| N1 | Метастазы в ипсилатеральных перибронхиальных и/или ипсилатеральных грудных лимфатических узлах и внутрилегочных узлах, включая непосредственное распространение опухоли на лимфатические узлы |
| N2 | Метастазы в ипсилатеральном медиастинальном и/или бифуркационном лимфатическом узле (узлах) |
| N3 | Метастазы в лимфатических узлах средостения или корня легкого на противоположной стороне, прескаленных или надключичных лимфатических узлах на стороне поражения или на противоположной стороне |
В 8-м издании системы TNM метастатический рак по-прежнему классифицируется как M1a, если он ограничен грудной клеткой (отдельные опухолевые узлы (узел) в контралатеральном легком, опухоль с диссеминацией по плевре, злокачественный или перикардиальным выпотом). Субклассификация при отдаленных метастазах изменилась: в отличие от системы 7-го пересмотра, предусматривающей только стадию M1b (другие отдаленные метастазы), в системе 8-го пересмотра появилось разделение на стадию M1b (единичный отдаленный метастаз) и M1c (множественные отдаленные метастазы в одном или более органе).
Эти изменения обусловили введение стадии IVa, при которой заболевание ограничивается либо внутригрудным метастатическим поражением, либо одиночным отдаленным метастазом, и стадии IVb, при которой существуют множественные отдаленные метастазы. Предполагается, что эти нововведения в стадирование рака легкого помогут определиться со способами лечения олигометастатического заболевания.
Таблица 3. Стадирование рака легкого
в соответствии с классификацией TNM 8-го пересмотра.
| Скрытая карцинома | ТХ | Т0 | М0 |
| Стадия 0 | Tis | N0 | M0 |
| Стадия IA1 | T1a(mi) | N0 | M0 |
| T1a | N0 | M0 | |
| Стадия IA2 | T1b | N0 | M0 |
| Стадия IA3 | T1c | N0 | M0 |
| Стадия IB | T2a | N0 | M0 |
| Стадия IIA | T2b | N0 | M0 |
| Стадия IIB | T1a-c | N1 | M0 |
| T2a | N1 | M0 | |
| T2b | N1 | M0 | |
| T3 | N0 | M0 | |
| Cтадия IIIA | T1a-c | N2 | M0 |
| T2a-b | N2 | M0 | |
| T3 | N1 | M0 | |
| T4 | N0 | M0 | |
| T4 | N1 | M0 | |
| Стадия IIIB | T1a-c | N3 | M0 |
| T2a-b | N3 | M0 | |
| T3 | N2 | M0 | |
| T4 | N2 | M0 | |
| Стадия IIIC | T3 | N3 | M0 |
| T4 | N3 | M0 | |
| Cтадия IVa | Любой Т | Любой N | M1a |
| Любой Т | Любой N | M1b | |
| Стадия IVb | Любой Т | Любой N | M1c |
* Tis – карцинома in situ; T1a(mi) – минимально инвазивная карцинома.
В соответствии с системой стадирования TNM, медиана выживаемости при раке легкого связана как с клинической (на этапе обследования), так и хирургически-патологической стадией. В большинстве случаев определяется значимая разница в выживаемости при сравнении заболеваний с двумя соседними стадиями.

Рисунок 2. Общая выживаемость в соответствии с патологической стадией
согласно системе TNM 7 издания [3].

Рисунок 3. Общая выживаемость в соответствии с патологической стадией
согласно системе TNM 8 издания [3].
TNM-классификация рака легкого 8-редакции была представлена IASLC (Международной Ассоциацией по изучению рака легких) и заменяет предыдущую 7-редакцию. Хотелось бы напомнить, что TNM-классификация является стандартом при стадировании не-мелкоклеточного рака легких.
Как и в предыдущих изданиях есть три компонента, которые описывают анатомическую характеристику опухоли:
- T для оценки первичной опухоли,
- N для поражения лимфатических узлов
- M для метастатазов.
- T-классификация выполняется с использованием КТ,
- N-и M-классификации с использованием КТ и ПЭТ-КТ.
Классификация может быть использована в предоперационной визуализации и клинической классификации iTNM/cTNM, но также применима для окончательной патологической постановки при помощи классификации pTNM, для рестадирования после терапии и рецидивах выбирают классификации yTNM и rTNM.
Ниже представлена классификация TNM.
T – первичная опухоль
Тx – оценка первичной опухоли невозможна, или опухоль верифицирована при обнаружении злокачественных клеток в мокроте или бронхоальвеолярном лаваже, при этом опухоль не определяется на бронхоскопии
Т0 – нет видимости первичной опухоли
Tis – карцинома in situ
Т1 – опухоль достигает 30 мм в диаметре или меньше в наибольшем измерении, окружена легочной паренхимой или висцеральной плеврой, нет признаков инвазии проксимальнее долевого бронха при бронхоскопии (опухоль не локализуется в главном бронхе)
Т1(mi) минимально инвазивная аденокарцинома
T1а – опухоль 10 мм в диаметре или менее в наибольшем измерении
T1b – опухоль от 10 до 20 мм в диаметре в наибольшем измерении
Т1с – опухоль от 20 до 30 мм в диаметре в наибольшем измерении
Т2 – опухоль от 31 до 50 мм в диаметре в наибольшем измерении, или опухоль в сочетании:
с вовлечением главного бронха, независимо от расстояния до карины, но без её поражения
с поражением висцеральной плевры
с ателектазом или обструктивным пневмонитом, который располагается в прикорневых отделах, вовлекает часть легкого или все легкое
Т2а – опухоль от 31 до 40 мм в диаметре в наибольшем измерении, или размер не может быть определен (например, когда опухоль неотделима от ателектаза)
Т2b – опухоль от 41 до 50 мм в диаметре в наибольшем измерении
Т3 – опухоль от 51 до 70 мм в диаметре в наибольшем измерении, или прямая инвазия в:
грудную стенку (включая париетальную плевру и опухоли верхней борозды)
или определяются метастатические опухолевые узлы или узел в патологически измененной доле
Т4 – опухоль более 70 мм в диаметре в наибольшем измерении, или поражение:
возвратного гортанного нерва
метастатические узелки (узел) в других ипсилатеральных долях
N – вовлечение регионарных лимфатических узлов
Nx – невозможно оценить регионарные лимфатические узлы
N0 – нет метастазов в регионарных лимфатических узлах
N1 – метастазы в ипсилатеральных перибронхиальных и/или ипсилатеральных корневых лимфатических узлах, или метастазы во внутрилегочных лимфатических узлах, включая прямое поражение лимфатических узлов
N1a – поражены лимфатические узлы одного N1 коллектора
N1b – поражены лимфатические узлы нескольких N1 коллекторов
N2 – метастазы в ипсилатеральных медиастинальных и/или субкаринальных лимфатических узлах
N2a1 – поражены лимфатические узлы одного коллектора N2 без вовлечения лимфатических узлов коллектора N1 (скип-метастаз)
N2a2 – поражены лимфатические узлы одного коллектора N2 с вовлечением лимфатических узлов коллектора N1
N2b – множественное вовлечение лимфатических узлов коллектора N2
N3 – метастазы в контрлатеральных медиастинальных, хиларных, любых лестничных или надключичных лимфатических узлов.
M – отдаленные метастазы
М0 – нет отдаленных метастазов
М1 – отдаленные метастазы есть
М1а – опухолевые узлы в контрлатеральном легком, опухолевое узелковое поражение плевры, метастатический плевральный или перикардиальный выпот
M1b – одиночный отдаленный опухолевый узел
М1с – множественные внелегочные метастазы в одном или нескольких органах
Подмножества категорий T, N и M сгруппированы в определенные стадии, так как эти пациенты имеют схожий прогноз [1].
Например, стадия сT1N0 (стадия IA) имеет 5-летнюю выживаемость 77-92%.
С другой стороны рак легкого с любым метастатическим поражением M1c (стадия IVB) имеет 5-летнюю выживаемость равную 0%.
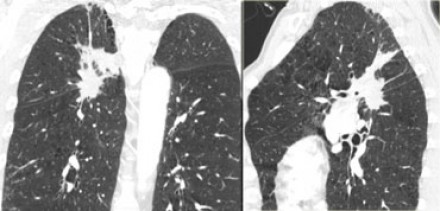
Лобэктомия нецелесообразна при:
- Трансфиссуральном росте.
- Сосудистой инвазии.
- Инвазии основного бронха.
- Вовлечении верхне-долевого и нижне-долевого бронхов.
Тонко-срезанные изображения с последующими трехплоскостными реконструкциями необходимы, чтобы наилучшим образом продемонстрировать связь опухоли с окружающими структурами.
В случае неопределимой инвазии, в онкологической клинике должен проведен мультидисциплинарный консилиум специалистов для выбора дальнейшей тактики лечения, в зависимости от особенностей данного случая и сопутствующих заболеваний пациента.
- Т0 – нет видимой первичной опухоли на изображении.
- Tis – карцинома in situ.
- Диагностируется ретроспективно после резекции опухоли.
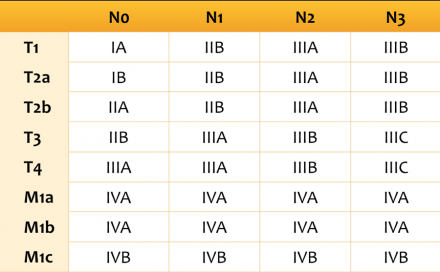
- Т1 – опухоль достигает 30 мм в диаметре или меньше в наибольшем измерении, окружена легочной паренхимой или висцеральной плеврой, нет признаков инвазии проксимальнее долевого бронха при бронхоскопии (опухоль не локализуется в главном бронхе)
- Т1(mi) минимально инвазивная аденокарцинома
- T1а – опухоль 10 мм в диаметре или менее в наибольшем измерении
- T1b – опухоль от 10 до 20 мм в диаметре в наибольшем измерении
- Т1с – опухоль от 20 до 30 мм в диаметре в наибольшем измерении
- Т2 – опухоль от 31 до 50 мм в диаметре в наибольшем измерении, или опухоль в сочетании:
- с вовлечением главного бронха, независимо от расстояния до карины, но без её поражения
- с поражением висцеральной плевры
- с ателектазом или обструктивным пневмонитом, который располагается в прикорневых отделах, вовлекает часть легкого или все легкое
- Т2а – опухоль от 31 до 40 мм в диаметре в наибольшем измерении, или размер не может быть определен (например, когда опухоль неотделима от ателектаза)
- Т2b – опухоль от 41 до 50 мм в диаметре в наибольшем измерении
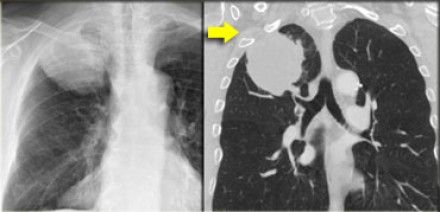
- Т3 – опухоль от 51 до 70 мм в диаметре в наибольшем измерении, или прямая инвазия в:
- грудную стенку (включая париетальную плевру и опухоли верхней борозды)
- диафрагмальный нерв
- париетальный перикард
- или определяются метастатические опухолевые узлы или узел в патологически измененной доле
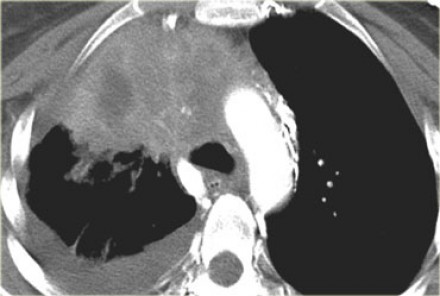
- Т4 – опухоль более 70 мм в диаметре в наибольшем измерении, или поражение:
- диафрагмы
- средостения
- сердца
- крупных сосудов
- трахеи
- возвратного гортанного нерва
- пищевода
- тела позвонка
- бифуркации трахеи
- висцерального перикарда
- метастатические узелки (узел) в других ипсилатеральных долях
Courtesy of Wouter van Es, MD. St. Antonius Hospital Nieuwegein, The Netherlands
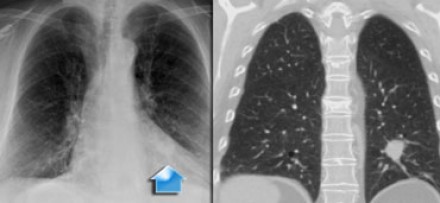
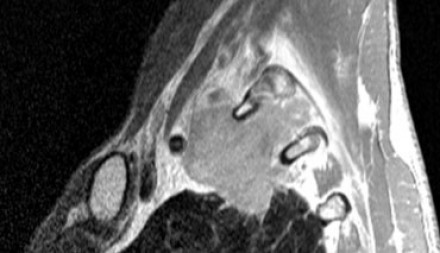
Типичные проявления рака Панкоста следующие:
- боли, обусловленные инвазией в плечеголовное сплетение.
- синдром Горнера
- деструкция костных структур
Выполнение МРТ приоритетнее в связи с лучшим мягкотканным контрастом в сравнении с КТ.
Courtesy of Wouter van Es, MD. St. Antonius Hospital Nieuwegein, The Netherlands
На Т1-изображениях представлен пациент с раком Панкоста Т3-стадии в связи с тем, что поражены корешки только Th1, Th2
- ПкА = подключичная артерия,
- ПЛМ = передняя лестничная мышца.
(Courtesy of Wouter van Es, MD. St. Antonius Hospital Nieuwegein, The Netherlands)
Courtesy of Wouter van Es, MD. St. Antonius Hospital Nieuwegein, The Netherlands
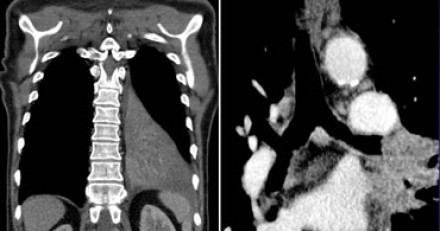
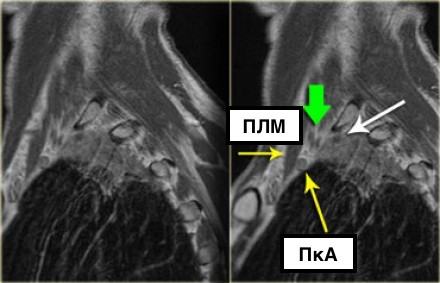
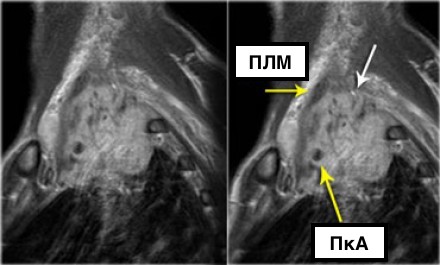
На данном постконтрастном Т1-изображении представлена неоперабельная опухоль (T4) Панкоста.
Заметна инвазия в плечевое сплетение (белая стрелка) и инвазия в подключичную артерию (а).
- ПкА = подключичная артерия,
- ПЛМ = передняя лестничная мышца.
(Courtesy of Wouter van Es, MD. St. Antonius Hospital Nieuwegein, The Netherlands)
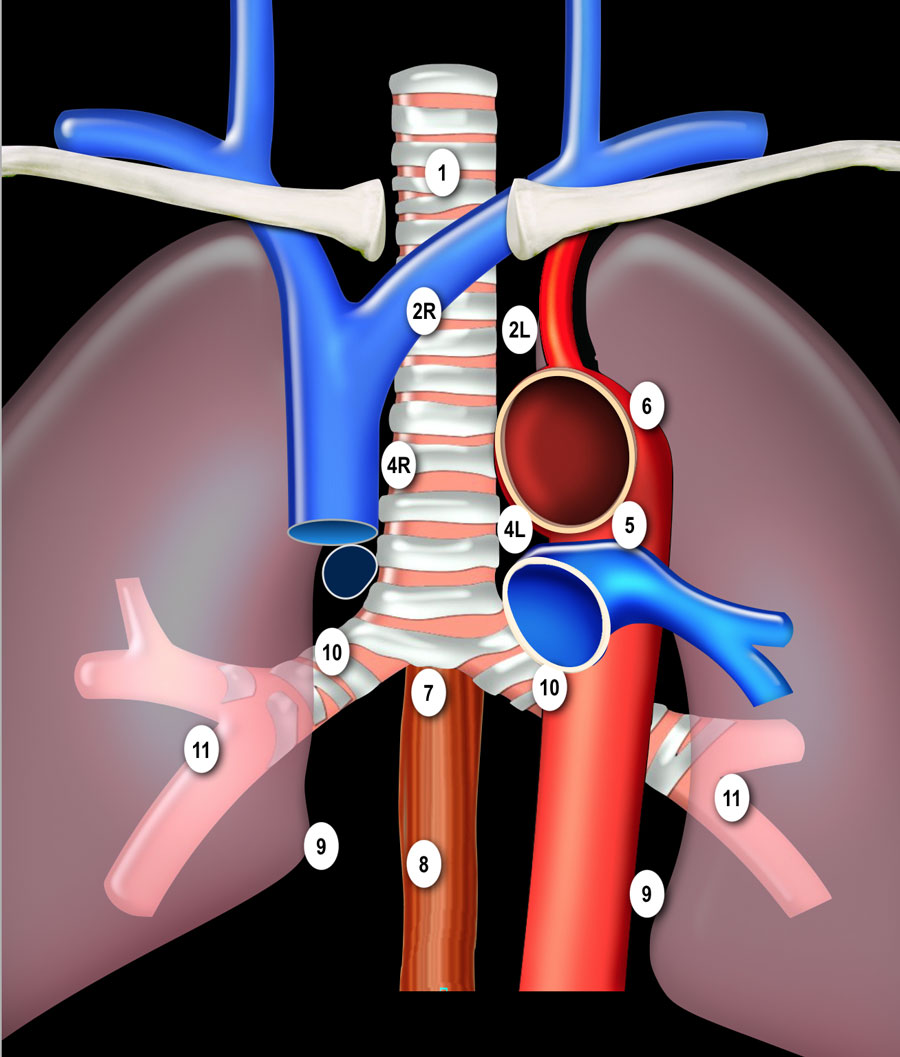
- Надключичные лимфатические узлы 1
- 1 Нижние шейные, надключичные и лимфатические узлы вырезки грудины (левые и правые). Располагаются по обе стороны от срединной линии трахеи в нижней трети шеи и надключичных областях, верхней границей является нижний край перстневидного хряща, нижней - ключицы и яремная вырезка рукоятки грудины.
- Верхние медиастинальные лимфатические узлы 2-4
- 2L Левые верхние паратрахеальные располагаются вдоль левой стенки трахеи, от верхнего края рукоятки грудины до верхнего края дуги аорты.
- 2R Правые верхние паратрахеальные располагаются вдоль правой стенки трахеи и спереди от трахеи до ее левой стенки, с уровня верхнего края рукоятки грудины до нижней стенки левой плечеголовной вены в зоне пересечения с трахеей.
- 3А Преваскулярные лимфатические узлы не примыкают к трахее как узлы 2 группы, а располагаются кпереди от сосудов (от задней стенки грудины, до передней стенки верхней полой вены справа и передней стенки левой сонной артерии слева) 3P Превертебральные(Ретротрахеальные) располагаются в заднем средостении, не примыкают к трахее как узлы 2 группы, а локализуются кзади от пищевода.
- 4R Нижние паратрахеальные от пересечения нижнего края плечеголовной вены с трахеей до нижней границы непарной вены, вдоль правой стенки трахеи до ее левой стенки.
- 4L Нижние паратрахеальные от верхнего края дуги аорты до верхнего края левой главной легочной артерии
- Аортальные лимфатические узлы 5-6
- 5. Субаортальные лимфатические узлы располагаются в аортопульмонарном окне, латеральнее артериальной связки, они расположены не между аортой и легочным стволом, а латеральнее них.
- 6. Парааортальные лимфатические узлы лежат спереди и сбоку от восходящей части дуги аорты
- Нижние медиастинальные лимфатические узлы 7-9
- 7. Подкаринальные лимфатические узлы.
- 8. Параэзофагеальные лимфатические узлы. Лимфатические узлы ниже уровня карины.
- 9. Узлы легочной связки. Лежат в пределах легочной связки.
- Корневые, долевые и (суб) сегментарные лимфатические узлы 10-14
- Все эти группы относятся к N1 лимфатическим узлам. Узлы корня легкого располагаются вдоль главного бронха и сосудов корня легкого. Справа они распространяются от нижнего края непарной вены до области деления на долевые бронхи, слева – от верхнего края легочной артерии.
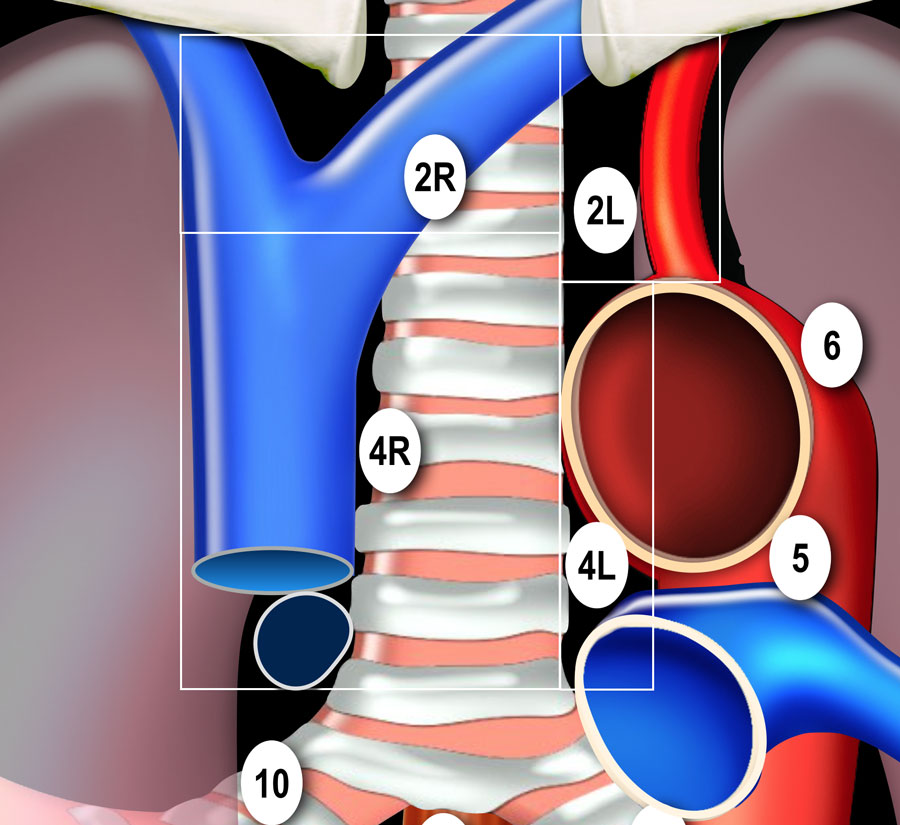
Граница между лимфатическими узлами 10 и 4 группы находится на правой нижней границе непарной вены и на левой верхней границе легочной артерии (отличие N1 и N2 стадий).
Достаточно важно разделять лимфатические узлы 1-ой группы и 2/3-ей групп (отличие N3 и N2 стадий).
Нижняя граница лимфатических узлов 1-ой группы с обеих сторон это ключицы, а если оценивать по средней линии, то верхней границей будет рукоятка грудины.
Граница между группами лимфатических 4R и 4L является левый латеральный контур трахеи, а не срединная линия.
Паракардиальные, лимфатические узлы молочных желез, диафрагмальные, межреберные и подмышечные лимфатические узлы не входят в карту лимфатических узлов согласно IALSC, несмотря на то, что они редко, но могут вовлекаться в патологический процесс.
При поражении данных нерегиональных узлов предлагается расценивать их поражение, как метастатическое [2].
ПЭТ/КТ является методом выбора при определении N-статуса.
Ложноположительные результаты возможно у больных саркоидозом, туберкулезом и другими инфекционными заболеваниями. Из-за высокой отрицательной прогностической ценности ПЭТ-сканирование должно проводиться у всех пациентов до операции.




Статьи
В 2017 году вышли 8-е издание классификации TNM UICC и 8-е издание руководства по стадированию злокачественных новообразований AJCC, которые почти идентичны. Издания представляют правила классификации и стадирования опухолей различных локализаций с изменениями, соответствующими современным данным и представлениям. Руководство UIСС/TNM 8 принято всеми национальными комитетами TNM, и в настоящее время в данных странах его необходимо использовать в рутинной работе при установлении стадии опухоли.
Остаются неизменными общие правила, применимые к новообразованиям всех локализаций. Во-первых, все злокачественные опухолевые процессы должны быть подтверждены гистологически. Во-вторых, для каждой локализации описаны две классификации: клиническая и патологическая, которые могут иметь некоторые различия.
Клиническая классификация TNM (или cTNM) имеет большое значение для выбора терапии. Стадирование сTNM основано на данных, полученных до лечения: по результатам физического осмотра, эндоскопии, биопсии, хирургического исследования и других обследований.
Патологическая классификация pTNM определяется после хирургического вмешательства и морфологического исследования удаленного материала, она предоставляет дополнительные данные для оценки прогноза и конечных результатов, а также дополнительной адьювантной терапии.
После определения категорий T, N, M и/или pT, pN и pM их группируют по стадиям заболевания. Категории T, N, M и стадия устанавливаются единожды и должны оставаться неизменными в медицинской документации.
Факторы, характеризующие опухоль, могут быть связаны с ее морфологическим строением (вариант карциномы, градация, степень дифференцировки) и молекулярными особенностями, а также с профилем экспрессии генов, который отражает биологическое поведение новообразования. В указанную группу входят предиктивные и прогностические факторы, учитывающие связь опухоли с вирусной инфекцией или же уровень диагностического маркера в сыворотке крови (например, PSA при карциноме простаты или CEA при колоректальной карциноме).
Факторы, связанные с пациентом, — демографические (возраст и пол) или приобретенные (такие как иммунодефицит, работоспособность, наличие вредных привычек). Факторы окружающей среды могут включать в себя вариант и качество оказанного лечения (возраст и опыт врача, доступность и общую организацию медицинской помощи).
Определение стадии заболевания базируется на категориях T, N и М, однако при опухолях некоторых локализаций могут учитываться степень дифференцировки, возраст больного и другие данные. Для ряда новообразований различных локализаций разработаны и представлены, помимо стадий, прогностические группы, основанные на стадии опухоли и других факторах, например на уровне PSA и сумме Глисона (степени дифференцировки) при карциноме предстательной железы.
Появилась новая глава, посвященная метастазам гистологически подтвержденного плоскоклеточного рака в лимфатические узлы шеи без выявленного первичного очага. В новой парадигме каждый случай метастаза плоскоклеточного рака без выявленного первичного очага должен быть гистологически (иммуногистохимически) исследован для выявления связи с ВПЧ или вирусом Эпштейна-Барр (ВЭБ). При выявлении ВЭБ для стадирования применяют классификацию назофарингеальных карцином, при наличии связи с ВПЧ (экспрессии р16) — классификацию для опухолей ротоглотки. При отсутствии связи с ВЭБ и ВПЧ применяется третья схема стадирования.
Стадирование опухолей губы и полости рта в новой редакции классификации изменено касательно категории Т. Рекомендовано учитывать не только размер опухоли, но и глубину инвазии.
Для большинства опухолей головы и шеи при определении категории N необходимо принимать во внимание не только количество пораженных лимфатических узлов, но и наличие экстранодального распространения онкопроцесса, которое служит разграничением между N3a и N3b.
При стадировании опухолей щитовидной железы следует учитывать, что в 8-м издании классификации категория Т равноправно применима ко всем новообразованиям данного органа независимо от степени дифференцировки (в 7-м издании все анапластические/недифференцированные карциномы независимо от размера опухоли относили к Т4). Категорию Т3 разделили на подстадии Т3а и T3b в зависимости от распространения за пределы органа с вовлечением скелетных мышц.
Метастазы в лимфоузлы переднего и верхнего средостения теперь следует относить к N1a (ранее относили к N1b). При группировке опухолей щитовидной железы по стадиям изменился возрастной критерий пациентов — с 45 на 55 лет. Прогностические признаки для папиллярного и фолликулярного рака отличаются от медуллярного. Для папиллярной и фолликулярной карцином важными признаками являются экстратиреоидное распространение (категория Т), категория М, лечение тиреоглобулином, возраст и наличие резидуальной опухоли. Для медуллярного рака — уровень кальцитонина до и после операции, СЕА, возраст и объем резекции.
В разделе, посвященном опухолям пищеварительной системы, тоже есть нововведения. Во-первых, изменился критерий для определения опухолей пищеводно-желудочного перехода (ПЖП). Теперь новообразования проксимального отдела желудка, вовлекающие ПЖП с эпицентром, расположенным на расстоянии не более 2 см от него, стадируются как рак пищевода (ранее в этом критерии указывалось расстояние в 5 см). Опухоли проксимального отдела желудка с эпицентром, удаленным от него более чем на 2 см, стадируются как желудочные даже при вовлечении ПЖП, независимо от гистогенеза (плоскоклеточный рак или аденокарцинома). Однако для определения стадии при карциномах пищевода учитывается гистогенез опухоли и применяются разные критерии для плоскоклеточного рака и для аденокарциномы. А в определении прогностической группы для плоскоклеточного рака пищевода кроме критериев Т, N, M учитывается локализация опухоли, а для аденокарциномы — степень дифференцировки.
Для стадирования новообразований тонкой кишки при определении категории Т3 более не учитывается критерий протяженности распространения в 2 см, а указывается условие — не должно быть нарушения серозной оболочки. Опухоль T4 — та, что перфорирует висцеральную брюшину или непосредственно прорастает в другие органы или структуры через серозную оболочку независимо от размера новообразования (прежний критерий размера — 2 см — более не учитывается).
Определено отношение к аппендикулярной муцинозной опухоли низкой степени злокачественности, которую относят к Тis, даже если определяется наличие бесклеточного муцина или муцинозного эпителия в мышечной оболочке, но при вовлечении субсерозы или серозной поверхности (висцеральной брюшины) опухоль относят к T3 или T4a соответственно.
В классификации опухолей анального канала изменились подходы к категории N в зависимости от группы пораженных лимфатических узлов.
При стадировании гепатоцеллюлярного рака и рака внутрипеченочных желчных протоков при определении категории Т1, которую разделили на Т1а и Т1b, теперь необходимо учитывать размер опухолевого узла, а наличие сосудистой инвазии более не исключает Т1 стадию. В то же время категория Т3 для гепатоцеллюлярного рака теперь не разделена на подстадии, а опухоли, соответствующие критериям Т3b по данным 7-го издания, следует относить к Т4.
Подобные изменения произошли и в стадировании опухолей внепеченочных желчных протоков. Кроме того, были скорректированы подходы к категории N.
Среди новых аспектов в руководстве в отдельный раздел выделены нейроэндокринные опухоли желудочно-кишечного тракта. При этом критерии для стадирования высокодифференцированных и низкодифференцированных новообразований различны. Это касается оценки как первичной опухоли, так и метастазов в регионарные лимфатические узлы, а также отдаленных метастазов. В этой же главе дана отдельная схема классификации высокодифференцированных нейроэндокринных опухолей поджелудочной железы, которые ранее стадировались по общим правилам для рака этого органа.
При обозначении стадии нейроэндокринных опухолей принципиальным моментом является разделение их на основании гистологической градации на две категории: высокодифференцированные и низкодифференцированные, с разным подходом к их стадированию. В последнем пересмотре классификации введена отдельная система, которую применяют для высокодифференцированных нейроэндокринных новообразований желудочно-кишечного тракта, включая поджелудочную железу. Нейроэндокринные карциномы высокой гистологической градации (низкодифференцированные) должны классифицироваться по критериям для карцином соответствующей локализации. Это определяет необходимость обязательной гистологической и иммуногистохимической верификации каждой рассматриваемой опухоли.
В настоящее время определение гистологической градации следует проводить по критериям ВОЗ 2010 г., основанным на митотическом индексе и уровне Ki-67. К высокодифференцированным нейроэндокринным новообразованиям относят опухоли градации G1 и G2. К низкодифференцированным нейроэндокринным образованиям — карциномы градации G3, то есть мелкоклеточный и крупноклеточный рак.
Необходимо отметить, что данная классификация не распространяется на нейроэндокринные опухоли, расположенные в пищеводе и пищеводно-желудочном переходе. Согласно классификации ВОЗ 2010 г. допускается стадирование этих нейроэндокринных карцином по критериям аденокарциномы.
Для большинства локализаций при оценке N-стадии для высокодифференцированных опухолей имеет значение сам факт наличия метастаза, а для низкодифференцированных — количество пораженных лимфатических узлов. Для оценки отдаленных метастазов высокодифференцированных нейроэндокринных опухолей почти всех локализаций важно наличие поражения печени.
Стадирование опухолей тимуса, легких, костей и мягких тканей
В новое издание включена специальная глава, посвященная стадированию опухолей тимуса. Классификация применяется к эпителиальным опухолям тимуса, включая тимомы, тимические карциномы и нейроэндокринные новообразования. Ее не следует применять при саркомах, лимфомах и других редких опухолях. Эта классификация является новшеством 8-го издания и основана на рекомендациях Международной ассоциации по изучению рака легких (IASLC) и Международного проекта по изучению злокачественных новообразований тимуса (ITMIG).
При стадировании опухолей легких для категории Т изменились критерии размера опухоли в сторону уменьшения, и теперь Т не зависит от расстояния до киля трахеи (карины).
В классификации опухолей костей и мягких тканей произошли радикальные изменения: она теперь зависит от локализации опухоли. Опухоли костей конечностей, туловища, черепа и лицевых костей стадируют согласно прежнему порядку, а для опухолей позвоночника и тазовых костей предложены совершенно иные принципы установления стадий. При определении категории Т опухолей позвоночника учитывают количество пораженных позвонков, распространение в спинномозговой канал, вовлечение прилежащих сосудов и наличие опухолевого тромбоза. При стадировании опухолей костей таза имеют значение размер опухоли, количество пораженных сегментов, экстраоссальное распространение, вовлечение сосудов и тромбоз.
Новообразования мягких тканей разделены по локализациям. Опухоли конечностей и поверхности туловища, а также забрюшинного пространства стадируются одинаково, и категория Т зависит от их размера. Опухоли головы и шеи, а также органов грудной и брюшной полостей имеют другие принципы стадирования: учитывается их размер и прорастание в соседние органы, кости, сосуды. Кроме того, применительно к новообразованиям органов грудной и брюшной полостей на Т-категорию влияет их множественность и количество пораженных органов.
Относительно опухолей костей позвоночника и таза, саркомы мягких тканей головы и шеи, грудных и брюшных внутренних органов критерии для определения стадии не предложены.
Невозможно в одной статье охватить все изменения, внесенные в 8-е издание классификации TNM, и многие его аспекты остались незатронутыми. Однако хочется надеяться, что удалось привлечь внимание к теме стадирования опухолей и состоянию этого вопроса на данный момент. Важно отметить, что для адекватного стадирования некоторых новообразований принципиальное значение имеет гистологическая верификация их гистогенеза, а в ряде случаев — и иммуногистохимическое исследование, без которого невозможно классифицировать опухоль. Так, без иммуногистохимического исследования с маркерами р16 и EBV при метастазах в лимфатические узлы шеи или ротоглотки невозможно принять решение, какую классификационную схему необходимо использовать, требуется иммуногистохимическое подтверждение нейроэндокринной природы опухоли с прояснением вопроса о степени дифференцировки. Последующее стадирование зависит от результата.
Любая классификационная схема отражает состояние знаний в этой области в определенный период времени, и, соответственно, ни одна классификация не бывает совершенной и вечной. Накопление знаний приводит к пересмотру представлений, принятых на текущий момент. Можно не сомневаться в появлении и 9-го издания TNM-классификации. Вместе с тем на сегодняшний день в нашей стране врачи по-прежнему руководствуются 7-м изданием документа в соответствии с приказом Минздрава России о правомочности данного издания. Приказ министерства о необходимости перехода во врачебной практике к 8-му изданию пока не поступил. Однако необходимо быть готовыми к этому переходу, причем как клиническим врачам, так и патологоанатомам.
НОВЫЕ КЛАССИФИКАЦИИ ДЛЯ ОПУХОЛЕЙ СЛЕДУЮЩИХ ЛОКАЛИЗАЦИЙ
p16 + опухоли ротоглотки
Метастазы в лимфатические узлы шеи без первичного выявленного очага
Рак кожи головы и шеи
Нейроэндокринные опухоли поджелудочной железы
Остеосаркомы костей таза и позвоночника
Саркомы мягких тканей головы и шеи, забрюшинные, органов грудной и брюшной полости
Опухоли детского возраста различных локализаций
МИНИМАЛЬНЫЕ ИЗМЕНЕНИЯ В СТАДИРОВАНИИ ОПУХОЛЕЙ
Тонкой и толстой кишок
Нейроэндокринных (исключая опухоли поджелудочной железы)
Мужских половых органов и мочевыделительной системы
Читайте также:

