Кислотный оксид с хлором

Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).

Рис. 1. Виды оксидов.
Часто перед учащимися встает вопрос, как отличить основной оксид от кислотного. Прежде всего необходимо обратить внимание на второй элемент рядом с кислородом. Кислотные оксиды – содержат неметалл или переходный металл (CO2 , SO3 , P2 O5 ) основные оксиды – содержат металл (Na2 O, FeO, CuO).
Основные свойства кислотных оксидов
Кислотные оксиды (ангидриды) – вещества, которые проявляют кислотные свойства и образуют кислородосодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO2 ,SO3 соответствуют кислоты H2 SO3 и H2 SO4 .

Рис. 2. Кислотные оксиды с соответствующими кислотами.
Кислотные оксиды, образуемые неметаллами и металлами с переменной валентностью в высшей степени окисления (например, SO3 , Мn2 O7 ), реагируют с основными оксидами и щелочами, образуя соли:
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |

Рис. 3. Примеры кислотные оксиды.
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Тест по теме
Средняя оценка: 4.5 . Всего получено оценок: 865.
Не понравилось? - Напиши в комментариях, чего не хватает.
Содержание
- Классификация оксидов
- Основные свойства кислотных оксидов
- Что мы узнали?
- Тест по теме
- Оксид кальция
- Химические свойства солей
- Чистые вещества и смеси
- Классификация неорганических веществ
- Основания
- Таблица окисления химических элементов
- Оксид кремния
- Гидроксид кремния
- Чистые вещества и смеси
- Углекислый газ
- Общие химические свойства солей
- Основные оксиды Кислотные оксиды
- Химические свойства кислотных оксидов
- Гидроксид кальция

По многочисленным просьбам теперь можно: сохранять все свои результаты, получать баллы и участвовать в общем рейтинге.
- 1.
![]()
Николь Пак 285 - 2.
![]()
Мария Уразовская 223 - 3.
![]()
Ангелина Ященко 201 - 4.
![]()
Светлана Бабенко 199 - 5.
![]()
Gleb Apple 182 - 6.
![]()
Морин Егор 170 - 7.
![]()
Катя Деева 164 - 8.
![]()
Никита Дейнеко 160 - 9.
![]()
Дима Карасев 108 - 10.
![]()
Елена Васильева 105
- 1.
![]()
Кристина Волосочева 19,120 - 2.
![]()
Ekaterina 18,721 - 3.
![]()
Юлия Бронникова 18,580 - 4.
![]()
Darth Vader 17,856 - 5.
![]()
Алина Сайбель 16,787 - 6.
![]()
Мария Николаевна 15,775 - 7.
![]()
Лариса Самодурова 15,735 - 8.
![]()
Liza 15,165 - 9.
![]()
TorkMen 14,876 - 10.
![]()
Влад Лубенков 13,530
Самые активные участники недели:
- 1. Виктория Нойманн - подарочная карта книжного магазина на 500 рублей.
- 2. Bulat Sadykov - подарочная карта книжного магазина на 500 рублей.
- 3. Дарья Волкова - подарочная карта книжного магазина на 500 рублей.
Три счастливчика, которые прошли хотя бы 1 тест:
- 1. Наталья Старостина - подарочная карта книжного магазина на 500 рублей.
- 2. Николай З - подарочная карта книжного магазина на 500 рублей.
- 3. Давид Мельников - подарочная карта книжного магазина на 500 рублей.
Карты электронные(код), они будут отправлены в ближайшие дни сообщением Вконтакте или электронным письмом.
ХЛОРА ОКСИДЫ
Все Х. о. имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду, имеют положит. 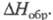
Монооксид [оксид С1(I), дихлороксид, гемиоксид] Cl2O — желто-оранжевый газ со слабым зеленоватым оттенком, в жидком состоянии — красно-коричневый; длина связи С1 — О 0,1700 нм, угол OClO 111°, μ 2,60∙10 −30 Кл∙м (табл.); уравнение температурной зависимости давления пара lgp (мм рт. ст.) = 7,87 — 1373/Т (173–288 К); раств. в воде с образованием HClO, растворимость (г в 100 г H2O при 0 °C): 33,6 (2,66 кПа), 52,4 (6,65 кПа). При 60–100 °C термич. распад Cl2O завершается за 12–24 ч, выше 110 °C через неск. мин происходит взрыв, освещение ускоряет распад и повышает вероятность взрыва. С хлоридами образует оксихлориды, напр., с TlCl4, TaCl5 и AsCl3 дает соотв. Т1OCl2, TaOCl3 и AsO2Cl. С NO2 образует смесь NO2C1 и NO3C1, с N2O5 — чистый NO3C1. Фторированием Cl2O с помощью AgF2 можно получить C1OF3, а реакцией с AsF5 или SbF5 — соли хлорила ClO + 2MF − 6. Аналогично реагируют с MF5 (где М — As и Sb) ClO2 и Cl2O6. С насыщ. орг. соединениями Cl2O ведет себя как хлорирующий агент, подобный хлору. Получают Cl2O пропусканием Cl2, разбавленного N2, над HgO или реакцией Cl2 с влажным Na2CO3.
СВОЙСТВА ОКСИДОВ ХЛОРА
таблица в процессе добавления
* Расчетная. ** 2,38 г/см 3 при −160 °C.
Диоксид ClO2 — желтый газ, в жидком состоянии — ярко-красный, в твердом — красновато-желтый; длина связи С — О 0,1475 нм, угол OClO 117 °C; уравнение температурной зависимости давления пара lgp (мм рт. ст.) = 7,7427 -- 1275,1/T (226–312 К); растворимость в воде 26,1 г/л (25 °C, 20,68 кПа), раств. в CCl4, HClO4, CH3COOH. В индивидуальном состоянии взрывоопасен, при 30–50 °C распад идет с измеримой скоростью, выше 50 С после периода индукции взрывается. В щелочной среде ClO2 диспропорционирует на 
и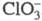
, в присутствии H2O2 образуется 
и выделяется O2. Восстанавливается иодидами, арсенидами, PbO, H2SO3, аминами до хлорит-иона. СNO2 и N2O5 образует NO3C1, с NOC1 -NO2C1. Фторируется посредством AgF2, BrF3 или разб. F2 до C1O2F. Получают ClO2 действием восстановителей (SO2, NO2, метанол, орг. пероксиды) на подкисленный раствор хлората щелочного металла, при нагр. смеси хлората с влажной щавелевой кислотой, действием Cl2 на хлориты. В отличие от остальных Х. о. ClO2 — продукт пром. производства, его используют вместо Cl2 как экологически более безопасный продукт для отбеливания древесной пульпы, целлюлозы, синтетич. волокон, для подготовки питьевой и технол. воды, обеззараживания сточных вод. Раздражает слизистые оболочки, вызывает кашель, рвоту и др.; ПДК в воздухе рабочей зоны 0,1 мг/м 3 , ЛД50 140 мг/кг (крысы, внутрижелудочно).
Перхлорат хлора (цихлоротетраоксид) Cl2O4, или ClOClO3 — светло-желтая жидкость, в кристаллич. состоянии почти бесцветен ( см. перхлораты).
Триоксид (дихлорогексаоксид) Cl2O6 — ярко-красная жидкость, в твердом состоянии — оранжевый, при охлаждении окраска ослабевает. В газе и жидкости молекулы имеют строение O2Cl — О — ClO3, в кристаллах - 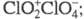
кристаллы моноклинной сингонии (пространств. группа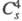
, z = 4); давление пара 39,9 Па (0 °C), 133 Па (19 °C). Медленно разлагается уже при 0–10 °C на ClO2 и O2, выше 20 °C в продуктах распада появляется Cl2; с водой реагирует со вспышкой, продукты гидролиза — HClO3 и HClO4. С хлоридами, бромидами, нитратами образует перхлораты, напр. с NOC1 дает NOC1O4, с N2O5 — NO2C1O4, с AlCl3 -ClO2[А1(ClO4)4], с FeCl3 — ClO2[Fe2(ClO4)7]. При нагр. в вакууме такие комплексы отщепляют Cl2O6 и превращаются в несольватированные перхлораты А1(ClO4)3, Fe(ClO4)3. Получают Cl2O6 реакцией озона с ClO2 или действием F2 на хлораты металлов. Применяют для синтеза безводных перхлоратов в лаб. условиях.
Оксид Cl(VII) (хлорный ангидрид, дихлорогептаоксид) Cl2O7 — бесцв. подвижная жидкость, чувствителен к удару и трению. Молекула имеет строение O3С1 — О — ClO3, длина связи С1 — О 0,1709 нм, в группах ClO3 — 0,1405 нм, угол ClOС1 118,6°, OClO 115,2°, μ 2,40∙10 −30 Кл∙м; кристаллы моноклинные (пространств. группа C2/с); уравнение температурной зависимости давления пара lgp( мм рт. ст.) = 7,796-1770/Т. Неограниченно раств. в CCl4, хорошо раств. в HClO4, POCl3 и т. п. С водой не смешивается, на границе раздела фаз реагирует с образованием HClO4, реакция сильно экзотермична 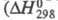
реакции −211 кДж/моль); разогревание слоя Cl2O7 может привести к взрыву. Распад Cl2O7 в газе на хлор и кислород идет с измеримой скоростью при 100–120 °C, но при давлении Cl2O7 выше 13,3 кПа приобретает взрывной характер. Жидкий Cl2O7 устойчив до 60–70 °C, примесь низших Х. о. ускоряет его распад. Для жидкого Cl2O7 характерны реакции с образованием ковалентных соед. с группой — ClO3. С NH3 в CCl4 образует NH4HNC1O3 и NH4C1O4, с алкиламинами — соотв. RHNC1O3 и R2NC1O3, с SbF5 — SbOF3 и FC1O3, с N2O5 в CCl4 NO2C1O4. Используя Cl2O7, можно синтезировать орг. перхлораты из спиртов. Получают Cl2O7 действием P2O5 или олеума на хлорную кислоту или электролизом раствора HClO4 на Pt-электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно получить также при нагр. в вакууме некоторых перхлоратов, напр. Nb(ClO4)5, MoO2(ClO4)2.
Известен ряд хлоркислородных свободных радикалов, полученных в разл. низкотемпературных матрицах и исследованных преим. методом ЭПР,- ClO3, ClOO, ClClO, а также малостабильный сесквиоксид Cl2O3, распадающийся при −50 — 0 °C и имеющий, вероятно, структуру хлората хлора ClOClO2. Термически устойчивый радикал ClO (длина связи С1 — О 0,1569 нм, 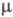
4,133 Кл∙м, 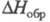
101,6 кДж/ моль) — промежут. продукт окисления углеводородов хлорной кислотой и Х. о., распада всех Х. о. и др. хлоркислородных соед., а также реакции озона с атомарным хлором в стратосфере.
Лит.: Никитин И. В., Химия кислородных соединений галогенов, М., 1986.
Оксидами или окислами называют соединения различных элементов с кислородом. Почти все элементы образуют такие соединения. Хлор, как и другие галогены, характеризуется в таких соединениях положительной степенью окисления. Все оксиды хлора являются чрезвычайно неустойчивыми веществами, что характерно для окислов всех галогенов. Известно четыре вещества, в молекулах которых содержатся хлор и кислород.
- Газообразное соединение от желтого до красноватого цвета с характерным запахом (напоминает запах газа Cl2) — оксид хлора (I). Формула химическая Cl2O. Температура плавления минус 116 °C, температура кипения плюс 2 °C. При нормальных условиях его плотность равняется 3,22 кг/м³.
- Желтый или желто-оранжевый газ с характерным запахом — оксид хлора (IV). Формула химическая ClO2. Температура плавления минус 59 °C, температура кипения плюс 11 °C.
- Красно-коричневая жидкость — оксид хлора (VI). Формула химическая Cl2O6. Температура плавления плюс 3,5 °C, температура кипения плюс 203 °C.
- Бесцветная маслянистая жидкость — оксид хлора (VII). Формула химическая Cl2O7. Температура плавления минус 91,5 °C, температура кипения плюс 80 °C.
Оксид хлора со степенью окисления +1 является ангидридом слабой одноосновной хлорноватистой кислоты (HClO). Получают его по методу Пелуза взаимодействием оксида ртути с газообразным хлором по одному из уравнений реакций: 2Cl2 + 2HgO → Cl2O + Hg2OCl2 или 2Cl2 + HgO → Cl2O + HgCl2. Условия протекания этих реакций разные. Оксид хлора (I) конденсируют при температуре минус 60 оС, потому что при более высокой температуре он разлагается, взрываясь, и в концентрированном виде является взрывоопасным. Водный раствор Cl2O получают при хлорировании в воде карбонатов щелочноземельных или щелочных металлов. Оксид хорошо растворяется в воде, при этом образуется хлорноватистая кислота: Cl2O + H2O ↔ 2HClO. Кроме того, он также растворяется в углероде четыреххлористом.
Оксид хлора со степенью окисления +4 иначе называется диоксид. Это вещество растворяется в воде, серной и уксусной кислотах, ацетонитриле, углероде четыреххлористом, а также в других органических растворителях, с увеличением полярности которых растворимость его возрастает. В лабораторных условиях его получают взаимодействием хлората калия со щавелевой кислотой: 2KClO3 + H2C2O4 → K2CO3 + 2ClO2 + CO2 + H2O. Так как оксид хлора (IV) является взрывоопасным веществом, то его в растворе хранить нельзя. Для этих целей используется силикагель, на поверхности которого в адсорбированном виде ClO2 может храниться долго, одновременно удается избавиться от загрязняющих его примесей хлора, так как он силикагелем не поглощается. В промышленных условиях ClO2 получают восстановлением диоксидом серы, в присутствии серной кислоты, хлората натрия: 2NaClO3 + SO2 + H2SO4 → 2NaHSO4 + 2ClO2. Применяется в качестве отбеливателя, например, бумаги или целлюлозы и прочее, а также для стерилизации и дезинфекции различных материалов.
Оксид хлора со степенью окисления +6, при плавлении распадается по уравнению реакции: Cl2O6 → 2ClO3. Получают оксид хлора (VI) окисляя озоном диоксид: 2O3 + 2ClO2 → 2O2 + Cl2O6. Этот окисел способен взаимодействовать растворами щелочей и с водой. При этом протекают реакции диспропорционирования. Например, при взаимодействии с гидроокисью калия: 2KOH + Cl2O6 → KClO3 + KClO4 + H2O, в результате получаются хлорат и перхлорат калия.
Высший оксид хлора называют еще хлорный ангидрид или дихлорогептаоксид является сильным окислителем. Он способен от удара или при нагревании взрываться. Однако это вещество более устойчиво, чем окислы со степенью окисления +1 и +4. Распад его до хлора и кислорода ускоряется из-за присутствия низших окислов и с повышением температуры от 60 до 70 оС. Оксид хлора (VII) способен медленно растворяться в холодной воде, в результате реакции образуется хлорная кислота: H2O + Cl2O7 → 2HClO4. Получают дихлорогептаоксид, осторожно нагревая хлорную кислоту с фосфорным ангидридом: P4O10 + 2HClO4 → Cl2O7 + H2P4O11. Также Cl2O7 можно получить, используя вместо фосфорного ангидрида олеум.
Раздел неорганической химии, который изучает оксиды галогенов, включая оксиды хлора, в последние годы стал развиваться активно, так как эти соединения являются энергоемкими. Они способны в камерах сгорания реактивных двигателей отдавать энергию мгновенно, а в химических источниках тока скорость ее отдачи может регулироваться. Другая причина интереса — это возможность синтеза новых групп неорганических соединений, например, оксид хлора (VII) является родоначальником перхлоратов.
Кислородные соединения хлора
| Свойство | Cl2O | ClO2 | Cl2O6 | Cl2O7 |
| Степень окисления | +1 | +4 | +6 | +7 |
| Температура плавления, ºС | –120,6 | –59 | 3,5 | –91,5 |
| Температура кипения, ºС | ||||
| Внешний вид | Темно-желтый газ | Желто-зеленый газ | Красная жидкость | Бесцв. жидкость |
Оксид хлора (I) Cl2O – темно-желтый газ с резким запахом. Ядовит. Молекула Cl2O имеет угловую форму (валентный угол 111º), длина связи O – Cl 170 пм. Получают оксид хлора (I) взаимодействием газообразного хлора с оксидом ртути (II) или оксидом висмута (III):
Оксид хлора (I) неустойчивое соединение, при небольшом нагревании, при соприкосновении с органическими веществами разлагается со взрывом на Cl2 и О2. Cl2O хорошо растворим в воде (при температуре 0 ºС в одном объеме воды растворяется 200 объемов Cl2O). При растворении в воде образуется хлорноватистая кислота HClO:
ClO2 – желто-зеленый газ с резким запахом. Ядовит. Молекула ClO2 имеет угловую форму (валентный угол OClO 117º), длина связи O – Cl 149 пм. Молекула содержит нечетное число электронов и поэтому парамагнитна.
Оксид хлора (IV) ClO2 – единственный оксид галогенов, который получают в промышленности путем пропускания оксида серы (IV) через подкисленный раствор хлората натрия NaClO3:
Прим. Образующийся газ в реакторе разбавляют азотом, чтобы избежать взрыва. Используется как отбеливающее средство и для обеззараживания воды.
В лабораторных условиях оксид хлора (IV) ClO2 получают взаимодействием хлората калия с щавелевой кислотой в присутствии концентрированной серной кислоты:
Оксид хлора (IV) – сильный окислитель. Взаимодействует с водой (медленно), со щелочью (быстро), при этом протекают реакции диспропорционирования:
Оксид хлора (IV) ClO2 взрывоопасен, взрывается от механического воздействия, при нагревании до 100 ºС, при введении в систему восстановителя.
Оксид хлора (VI) Cl2O6 (ClO3) – вязкая красная жидкость. При обычных условиях Cl2O6 постепенно разлагается на ClO2 и О2. В газовой фазе происходит распад:
Получают окислением ClO2 озоном:
Оксид хлора (VI) – сильный окислитель. Взаимодействует с водой, со щелочью, при этом протекают реакции диспропорционирования:
Оксид хлора (VI) взрывается при соприкосновении с органическими веществами.
Оксид хлора (VII) Cl2О7 – маслянистая бесцветная жидкость. Очень взрывоопасен. Получают путем взаимодействия оксида фосфора (V) с концентрированной хлорной кислотой:
При растворении Cl2О7 в воде образуется хлорная кислота HClO4 (ангидрид хлорной кислоты):
| | | следующая лекция ==> | |
| Сравнительная характеристика галогенводородов | | | Соединения хлора с положительной степенью окисления |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Водород.
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью.

| Получение: 1.В промышленности: Конверсионный способ. Вначале получают водяной газ, пропуская пары воды через раскаленный кокс при 1000 °С: С + Н2О -tà СО + Н2. Затем оксид углерода (II) окисляют в оксид углерода (IV), пропуская смесь водяного газа с избытком паров воды над нагретым до 400–450 °С катализатором Fe2O3: CO +H2O = CO2 + H2. Окисление метана водяным паром: CH4 + 2Н2O –(t, Ni)à4Н2 + CO2 Термическое разложение метана при 1200 °С: CH4 -tà C + 2H2 Электролиз водного раствора поваренной соли или гидроксида натрия: (NaOH) + 2Н2O –эл.токà 2Н2 + O2 2NaCl + 2H2O –эл.токà H2 + Cl2 + 2NaOH; 2. В лаборатории: Zn + 2HCl à ZnCl2 + Н2 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2; Si + 2NaOH + H2O = Na2SiO3 + 2H2. | Свойства: 1.С металлами: Н2 + 2Na -tà2NaH Н2 + Са -tà СаН2 2. С неметаллами: 2Н2 + O2 à 2Н2O Н2 + Cl2 -hvà 2HCl 3Н2 + N2 -t, p, кат.à 2NH3 H2 + S à H2S 3. С оксидами металлов (неактивных) и неметаллов: CuO + H2 à Cu + H2O 2NO + 2H2 = N2 + 2H2O. |
Водородные соединения металлов и неметаллов.
1. Ионные гидриды: Получение: Н2 + 2Na -tà2NaH
Свойства: разлагаются водой и кислотами:
2. Ковалентные водородные соединения:
Все газы, кроме воды (водородные связи).
| CH4- метан | NH3-аммиак | H2O - вода | HF –фтороводород |
| SiH4 - силан | PH3 - фосфин | H2S - сероводород | HCl - хлороводород |
Неустойчивые: фосфин и силан.
Основными свойствами обладает: аммиак.
Амфотерные свойства проявляет: вода.
Кислоты образуют в водном растворе: сероводород и галогеноводороды.
Вода.
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличии от ее газообразных аналогов H2S, H2Se и Н2Те.
а) щелочные и щелочноземельные (кроме бериллия и магния): 2Na + 2Н2O = 2NaOH + Н2
б) остальные металлы в ряду активности до Н могут окисляться водяным паром до оксида при высокой температуре: Fe + 4Н2O-tà Fe3O4 + 4Н2
2. С оксидами щелочных и щелочноземельных металлов: Н2O + СаО = Са(OH)2
3. С кислотными оксидами растворимых кислот: P2O5 + 3H2O = 2H3PO4.
4. Гидролиз солей, бинарных соединений металлов и неметаллов:
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварки металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- для получения аммиака и искусственного жидкого топлива, для гидрогенизации жиров.
ГАЛОГЕНЫ.
Это элементы VII-A группы. Являются типичными неметаллами. На внешнем электронном слое содержится 7 электронов (ns 2 np 5 ). В природе встречаются в виде соединений или ионов (в морской воде).
Проявляют степени окисления от -1 до +7 (фтор – только -1). Молекулы состоят из двух атомов, связанных одной ковалентной неполярной связью. Плохо растворимы в воде, все имеют запах, летучи. Хорошо растворяются в неполярных растворителях.
ФТОР F2 – газ светло-желтого цвета.
электролиз расплава гидрофторида калия KHF2: 2KHF2 -эл/токà 2K + H2 + 2F2
Химические свойства:
F2 – самый сильный окислитель из всех веществ.
| 1. Реагирует с водородом, образуя фтороводород: | H 2 + F2 ® 2HF (со взрывом) |
| 2. Реагирует с другими галогенами: | Cl2 + F2 ® 2ClF |
| 3. Окисляет воду, при этом выделяется кислород: | 2F2 + 2H2O ® 4HF + O2 |
| 4. С металлами (часто со взрывом), включая золото. | 2К + F2 ® 2KF 2Au + 3F2 ® 2AuF3 |
| 5. С другими неметаллами | S + 3F2 ® SF6 |
| 6. Вытесняет другие галогены из растворов их солей и водородных соединений | 2НС1 + F2 ® 2HF + С12 |
Фтористый водород
Едкий газ, хорошо растворим в воде с образованием плавиковой кислоты.
Получение:из фторида кальция: CaF2 + H2SO4(конц.) ® CaSO4 + 2HF
ХИМИЧЕСКИЕ СВОЙСТВА:
| 1) Раствор HF в воде – слабая кислота (плавиковая) | HF⇄H + + F - Соли плавиковой кислоты – фториды. |
| 2) Реагирует с основаниями и основными оксидами: | HF + NaOH = NaF + H2O 2HF + MgO = MgF2 + H2O |
| 3) Плавиковая кислота растворяет стекло: | SiO2 + 4HF ® SiF4+ 2H2O |
Фторид кислорода О +2 F2
В этом соединении кислород проявляет положительную степень окисления. Это бесцветный газ, плохо растворимый в воде.
Фторне образует соединения типа ННаlОn
Газ желто-зеленого цвета с едким запахом. Ядовит. Используется для обеззараживания.
1) Электролиз раствора NaCl (промышленный способ):
2) Окисление ионов Cl - сильными окислителями:
ХИМИЧЕСКИЕ СВОЙСТВА:
| 1) Реакции с металлами: | 2Na + Cl2 ® 2NaCl 2Fe + 3Cl2 ® 2FeCl3 |
| 2) Реакции с неметаллами. С кислородом не реагирует. | H2 + Cl2 – h n ® 2HCl 2P + 5Cl2 ® 2PCl5 |
| 3) Реакция с водой: | Cl2 + H2Oà HCl + HClO (диспропорционирование) 3Сl2 + 3H2O – t ° ® 5HCl + HClO3 |
| 4) Реакции со щелочами: | Cl2 + 2KOH – 5 ° C ® KCl + KClO + H2O 3Cl2 + 6KOH – 40 ° C ® 5KCl + KClOЗ + 3H2O Cl2 + Ca(OH)2 ® CaOCl2(хлорная известь) + H2O |
| 5) Вытесняет бром и йод из галогеноводородных кислот и их солей. | Cl2 + 2KI ® 2KCl + I2 Cl2 + 2HBr ® 2HCl + Br2 |
| 6) Окисляет бром и йод: | Cl2 + I2 +H2O → HCl + HIO3 |
ХЛОРИСТЫЙ ВОДОРОД
Бесцветный газ с резким запахом, ядовитый, тяжелее воздуха, хорошо растворим в воде.
1) Синтетический способ (промышленный): H2 + Cl2 ® 2HCl
2) Гидросульфатный способ (лабораторный): NaCl(тв.) + H2SO4(конц.) ® NaHSO4 + HCl↑
ХИМИЧЕСКИЕ СВОЙСТВА:
| 1) Раствор HCl в воде – соляная кислота (сильная, одноосновная) | HCl à H + + Cl - |
| 2) Реагирует с металлами, стоящими в ряду напряжений до водорода: | 2Al + 6HCl ® 2AlCl3 + 3H2 |
| 3) с оксидами металлов: | MgO + 2HCl ® MgCl2 + H2O |
| 4) с основаниями и аммиаком: | HCl + KOH ® KCl + H2O 3HCl + Al(OH)3 ® AlCl3 + 3H2O HCl + NH3 ® NH4Cl |
| 5) с солями: | CaCO3 + 2HCl ® CaCl2 + H2O + CO2 HCl + AgNO3 ® AgCl¯ + HNO3 |
Образование белого осадка хлорида серебра, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl - в растворе:
ХЛОРИДЫ МЕТАЛЛОВ – соли соляной кислоты.
| 1) взаимодействием металлов с хлором: | 2Fe + 3Cl2 ® 2FeCl3 |
| 2) реакция соляной кислоты с металлами, | Mg + 2HCl ® MgCl2 + H2 |
| 3) реакция соляной кислоты с оксидами | CaO + 2HCl ® CaCl2 + H2O |
| 4) с гидроксидами | Ba(OH)2 + 2HCl ® BaCl2 + 2H2O |
| 5) реакции обмена с некоторыми солями: | Pb(NO3)2 + 2HCl ® PbCl2¯ + 2HNO3 |
| 6) Замещение металлом другого металла в соли: | Mg + CuС12 à MgС12 + Cu |
| 1) Растворимые хлориды вступают в обменные реакции, если образуется осадок, газ или вода: | NaCl + AgNO3 à AgCl ¯+ NaNO3 |
| 2) Хлориды тяжелых металлов реагируют с более активными металлами – реакция замещения | Mg + CuС12 à MgС12 + Cu |
| 3) В процессе электролиза на аноде выделяется газообразный хлор | 2NaCl + 2H2O –эл.токà 2NaOH + Cl2 + H2 в растворе 2NaCl –эл.токà 2Na+ Cl2 только в расплаве CuCl2 –эл.токà Cu + Cl2 и в растворе, и в расплаве |
Оксиды и кислородсодержащие кислоты хлора
Это бурая жидкость с тяжелыми ядовитыми парами; имеет неприятный запах.
ПОЛУЧЕНИЕ.
Окисление ионов Br - сильными окислителями:
ХИМИЧЕСКИЕ СВОЙСТВА.
| 1) Реагирует с металлами: | 2Al + 3Br2 ® 2AlBr3 |
| 2) Реагирует с неметаллами. С кислородом не реагирует. | H2 + Br2 « 2HBr 2P + 5Br2 ® 2PBr5 |
| 3) Реагирует с водой и щелочами: | Br2 + H2O « HBr + HBrO Br2 + 2KOH ® KBr + KBrO + H2O |
| 4) Реагирует с сильными восстановителями: | Br2 + 2HI ® I2 + 2HBr Br2 + H2S ® S + 2HBr |
БРОМИСТЫЙ ВОДОРОД HBr
Бесцветный газ, хорошо растворим в воде. Раствор в воде – сильная бромоводородная кислота.
ПОЛУЧЕНИЕ
1) Вытеснение из бромидов кислотой-неокислителем:
2) Гидролиз бромидов неметаллов:
ХИМИЧЕСКИЕ СВОЙСТВА.
Бромоводородная кислота еще более сильная, чем соляная. Она вступает в те же реакции, что и HCl:
| 1) Диссоциация: | HBr « H + + Br - |
| 2) С металлами, стоящими в ряду напряжения до водорода: | Mg + 2HBr ® MgBr2 + H2 |
| 3) с оксидами металлов: | CaO + 2HBr ® CaBr2 + H2O |
| 4) с основаниями и аммиаком: | NaOH + HBr ® NaBr + H2O Fe(OH)3 + 3HBr ® FeBr3 + 3H2O NH3 + HBr ® NH4Br |
| 5) с солями: | MgCO3 + 2HBr ® MgBr2 + H2O + CO2 AgNO3 + HBr ® AgBr¯ + HNO3 |
| 6) HBr – сильный восстановитель: | 2HBr + H2SO4(конц.) ® Br2 + SO2 + 2H2O 2HBr + Cl2 ® 2HCl + Br2 |
| Образование желтовато-белого осадка бромида серебра используется в качестве качественной реакции для обнаружения анионов Вr - в растворе: HBr + AgNO3 ® AgBr¯ + HNO3 |
Кристаллическое вещество темно-фиолетового цвета с металлическим блеском. При нагревании возгоняется (переходит из твердого состояния сразу в газ, минуя жидкое).
ПОЛУЧЕНИЕ.
Окисление ионов I - сильными окислителями:
ХИМИЧЕСКИЕ СВОЙСТВА.
| 1) c металлами: | 2Al + 3I2 ® 2AlI3 |
| 2) c водородом: | H2 + I2 « 2HI |
| 3) с сильными восстановителями: | I2 + SO2 + 2H2O ® H2SO4 + 2HI I2 + H2S ® S + 2HI |
| 4) со щелочами: | 3I2 + 6NaOH ® 5NaI + NaIO3 + 3H2O |
| 5) с хлором: | I2 + 5Cl2 + 6H2O à 10HCl + 2HIO3 |
ИОДИСТЫЙ ВОДОРОД HI
Бесцветный газ с резким запахом, хорошо растворим в воде. Раствор в воде – сильная одноосновная иодоводородная кислота.
Восстановление йода сероводородом: I2 + H2S ® S + 2HI
Читайте также:

