Ki 67 нейроэндокринная опухоль
Аннотация научной статьи по клинической медицине, автор научной работы — Делекторская Вера Владимировна, Козлов Николай Александрович, Чемерис Г. Ю.
Проведен ретроспективный морфологический анализ 72 первичных нейроэндокринных опухолей поджелудочной железы (НЭН ПЖ) и 32 синхронных и метахронных метастазов этих опухолей в печени. Целью исследования было определение индекса пролиферации Ki-67 в первичной опухоли и метастазах в печени для выявления клинической значимости изменений пролиферативной активности клеток в процессе опухолевой прогрессии. Результаты исследования показали, что индекс Ki-67, определенный в клетках первичных НЭО ПЖ, увеличивается в 52,0 % вторичных очагов опухолевого роста в 1,7–15 раз, сопровождаясь в ряде случаев изменением степени злокачественности новообразования. Кроме того, в первичных и метастатических опухолях наблюдаются статистически достоверные различия между средними значениями индекса Ki-67 ( р = 0,000), а также показателями выживаемости больных в зависимости от степени злокачественности первичных и метастатических опухолей ( p = 0,01 и p = 0,03, соответственно). Таким образом, точная и своевременная оценка индекса Ki-67 в метастазах НЭО ПЖ является основой для уточнения степени злокачественности и базой для дальнейшей клинической оценки агрессивности течения заболевания и обоснованного назначения соответствующих режимов лекарственного лечения.
Похожие темы научных работ по клинической медицине , автор научной работы — Делекторская Вера Владимировна, Козлов Николай Александрович, Чемерис Г. Ю.
EXPRESSION OF Ki-67 IN DISTANT METASTASES OF NEUROENDOCRINE NEOPLASM OF PANCREAS
A retrospective analysis of 72 morphological primary NaN RV and synchronous and metachronous 32 metastases of these tumors in the liver is conducted. The aim of this study was to determine the proliferation index Ki-67 in primary tumors and metastases in the liver to detect clinically significant changes in proliferative activity of cells during tumor progression. The results showed that the Ki-67 index, defined in primary cells NEO prostate increases in 52.0 % of secondary foci of tumor growth in 1.7–15 times, accompanied in some cases change in the degree of malignancy. Furthermore, in primary and metastatic tumors there is a statistically significant difference between the mean index of Ki-67 ( p = 0.000), and survival rates of patients depending on the grade of primary and metastatic tumors ( p = 0.01 and p = 0.3, respectively). Thus, accurate and timely assessment of the index of Ki-67 in metastatic NETs RV is the basis for verifying grade and a base for further clinical evaluation of the aggressiveness of the disease and the sound administration of appropriate drug treatment regimes.
ЭКСПРЕССИЯ Ki-67 В ОТДАЛЕННЫХ МЕТАСТАЗАХ НЕЙРОЭНДОКРИННЫХ НОВООБРАЗОВАНИЙ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Ключевые слова: индекс пролиферации опухолевых клеток Кл-67; нейроэндокринные опухоли поджелудочной железы; первичные опухоли; метастатические опухоли.
Проведен ретроспективный морфологический анализ 72 первичных нейроэндокринных опухолей поджелудочной железы (НЭН ПЖ) и 32 синхронных и метахронных метастазов этих опухолей в печени. Целью исследования было определение индекса пролиферации Кл-67 в первичной опухоли и метастазах в печени для выявления клинической значимости изменений пролиферативной активности клеток в процессе опухолевой прогрессии. Результаты исследования показали, что индекс Кл-67, определенный в клетках первичных НЭО ПЖ, увеличивается в 52,0 % вторичных очагов опухолевого роста в 1,7-15 раз, сопровождаясь в ряде случаев изменением степени злокачественности новообразования. Кроме того, в первичных и метастатических опухолях наблюдаются статистически достоверные различия между средними значениями индекса Кл-67 (р = 0,000), а также показателями выживаемости больных в зависимости от степени злокачественности первичных и метастатических опухолей (р = 0,01 и р = 0,03, соответственно). Таким образом, точная и своевременная оценка индекса Кл-67 в метастазах НЭО ПЖ является основой для уточнения степени злокачественности и базой для дальнейшей клинической оценки агрессивности течения заболевания и обоснованного назначения соответствующих режимов лекарственного лечения.
Нейроэндокринные новообразования (НЭН) поджелудочной железы (ПЖ) характеризуются вариабельными биологическими характеристиками и метастатическим потенциалом 2. Согласно современной классификации Всемирной организации здравоохранения (ВОЗ, 2010), ключевым параметром для определения степени злокачественности опухоли является пролиферативная активность клеток, которая определяется на основе оценки ядерной экспрессии антигена Кь67 [2, 4-7]. Различают 3 прогностические категории НЭН ПЖ: опухоли низкой ^1), промежуточной ^2) и высокой ^3) степени злокачественности 11. Все высокодифференцированные новообразования, независимо от наличия или отсутствия метастазов, имеют название нейроэндокринная опухоль (НЭО) и градацию G1 (Кь67 20 %).
Учитывая, что более 60 % больных НЭО имеют метастазы на момент постановки диагноза, большое значение для оптимизации лечения имеет определение индекса Кь67 не только в первичной опухоли, но и во вторичных очагах роста [2, 3, 14-16]. Вместе с тем вероятность изменения пролиферативной активности нейроэндокринных клеток в метастазах НЭО ПЖ в процессе опухолевой прогрессии изучена недостаточно.
Цель настоящего исследования - оценка особенностей экспрессии антигена Кь67 в клетках метастазов НЭН ПЖ в печени и выявление их связи со степенью злокачественности первичной опухоли и прогнозом заболевания.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
На момент постановки диагноза у 35 (48,6 %) больных наблюдалась локализованная форма болезни без регионарных и/или отдаленных метастазов (стадии ЬА, IB, ПА), у 12 (16,7 %) пациентов выявляли регионарное распространение (стадия IIB и III), у 25 (19,41 %) больных заболевание сопровождалось наличием регионарных и отдаленных метастазов в печени (стадия IV). Общий период послеоперационного наблюдения составил от 6 месяцев до 17 лет. У 23 (31,9 %) больных отмечалось прогрессирование заболевания в разные сроки после хирургического лечения: у 17 пациентов (23,6 %) были выявлены вторичные опухолевые очаги в печени, у 6 (8,3 %) больных наблюдались местные рецидивы заболевания. За период наблюдения умерло 10 (13,8 %) пациентов.
Математический анализ полученных результатов проводили с использованием пакета статистических программ SPSS 17.0 for Windows и Microsoft® Office Access 2007. Достоверность различий частот признаков в изучаемых группах определяли с использованием критерия х2 (различия считались статистически значимыми прир Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Рис. 2. Рост пролиферативной активности клеток НЭО ПЖ в метастазе в печени: а) первичная опухоль. Индекс Кл-67 равен 1 %, что соответствует низкой степени злокачественности G1 (х200); б) метахронный метастаз данной опухоли в печени. Индекс Кл-67 равен 9 %, что соответствует промежуточной степени злокачественности G2 (х200)
Оценка выживаемости больных НЭО ПЖ в зависимости от степени злокачественности как первичных, так и метастатических очагов демонстрировала статистически достоверные различия (р = 0,01 и р = 0,03, соответственно) (рис. 3а, 3б).
Рис. 3. График общей выживаемости (ОВ) в зависимости от степени злокачественности НЭО ПЖ (метод Каплана-Майера): а) ОВ в зависимости от степени злокачественности первичных опухолей (р = 0,01); б) ОВ в зависимости от степени злокачественности отдаленных метастазов (р = 0,03)
Клиническое течение как локализованных, так и метастатических форм НЭО ПЖ отличается значительным разнообразием. Определение пролиферативной активности клеток опухоли имеет большое значение для своевременного уточнения злокачественного потенциала новообразования и выбора оптимального лечения. Результаты многочисленных исследований демонстрируют различия в количестве пролиферирующих клеток в первичных и метастатических очагах новообразования [6, 8, 13, 16]. Наиболее важным моментом является тот факт, что рост пролиферативной активности в метастазах НЭО ПЖ может сопровождаться повышением степени злокачественности опухоли, что требует изменений в подходах к ведению и лечению больного [3, 9, 11, 14, 17].
Проведенный в настоящем исследовании анализ пролиферативной активности клеток отдаленных метастазов НЭО ПЖ в печени выявил повышение индекса Кь67 в 52,0 % вторичных очагов опухолевого роста. При этом пролиферативный индекс в метастазах в печени возрастал в 1,7-15 раз по сравнению с первичной опухолью, что в 4 наблюдениях сопровождалось увеличением степени злокачественности НЭО ПЖ. Показаны статистически достоверные различия между средними значениями индекса Кь67 в первичных НЭО ПЖ и их отдаленных метастазах в печени (р = 0,000), а также между выживаемостью больных, имеющих различную степень злокачественности как первичных, так и метастатических опухолей (р = 0,01 и р = 0,03, соответственно).
Таким образом, результаты нашего исследования показывают, что рост пролиферативной активности в метастазах НЭО ПЖ является достаточно частым событием и в отдельных случаях ведет к увеличению степени злокачественности новообразования. В этой связи показатель пролиферативной активности опухолевых клеток Ki-67 следует относить к параметрам, которые обязательно должны определяться в процессе современной морфологической диагностики при исследовании метастатических опухолей. Точная и своевременная оценка индекса Ki-67 в метастазах является основой для уточнения степени злокачественности НЭО ПЖ и служит базой для дальнейшей клинической оценки агрессивность течения заболевания и обоснованного назначения соответствующих режимов лекарственного лечения.
1. Amador Cano A., Garcia F., Espinoza A. et al. Nonfunctional neuroendocrine tumor of the pancreas: Case report and review of the literature // Int. J. Surg. Case Rep. 2013. V. 4. № 2. P. 225-228.
2. Kloppel G. Classification and pathology of gastroenteropancreatic neuroendocrine neoplasms // Endocr.-Relat. Cancer. 2011. V. 18 (Suppl. 1). P. S1-S16.
3. Klimstra D.S., Modlin I.R., Adsay N.V. et al. Pathology Reporting of Neuroendocrine Tumors: Application of the Delphic Consensus Process to the Development of a Minimum Pathology Data Set // Am. J. Surg. Pathol. 2010. V. 34. № 3. P. 300-313.
4. Adsay V. Ki-67 labeling index in neuroendocrine tumors of the gastrointestinal and pancreatobiliary tract: to count or not to count is not the question, but rather how to count // Am. J. Surg. Pathol. 2012. V. 36. № 12. P. 1743-1746.
5. Boninsegna L., Panzuto F., Partelli S. et al. Malignant pancreatic neuroendocrine tumour: lymph node ratio and Ki-67 are predictors of recurrence after curative resections // Eur. J. Cancer. 2012. V. 48. № 11. P. 1608-1615.
6. Couvelard A. Ki-67 and neuroendocrine tumors // Ann Pathol. 2011. V. 31 (5 Suppl). P. S55-S56.
7. Tang L.H., Gonen M., Hedvat C. et al. Objective quantification of the Ki-67 proliferative index in neuroendocrine tumors of the gastroenteropancreatic system: a comparison of digital image analysis with manual methods // Am. J. Surg. Pathol. 2012. V. 36. № 12. P. 1761-1770.
8. Couvelard A., Deschamps L., Ravaud P. et al. Heterogeneity of tumor prognostic markers: a reproducibility study applied to liver metastases of pancreatic endocrine tumors // Mod. Pathol. 2009. V. 22. № 2. P. 273-281.
9. McCall C.M., Shi C., Cornish T.C. et al. Grading of Well-differentiated Pancreatic Neuroendocrine Tumors is Improved by the Inclusion of Both Ki-67 Proliferative Index and Mitotic Rate // Am. J. Surg. Pathol. 2013. V. 37. № 11. P. 1671-1677.
10. Oh T.G., Chung M.J., Park J.Y. et al. Prognostic factors and characteristics of pancreatic neuroendocrine tumors: single center experience // Yonsei. Med. J. 2012. V. 53. № 5. P. 944-951.
11. Remes S.M., Tuominen V.J., Helin H. et al. Grading of neuroendocrine tumors with Ki-67 requires high-quality assessment practices // Am. J. Surg. Pathol. 2012. V. 36. № 9. P. 1359-1363.
12. Scarpa A., Mantovani W., Capelli P. et al. Pancreatic endocrine tumors: improved TNM staging and histopathological grading permit a clinically efficient prognostic stratification of patients // Mod. Pathol. 2010. V. 23. № 6. P. 824-833.
13. Strosberg J., Nasir A., Coppola D. et al. Correlation between grade and prognosis in metastatic gastroenteropancreatic neuroendocrine tumors // Hum. Pathol. 2009. V. 40. № 9. P. 1262-1268.
14. Palazzo M., Lombard-Bohas C., Cadiot G. et al. Ki67 proliferation index, hepatic tumor load, and pretreatment tumor growth predict the antitumoral efficacy of lanreotide in patients with malignant digestive neuroendocrine tumors // Eur. J. Gastroenterol. Hepatol. 2013. V. 25. № 2. P. 232-238.
15. Panzuto F., Boninsegna L., Fazio N. et al. Metastatic and locally advanced pancreatic endocrine carcinomas: analysis of factors associated with disease progression // J. Clin. Oncol. 2011. V. 29. № 17. P. 23722377.
16. Yang Z., Tang L.H., Klimstra D.S. Effect of tumor heterogeneity on the assessment of Ki67 labeling index in well-differentiated neuroendocrine tumors metastatic to the liver: implications for prognostic stratification // Am. J. Surg. Pathol. 2011. V. 35. № 6. P. 853-860.
17. Jamali M., Chetty R. Predicting prognosis in gastroentero-pancreatic neuroendocrine tumors: an overview and the value of Ki-67 immunos-taining // Endocr. Pathol. 2008. V. 19. № 4. P. 282-288.
Поступила в редакцию 22 ноября 2013 г.
Delektorskaya V.V., Kozlov N.A., Chemeris G.Y. EXPRESSION OF Ki-67 IN DISTANT METASTASES OF NEUROENDOCRINE NEOPLASM OF PANCREAS
A retrospective analysis of 72 morphological primary NaN RV and synchronous and metachronous 32 metastases of these tumors in the liver is conducted. The aim of this study was to determine the proliferation index Ki-67 in primary tumors and metastases in the liver to detect clinically significant changes in proliferative activity of cells during tumor progression. The results showed that the Ki-67 index, defined in primary cells NEO prostate increases in 52.0 % of secondary foci of tumor growth in 1.715 times, accompanied in some cases change in the degree of malignancy. Furthermore, in primary and metastatic tumors there is a statistically significant difference between the mean index of Ki-67 (p = 0.000), and survival rates of patients depending on the grade of primary and metastatic tumors (p = 0.01 and p = 0.3, respectively). Thus, accurate and timely assessment of the index of Ki-67 in metastatic NETs RV is the basis for verifying grade and a base for further clinical evaluation of the aggressiveness of the disease and the sound administration of appropriate drug treatment regimes.
Key words: proliferation index Ki-67 of tumor cells; neuroendocrine tumors of pancreas; primary tumors; metastatic tumors.
Локализация НЭО крайне разнообразна, но чаще всего они обнаруживаются в органах пищеварительной системы (более 50 %): прямая (17,2 %) и тонкая кишка (13,4 %), желудок (6,0 %), поджелудочная железа (6–7 %). НЭО занимают второе место в общей структуре онкологической патологии ЖКТ, уступая лидерские позиции лишь колоректальному раку. Около 27 % случаев НЭО возникают в легких (согласно базе данных Surveillance, Epidemiology, and End Results (SEER) 1975-2016) [1].
Еще недавно обсуждались вопросы включения НЭО в список орфанных заболеваний. Но в настоящее время отмечается увеличение частоты встречаемости этой патологии, в том числе из-за улучшения диагностических возможностей (в частности, распространение гастроскопии, колоноскопии, капсульной эндоскопии).
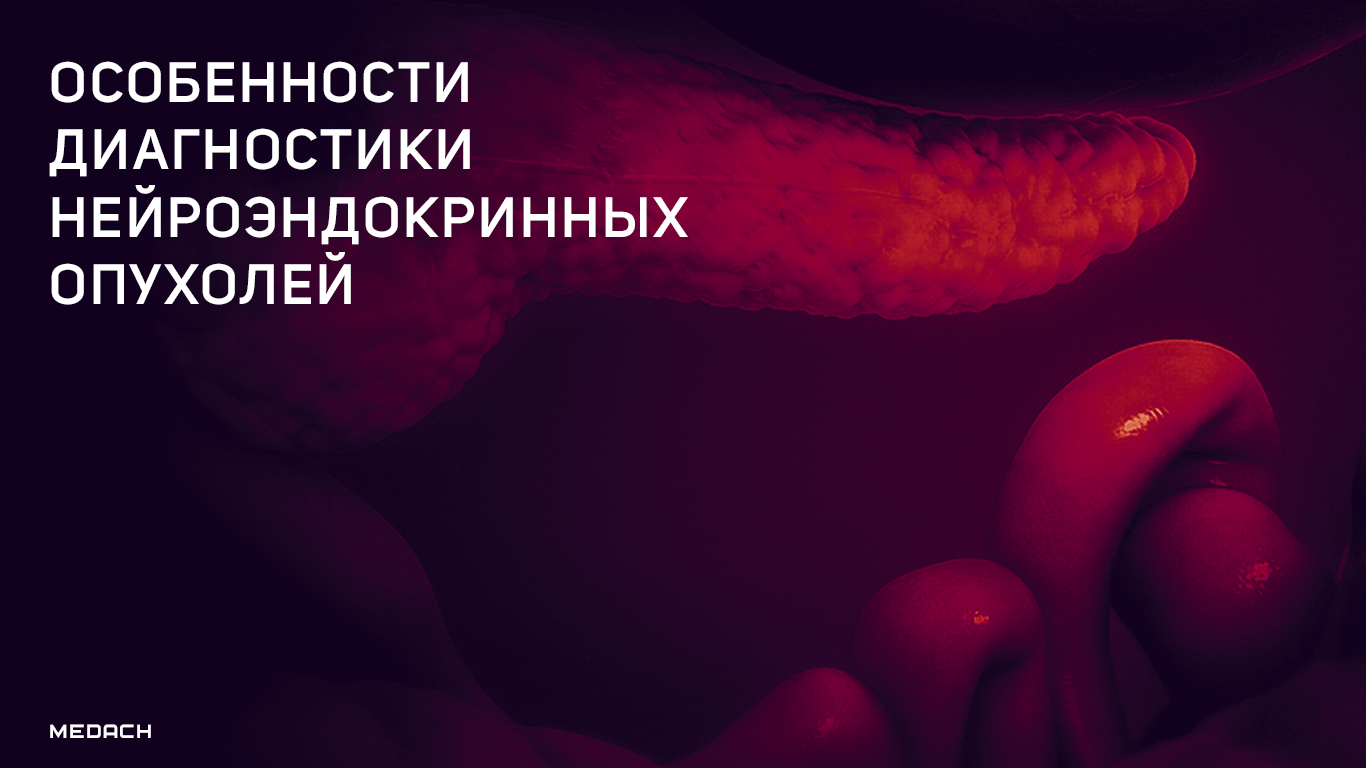
НЭО классифицируют в зависимости от отдела эмбриональной кишечной трубки: из передней, средней и задней кишки (табл. 1) [2].
Табл.1 | Классификация НЭО по эмбриогенезу [2].
Карциноидный синдром — важный клинический признак. В основном, он обусловлен эффектами серотонина, а также брадикинина, гистамина, дофамина и в меньшей степени других биологически активных веществ (БАВ).
Клинические проявления карциноидного синдрома разнообразны. Наиболее часто у пациентов отмечается гиперемия кожи лица, приливы, диарея, боль в животе. У 60 % пациентов отмечают формирование карциноидной болезни сердца, с нарушением работы преимущественно клапанного аппарата правых отделов (стеноз и/или недостаточность легочного и трехстворчатого клапанов). Серьезным осложнением является декомпенсация нарастающей сердечной недостаточности. Морфологическим субстратом служит выраженный диффузный фиброэластоз эндокарда. Возможны появления телеангиоэктазий, одышки, пеллагры, бронхоспазма. Усиливается продукция соединительнотканных компонентов, в частности, коллагена. Это ведет к фиброзированию и стенозу брыжеечных артерий, фиброзирующему стенозу уретры. Ввиду склонности к развитию спаечного процесса в брюшной полости нарастает риск формирования кишечной непроходимости.
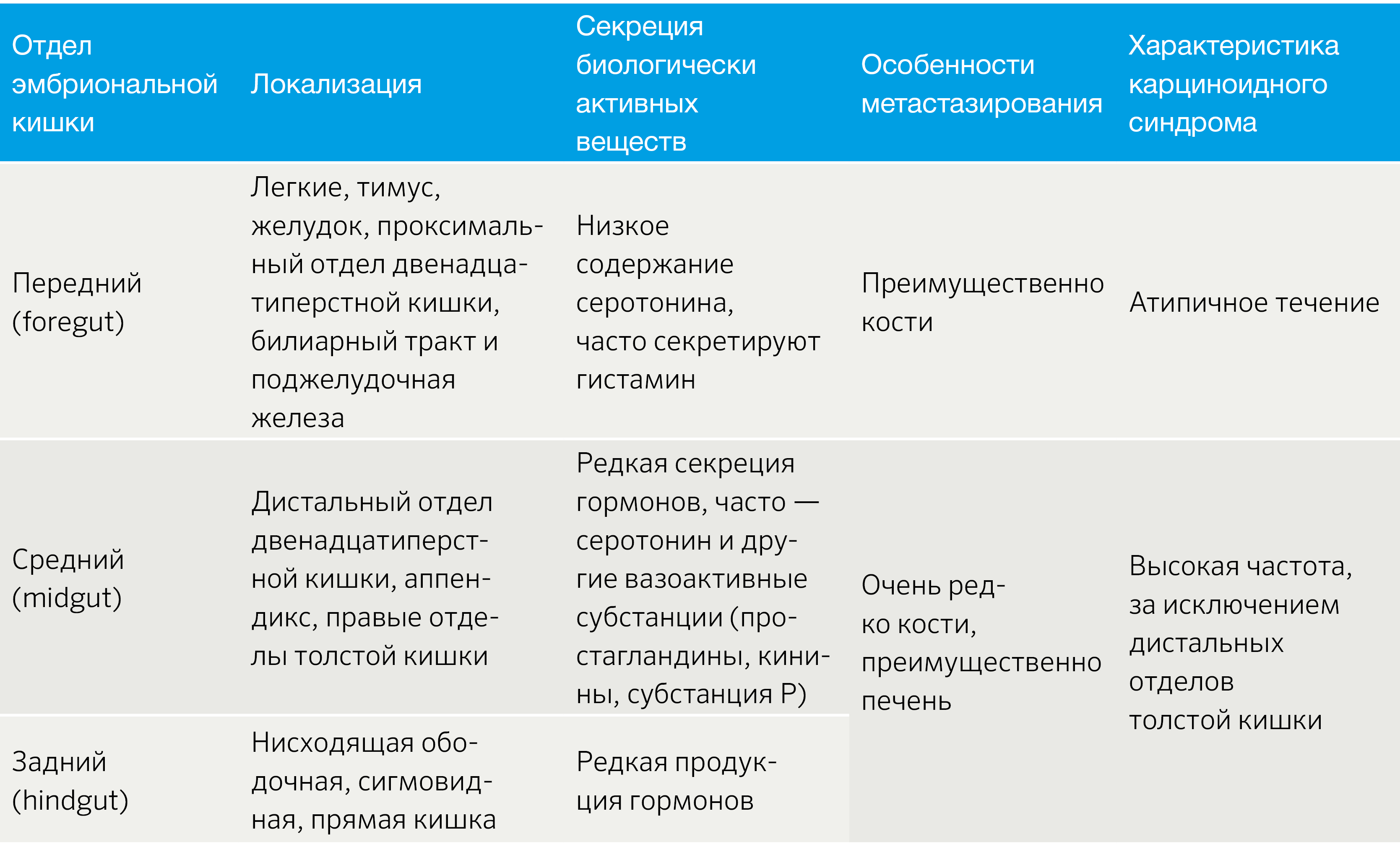
Важным аспектом является функциональный статус опухоли. В зависимости от наличия продукции БАВ выделяют функционирующие (табл. 2) и нефункционирующие новообразования [3].
Табл.2 | Функционирующие НЭО [3].
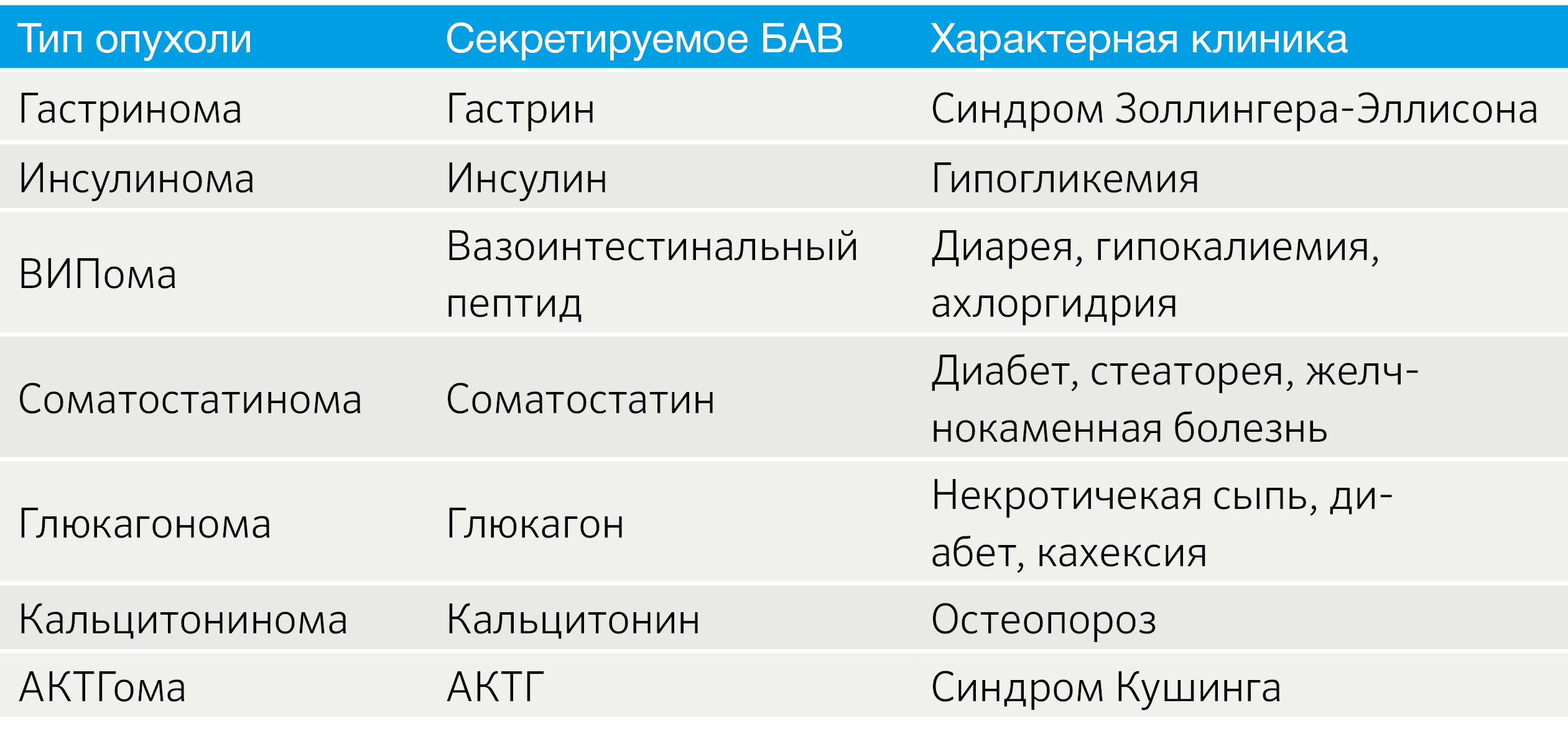
Особенности TNM-классификации определяются локализацией НЭО. НЭО легких стадируются как немелкоклеточный рак легких, для НЭО ЖКТ и поджелудочной железы разработаны рекомендации Европейского общества по изучению НЭО (ENETS) [4]. Также установление стадии TNM для всех анатомических локализаций регламентируется руководством, созданным Американским объединенным комитетом по раковым заболеваниям (the American Joint Committee on Cancer, AJCC) [5, 6]. Так как эти системы не идентичны, возникают вопросы унификации подходов к стадированию. Например, была создана модифицированная система ENETS (mENETS), для диагностики НЭО поджелудочной железы (pNET) (табл. 3) [7].
Табл.3 | Стадирование НЭО поджелудочной железы согласно модифицированной системе ENETS (mENETS) [7].
И вот мы подходим к той черепахе, на которой стоят киты онкологической диагностики. Это, несомненно, гистологическая верификация диагноза. Как и многие опухолевые заболевания, морфологические градации НЭО подвергались различным модификациям, уточнениям, дополнениям. Дискуссии в этой области в итоге привели к созданию 4-ой редакции классификации ВОЗ (2017 год) [8]. Именно она является актуальной на настоящий момент и заключение при проведении патологоанатомическом исследовании должно отвечать введенным в ней понятиям и требованиям.
Параметрами морфологической оценки нейроэндокринных новообразований являются: гистологическое строение опухоли, определение сосудистой и периневральной инвазии, митотический индекс. Несмотря на многообразия источников НЭО, морфологическая картина является сходной (рис. 1) [9].
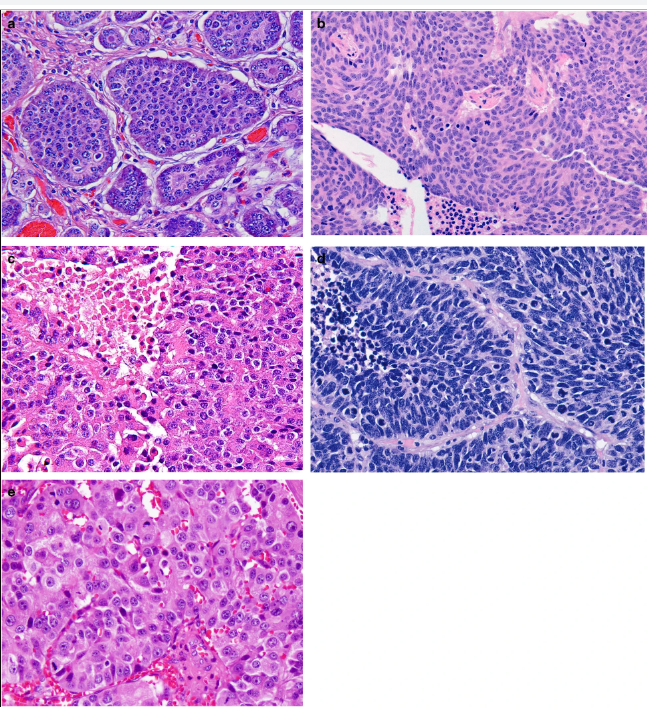
Нейроэндокринное происхождение атипичных клеток доказывает положительная экспрессия так называемых общих нейроэндокринных маркеров. Основные из них это хромогранин А, окрашивающий компоненты нейросекреторных гранул, и пептид синаптофизин, накапливающийся в мелких синаптических везикулах. Также применяется дополнительно установление экспрессии рецепторов соматостатина 2 и 5 типов (SSTR2 и SSTR5). В этом случае возможно определить чувствительность опухолевых клеток к аналогам соматостатина.
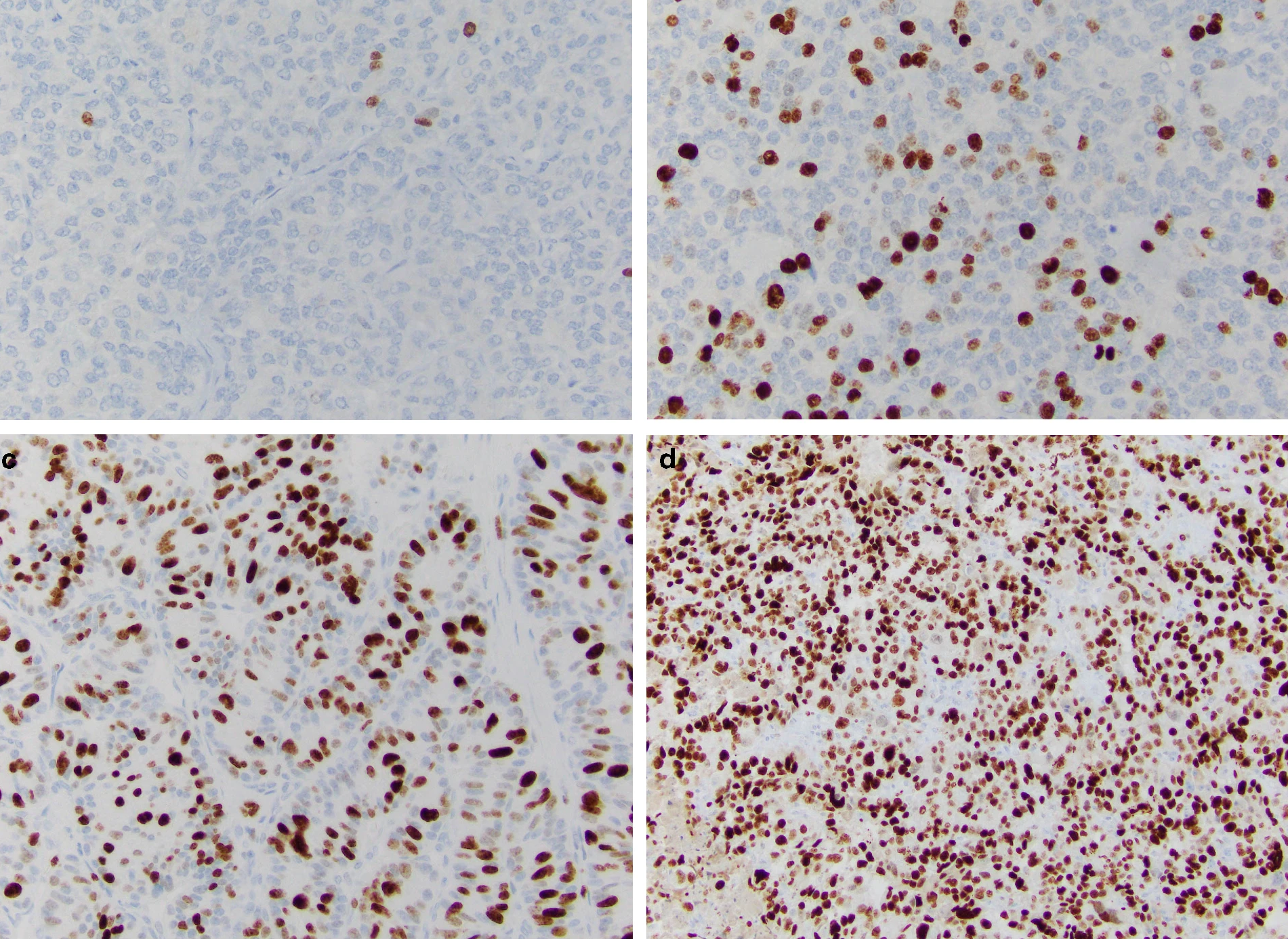
Степень злокачественности НЭО определяют на основании двух основных критериев: уровня дифференцированности опухолевых клеток и их пролиферативной активности. Традиционно выделяют три степени злокачественности (grade): G1, G2, G3. Для НЭО ЖКТ и поджелудочной железы введены понятия высокодифференцированных и низкодифференцированных новообразований (или нейроэндокринного рака (карциномы), НЭР). Высокодифференцированные НЭО объединяют G1 (менее 2 митозов на 10 репрезентативных полей зрения (РПЗ) при большом увеличении микроскопа (х400) и индекс Ki-67 ≤ 2%), G2 (2–20 митозов на 10 РПЗ и индекс Ki-67 3–20 %), G3 (> 20 митозов на 10 РПЗ и индекс Ki-67 > 20 %). Grade 3 опухоли разделяют на мелко- и крупноклеточный рак. Опухоли мелкоклеточного типа построены из однотипных клеток округлой, овальной или вытянутой формы, мелкого размера, со скудной цитоплазмой и нечеткими границами. Ядра имеют характерный вид за счет нежного хроматина и невизуализирующихся ядрышек. Определяются массивные некрозы. Крупноклеточные НЭР образованы, соответственно, клетками крупного или среднего размера, с низким ядерно-цитоплазматическим соотношением, выраженной атипией ядер, содержащих гранулярный хроматин и четкие ядрышки. В опухолевой ткани выявляются мультифокальные некрозы, значительное число митозов [8, 9].
Индекс Ki-67 определяют как средний процент окрашенных ядер при учете 500–2000 злокачественно трансформированных клеток (рис. 2) [9].
Рассмотрим различия понятий НЭО G3 и НЭР при локализации в поджелудочной железе. Несмотря на высокую степень злокачественности НЭО G3 гистологически имеют органоидную модель строения (рис. 3), отсутствие некрозов [10]. При иммуногистохимическом исследовании опухолевая ткань сохраняет экспрессию общих маркеров нейроэндокринной дифференцировки (диффузно и интенсивно определяется экспрессия синаптофизина, зачастую хромогранина А), а также панкреатические экзокринные или эктопические гормоны. Кроме того, в них отсутствует выраженная экспрессия p53 и утрата экспрессии RB (также определяются иммуногистохимически).
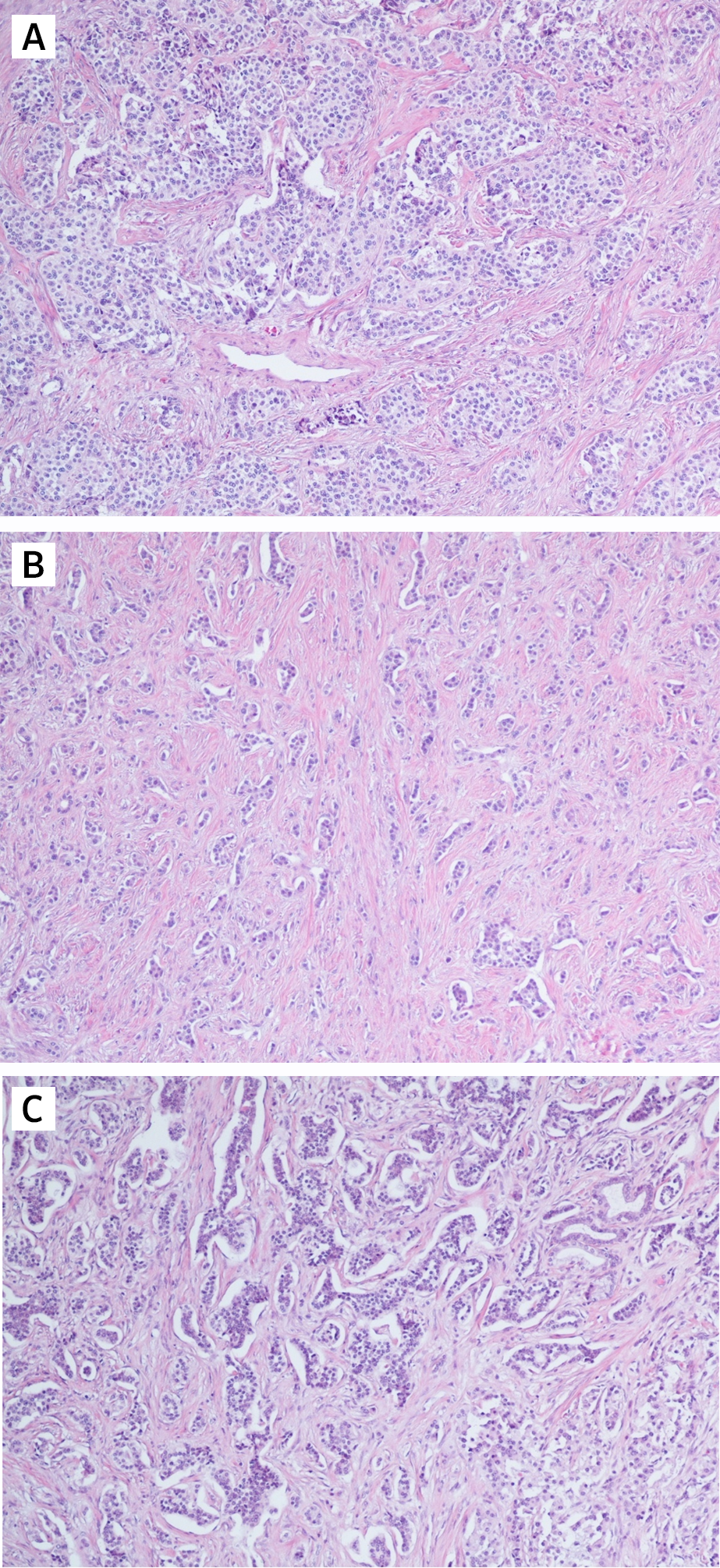
НЭР поджелудочной железы — это опухоли низкой степени дифференцировки и соответственно высокой степени злокачественности. Экспрессия общих маркеров нейроэндокринной дифференцировки атипичными клетками снижается: синаптофизин определяется слабо или диффузно, хромогранин А также слабо или фокально. Экзокринные гормоны отрицательны в таких опухолях [9]. Часто определяется экспрессия р53, белков ремоделирования хроматина DAXX (death-associated protein 6) и ATRX (АТФ-зависимая хеликаза), потеря экспрессии RB (белок ретинобластомы) и ISL1 (энхансер гена инсулина 1) [11].
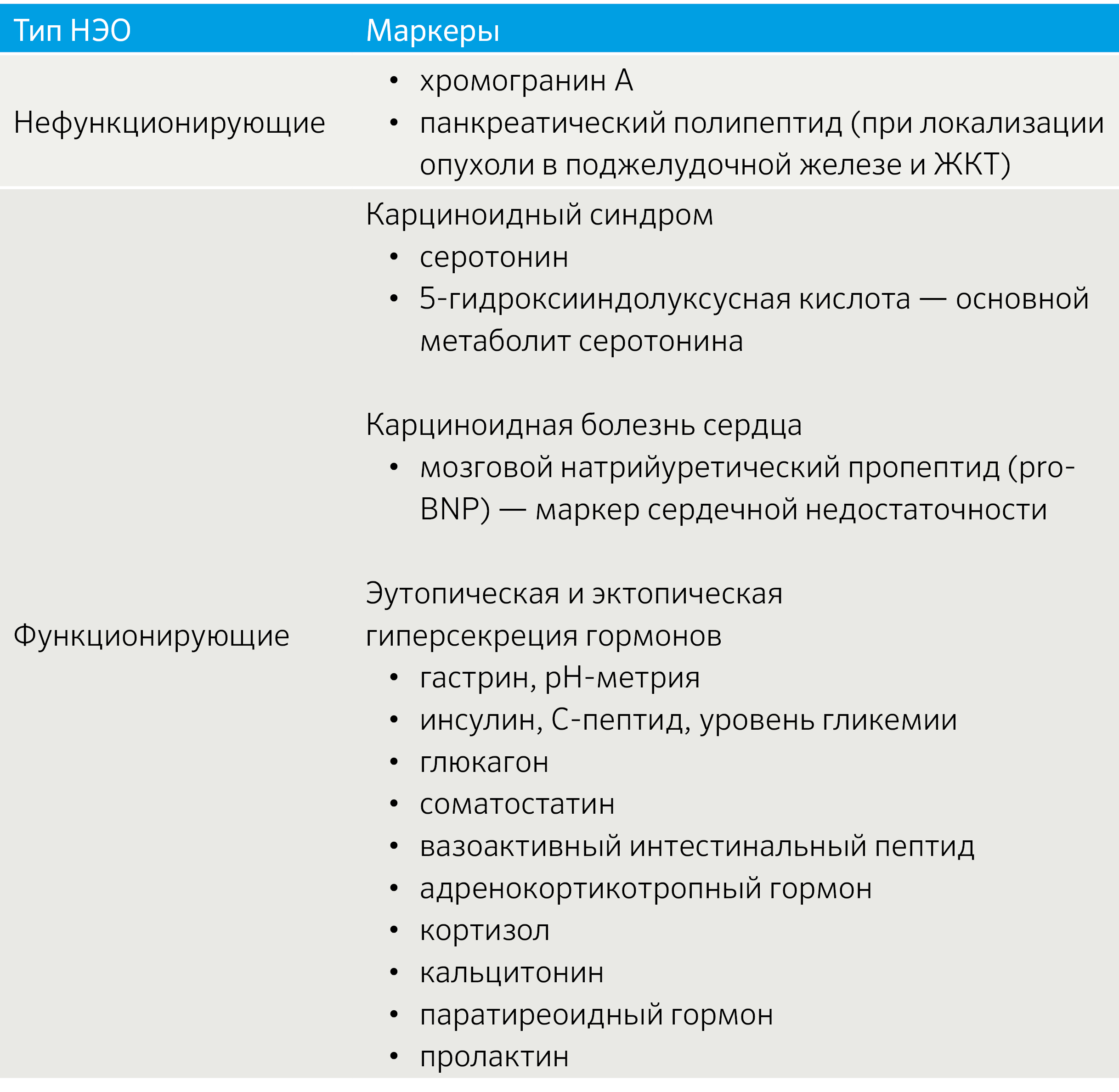
Ввиду многообразия секретирующего профиля НЭО биохимическая диагностика включает различные маркеры, комбинируемые с учетом клинической картины (табл. 4).
Табл. 4 | Спектр биохимических маркеров НЭО [2].
Радионуклидная диагностика играет важную роль в топической характеристике НЭО. Она включает методы специфической метаболической визуализации ( 123 I-MIBG), рецепторной визуализации ( 111 In-октреотид, 68 Ga-DOTA-TOС/DOTA-NOC/DOTA-TATE) и неспецифической метаболической визуализации ( 18 F-FDG, 18 F-DOPA).
123 I-метайодбензилгуанидин (MIBG) является аналогом норадреналина (норэпинефрина). Он накапливается в адренергических тканях и опухолях, происходящих из них. Сцинтиграфия с 123 I-MIBG используется для диагностики нейробластомы, феохромоцитомы, параганглиомы, карциноидов бронха и тонкой кишки [12].
Для рецепторной визуализации применяют 111 In (индий)-октеотид. Он выявляет высокодифференцированные нейроэндокринные опухоли, опухоли из клеток островкового аппарата поджелудочной железы (гастринома, глюкагонома, инсулинома). Также для верификации НЭО ЖКТ применяется соматостатин-рецепторная сцинтиграфия, так как большинство из них имеют рецепторы к соматостатину (SSTR) на поверхности опухолевых клеток (чаще 2 и 5 типа).
Выбор радионуклидного метода связан со степенью дифференцировки опухолевых клеток. Первичная диагностика НЭО Grade 1 и 2 проводится путем ПЭТ/КТ с радиофармпрепаратами (РФП), мечеными галлием 68 (является ПЭТ-радионуклидом). Сродство (аффинитет) РФП к конкретному подтипу трансмембранных рецепторов соматостатина определяет выбор диагностического индикатора (ПЭТ-лиганда, представленного различными модификациями DOTA). Например, для визуализации НЭО, экспрессирующих рецепторы подтипов SSTR2a и SSTR2b, применяют 68 Ga-DOTA-TATE (DOTA-Tyr3-октреотад). 68 Ga-DOTA-NOC (DOTA-1-Nal3-октреотид) выявляет подтипы SSTR3 и SSTR5, 68 Ga-DOTA-ТOC (DOTA-Tyr3-октреотид) — рецепторы SSTR5 [13].
При отсутствии возможности проведения данного исследования следует выполнить однофотонную эмиссионную компьютерную томографию (ОФЭКТ)/КТ (гибридный метод визуализации) с соматостатин-рецепторным радиофармпрепаратом.
Для недифференцированных НЭО Grade 3 и НЭР при отрицательных результатах соматостатин-рецепторной сцинтиграфии рекомендуется ПЭТ неспецифическая метаболическая визуализация с использованием других РФП. В частности, ПЭТ/КТ c 18F-фтордезоксиглюкозой (18F-ФДГ), которая неэффективна при высокодифференцированных НЭО [14]. Также рассматривают применение 18F-L–DOPA (дигидроксифенил-аланин) — меченого предшественника допамина, который эффективен для обнаружения медуллярного рака щитовидной железы, НЭО, параганглиомы и феохромоцитомы [15].
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Реферат. В статье представлен обзор литературных данных по проблеме нейроэндокринных опухолей (НЭО) в историческом аспекте, включая современное состояние. Рассматриваются вопросы классификации, эпидемиологии, местного и общего проявления НЭО, их биологические маркеры, а также характеристики некоторых органных локализаций и лечение.
Ключевые слова. Нейроэндокринная опухоль, карциноид, APUD–система, островково–клеточные опухоли, гастрин, вазоактивный пептид (VIP), серотонин, карциноидный синдром.
66%) – ЖКТ, преобладающее место расположения – слепая кишка (17,1%), прямая кишка (16,3%). Около 30% НЭО встречаются в бронхопульмональной системе (рис. 2).
Функционирующие НЭО
и другие синдромы
Специфическим клиническим проявлением НЭО является карциноидный синдром.
В разных пропорциях эти опухоли секретируют биоактивные амины и пептиды, включая серотонин, хромогранины А и С, нейронспецифическую енолазу, 5–гидрокситриптофан, синаптофизин, инсулин, панкреатический полипептид, гормон роста, нейротензин, АКТГ, меланоцитстимулирующий гормон, кальцитонин, различные тахикинины, рилизинг–гормон, фактор роста тромбоцитарного происхождения, гормон роста, бомбезин, трансформирующий фактор роста Р.
При ГЭП опухолях перечень таких маркеров достаточно широк и включает гастрин, глюкагон, инсулин, проинсулин, С–пептид, панкреатический полипептид (ПП), вазоактивный интестинальный пептид (ВИП), соматостатин, гистамин и некоторые другие гормоны. Спектр биохимических маркеров расширяется при НЭО легких и средостения определением кальцитонина, гистамина, НСЕ, паратиреоидного гормона (ПТГ) и АКТГ; при феохромоцитоме – основных катехоламинов (адреналина и норадреналина в крови или моче) и их метаболитов (экскреция с мочой нор– и метанефринов). Биохимические маркеры нашли применение при опухолях гипофиза – определение пролактина, ЛГ, ФСГ, тестостерона (у мужчин), эстрадиола (у женщин); при НЭО щитовидной железы – определение кальцитонина, ТТГ, Т3 и Т4; при АКТГ–эктопическом синдроме – определение АКТГ и кортизола. При некоторых локализациях НЭО требуется также определение других гормонов и нейропептидов.
Секреция того или иного гормона не является стабильным параметром опухоли: многие неоплазмы могут секретировать несколько биологически активных веществ, причем по мере прогрессирования опухоли спектр продуцируемых веществ зачастую подвергается изменениям.
У части больных имеется только повышение биохимических маркеров без каких–либо проявлений клинических симптомов болезни с последующим развитием осложнений.
Нефункционирующие неоплазмы могут обнаруживаться на более поздних стадиях, чем функционирующие, они характеризуются относительно агрессивным течением [7–9].
Наиболее тяжелым осложнением является карциноидный криз. Он может возникнуть спонтанно или провоцироваться такими факторами, как стресс, анестезия, биопсия опухоли. Все симптомы в этот период обостряются в связи с выбросом в кровь больших количеств биологически активных веществ. Карциноидный криз является неотложным жизнеугрожающим состоянием.
Биохимические маркеры НЭО
Предварительный диагноз НЭО может быть поставлен на основании клинической картины и обычного гистологического исследования, а окончательная верификация проводится с помощью ИГХ–исследования.
Необходимо отметить особое место хромогранина А в группе общих маркеров НЭО, который обладает, в отличие от других маркеров, наилучшим сочетанием диагностической чувствительности и специфичности. Хромогранин А относится к большому семейству растворимых высокомолекулярных белков, экспрессируемых нейроэндокринными клетками. В соответствии с рекомендациями Европейского общества по НЭО (ENETS), хромогранин А является обязательным маркером биохимического обследования в целях диагностики, мониторинга и прогноза НЭО. Хромогранин А характеризуется высокой диагностической чувствительностью при НЭО желудка (95%), подвздошной кишки (80%), синдроме МЭН (78%), бронхолегочной системы (70%), при этом в различных исследованиях была выявлена зависимость хромогранина А от распространенности процесса. По данным лаборатории клинической биохимии РОНЦ, при обследовании 55 больных ГЭП НЭО, получавших лечение в отделении химиотерапии РОНЦ с 2008 по 2010 г., было выявлено, что секреция хромогранина А коррелирует с биологической активностью и распространенностью этих опухолей [10].
Повышение эффективности биохимической диагностики НЭО может быть достигнуто при расширении спектра исследуемых маркеров, как общих, так и специфических, в соответствии с опухолевой локализацией и клинической картиной. Важными маркерами для оценки биологической активности НЭО и карциноидного синдрома остаются серотонин и его метаболит – 5–ОИУК. В клинической практике в качестве маркера карциноидных опухолей наиболее информативно исследование 5–ОИУК, суточная экскреция которой более стабильна и менее подвержена вариабельности, чем концентрация серотонина в периферической крови, поскольку на уровень 5–ОИУК в существенно меньшей степени влияют индивидуальные особенности больных, их суточные биоритмы и психологическое состояние при взятии крови [6].
По результатам лаборатории клинической биохимии РОНЦ, у 65% больных при повышенном уровне серотонина в сыворотке крови наблюдается координированное увеличение экскреции 5–ОИУК суточной мочи, хотя существуют и исключения из данного правила [10].
Лечение НЭО
Наиболее четкий алгоритм выбора метода лечения при НЭО ЖКТ и поджелудочной железы был представлен на ESMO (схема 1) [Oberg К., 2010].
На первом этапе предпочтение отдается оперативному лечению ± радиотермоаблация, эмболизация и химиоэмболизация. Далее, в зависимости от гистологической принадлежности, при опухолях с Ki–67 20% предлагается комбинированная химиотерапия темозоломидом, капецитабином и бевацизумабом либо цисплатином с этопозидом, аналоги соматостатина применяются при наличии клинического карциноидного синдрома.
Высокое содержание рецепторов соматостатина на клетках НЭО дало возможность разработать новый перспективный метод лечения – таргетную радионуклидную терапию, которая заключается в применении радионуклидов, связанных с молекулой аналога соматостатина, что позволяет прицельно доставлять энергию радиоактивного излучения (при распаде радионуклидов) к клеткам опухоли, содержащим рецепторы соматостатина.
В случае прогрессирования возможно использование (таргетной) радиотерапии: 177Lu–DOTA–октреотам либо 90Y–DOTA–октреотид в микросферах [11,12]. Также проводятся экспериментальные протоколы для второй линии лечения, включающие иматиниб, гефитиниб, цетуксимаб, бевацизумаб, темсиролимус.
Данные рекомендации являются условно универсальными, т.к. не охватывают все клинические ситуации, связанные с наличием НЭО и карциноидного синдрома. Сюда не вошли случаи множественного метастатического поражения из невыявленного первичного очага, первично–множественные опухоли, карциноидный синдром без наличия опухоли, МЭН–1, НЭО других локализаций (легкие, тимус и др.).
Таким образом, для больных высокодифференцированными НЭО актуальным является изучение новых препаратов и режимов, а также разработка последовательности лечения.
Читайте также:

