Какие признаки характеризуют опухоли системы крови
Диагностика раковых опухолей – комплексное обследование с использованием специфических инструментальных и лабораторных методов. Проводится она по показаниям, среди которых находятся и выявленные стандартным клиническим анализом крови нарушения.
Злокачественные новообразования растут очень интенсивно, потребляя при этом витамины и микроэлементы, а также выделяя в кровь продукты своей жизнедеятельности, приводят к значительной интоксикации организма. Питательные вещества берутся из крови, туда же попадают продукты их переработки, что и влияет на ее состав. Поэтому зачастую именно в ходе плановых осмотров и лабораторных исследований обнаруживаются признаки опасного заболевания.
- 1 Какие анализы крови показывают онкологию
- 1.1 Можно ли по общему анализу крови определить онкологию (рак)
- 1.2 Биохимическое исследование
- 1.3 Основной анализ
- 1.4 Может ли при раке быть хороший анализ крови
- 1.5 Какие показатели крови показывают онкологию у женщин
- 2 Когда необходим анализ на онкомаркеры?
- 3 Как подготовиться к сдаче анализа на онкомаркеры
Какие анализы крови показывают онкологию
Заподозрить рак можно по результатам стандартных и специальных исследований. При патологических процессах в организме изменения состава и свойств крови отражаются в:
- общем анализе крови;
- биохимическом исследовании;
- анализе на онкомаркеры.
Однако достоверно определить рак по анализу крови нельзя. Отклонения любых показателей могут вызываться заболеваниями, с онкологией никак не связанными. Даже специфический и наиболее информативный анализ на онкомаркеры не дает 100% гарантию наличия или отсутствия заболевания и нуждается в подтверждении.
Этот вид лабораторного исследования дает представление о количестве основных форменных элементов, которые отвечают за функции крови. Уменьшение или увеличение каких-либо показателей – сигнал о неблагополучии, в том числе и о наличии новообразований. Берется проба из пальца (иногда из вены) в первой половине дня, натощак. В таблице ниже представлены основные категории общего или клинического анализа крови и их нормальные значения.
При трактовке анализов необходимо учитывать, что в зависимости от пола и возраста показатели могут различаться, также существуют физиологические причины повышения или снижения значений.
Практически все эти показатели крови при онкологии изменяются в сторону уменьшения или увеличения. На что именно обращает внимание врач при изучении результатов анализа:
- СОЭ. Скорость оседания в плазме эритроцитов выше нормы. Физиологически это может объясняться менструацией у женщин, повышенной физической активностью, стрессами и т.д. Однако, если превышение значительное и сопровождается симптомами общей слабости и субфебрильной температурой, можно заподозрить рак.
- Нейтрофилы. Их количество увеличено. Особенно опасно появление новых, незрелых клеток (миелоцитов и метамиелоцитов) в периферической крови, характерное для нейробластом и других онкозаболеваний.
- Лимфоциты. Эти показатели ОАК при онкологии выше нормы, поскольку именно этот элемент крови отвечает за иммунитет и борется с раковыми клетками.
- Гемоглобин. Уменьшается, если имеются опухолевые процессы внутренних органов. Объясняется это тем, что продукты жизнедеятельности клеток опухоли повреждают эритроциты, снижая их количество.
- Лейкоциты. Численность белых кровяных телец, как показывают анализы при онкологии всегда снижается, если метастазами поражен костный мозг. Лейкоцитарная формула при этом сдвигается влево. Новообразования другой локализации приводят к повышению.
Следует учитывать, что снижение гемоглобина и количество эритроцитов характерно для обычной анемии, вызванной недостатком железа. Повышение СОЭ наблюдается при воспалительных процессах. Поэтому такие признаки онкологии по анализу крови считаются косвенными и нуждаются в подтверждении.
Назначение этого анализа, проводимого ежегодно – получение информации об обмене веществ, работе различных внутренних органов, балансе витаминов и микроэлементов. Биохимический анализ крови при онкологии тоже информативен, поскольку изменение определенных значений позволяет делать выводы о наличии раковых опухолей. Из таблицы можно узнать, какие показатели должны быть в норме.
Заподозрить рак биохимический анализ крови возможно в том случае, когда следующие значения не соответствуют норме:
- Альбумин и общий белок. Они характеризуют общее количество протеинов в сыворотке крови и содержание основного из них. Развивающееся новообразование активно потребляет белок, поэтому данный показатель существенно снижается. Если поражена печень, то даже при полноценном питании наблюдается дефицит.
- Глюкоза. Рак репродуктивной (особенно женской) системы, печени, легких влияет на синтез инсулина, тормозя его. В результате появляются симптомы сахарного диабета, что и отражает биохимический анализ крови при раке (уровень сахара растет).
- Щелочная фосфатаза. Повышается, прежде всего, при опухолях костей или метастазах в них. Может также свидетельствовать об онкологии желчного пузыря, печени.
- Мочевина. Этот критерий позволяет оценить работу почек, и если он повышен – имеется патология органа либо идет интенсивный распад белка в организме. Последнее явление характерно для опухолевой интоксикации.
- Билирубин и аланинаминотрансфераза (АлАТ). Повышение количества этих соединений информирует о поражении печени, в том числе раковой опухолью.
Если есть подозрение на рак, биохимический анализ крови не может использоваться как подтверждение диагноза. Даже если наблюдаются совпадения по всем пунктам, потребуется сделать дополнительные лабораторные исследования. Что касается непосредственно сдачи крови, то берется она из вены с утра, а есть и пить (разрешено употреблять кипяченую воду) нельзя уже с предыдущего вечера.
Если биохимический и общий анализ крови при онкологии дают только общее представление о наличии патологического процесса, то исследование на онкомаркеры позволяет даже определить местоположение злокачественного новообразования. Именно так называется анализ крови на рак, при котором выявляются специфические соединения, вырабатываемые самой опухолью или организмом в ответ на ее присутствие.
Всего известно около 200 онкомаркеров, но для диагностики используется чуть больше двадцати. Некоторые из них являются специфичными, то есть свидетельствуют о поражении конкретного органа, а другие могут выявляться при разных видах рака. Например, альфа-фетопротеин – это общий онкомаркер на онкологию, он обнаруживается почти у 70% больных. То же относится и к РЭА (раково-эмбриональному антигену). Поэтому для определения разновидности опухоли кровь исследуется на комбинации общих и специфичных онкомаркеров:
- Белок S-100, НСЕ – мозг;
- СА-15-3, СА-72-4, РЭА – поражена молочная железа;
- SCC, альфа-фетопротеин – шейка матки;
- АФП, СА-125, ХГЧ – яичники;
- CYFRA 21–1, РЭА, НСЕ, SCC – легкие;
- АФП, СА 19-9, СА-125 – печень;
- СА 19-9, РЭА, СА 242 – желудок и поджелудочная;
- СА-72-4, РЭА – кишечник;
- PSA – предстательная железа;
- ХГЧ, АФП – яички;
- Белок S-100 – кожа.
Но при всей точности и информативности, диагностика онкологии по анализу крови на онкомаркеры носит предварительный характер. Наличие антигенов может быть признаком воспалительных процессов и других заболеваний, а РЭА всегда повышен у курильщиков. Поэтому без подтверждения инструментальными исследованиями диагноз не ставится.
Этот вопрос закономерен. Если плохие результаты не являются подтверждением онкологии, то может ли быть наоборот? Да, это возможно. На результат анализа может повлиять малый размер опухоли или прием лекарственных средств (учитывая, что для каждого онкомаркера существует специфический перечень препаратов, прием которых может привести к получению ложноположительных или ложноотрицательных результатов, лечащий врач и сотрудники лаборатории должны быть уведомлены о препаратах, принимаемых пациентом).
Даже если анализы крови хорошие и инструментальная диагностика результата не дала, но есть субъективные жалобы на боли, речь может идти о внеорганной опухоли. Например, ее забрюшинная разновидность выявляется уже на 4 стадии, до этого практически никак не давая знать о себе. Возрастной фактор тоже имеет значение, поскольку метаболизм с годами замедляется, и в кровь антигены поступают тоже медленно.
Опасность заболеть раком приблизительно одинакова у обоих полов, но у прекрасной половины человечества есть дополнительное уязвимое место. Женская репродуктивная система подвергается высокому риску онкозаболеваний, особенно молочные железы, что выводит рак груди на 2 место по частоте встречаемости, среди всех злокачественных новообразований. Эпителий шейки матки тоже склонен к злокачественному перерождению, поэтому женщины должны ответственно относиться к обследованиям и обращать внимание на следующие результаты анализов:
- ОАК при онкологии показывает снижение уровня эритроцитов и гемоглобина, а также повышении СОЭ.
- Биохимический анализ – здесь поводом для беспокойства является увеличение количества глюкозы. Такие симптомы сахарного диабета особенно опасны для женщин, поскольку нередко становятся предвестниками рака молочных желез и матки.
- При исследовании на онкомаркеры одновременное присутствие антигенов SCC и альфа-фетопротеина свидетельствует о риске поражения шейки матки. Гликопротеин СА 125 – угроза рака эндометрия, АФП, СА-125, ХГЧ – яичников, а комбинация СА-15-3, СА-72-4, РЭА говорит о том, что опухоль может быть локализована в молочных железах.
Если что-то настораживает в анализах и имеются характерные признаки онкологии в начальной стадии, визит к врачу откладывать нельзя. Кроме того, гинеколога посещать надо не реже раза в год, а грудь регулярно обследовать самостоятельно. Эти простые меры профилактики часто помогают выявить рак на ранних стадиях.
Когда необходим анализ на онкомаркеры?
Пройти обследование следует при продолжительном ухудшении самочувствия в виде слабости, постоянной невысокой температуры, утомляемости, потере веса, анемии неясного генеза, увеличении лимфатических узлов, появлении уплотнений в молочных железах, изменении цвета и размера родинок , нарушениях работы ЖКТ, сопровождающихся отхождением крови после дефекации, навязчивом кашле без признаков инфекции и т.д.
Дополнительным причинами являются:
- возраст за 40;
- онкология в семейном анамнезе;
- выход за пределы нормы показателей биохимического анализа и ОАК;
- боли или продолжительное нарушение функций каких-либо органов или систем даже в незначительной степени.
Анализ не занимает много времени, помогая при этом вовремя выявить угрожающее жизни заболевание и вылечить его наименее травматичными способами. Кроме того, такие обследования должны стать регулярными (не реже раза в год) для тех, кто имеет родственников с онкологией или перешагнул сорокалетний возрастной рубеж.
Как подготовиться к сдаче анализа на онкомаркеры
Кровь для исследований на антигены сдается из вены, утром. Результаты выдаются в течение 1-3 дней, а чтобы они получились достоверными, необходимо выполнить определенные рекомендации:
- не завтракать;
- не принимать накануне какие-либо медикаменты и витамины;
- за трое суток до того, как делать диагностику рака по анализу крови, исключить алкоголь;
- не принимать накануне жирную и жареную пищу;
- за сутки до исследования исключить тяжелые физические нагрузки;
- в день сдачи не курить с утра (курение повышает РЭА);
- чтобы сторонние факторы не исказили показатели, сначала вылечить все инфекции.
После получения результатов на руки не следует делать какие-либо самостоятельные выводы и ставить диагнозы. Стопроцентной достоверностью этот анализ крови при раке не обладает и требует инструментального подтверждения.
Гемобластозы – опухолевые заболевания кроветворной и лимфатической ткани. Они подразделяются на системные заболевания – лейкозы, и регионарные – злокачественные лимфомы, или гематосаркомы.
Этиология гемобластом – это различные мутагенные факторы экзо- и эндогенного происхождения, действующие на стволовые и полустволовые клетки-предшественницы, огромную роль играет наследственный фактор.
Патогенез– факторы воздействуют на геном стволовых и полустволовых клеток, приводя к их злокачественной трансформации. Их развитие начинается с малигнизации одной стволовой или полустволовой клеток. Все последующие опухолевые клетки развиваются из первоначально мутировавшей клетки и относятся к одному клону. Кроме малигнизации развивается еще блок дифференцировки в форме опухолевых клеток, и они теряют способность к созреванию.
Лейкозы - злокачественное заболевание системы крови, при котором в костном мозге образуется патологический автономный клон с безудержной пролиферацией и нарушенной дифференцировкой. Лейкоз – это опухоль, происходящая из кроветворных клеток с первичным поражением костного мозга.
Мужчины болеют в 1,5 раза чаще женщин. Острыми лейкозами чаще страдают молодые люди в возрасте от 10 – 18 лет, но не редко и маленькие дети, а хроническими – люди старше 40 лет.
Патогенез :
1.Нарушение пролиферации и дифференцировки клеток
2.Нарушение нормального гемопоэза
3.Иммуносуппрессия
4.Нарушение биохимических показателей крови
5.Нарушения, связанные с гиперлейкоцитозом
6.Осложнения, связанные с метастазированием и инфильтрацией лейкозными клетками, включая увеличение лимфоузлов, поражение ЦНС.
Морфогенез – опухоль сначала растет на территории костного мозга, там она подавляет и вытесняет нормальные ростки кроветворения. Поэтому первоначально развиваются анемии, тромбоцитопения, лимфопения, гранулоцитопения, что приводит к снижению иммунитета, кровоточивости, к частым инфекционным заболеваниям. Метастазирование при лейкозах заключается в развитии лейкозных инфильтратов в различных органах – печени, селезенке, лимфатических узлах и т.д.
Классификация основана на пяти признаках этих заболеваний:
1. По степени дифференцировки опухолевых клеток:
Такие лейкозы протекают остро и очень злокачественно.
2. По цитогенетическому признаку:
- острые лейкозы подразделяются:
* миелоцитарный (хр. миелоцитарный, хр. нейтрофильный, хр. эозинофильный и т.д.)
* лимфоцитарный (хр. лимфолейкоз, парапротеинемические лейкозы – миеломная болезнь и т.д.)
* моноцитарный (хр. моноцитарный лейкоз, гистицитоз Х)
3. По иммунному фенотипу:
* на основании появления маркеров их антигенов
4. По общему количеству Le в периферической крови:
* лейкемические – в 1 мкл крови сотни тысяч Le, включая бласты.
* сублейкемические – Le 25 – 50*10 9 /л, включая бластные формы.
* лейкопенические – Le ниже нормы в периферической крови, но есть бласты.
* алейкемические – Le ниже нормы, нет бластов в периферической крови, но они определяются в костном мозге.
5. По характеру течения:
* острые лейкозы (они же недифференцированные и бластные)
* хронические лейкозы (цитарные)
(подробный разбор на практике)
Лимфомы (лимфогематосаркомы) - это регионарные злокачественные опухоли лимфоидной ткани, моноклонального происхождения. Они развиваются из незрелых форм лимфоцитов и поражают лимфатическую ткань, в терминальной стадии заболеваний метастазирование в костный мозг.
Этиология – все те же факторы, которые вызывают другие опухоли. Но нередко лимфомы бывают вирусного происхождения, не исключена и наследственная предрасположенность.
Классификация:
1. По клинико-морфологическим особенностям:
* лимфогрунулематоз, или болезнь Ходжкина
2. По источнику роста (цитогенезу)
3. По степени дифференцировки:
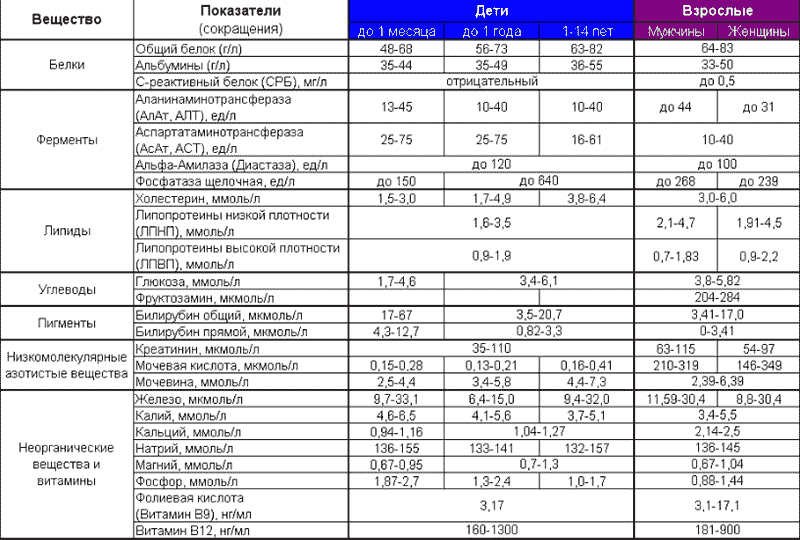
| пол | Лейкоциты | Эритроциты | Гемоглобин | Цветной показатель | Нейтрофилы | Эозинофилы | Базофилы | Лимфоциты | Моноциты | Тромбоциты | СОЭ | |||
| Миелоциты | Метамиелоциты | Палочкоядерные | Сегментоядерные | |||||||||||
| муж | 4,0 – 9,0 x 10 9 /л | 4,0 - 5,1x10 12 /л | 130-160г/л | 0,86-1,05 | нет | нет | 1 – 6% | 45 – 70% | 0 – 5% | 0 – 0,5% | 4,3 – 13,7 | 0,7 – 3,1 | 170 – 380*10 12 /л | 2 - 10 мм/ч |
| жен | 3,9- 4,7 x 10 12 /л | 120-140 г/л | 2 – 15 мм/ч |
Рис.4. Лейкоцитарная формула
Рис. 5. Сдвиги в крови.
| Сдвиг влево – в крови присутствуют метамиелоциты, миелоциты | Сдвиг влево с омоложением – в крови присутствуют метамиелоциты, миелоциты, промиелоциты, миелобласты, эритробласты. | Сдвиг вправо – уменьшение количества палочкоядерных нейтрофилов в сочетании с гиперсегментирорванных ядер нейтрофилов. |
| Острые воспалительные процессы, гнойные инфекции, интоксикации, острые кровотечении, ацидоз и коматозные состояния, физические перенапряжения. | Хронические лейкозы, эритролейкоз, миелофиброз, метастазы новообразований, острые лейкозы, коматозные состояния. | Мегалобластная анемия, болезни почек и печени, состояние после переливания крови |
| | | следующая лекция ==> | |
| Болезни системы крови | | | Предмет |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
ОПУХОЛИ СИСТЕМЫ КРОВИ
Составила доцент М.Е.Матвеенко.
Опухоли системы крови или гемобластозы делят на две группы: лейкозы – системные опухолевые заболевания кроветворной ткани и лимфомы – регионарные опухолевые заболевания кроветворной и (или) лимфатической ткани.
Первоначально, опухолевые клетки появляются в красном костном мозге и затем метастазируют в селезенку, лимфатические узлы, печень, брыжейку и другие органы и ткани. Так как метастазирование происходит гематогенно, первые метастазы располагаются по ходу сосудов, поэтому в периваскулярной соединительной ткани образуются скопления опухолевых клеток (инфильтраты). Инфильтраты нарушают кровоснабжение паренхимы органов таких, как печень, почки, легкие, они сдавливают паренхиматозные клетки, усиливая гипоксию, которая характерна для лейкозов из-за подавления эритропоэза. В свою очередь, гипоксия ведет к дистрофии функциональных клеток.
Инфильтрация может быть диффузной и очаговой. Диффузная инфильтрация многочисленными лейкозными клетками приводит к значительному увеличению объѐма органа, но это процесс длительный, так как накопление клеток связано с их делением. В связи с этим при острых лейкозах, где продолжительность жизни с момента развития заболевания небольшая (до 1 года) гепатолиенальный синдром выражен менее значительно, чем при хронических лейкозах, при которых больные живут гораздо дольше. Очаговая инфильтрация меньше влияет на функцию органа, но может привести к прорастанию капсулы и распространению опухолевого роста на соседние ткани. Для лейкозов характерно присутствие лейкозных клеток в крови. Это было замечено известным ученым Вирховым и послужило причиной для того, чтобы назвать эти заболевания лейкемиями.
Увеличение количества опухолевых клеток в красном костном мозге приводит к тому, что они вытесняют нормальные ростки кроветворения, включая популяции клеток эритроцитарного, гранулоцитарного, тромбоцитарного и лимфоидного рядов (Рис.1). Недостаток эритроцитов приводит к анемии (анемический синдром), уменьшение количества тромбоцитов (тромбоцитопения) вызывает геморрагический синдром, при уменьшении численности лимфоцитов возникает вторичный иммунодефицитный синдром, для которого характерны некротические процессы в слизистых оболочках, инфекционные заболевания с последующей генерализацией и сепсисом.

Рис.1 . На препарате с обеих сторон от костной трабекулы, окрашенной в розовый цвет, видны опухолевые клетки. В отличие от апластической анемии лейкоз характеризуется высокой клеточностью.
Роль вирусов в этиопатогенезе лейкозов доказана для: а) острого эндемического Т-лимфоцитарного лейкоза; б) волосато-клеточного лейкоза; в) для лимфомы Беркитта. Ионизирующее излучение является признанным фактором, влияющим на заболеваемость лейкозами. Причем частота мутаций зависит от дозы облучения. После ядерных взрывов в Хиросиме и Нагасаки заболеваемость острым и хроническим лейкозами среди облученных людей возросла в 7,5 раз. Химические вещества, такие как дибензатрацен, бензпирен, метилхолантрен и другие, могут инициировать злокачественный процесс в кроветворных клетках. Наследственные факторы проявляются в семейном характере болезни.
При лейкозах, как и при других опухолях в лейкозных клетках обнаруживаются изменения в хромосомах – хромосомные аберрации. Например: при хроническом миелоидном лейкозе повреждена 22-я пара хромосом (ее называют Рh1хромосома или филадельфийская). У детей с болезнью Дауна, у которых также обнаруживается Ph1хромосома, лейкоз бывает в 10-15 раз чаще.
Патогенез лейкоза связан с активацией клеточных протоонкогенов и подавлением активности опухолевых суппрессорных генов под воздействием вышеперечисленных факторов. У человека зарегистрировано усиление активности протоонкогенов при лейкозах: rаs (1-ая хромосома – при различных лейкозах), sis (22-я хромосома – при хроническом лейкозе), myc (8-ая хромосома – при лимфоме Беркитта)
Развитие лейкозов подчинено правилам опухолевой прогрессии, т.е. вначале заболевание протекает с моноклональными лейкозными клетками, эта стадия протекает относительно доброкачественно, именно в это время хорошо действуют цитостатики и возможна пересадка клеток красного костного мозга. Затем в результате дополнительных мутаций в опухолевых клетках появляются поликлональные лейкозные клетки, отличающиеся большей агрессивностью и устойчивостью к химиотерапии.
По количеству лейкоцитов в крови различают лейкозы:
4) алейкемические (мало лейкозных клеток в крови).
В зависимости от степени зрелости клеток, составляющих опухоль лейкозы делят на острые и хронические. Современная классификация кроветворных клеток содержит следующие классы:
1-й класс – полипотентная стволовая клетка-предшественница.
2-й класс – частично детерминированная полипотентная клеткапредшественница .
3-й класс – унипотентные клетки предшественники В-лимфоцитов, Т- лимфоцитов, лейкопоэза, эритропоэза, тромбоцитопоэза.
4-й класс – бласты (миелобласт, лимфобласт, монобласт, эритробласт, мегакариобласт), морфологически дифференцируются, имеют определенную гистохимическую характеристику: содержание определенных ферментов, липидов, гликогена и т.д.
5-й класс – созревающие клетки.
6-й класс – зрелые клетки.
Клетки первых 3-х классов не имеют характерных морфологических различий и не могут быть отнесены к какому-либо ростку.
На основании гистоцитогенеза лейкозных клеток среди острых лейкозов выделяют недифференцированный, который развивается из клеток первых 3-х классов. Остальные формы развиваются из клеток 4-го класса, т.е. бластов (миелобластный, лимфобластный, эритромиелобластный (Ди Гульемо), мегакариобластный).
Хронические лейкозы , в зависимости от происхождения опухолевых клеток, делятся на: хронические лейкозы миелоидного происхождения; хронические лейкозы лимфоидного происхождения.
1). Хронические лейкозы миелоцитарного ряда делятся на: а) хронический миелоидный лейкоз, б) хронический миелоз, в) истинную полицетемию (эритремия), г) эссенциальная тромбоцитемия.
2) Хронические лейкозы лимфоцитного ряда включают:а) хроничический. лимфолейкоз б) лимфоматоз кожи (болезнь Сезари) в) парапротеинемические лейкозы: (миеломная болезнь, первичная макроглобулинемия Вальдерстрема, болезнь тяжелых цепей Франклина).
Диагноз острого лейкоза ставят при обнаружении в костном мозге (пунктате из грудины) бластных клеток более 30% (в нормальной миелограмме их до 5%). Однако, при содержании от 5% до 20% бластов в красном костном мозге ставится диагноз миелодиспластического синдрома (МДС) в форме рефрактерной анемии с избытком бластов (РАИБ). Если при трепанобиопсии из подвздошной кости находят 20-30% бластов, это значит, что имеет место миелодиспластический синдром в форме рефрактерной анемии с избытком бластов в стадии трансформации в острый лейкоз, при этом в трепанобиоптате видны скопления бластов. Острые лейкозы чаще встречаются у лиц молодого возраста. Основные синдромы острого лейкоза связаны с замещением костного мозга опухолевыми клетками и инфильтрацией селезенки, печени, лимфоузлов, почек, головного мозга, его оболочек и других органов.
Наиболее частые клинические синдромы: анемия, геморрагический синдром, иммунодефицитный синром с язвенно-некротическими и септическими осложнениями, спленомегалия, но чаще, невыраженная, так как острый лейкоз быстро приводит к смерти. Особенность острых лейкозов - hiatus leucemicus - лейкемический провал (наличие зрелых форм клеток и бластов), в то время, как в норме и при лейкемоидных реакциях в крови наблюдаются промежуточные формы клеток (промиелоциты, миелоциты, метамиелоциты, палочкоядерные лейкоциты).
Форма или вид острого лейкоза устанавливают гистохимически и (или) при помощи моноклональных антител. Гистохимически определяют профиль данной популяции клеток, например, для миелобластного лейкоза характерно наличие в цитоплазме диффузного гликогена, липидов, пероксидазы, кислой фосфатазы и отсутствие гликозаминогликанов.
Острые лейкозы у детей имеют некоторые особенности: они встречаются чаще; для них характерно широкое распространение инфильтрации (во всех органах, за исключением половых органов); узловатые инфильтраты, особенно в тимусе; чаще встречается Т- клеточный лимфобластный лейкоз.
Острый недифференцированный лейкоз протекает быстро,
злокачественно, так как недифференцированные, молодые опухолевые клетки резистентны к химиотерапии. Клиническая картина характеризуется инфильтрацией костного мозга, селезенки, лимфоузлов, миндалины, лимфатических фолликулов, стенок сосудов, миокарда, почек, головного мозга недифференцированными опухолевыми клетками. Селезенка и печень увеличены (сплено- и гепатомегалия). Часто встречаются гингивит, тонзиллит (некротическая ангина), которые приводят к сепсису и связаны с нарастающим иммунодефицитом. Геморрагический синдром приводит к кровотечениям и кровоизлиянию в мозг, геморрагической сыпи. Анемия, которая связана с замещением костного мозга лейкозными клетками, приводит к дистрофии

паренхиматозных органов. Смерть наступает от сепсиса, язвеннонекротических осложнений, кровотечений (желудок, кишечник и т.д.), кровоизлияний в мозг.
Острый миелобластный лейкоз имеет свой гистохимический профиль. Костный мозг становится сероватым, иногда пиогенным (зеленоватым). Гепатолиенальный синдром выражен умеренно (печень небольших размеров, тогда как селезенка увеличивается более быстро), но этот лейкоз также быстро приводит к смерти. Отмечается инфильтрация лейкозными клетками слизистой оболочки желудочно-кишечного тракта: некрозы в зеве, миндалинах, желудке, а также в почках. В трети случаев
выявляется инфекция легких – лейкозный пневмонит, в трети случаев наблюдается инфекция в оболочках мозга – лейкозный менингит. (Рис.2, 3).
Рис.3. Острый миелобластный лейкоз. На препарате видно замещение нормальных клеток опухолевыми, справа виден единственный мегакариоцит.
Острый монобластный лейкоз мало отличается от острого миелобластного.
Острый эритромиелобластный лейкоз (острый эритромиелоз ди Гульемо) – редкая форма (1-3% всех лейкозов). При нем происходит разрастание как малодифференцированных ядерных клеток эритропоэза, так и миелобластов, монобластов и недифференцированных бластов. В результате замещения миелоидной ткани опухолевыми клетками возникают: анемия, лейкопения, тромбоцитопения. Инфильтрация опухолевыми клетками печени и селезенки приводит к их увеличению.
Острый мегакариобластный лейкоз – редкий лейкоз. В крови и красном костном мозге наряду с недифференцированными бластами присутствуют мегакариобласты, уродливые мегакариоциты и скопления

тромбоцитов. Число тромбоцитов в крови увеличивается до 1000-1500 в 1 мкл.
Острый плазмобластный лейкоз возникает из клеток – предшественников В-лимфоцитов, способных к продукции иммуноглобулинов, которые превращаются в опухолевые плазмобласты. Они секретируют патологические иммуноглобулины (парапротеины). Этот лейкоз относят к группе парапротеинемических гемобластозов.
Протекают более доброкачественно, чем острые. В периферической крови нет лейкемического провала.
Хронический миелолейкоз – первый лейкоз, при котором выявлена специфическая генетическая аномалия. По месту своего открытия она получила название Филадельфийская (Ph1)-хромосома. Основным событием, происходящим при образовании Ph1-хромосомы, является обмен генетическим материалом между хромосомами 9 и 22 (Рис.4). В результате этой реципрокной транслокации рядом оказываются расположенными 2 гена: ген bcr с 22 хромосомы и ген abl, производный от хромосомы 9. В настоящее время установлено, что основная роль в развитии патологических проявлений хронического миелолейкоза связана с геном bcr-abl. В итоге этой генной перестройки образуется химерический цитоплазматический белок р210, который является
ответственным за большинство, если не за все фенотипические аномалии.
Рис.4 . Хронический миелоз. Миелоидные клетки содержат Филадельфийскую хромосому (Ph1), которая появляется в результате обмена генетическим материалом между 9 и 22 хромосомами.
Гибридный белок р210 обладает повышенной тирозинкиназной активностью. Белок р210 локализован в цитоплазме, в то время как нормальный белок р145 расположен в ядре. За счет своего аномального положения и повышенной тирозинкиназной активности он трансформирует стволовые клетки в клетки хронического миелолейкоза. В норме созревание и пролиферация кроветворных клеток находятся под контролем костномозгового стромального микроокружения, которое регулирует их взаимодействие с помощью ростовых факторов. С наличием белка р210 в лейкемических предшественниках связывают нарушение проведения сигналов, обеспечивающих нормальное функционирование клетки. Вмешательство в основные клеточные процессы приводит к злокачественной трансформации клеток и нарушению таких процессов, как контроль над

пролиферацией, адгезией и апотозом. Ph1-хромосома обнаруживается у 95% больных с типичной клинической картиной хронического миелолейкоза.
В течение лейкоза чѐтко различаю 2 стадии: моноклоновую – доброкачественную, поликлоновую – злокачественную. Первая протекает с нарастающим нейтрофильным сдвигом до промиелоцитов.
Читайте также:

