Какая степень окисления у магния с хлором
§3.7 Окислительно-восстановительные свойства элементов. Степень окисления.
Передача электронов от атома к атому называется окислением-восстановлением. Окисляется тот атом, который отдает свои электроны, а принимающий электроны – восстанавливается.
Если в результате реакции получается ионное соединение, то положительно заряженный ион образовался из того элемента, который отдал свои электроны, а отрицательный ион – из элемента, который электроны принял .
Например, натрий активно взаимодействует с хлором (внешне это напоминает горение с выделением белого дыма – очень мелких кристаллов NaCl). В образовавшейся соли Na + Cl – натрий заряжен положительно, а хлор отрицательно. Следовательно, натрий окислился, а хлор - восстановился. Чуть позже мы объясним, как легче запомнить новые термины.
Благодаря передаче электронов от атома к атому многие ионы, образующиеся в таких реакциях, имеют электронную конфигурацию инертных газов. Приобретение устойчивых “завершенных” оболочек дает большой выигрыш в энергии. Такие одинаковые электронные оболочки ионов называются изоэлектронными . В первой части таблицы 3-4 собраны ионы, изоэлектронные атому неона (он поставлен первым), в другой части таблицы – ионы, изоэлектронные атому аргона.
Таблица 3-4. Ионы, находящиеся в каждой вертикальной колонке, имеют одинаковое электронное строение, совпадающее с электронной оболочкой одного из инертных газов.
1s 2 2s 2 2p 6
Степень окисления
1s 2 2s 2 2p 6 3s 2 3p 6
Степень окисления
В таблице рядом с каждой частицей указана ее степень окисления . Что это такое? Дело в том, что при образовании химических связей во многих случаях электроны могут частично передаваться от менее электроноакцепторных атомов к более электроноакцепторным атомам. Число переданных (или принятых) электронов и называется степенью окисления атома.
Количество отданных или принятых атомом электронов называется степенью окисления атома в молекуле.
Можно продолжить это определение:
При связывании разных атомов степень окисления равна заряду, который приобрел бы атом в этом соединении, если бы оно могло состоять из ионов.
Довольно просто определять степень окисления в ионных соединениях, где сразу видно, откуда и куда перешли электроны. Из табл. 3-4 видно, что знак и величина степени окисления всегда совпадают со знаком и зарядом одноатомных ионов.
Например, при взаимодействии магния с кислородом образуется ионное соединение Mg 2+ O 2– (где 2+ и 2– заряды ионов магния и кислорода, табл. 3-4). Посмотрите видеоопыт из "Единой коллекции цифровых образовательных ресурсов" – горение магния в кислороде.
Степень окисления магния составляет +2, а степень окисления кислорода составляет –2. Точно так же в соединении CaCl 2 степень окисления кальция +2, а степень окисления хлора –1.
Сложнее обстоит дело с полярными ковалентными соединениями. Здесь на помощь приходит знание относительной электроотрицательности элементов. Например, в молекуле воды Н 2 О кислород более электроотрицателен, чем водород, поэтому электроны связей смещены в сторону кислорода. Если бы вода была ионным соединением, то ее формулу можно было бы записать так:
Здесь степени окисления - это условные заряды атомов в молекуле, если считать, будто бы это ионная, а не полярная ковалентная молекула. Тогда степень окисления кислорода в воде составляет -2, а степень окисления водорода +1.
Можно дать еще одно определение степени окисления:
Степень окисления – это условный заряд атома в молекуле или кристалле. Его определяют, условно считая все полярные связи полностью ионнымии.
Кому-то из вас может показаться, что степень окисления – это та же валентность, но только со знаком "+" или "–". На самом деле это не всегда верно. Давайте посчитаем степень окисления в другом соединении водорода и кислорода – перекиси водорода Н 2 О 2 . Структурная и гипотетическая “ионная” формулы этого вещества выглядят так:
Второй заряд "–" не может появиться на атоме кислорода потому, что кислород не в состоянии оттянуть электроны от своего соседа – точно такого же атома кислорода. Вывод: степень окисления кислорода в этом соединении составляет –1 (хотя его валентность по-прежнему II). Степень окисления водорода составляет +1.
Степень окисления и валентность несут разную информацию об атоме в его соединениях. Валентность просто характеризует способность атома образовывать некоторое количество химических связей, а степень окисления описывает смещения электронов при образовании химических связей.
Итак, уточним определение степени окисления с учетом всего того, что было сказано о ковалентных соединениях:
СТЕПЕНЬ ОКИСЛЕНИЯ выражают числом частично или полностью смещенных электронов от одного атома к другому в их соединении.
Если атом отдал электроны, его степени окисления приписывается знак “+”, а если атом принял электроны, то знак “–”. Возможна и нулевая степень окисления атома в молекуле, если электроны никуда не смещались или число отданных и принятых электронов одинаково.
Степень окисления – очень важная величина, относящаяся к основным понятиям химии. Фактически, степень окисления описывает состояние атома в соединении.
Есть несколько полезных правил, которые касаются степеней окисления:
1) Степень окисления атома любого элемента в свободном состоянии равна нулю.
Это связано с тем, что в чисто ковалентных двухатомных молекулах электроны не смещены ни к одному из атомов. Если вещество находится в атомном состоянии, то степень окисления его атомов также равна нулю. Примеры молекул, где степени окисления атомов равны нулю: H 2 , Fe, F 2 , Na, O 2 , N 2 , Ar.
2) Степень окисления любого простого одноатомного иона равна его заряду. Примеры:
3) Степень окисления водорода в его соединениях с другими элементами равна +1.
Примеры молекул, где водород имеет степень окисления +1: H 2 O, NH 3 , CH 4 , HF, HCl. Исключение составляют довольно редкие соединения - гидриды металлов (например, LiH), в которых степень окисления водорода равна –1, потому что электроотрицательность металлов меньше, чем у водорода.
4) Степень окисления кислорода равна -2 во всех соединениях, где кислород не образует простой ковалентной связи О—О.
Примеры молекул, где кислород имеет степень окисления –2 (таких соединений кислорода – подавляющее большинство): H 2 O, SO 2 , SO 3 , NO 2 . Положительную степень окисления кислород проявляет только в соединениях с фтором (например, в соединении OF 2 , где степень окисления кислорода равна +2).
5) Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю.
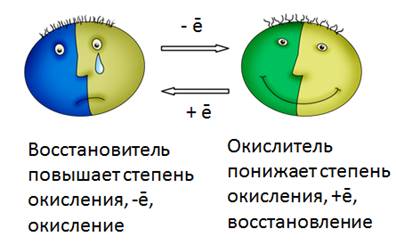
6) Если в ходе химической реакции степень окисления атома повышается, то говорят, что он ОКИСЛЯЕТСЯ. Если же степень окисления понижается, то говорят, что он ВОССТАНАВЛИВАЕТСЯ.
Эти правила полезны во многих случаях. Посмотрите, например, как c их помощью легко определяется степень окисления элемента с переменной (или неизвестной) валентностью по молекулярной формуле. Допустим, имеется соединение H 2 SO 3 . Спрашивается, какова степень окисления серы? Поскольку степень окисления водорода всегда (+1), а степень окисления кислорода (–2), то нетрудно подсчитать, что положительные и отрицательные степени окисления "уравновесят" друг друга в молекуле H 2 SO 3 тогда, когда степень окисления серы составит (+4). В этом случае алгебраическая сумма всех степеней окисления в молекуле равна нулю:
Действие этого правила можно показать и на примере реакции серы с кислородом, в которой электроны формально переходят от одного атома к другому:
До реакции сера и кислород имели одинаковую – нулевую степень окисления. В результате реакции степень окисления серы повысилась (+4). Значит, сера окислилась .
Степень окисления кислорода понизилась (-2), то есть кислород восстановился . Алгебраическая сумма всех степеней окисления в SO 2 осталась равной нулю.
Подобных реакций с изменением степеней окисления реагирующих атомов – огромное множество. Все вместе они называются окислительно-восстановительными реакциями.
В последующих главах мы рассмотрим эти реакции подробнее, а пока еще раз разберемся в новых терминах.
Просто так трудно запомнить, какой процесс – отдачи или захвата электронов – называется окислением, а какой – восстановлением. Какой атом приобретает отрицательную, а какой – положительную степень окисления.
Рис. 3-11. Не совсем обычная запись уравнения химической реакции: Na + Cl = NaCl (см. текст). Хлор – "отрицательный", он отбирает чужие электроны. Натрий "окислился" – это заметно по его кислой физиономии.
Кому-то из вас поможет рис. 3-11, который рассказывает о реакции между натрием и хлором так, как будто это случилось в "химическом детском саду". В этом “детском саду” порядки такие же, как и в обычном. У Хлора целых 7 игрушек (электронов). Натрию же достался только грузовичок (1 электрон). Тут Хлор увидел у Натрия грузовичок и решил, что именно этой игрушки ему и не хватает! Хлор посильнее, поэтому грузовичок мгновенно оказался у него. А чтобы Натрий не ябедничал (у него такой окислившийся вид!), Хлор предложил поиграть вместе. Какое там! Конечно же, все 8 игрушек Хлор подтащил поближе к себе, а Натрию только и остается, что стоять рядом с “окисленным” видом.
Итак, какова мораль? Хлор, конечно, отрицательный . Он отобрал чужую игрушку-электрон. Теперь у него отрицательная степень окисления. Натрий, безусловно, окислился - вон какой у него “кислый” вид. Но и от Хлора не отходит - игрушек-то больше нет! Чем не картина образования химической связи в типичной окислительно-восстановительной реакции?
Остается только добавить, что восстанавливается в таких реакциях окислитель , а окисляется – восстановитель . В нашей истории хлор – окислитель, а натрий – восстановитель.
Точно так же реагирует с хлором-окислителем металлический калий (востановитель). У калия еще легче "отобрать" электрон, чем у натрия, поскольку его внешняя электронная оболочка находится дальше от ядра. Реакция протекает с выделением белого "дыма" - кристаллов соли KCl (посмотрите видеоопыт из "Единой коллекции цифровых образовательных ресурсов").
3.25. Пользуясь таблицей электроотрицательностей элементов и правилами для определения степеней окисления, определите степени окисления всех атомов в следующих молекулах: HClO 4 , HClO 3 , HClO 2 , HClO, HCl, Cl 2 , NH 3 , PH 3 , H 3 PO 4 , O 2 , O 3 .
** 3.26. Численное значение степени окисления, как вы знаете, может не совпадать с валентностью элемента. Ниже приведены структурные формулы нескольких соединений углерода. Напишите их молекулярные формулы и, пользуясь правилами для определения степеней окисления, определите степени окисления атомов углерода в каждой молекуле:
3.27. Определите степени окисления всех атомов в следующих молекулах: H 2 S, SeO 2 , SO 3 , F 2 O 2 .
Магний в таблице менделеева занимает 12 место, в 3 периоде.
| Символ | Mg |
| Номер | 12 |
| Атомный вес | 24.3040000 |
| Латинское название | Magnesium |
| Русское название | Магний |
Электронная схема магния
Mg: 1s 2 2s 2 2p 6 3s 2
Короткая запись:
Mg: [Ne]3s 2
Одинаковую электронную конфигурацию имеют атом магния и Na -1 , Al +1 , Si +2 , P +3 , S +4 , Cl +5
Порядок заполнения оболочек атома магния (Mg) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ - до 6, на ‘d’ - до 10 и на ‘f’ до 14
Магний имеет 12 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
Степень окисления магния
Атомы магния в соединениях имеют степени окисления 2.
Степень окисления - это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы магния
Валентность Mg
Атомы магния в соединениях проявляют валентность II.
Валентность магния характеризует способность атома Mg к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Mg
Квантовые числа определяются последним электроном в конфигурации, для атома Mg эти числа имеют значение N = 3, L = 0, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат: 
Энергия ионизации
Чем ближе электрон к центру атома - тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации - это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева

Сравним две реакции: первая реакция – взаимодействие гидроксида натрия с соляной кислотой.
NaOH + HCl = NaCl + H2O.
Расставим степени окисления у всех атомов. У натрия степень окисления +1, у кислорода -2, у водорода +1, в соляной кислоте у водорода степень окисления +1, а у хлора -1. В хлориде натрия у натрия степень окисления +1, у хлора -1, в воде у водорода степень окисления +1, у кислорода -2. Как видно, атомы химических элементов не изменили свои степени окисления.
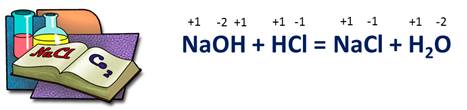
Сравним вторую реакцию – взаимодействие магния с соляной кислотой.
Mg + 2HCl = MgCl2 + H2↑.
У магния степень окисления нуль, т.к. это простое вещество, у водорода в соляной кислоте +1, у хлора -1, в хлориде магния у магния степень окисления +2, у хлора -1, у водорода, как простого вещества степень окисления равна нулю. Следовательно, в данной реакции магний и водород изменили свои степени окисления: магний с нуля до +2, а водород с +1 до нуля. Т.е. каждый атом магния отдал два электрона, а каждый атом водорода принял по одному электрону.
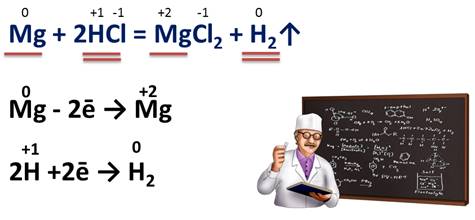
Эти химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, называют окислительно-восстановительными реакциями.
Процесс присоединения электронов атомами, ионами или молекулами называется восстановлением. Степень окисления при этом понижается. В нашем случае атомы водорода присоединяют электроны и понижают свою степень окисления, т.е. этот процесс является восстановлением. Например, атомы неметаллов могут присоединять электроны и превращаться при этом в отрицательные ионы, т.е. они восстанавливаются. Так атом серы может присоединить два электрона и превратиться в сульфид-ион, где степень окисления серы -2.
Электроны могут присоединяться и к положительным ионам, которые при этом превращаются в нейтральные атомы или положительные ионы, у которых степень окисления понижается.
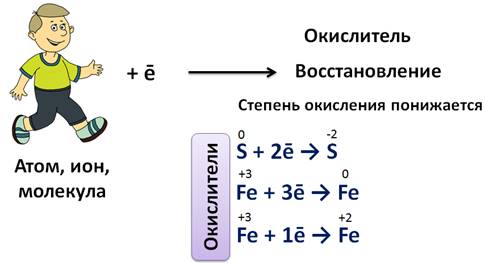
Т.е. ион железа (III) и атом серы являются окислителями. Т.о., атомы, ионы или молекулы, принимающие электроны, называют окислителями.
Процесс отдачи электронов атомами, ионами или молекулами называется окислением. При этом степень окисления повышается. Атомы металлов отдают электроны, превращаются при этом в положительные ионы, т.е. они окисляются. Например, атом кальция отдает два электрона и превращается в ион кальция, со степенью окисления +2.
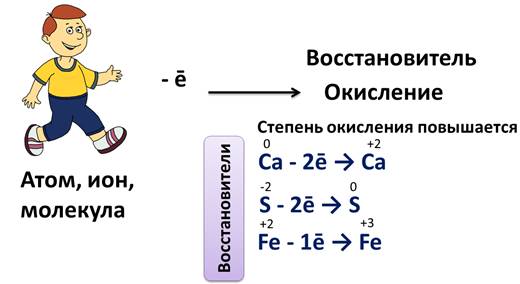
Отдавать электроны могут также и отрицательные, и положительные ионы. Например, сульфид ион отдает два электрона и превращается в атом серы, или ион железа (II) отдает один электрон и превращается в ион железа (III).
Атомы, ионы или молекулы, которые отдают электроны, называют восстановителями. В нашем случае, это сульфид-ион и ион железа (II).
Все окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления.
Рассмотрим реакцию взаимодействия алюминия с серой. В нашем случае атом алюминий отдает три электрона и становится ионом алюминия со степенью окисления +3. Т.е. он является восстановителем, при этом он повышает свою степень окисления, а сам он окисляется. Атом серы, напротив, принимает два электрона, понижает свою степень окисления и превращается в сульфид-ион, где степень окисления серы -2. Атом серы является окислителем, т.е. он восстанавливается.
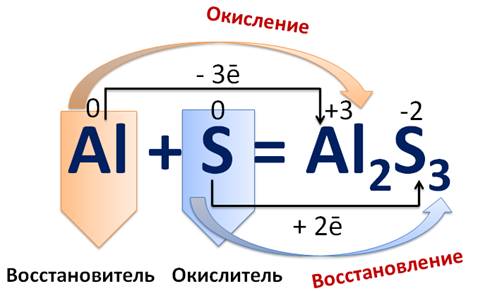
В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, т.е. соблюдается электронный баланс. Метод электронного баланса применяют для записей электронных уравнений процессов окисления и восстановления. Например, при записи уравнения реакции алюминия и серы над каждым атомом и ионом ставят степени окисления.
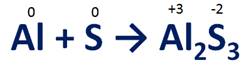
А в электронных уравнениях указывают число отдаваемых и принимаемых электронов, указывают восстановитель и окислитель, процессы окисления и восстановления.

Молекулярное уравнение этой реакции записать несложно, т.к. коэффициенты для него будут взяты из электронных уравнений.
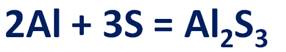
Так, перед алюминием будет стоять коэффициент 2, а перед серой – 3.
Попробуем расставить коэффициенты методом электронного баланса в более сложной реакции. Как вы помните, азотная кислота любой концентрации и концентрированная серная кислота реагирует с металлами иначе, чем другие кислоты. Запишем реакцию взаимодействия серебра с разбавленной азотной кислотой. В результате реакции образуется соль – нитрат серебра (I), оксид азота (II) и вода. Укажем степени окисления у атомов и ионов.
Подчеркнем знаки химических элементов, изменивших свои степени окисления. В нашем случае – это серебро и азот. Составим электронные уравнения, отразив процессы восстановления и окисления.

В реакциях между металлом и кислотой, коэффициенты ставят, как правило, сначала перед продуктами реакции, а затем перед исходными веществами. Значит, перед формулой нитрата серебра (I) ставим коэффициент 3, а перед оксидом азота (II) коэффициент 1.

Следовательно, и перед формулой серебра в левой части уравнения нужно поставить коэффициент 3. Считаем число атомов азота после реакции, 4 атома, до реакции один атом, значит, перед формулой азотной кислоты нужно поставить коэффициент 4. Считаем число атомов водорода в левой части уравнения, их – 4, в правой – 2, значит, перед формулой воды нужно поставить коэффициент 2. Считаем число атомов кислорода: в левой части 12, в правой тоже, теперь мы можем поставить знак равенства вместо стрелки.

Наиболее важными восстановителями являются активные металлы, водород (H2), уголь, оксид углерода (II) – CO, сероводород – H2S, аммиак (NH3) и др. Наиболее важными окислителями являются: кислород (O2), галогены, азотная кислота (HNO3), серная кислота (H2SO4), перманганат калия (KMnO4) и др.
Свойства простых веществ:
Свойства сложных веществ:
Особенности протекания реакций:
Возможные степени окисления элементов
Перед тем как начать писать окислительно-восстановительные реакции, необходимо знать какие степени окисления может проявлять тот или иной химический элемент. Рассмотрим степени окисления, знание которых необходимо для успешной сдачи ЕГЭ.
| Степень окисления | Элементы | Примеры соединений | Названия соединений |
|---|---|---|---|
| -1 | F | NaF OF2 | Фторид натрия Фторид кислорода |
| +1 | Все металлы 1-ой группы главной подгруппы (Li-Fr) | Na2O KH | Оксид натрия Гирид калия |
| +2 | Все металлы 2-ой группы главной подгруппы (Be-Ra), а также Zn и Cd | BeO CaH2 | Оксид бериллия Гидрид кальция |
| +3 | Al | Al2O3 Al(OH)3 Al2(SO4)3 | Оксид алюминия Гидроксид алюминия Сульфат алюминия |
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | H2 | Водород (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| +1 | H2O H2O2 H2SO4 KOH NaHSO3 | Вода Пероксид водорода Серная кислота Гидроксид калия Гидросульфит натрия | В таких соединениях, как вода, пероксид водорода, все кислоты, основания, кислые соли, все органические соединения |
| -1 | NaH CaH2 | Гидрид натрия Гидрид кальция | Только с металлами водород может проявлять степень окисления -1 |
Положительные степени окисления кислород проявляет только в соединениях с фтором
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | S8 | Сера | Светло-желтый порошок; нерастворим в воде, тяжелее её, но в воде не тонет, плавает на её поверхности, так как ею не смачивается. Молекулы S8 образуют молекулярную кристаллическую решетку. Сера существует в виде нескольких аллотропных модификаций: ромбическая, моноклинная, пластическая. |
| -2 | H2S CaS | Сероводородная кислота Сульфид кальция | Все сульфиды |
| -1 | FeS2 | Персульфид железа (II) (пирит, серный колчедан, железный колчедан) | Единственное соединение со ст. ок. -1 |
| +4 | SO2 H2SO3 CaSO3 | Оксид серы (IV) Сернистая кислота Сульфит кальция | В таких соединениях как оксид серы (IV), сернистой кислоте и всех её солях |
| +6 | SO3 H2SO4 CaSO4 | Оксид серы (VI) Серная кислота Сульфат кальция | В таких соединениях как оксид серы (VI), серной кислоте и всех её солях |
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | N2 | Азот (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| -3 | NH3 Na3N Ca3N2 | Аммиак Нитрид натрия Нитрид кальция | В таких соединениях, как аммиак и все нитриды |
| -2 | N2H4 | Гидразин | Степени окисления -2 и -1 встречаются только в органических соединениях |
| -1 | NH2OH | Гидроксиламин | |
| +1 | N2O | Оксид азота (I) | Азот проявляет положительные степени окисления только в соединениях с кислородом и фтором |
| +2 | NO | Оксид азота (II) | |
| +3 | N2O3 HNO2 NF3 | Оксид азота (III) Азотистая кислота Фторид азота (III) | В таких соединениях, как оксид азота (III), азотистой кислоте и всех её солях, фториде азота (III) |
| +4 | NO2 | Оксид азота (IV) | Смешанный оксид азота (IV) |
| +5 | N2O5 HNO3 | Оксид азота (V) Азотная кислота | В таких соединениях, как оксид азота (V), азотной кислоте и всех её солях |
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | F2 Cl2 Br2 I2 | Фтор Хлор Бром Йод | Светло-зеленый газ Желто-зеленый газ Темно-красная жидкость Серо-черные кристаллы |
| -1 | HF HCl HBr HI | Фтороводород (соли кислоты: фториды) Хлороводород (соли кислоты: хлориды) Бромоводород (соли кислоты: бромиды) Йодоводород (соли кислоты: йодиды) | Бесцветные ядовитые газы. При растворении в воде образуют соответствующие кислоты. |
| +1 | HClO HBrO HIO | Хлорноватистая кислота (соли: гипохлориты) Бромноватистая кислота (соли: гипобромиты) Йодноватистая кислота (соли: гипоиодиты) | В приведенных кислотах, а также всех их солях |
| +3 | HClO2 HBrO2 HIO2 | Хлористая кислота (соли: хлориты) Бромистая кислота (соли: бромиты) Йодистая кислота (соли: иодиты) | В приведенных кислотах, а также всех их солях |
| +5 | HClO3 HBrO3 HIO3 | Хлорноватая кислота (соли: хлораты) Бромноватая кислота (соли: броматы) Йодноватая кислота (соли: иодаты) | В приведенных кислотах, а также всех их солях |
| +7 | HClO4 HBrO4 HIO4 | Хлорная кислота (соли: перхлораты) Бромная кислота (соли: перброматы) Йодная кислота (соли: периодаты) | В приведенных кислотах, а также всех их солях |
* Для фтора только 0 и -1; At также является галогеном, но его не рассматриваем, так как в природе его практически нет.
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | C | Углерод | Аллотропные модификации: алмаз, графит, карбин (черный порошок, полимерные цепи -CC-, =С=С=), фуллерены (темные, похожие на сажу, C60-C200) |
| +2 | CO | Оксид углерода (II) (угарный газ) | В таких соединениях как CO, а также в некоторых органических соединениях |
| +4 | CO2 |
** В органических соединениях углерод проявляет все степени окисления от -4 (например, CH4) до +3 (например, CH3COOH).
Читайте также:
- Если при раке легких опухоль уже в голове
- Какие онкомаркеры сдавать при возможном раке поджелудочной
- Что за ругательство рак
- Почему раковые больные умирают от пневмонии
- Плохая гистология после выскабливания это рак

