Как ухаживать за больными раком поджелудочной железы

- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
В последние десятилетия отмечается рост пациентов со злокачественными опухолями органов гепатопанкреатодуоденальной зоны. При этом частота диагностики рака этих органов на ранних стадиях практически не повысилась. В основном пациенты продолжают поступать в стационары только при развитии осложнений, наиболее частым из которых является механическая желтуха. Рак головки поджелудочной железы находится на втором месте среди причин подпеченочной желтухи (30–35%), уступая лишь холедохолитиазу (35–40%), третье место занимает рак внепеченочных желчных протоков (10–12%), затем — рак большого сосочка двенадцатиперстной кишки (1–2%).

При этом, по данным литературы, только в 10–20% случаев при выявлении рака поджелудочной железы пациентам выполняется радикальная операция, несмотря на которую большинство умирает в первый год после вмешательства. К сожалению, большая часть больных по разным причинам не может рассчитывать на радикальное лечение. Лечение больных этой категории осложняется наличием обтурации желчных путей, холангита, а в большинстве случаев и печеночной недостаточности. Общепризнано, что оперативное вмешательство, выполненное при нарастающей механической желтухе, является чрезвычайно рискованным и сопровождается высокой летальностью, достигающей 20-60%, что наряду с возрастающей частотой опухолевого поражения поджелудочной железы, несомненно, обусловливает актуальность данной проблемы.
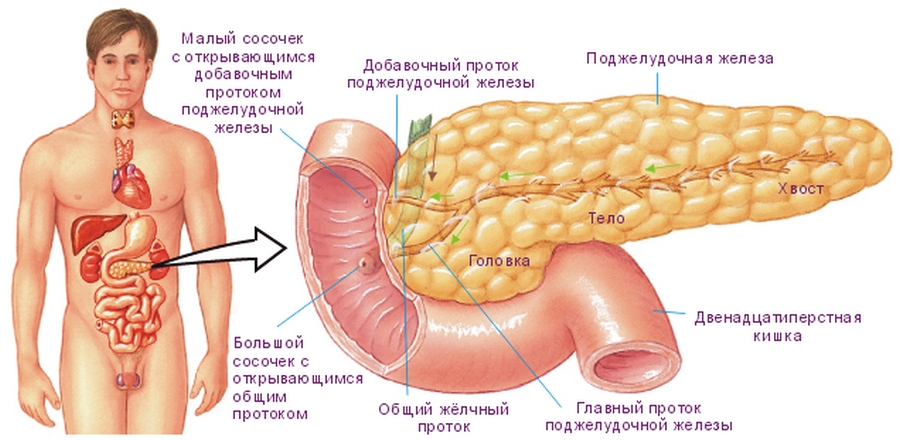
Антеградные методы декомпрессии желчевыводящей системы, реализуемые в виде чрескожно-чреспеченочной холангиостомии, продленного наружно-внутреннего дренирования, антеградного эндобилиарного стентирования, могут служить альтернативой эндоскопическим методам при их неэффективности или невозможности выполнения. При этом чрескожные миниинвазивные вмешательства позволяют либо успешно подготовить пациентов к основному этапу операции, в случае возможного выполнения радикального хирургического лечения, либо могут стать окончательным вмешательством, являясь примером паллиативного лечения. Целью нашего исследования явилась оценка эффективности паллиативного лечения с применением антеградных миниинвазивных технологий при раке поджелудочной железы.
Материалы и методы
За период с января 2010 по декабрь 2016 года в хирургическом отделении Орловской областной клинической больницы под наблюдением находилось 160 больных со злокачественным поражением поджелудочной железы, осложненным синдромом механической желтухи. В связи с чем все пациенты были госпитализированы в экстренном порядке. Больные доставлялись в стационар скорой медицинской помощью, направлялись другими лечебно-профилактическими учреждениями города и области, а также обращались самостоятельно. Женщин в исследуемой группе было 76 (47,5%), мужчин — 84 (52,5%). Возраст больных колебался от 48 до 76 лет. Проводилось комплексное обследование больных, включающее исследование клинико-лабораторных данных (общий и биохимический анализ крови, общий анализ мочи, коагулограмма и др.), выполнялось ультразвуковое исследование брюшной полости, гастродуоденоскопия, по показаниям эндоскопическая ретроградная холангиопанкреатография и мультиспиральная компьютерная томография, а также ряд других инструментальных исследований в зависимости от сопутствующей патологии.
У всех пациентов, находящихся под нашим наблюдением, при ультразвуковом исследовании были выявлены признаки актуальной желчной гипертензии, что наряду с невозможностью выполнения по различным причинам ретроградного эндоскопического дренирования явилось основанием для антеградного дренирования желчных путей под сонофлюороскопическим контролем по срочным показаниям (1-2 сутки от момента поступления в стационар). При этом во всех случаях антеградные миниинвазивные вмешательства несли не только лечебную, но и диагностическую нагрузку. Так как выполняемая интраоперационная антеградная холангиография позволяла уточнить уровень и степень блока. Адекватность выполненного чрескожного чреспеченочного дренирования оценивалась по изменению интенсивности желтухи, по суточному дебиту желчи, степени снижения гипербилирубинемии в биохимическом анализе крови, а также по устранению признаков билиарной гипертензии при динамическом ультразвуковом исследовании. После снижения уровня билирубина крови, дообследования и стабилизации состояния пациентов решался вопрос о переводе наружной холангиостомы в наружно-внутреннюю или об антеградном эндобилиарном стентировании.
Результаты исследования
Чувствительность, специфичность и диагностическая точность холангиографии во время постановки холангиостомы при раке поджелудочной железы составила соответственно 91,2%, 80,1% и 85,3%. Всего в группе пациентов со злокачественным поражением поджелудочной железы выполнено 204 минимально инвазивных вмешательств. Распределение характера вмешательств было следующим: наружная холангиостомия — 62,7% (128); антеградное эндобилиарное стентирование — 25% (51); наружно-внутреннее дренирование протоков — 10,3% (21); чрескожно-чреспеченочная микрохолецистостомия — 2% (4).
Учитывая, что у 51 пациента (32%) в исследуемой группе при проведении клинико-инструментальных и морфологических исследований был подтвержден неоперабельный характер поражения поджелудочной железы, выполнение радикального оперативного лечения не представлялось возможным. В связи с этим окончательным видом хирургического лечения, направленным на улучшение качества жизни, у данных больных, явилось антеградное стентирование внепеченочных желчных протоков.
В каждом исследуемом случае стентирование выполнялось вторым этапом после предварительной чрескожно-чреспеченочной холангиостомии или наружно-внутреннего дренирования. Техника стентирования заключалась в проведении металлического проводника через опухолевую структуру за зону большого сосочка двенадцатиперстной кишки под сонофлюороскопическим контролем, по которому в последующем производилась транспапиллярная установка стента. После выполненного стентирования в обязательном порядке производили постановку страховочной наружной холангиостомы, которая позволяла выполнять динамическую антеградную холангиографию для контроля процесса раскрытия стента и адекватности его функционирования в раннем послеоперационном периоде.
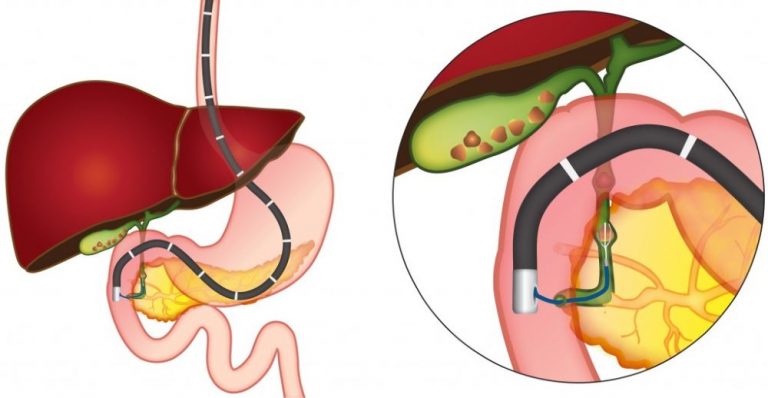
Выбор стента по диаметру раскрытия, длине и типу покрытия осуществлялся индивидуально в каждом конкретном случае в зависимости от протяженности зоны поражения. Использование покрытого стента при неоперабельном раке поджелудочной железы имеет ряд преимуществ, так как позволяет предотвратить возможное прорастание опухолевой или грануляционной тканью ячеистой стенки стента, тем самым вызывая обтурацию его просвета. Однако учитывая транспапиллярное положение устанавливаемого стента, применение покрытых форм было ограничено у пациентов с сохраненной проходимостью и функцией панкреатического протока.
Использование в подобных случаях покрытых форм стента значительно повышало риск перекрытия устья панкреатического протока. Как правило, в большинстве случаев сразу же после установки нитинолового саморасправляющегося стента под рентгенологическим контролем отмечали поступление контрастного препарата в просвет двенадцатиперстной кишки. Однако при этом рентгенологически сохранялась зона сужения в пораженном участке билиарного тракта. Полное раскрытие стента, сопровождавшееся свободным поступлением контрастного вещества в просвет двенадцатиперстной кишки, определялось в течение 24-48 часов с момента его установки. Восстановление пассажа подтверждалось контрольной антеградной холангиографией.
Обсуждение результатов
Осложнения после проведенных миниинвазивных вмешательств возникли в 26 случаях, и были связаны у 12 пациентов (7,5%) с дислокацией холангиостомического дренажа; в 4 случаях (2,5%) с развившимся острым холециститом; в 2 случаях (1,2%)с развившимся острым панкреатитом; у 5 пациентов с гидротораксом (3,1%). В отдаленные сроки после стентирования у 3 (1,9%) больных развился рецидив механической желтухи, обусловленный нарушением функции эндобилиарного стента.
В 2 наблюдениях через 4-5 мес. с момента постановки непокрытого стента произошла обтурация его внутреннего просвета за счет прорастания опухолевыми тканями ячеистой стенки.
Среди осложнений, развившихся после проведения антеградного эндобилиарного стентирования в ранний послеоперационный период, были зафиксированы острый холецистит (4 пациента) и острый панкреатит (2 пациента). В 3 случаях после установки непокрытого стента и в 1 после установки покрытого у пациентов отмечены клинико-эхографические признаки острого холецистита. У одного больного выполнена лапароскопическая холецистэктомия, у трех других произведена постановка чрескожно-чреспеченочной микрохолецистостомии под контролем УЗИ, на фоне которой клинические проявления острого холецистита удалось полностью купировать. Клиническая картина острого панкреатита, развившаяся в течение 24-48 часов после выполненного стентирования у двух пациентов, полностью купировалась на фоне проведенной консервативной терапии.
Выводы
У пациентов с неоперабельным раком поджелудочной железы выполнение антеградного эндобилиарного стентирования представляет собой окончательный вариант хирургического лечения, позволяющий при минимальном объеме вмешательства обеспечить адекватный дренирующий эффект желчевыводящих путей. Кроме того, отсутствие наружных дренажей улучшает качество жизни пациента, его психологическое состояние, позволяет активизировать его в более ранние сроки, избавляет от необходимости приема желчи внутрь.
Литература:
- Альянов А.Л., Мамошин А.В., Борсуков А.В., Мурадян В.Ф. Эффективность применения минимально инвазивных технологий в лечении больных с синдромом механической желтухи // Ученые записки Орловского государственного университета. Серия: Естественные, технические и медицинские науки. 2015. № 4. С. 280-284.
- Гальперин Э.И., Ветшев П.С. Руководство по хирургии желчных путей. М.: Издательский дом Видар-М, 2006.
- Данилов М.В., Фёдоров В.Д. Повторные и реконструктивные операции при заболеваниях поджелудочной железы.М.: Медицина, 2003.
- Долгушин Б.И., Авалиани М.В., Буйденок Ю.В. и др.Эндобилиарная интервенционная онкорадиология.М.: ООО "Медицинское информационное агентство«.2004. — 224 с.
- Затевахин И.И., Цициашвили М.Ш., Дзарасова Г.Ж. и др.Возможности доплеровской сонографии в оценке функционального состояния печени при механической желтухе // Анн. хирург. гепатолог. 2001. Т. № 1. С. 113-124.
- Ившин В.Г., Якунин А.Ю., Лукичев О.Д. Чрескожные диагностические и желчеотводящие вмешательства у больных механической желтухой. Тула, 2000. — 312 с.
- Израилов Р.Е. Миниинвазивные технологии в лечении больных с опухолями органов билиопанкреатодуоденальной зоны: автореф. дис. докт. мед. наук / Р.Е. Израилов.Москва, 2011. — 47 с.
- Кубышкин В.А., Вишневский В.А. Рак поджелудочной железы. М., 2003.
- Охотников О.И., Яковлева М.В., Григорьев С.Н., Пахомов В.И. Антеградные эндобилиарные вмешательства в лечении осложненной желчнокаменной болезни // Анн.хирург. гепатолог. 2013. Т. 18. № 1. С. 29-37.
- Патютко Ю.И., Котельников А.Г. Хирургия рака органов билиопанкреатодуоденальной зоны. М.: Медицина, 2007.
- Costamagna G., Pandolfi M. Endoscopic stenting for biliary and Pancreatic malignancies. J ClinGastroenterol 2004; 38: 59–67.
- Hans-Joachim Wagner. With or Against the Bile Flow?Radiology. 2002; 225: 7-9.
- Katsinelos P., Paikos D., Kountouras J. et al. Tannenbaum and metal stents in the palliative treatment of malignant distal bileduct obstruction: a comparative study of patency and cost effectiveness. SurgEndosc 2006; 20: 1587–1593.
- May A., Ell C. A New Self-Expanding Nitinol Stent for Palliation of Malignant Biliary obstruction. Endoscopy 2004; 36: 329–333.
- Mehmet M.D., Aksungur E., Seydaolu G. Percutaneousplacement of biliary metallic stents in patients with malignanthilar obstruction, unilobar versus bilobar drainage. Journal ofVascular and Interventional Radiology. 2003; 14: 1409-1416.
- Yushidome H., Miyazaki M., Shimizu H. et al. Obstructivejaundice impairs hepatic sinusoidal endothelial cell functionand renders liver susceptible to hepatic ischemia/ reperfusion //J. Hepatology. 2000. V.33 (1). P.59-67.
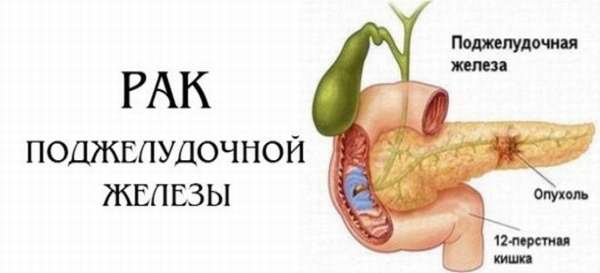
Рак поджелудочной железы – злокачественное новообразование в результате бесконтрольного деления мутированных клеток. По статистике, мужчины болеют чаще женщин на 13%. Данный вид рака занимает 9 место в мире по распространенности среди всех онкобольных и 5 место по смертности.
Причины возникновения опухоли в поджелудочной железе
Болезни, которые являются предраковыми, в любой момент могут перерасти в рак. Они требуют своевременного лечения и постоянного наблюдения:
- хронический панкреатит,
- аденома,
- киста.
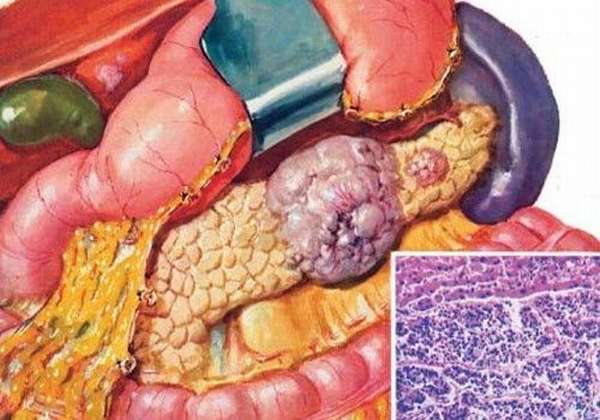
Основные факторы развития, которые могут вызывать начальную стадию мутации клеток:
- сахарный диабет 2 типа (появляется из-за нарушения секреции гормонов),
- желчнокаменная болезнь (камни в желчном пузыре или протоке),
- опухоли других органов (особенно рак кожи),
- цирроз печени (низкая секреция желчи),
- рацион питания (острая, жирная пища, красное и проработанное мясо в виде колбас и сосисок),
- курение (30% онкобольных имеют эту пагубную привычку),
- алкоголь,
- низкая физическая активность,
- работа на промышленном производстве (асбест, бензидин),
- возраст больше 60 лет,
- избыточная масса тела,
- заболевания или перенесённые операции на ЖКТ,
- болезни эндокринной системы,
- наследственность.
Рекомендация! Исключите из рациона тяжелую пищу, откажитесь от вредных привычек, займитесь спортом. Люди старше 30 лет должны регулярно проходить консультацию у гастроэнтеролога.
Особенности классификации рака ПЖ
Код по Международной Классификации Болезней (МКБ 10) – С25.
После проведения тщательной диагностики врач ставит полный диагноз заболевания. Он включает в себя расположение, размер, строение и возможные метастазы.
По расположению выделяют:
- рак головки,
- рак тела и хвоста.
Существует международная классификация раковых болезней − ТНМ. Подробная расшифровка:
- Т – размер опухоли,
- Н − поражение лимфоузлов,
- М – наличие метастазов.
Т4Н2М1 − самая тяжелая стадия развития с прободение соседних органов, поражением более 4 лимфоузлов и метастазами. Т1Н0М0 – легкая степень рака.
Определяет, из каких типов клеток состоит опухоль, какие из них явились первичным очагом мутации и деления. Распознать это можно после взятия биопсии, изучения клеток под микроскопом. Различают следующие формы:
- аденосквамозный,
- плоскоклеточный,
- перстневидно-клеточный,
- протоковая аденокарцинома (встречается в 95% случаев),
- муциозная цистоаденокарцинома (рак из кисты),
- ацинарно-клеточный (из железистых клеток, вырабатывающие ферменты),
- внутрипротоковая папиллярномузиозная опухоль (ipmn поджелудочной железы),
- недиффиренцированный (анапластический, клетки невыясненной этиологии),
- эндокринная опухоль (образуется из клеток, вырабатывающих гормоны. Чаще наблюдается доброкачественное течение, но с высоким риском малигнизации).
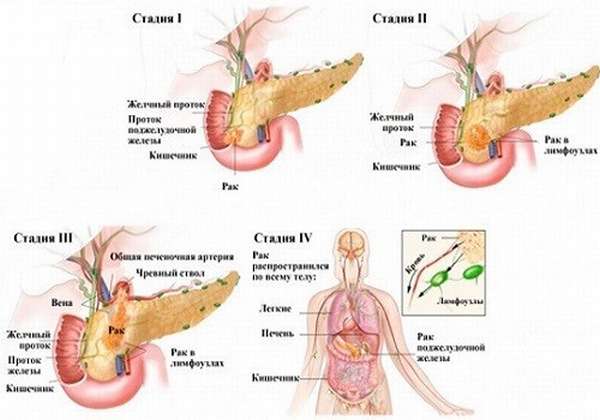
Онкология поджелудочной железы – агрессивная болезнь, которая очень быстро прогрессирует. В зависимости от размера опухоли различают 4 стадии:
- Первая− опухоль в пределах железы, капсула не повреждена.
- Вторая − распространение к железистому протоку и близлежащим лимфа узлам.
- Третья − инфильтрация в соседние ткани и органы.
- Четвертая − прободение соседних органов, распад опухоли за пределами поджелудочной железы, терминальная стадия.
Возможность определить операбельность появится только после УЗИ диагностики.
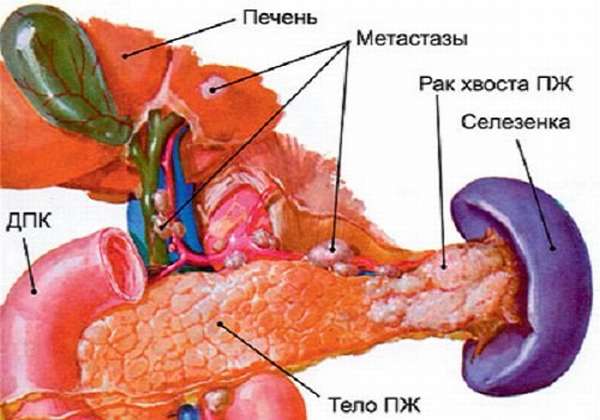
Формирование вторичных очагов рака, вследствие распространения клеток в другие части и органы тела. Происходит это тремя путями:
- через кровь по сосудам и венам,
- по лимфатической системе,
- через брюшину контактным способом вдоль нервных стволов.
Метастазирование может никак не проявляться, но первым признаком начала процесса является ухудшение общего состояния. Выделяют три степени распространения раковых клеток в виде метастазов:
- в ближайших лимфа узлах (не более 4-х),
- во всех близлежащих лимфоузлах,
- в удаленных органах (печень, легкие, сердце, желудок, почки).
Рак головки поджелудочной железы
Самый распространенный вид рака, встречается в 75% всех случаев. Характерно быстрое попадание в соседние органы за счет их близкого расположения.
- механическая желтуха,
- болеть будет под правым ребром,
- тромбоз глубоких вен ног,
- тяжесть в животе после приема пищи.
Рак тела или хвоста поджелудочной железы
Развивается в 25% случаях. Так как здесь находятся клетки, вырабатывающие гормоны и ферменты, из-за этого в первую очередь страдает функция поддержания нормального уровня глюкозы в крови и переваривания пищи. В том числе анатомическая близость хвоста к селезёнке приводит к симптоматическим особенностям заболевания:
- боль в эпигастрии и левом подреберье,
- сахарный диабет 2 типа,
- жажда, сухость в полости рта,
- потеря веса, жидкий стул,
- увеличение количества мочи,
- зуд кожных покровов,
- спленомегалия.

Клиническая картина онкозаболевания ПЖ
В большинстве случаев начальная стадия рака проходит бессимптомно. Опухоль может расти и не вызывать беспокойства. Даже на поздних стадиях можно спутать жалобы с заболеваниями желудочно-кишечного тракта. В основе этиопатогенеза клинических симптомов лежат 3 процесса:
- сдавливание опухолью сосудов, нервов и ближайших органов,
- закупорка протоков,
- интоксикация организма.
Системы и органы нашего тела тесно связаны между собой. Если болит один, то страдает весь организм. Признаки, характерные для рака:
- Сахарный диабет. Появляется в результате нарушения секреции гормонов.
- Общая интоксикация. Некротизированные клетки опухоли подавляют иммунную реакцию, провоцируя поднятие температуры, апатию, слабость и снижение аппетита.
- Тромбоз глубоких вен ног. Появляется вследствие нарушения системы свертывания крови.
- Тошнота, рвота. Из-за сдавливания верхней части 12-перстной кишки и давления на желудок.
- Анорексия. Изменение внешнего вида за счет резкой потери массы тела.
- Асцит/водянка. Набор веса в области живота на фоне общего похудания.
- Механическая желтуха. Патогенез связан со сдавливанием желчного протока. Характерно появления желтизны кожи, склер и слизистых. Моча темно-коричневая, кал бесцветный. Пальпаторно диагностируется увеличение желчного пузыря. Температура − в пределах нормы.
- Кишечная непроходимость. Сдавление 12-перстной кишки или толстого кишечника опухолью.
- Кровотечение внутренних органов. Появляется в результате их прободения и повреждения сосудов. Если поврежден кишечник или желудок, наблюдается черный стул и рвота со сгустками крови, селезёнка – анемия, лейкопения.
- Спленомегалия. Увеличение размера селезёнки в результате сдавления вен.
В области живота могут появиться боли без видимых причин, иррадиирущие в поясницу. Они усиливаются после приёма пищи и при горизонтальном положении туловища. Боль может быть от чувства дискомфорта до острых приступов. Всё зависит от стадии и расположения опухоли.

Справка! Очень часто боли при раке поджелудочной железы путают с хроническим панкреатитом. Для эффективного лечения и благоприятного прогноза необходимо вовремя обратиться к врачу для того, чтобы диагностировать рак на ранних стадиях.
Как проверить наличие злокачественной опухоли
Существует ряд стандартных методик распознавания рака:
- Первый этап – на осмотре у врача. Во время пальпации, перкуссии и сбора анамнеза специалист может заметить увеличение границ расположения органов.
- Анализ крови определяет количество ферментов, билирубина, инсулина, АлАт, АсАт и онкомаркеров в составе плазмы.
- Ультразвуковое исследование. Процедура позволяет увидеть пораженный орган на экране аппарата. Но в связи с анатомически глубоким расположением железы, изображение может искажаться.
- Компьютерная и магнитно-резонансная томография. Делает послойные снимки органа в одной плоскости.
- Биопсия. Врачом-онкологом берется кусочек ткани пораженного органа, и под микроскопом дифференцируется тип клеток.
- Холангиография. В печеночный проток вводится контрастное вещество, и делают рентген-снимок.
Особенность заключается в том, что у эндоскопа на кончике располагается датчик и оптический прибор. Он помещается в пищевод и проводит диагностику изнутри. Преимущества:
- четкая картина без искажений,
- возможность оценить васкуляризацию,
- полный контроль при взятии материала для биопсии.
Молодой американский ученый в течение семи месяцев изобрел портативный аппарат (похож на глюкометр) для ранней диагностики развития рака. Он имеет углеродные нанотрубки, которые способны найти в капле крови белок мезотелин (онкомаркер, который вырабатывают раковые клетки). Но данный метод мало изучен, и для массового производства устройства не проведено достаточное количество клинических испытаний. Поэтому купить в аптеке его пока нельзя.
Лечебная тактика и факторы, влияющие на выживаемость
Основная цель лечения – это избавиться от опухолевых клеток и помочь пациенту одолеть болезнь. Для этого существуют хирургические, лучевые, химиотерапевтические методы терапии.
Факторами, которые влияют на продолжительность жизни, являются:
- размер опухоли, возможность её удаления,
- наличие метастазов,
- возраст пациента и общее состояние его организма,
- качество лечения и ухода за больным.
Проводится лишь в случаях, когда нет возможности провести хирургическое иссечение опухоли. Заключается в лечении сопутствующих симптомов и поддержании качества жизни человека:
- ненаркотические и наркотические анальгетики (для купирования боли),
- антидепрессанты (лечение депрессии, апатии и психологических расстройств),
- гормональные препараты на основе эстрогена (белок раковых клеток чувствителен к женскому гормону и разрушается под его воздействием),
- ферменты и инсулин,
- лечебные физиопроцедуры и качественный уход.
Введение препаратов, которые останавливают деление и рост опухолевых клеток. Они не дают развиться новым путём разрушения их ДНК-спирали. Используют следующие препараты:
- Гемцитабин,
- FolFOXIRI,
- Эрлотиниб,
- Капецитобин,
- Гемзарон.

Возможно сочетание двух препаратов для достижения хорошего лечебного эффекта. Процедуру необходимо проходить повторно через каждый месяц, так как медикаменты действуют лишь во время фазы деления раковых клеток.
Существует много методов, как удалить опухоль, но чаще проводят панкретодуоденальную резекцию. Вырезается вся железа, желчный проток, близлежащие лимфоузлы и верхняя часть 12-перстной кишки.
Внимание! После резекции поджелудочной железы пациент вынужден до конца жизни принимать препараты, содержащие панкреатические ферменты и гормоны.
Когда опухоль неоперабельна:
- при наличии метастазов отдаленных органов,
- при общих соматических заболеваниях,
- если наблюдается инфильтрация опухоли в соседние ткани,
- в возрасте старше 70 лет.
Врачом всегда просчитывается риск и польза хирургической помощи. Пациент не должен оперироваться, если вероятность смертельного исхода составляет более 70%.
Интересно! Хирургия не стоит на месте, и существуют клиники, где есть инновационные технологии, которые позволяют провести операцию через небольшой прокол в животе. Это сокращает срок реабилитации пациента после операции до 5 дней.
Цель – улучшить качество жизни пациента на протяжении последних лет. Хирургическим путём ставится стенд или катетер для поддержания процессов пищеварения.
Процедура эффективна после хирургического удаления опухоли и используется для полного уничтожения единичных раковых клеток. Белковая структура новообразования очень чувствительна к ионизирующим лучам, и они разрушаются под их воздействием.
Для пациентов, которым не помогают обычные средства, могут предложить способы, клинически малоизученные. Эффективность данных процедур составляет 20%:
- генная терапия (введение здоровых генов, которые замещают мутированные),
- криоабляция (операция с помощью воздействия холодом),
- HIFU (высокоинтенсивные УЗ волны),
- ангиостатические лекарства (эмболизация кровотока и местное введение химиопрепаратов),
- лазеротерапия,
- нанотерапия (мини-гильзы с частицами золота, способные убить раковые клетки),
- иммунотерапия кейтрудой (препарат распознает и уничтожает клетки опухоли),
- виротерапия (заражение мутированных клеток вирусом).
Лечение народными средствами рака поджелудочной железы невозможно. Клинические симптомы имеют тяжелый и быстро развивающий характер, не нужно тратить время и заниматься самолечением.
Большая потеря массы тела связана со снижением аппетита, нарушением процесса пищеварения и интоксикацией организма продуктами распада раковых клеток. Важно поддерживать вес и соблюдать рекомендации врача-онколога:
- исключить жирную, жареную, острую пищу,
- употреблять только диетическое мясо, приготовленное на пару,
- есть фрукты и овощи в сыром виде,
- прием пищи должен быть разделен на 8-9 подходов в день,
- минимум 1,5 литра чистой воды в течение суток.
Подход к лечению рака ПЖ в России и за рубежом
Лечение рака поджелудочной железы состоит из множества этапов, тесно взаимосвязанных друг с другом. Необходим комплексный подход, так как эффективность борьбы с новообразованием зависит от компетентности и профессионализма врача, уровня оснащения медицинских учреждения, использования современных методик лечения, безопасности и сервиса по уходу за больными.

Большинство российских медицинских учреждений не имеет даже половины тех возможностей и навыков, что есть у зарубежных представителей. Лидерами по оказанию помощи иностранным гражданам являются Германия, Израиль, Америка, Турция.
Самые крупные клиники, которые могут оказать помощь онкобольным на поздних стадиях, находятся в Москве. Список современно оснащенных и популярных учреждений:
- Московский научный онкологический институт им.П.А. Герцена,
- Российский онкологический научный центр Н.Н. Блохина,
- НИИ онкологии им. Н.Н. Петрова.
Лечиться и проходить диагностику в чужой стране стоит больших денег, к тому же необходимо дополнительно оплачивать перелет и проживание. Самые популярные клиники, которые лечат больных раком поджелудочной железы:
- отделение онкологии в медицинском центре им. Сураски (Тель-Авив, Израиль),
- отделение онкологии в клинике университета Гамбурга (Германия),
- отделение онкологии в академической клинике Золинген (Германия),
- отделение онкологии в Норд Клиник Альянс (Бремен, Германия),
- отделение онкологии в клинике Liv Hospital (Стамбул, Турция),
- отделение онкологии в медицинском центре Anadolu (Стамбул, Турция).
Продолжительность жизни на разных стадиях развития опухоли
Прогноз лечения рака неблагоприятный. Победить болезнь нельзя даже на ранних фазах развития. Максимальный срок жизни составляет 5 лет. При 1 стадии развития лишь 5-10% онкобольных могут прожить около пяти лет. При развитии 2 и 3 стадии 20-40% людей живут не более трех лет. При нелеченой 4 стадии пациент умирает через 2 месяца, 90% больных погибают через 10 недель после окончания лечения.
В заключение хочется сказать, что хоть рак и нельзя вылечить, но можно его предупредить. Если человек будет следить за здоровьем, поддерживать хорошую физическую активность, правильно питаться, своевременно проходить диспансеризацию и обследования, то и побеждать никакую болезнь не придется. Живите в гармонии со своим телом и душой.
- Мукерджи Сиддхартха. Царь всех болезней. Биография рака. АСТ М., 2013 г.
- Лапкин К.В., Пауткин Ю.Ф. Билиопанкреатодуоденальный рак. М., издательство УДН, 1991 г.
- Патютко Ю.И., Котельников А.Г. Рак поджелудочной железы: диагностика и хирургическое лечение на современном этапе. Анналы хирургической гепатологии. 1998 г, том 3, №1, стр. 96–111.
- Блохин Н.Н., Итин А.Б., Клименков А.А. Рак поджелудочной железы и внепеченочных желчных путей. AМН СССР. М. Медицина, 1982 г.
- Гарин А.М., Базин И.С. Злокачественные опухоли пищеварительной системы. М., 2003 г.
Читайте также:





