Как посчитать объем опухоли формула
Проектирование СКС определения относительного объема опухолей головного мозга
Реферат по теме выпускной работы
Содержание
- Введение
- 1. Методы выделения границ объектов
- 1.1. Метод Собеля
- 1.2. Метод Лапласа
- 1.3. Метод Робертса
- 2. Методы определения объема объекта по серии изображений
- 2.1. Определение геометрических размеров объекта по перспективным снимкам
- 2.2. Расчет геометрических параметров по параллельным проекциям
- 3. Программы для клинического применения
- 3.1. Система Тонкий луч
- 3.2. Планирующая система Nucletron
- 3.3. Планирующая система Eclipse фирмы Varian
- Выводы
- Список источников
Введение
Компьютерные технологии занимают все больше областей жизни современного человека, поэтому не удивительно, что современная медицина активно использует новейшие научные разработки и методы. Чем стремительнее развиваются технологии, тем больше времени мы проводим сидя за экраном монитора. Применение компьютеров в медицине позволяет существенно упростить работу врачей, а также повысить точность постановки диагноза и улучшить планирование лечения пациентов.
Опухоли – это патологические разрастания тканей, состоящие из качественно изменившихся клеток, ставших атипичными в отношении дифференцировки, характера роста и других процессов. Различают доброкачественные и злокачественные опухоли. Лечение опухолей осуществляют различными методами в зависимости от их вида, локализации, стадии развития, возраста больного и др. В современном мире все большее внимание уделяется применению радиотерапии для лечения злокачественных новообразований.
Лучевая терапия представляет собой комплекс мероприятий, которые включают не только лечение, но и предварительный расчет параметров лечения. Последовательные этапы применения лучевой терапии:
- компьютерная томография;
- планирование лечебных полей облучения;
- симуляция цикла лучевой терапии;
- непосредственно облучение.
Важнейшим этапом лечения является клиническое планирование. На данном этапе определяется локализация и объем опухолей, производится их количественная и качественная оценка. На основании полученных данных разрабатывается план лечения, устанавливается необходимая экспозиционная доза облучения. В свою очередь, для разработки оптимального плана лечения необходимо правильно определить геометрические параметры новообразования.
1. Методы выделения границ объектов
Выделение краев играет важную роль в анализе изображений и распознавании образов при решении проблемы компьютерного зрения. Края являются точками перепада значений яркости в полутоновом изображении и поэтому важными характеристиками изображения. Эти резкие точки перехода указывают местоположения контуров объектов на изображениях. Представление краев объектов на изображении позволяет уменьшить количество данных, сохраняющих важную информацию о форме объектов в сцене. Выделение краев является наиболее используемой технологией в процессе обработки цифрового изображения. При определении границ объекта производится вычисление двумерного пространственного градиента на изображении, и выявляются области, соответствующие краям. При этом происходит оценка модуля градиента в каждой точке полутонового изображения.
Выделение краев – термин в теории обработки изображения и компьютерного зрения, частично из области поиска объектов и выделения объектов, основывается на алгоритмах, которые выделяют точки цифрового изображения, в которых резко изменяется яркость или есть другие виды неоднородностей. Результатом выделения границ является набор связанных кривых, обозначающих границы объектов, граней и оттисков на поверхности, а также кривые, которые отображают изменения положения поверхностей. Объекты состоят из многочисленных частей различных цветных уровней. Перепад яркости – это связное множество пикселей, лежащих на границе между двумя областями.
Рассмотрим некоторые наиболее популярные методы выделения границ.
Данный метод позволяет выделить границы изображения путем наложения двух масок вращения на каждый пиксел. Эти маски позволяют выявить горизонтальные и вертикальные границы объектов на изображении.

Рисунок 1.1 – Маски оператора Собеля
При раздельном наложении этих масок на пиксел можно получить значение вертикального Gy и горизонтального Gx градиентов. Конечное значение определяется по формуле 2.1.

Формула 1.1 – Оператор Собеля
Для решения задачи выделения перепадов яркости можно применить дифференциальные операторы более высокого порядка, например оператор Лапласа (формула 1.2).

Формула 1.2 – Оператор Лапласа
В дискретном случае оператор Лапласа можно реализовать в виде процедуры линейной обработки изображения окном 3x3.

Рисунок 1.2 – Маски оператора Лапласа
Для фильтрования изображения достаточно применения одной из предложенных масок. Здесь значения градиента вычисляется сразу, а не как некое среднее после наложения двух матриц. Следовательно, данный метод имеет преимущество в относительной простоте расчетов, однако при этом ухудшается качество контурирования изображения.
В компьютерном зрении перекрёстный оператор Робертса – один из ранних алгоритмов выделения границ, который вычисляет сумму квадратов разниц между диагонально смежными пикселами. Это может быть выполнено сверткой изображения с двумя ядрами.
Иными словами, каждый пиксель получаемого изображения вычисляется по правилу:
tmp1 = absolute_value(input_image(x, y) − input_image(x+1,y+1))
tmp2 = absolute_value(input_image(x+1,y) − input_image(x, y+1))
output_image(x, y) = Sqrt( tmp1 2 + tmp2 2 )
Преобразование каждого пиксела перекрёстным оператором Робертса может показать производную изображения вдоль ненулевой диагонали, и комбинация этих преобразованных изображений может также рассматриваться как градиент от двух верхних пикселов к двум нижним. Оператор Робертса всё ещё используется ради быстроты вычислений, но он проигрывает в сравнении с альтернативами с его значительной проблемой чувствительности к шуму. Он даёт линии тоньше, чем другие методы выделения границ. Иногда его называют фильтром Робертса .
2. Методы определения объема объекта по серии изображений
Определение объема объекта – задание достаточно распространенное и имеющее множество реализаций в различных языках программирования. В случае, если мы имеем дело с правильной геометрической фигурой, данная задача решается достаточно легко по известным математическим формулам. Однако в случае, если фигура неправильной формы, то возникает ряд сложностей в оценке ее объема.
Существует достаточно много методов оценки геометрических параметров объекта по его плоским снимкам. Основным различием данных методов является то, какие снимки используются для определения геометрических параметров и таким образом построения трехмерного изображения.
Рассмотрим различные способы определения геометрических параметров объекта в зависимости от комплекса фотографий объекта.

Рисунок 2.1 – Перспективное проектирование объекта W на плоскость P
Задача определения объема органа будет разбиваться на ряд подзадач. Главной и наиболее трудоемкой будет определение площади поперечного сечения органа (опухоли). Данная задача, в свою очередь, является трудоемкой и ресурсоемкой, так как органы и ткани имеют неправильные формы, и расчет их площадей будет производится методом программного интегрирования. Так как полученные результаты будут измеряться в пикселах, то для получения реальных размеров органов необходимо осуществить перевод их к линейным величинам. Для этого воспользуемся преимуществами стандарта DICOM.
Рисунок 2.2 – Продольные срезы головного мозга
Как известно из геометрии, объем фигуры определяется как произведение площади ее поперечного сечения на высоту. Тогда определить объем опухоли или органа можно путем умножения площади их поперечного среза на расстояние между последовательными срезами. Данный метод не исключает возникновения погрешностей измерений и приводит к погрешностям в расчетах, однако большое количество срезов ведет к тому, что уменьшается погрешность расчетов. Современные компьютерные МРТ и КТ сканеры позволяют получать снимки с толщиной среза от 1 до 4 мм, что не влияет существенно на результат.
3. Программы для клинического применения
Как отмечалось ранее, DICOM – это медицинский формат изображений. Разработка и внедрение данного типа файлов осуществлялась с целью упрощения работы врачей‑рентгенологов и радиологов.
Программы, используемые в медицинских учреждениях, зачастую являются специфическими, и применяются в конкретных областях медицины. Так как в дальнейшем планируется разработка программного обеспечения для анализа снимков больных с онкологическими заболеваниями, то рассмотрим несколько пакетов программ, которые одобрены для клинического применения в онкоцентрах. Дополнительной опцией таких программных продуктов является возможность планирования радиологического лечения.
Система Тонкий луч для планирования дистанционной лучевой терапии с источником 60 Co была разработана в начале 90‑х годов и ориентирована на технические возможности того времени. В частности, она работала под операционной системой MS DOS и имела ограниченные возможности коммуникации с другими программными средствами. В настоящее время Тонкий луч хотя и удовлетворяет по своим возможностям значительной доле рутинных задач планирования на одиночном поперечном срезе пациента, представляется крайне бедным с точки зрения открытости системы, поддержки информационных потоков и эффективного использования мощности современных вычислительных средств и многозадачных операционных систем. Его, к сожалению, до сих пор используют в ряде национальных клиник ввиду того, что нет финансовой возможности приобретения нового современного оборудования и программного обеспечения. Данная система на сегодняшний день уже морально устарела.
Преимущества данной планирующей системы:
- Простота в использовании.
- Относительно быстрый расчет дозного распределения.
- Возможность вывода на экран изодозы любой величины.
К недостаткам можно отнести следующее:
- Работа под ОС MS‑DOS.
- Ввод поперечного среза вручную, по шаблону, что может не соответствовать структуре внутренних органов пациента.
- Отсутствие БД, что делает невозможным сохранение плана облучения.
- Просчет времени сеанса облучения вручную.
Планирующая система Eclipse фирмы Varian – это всесторонняя система, которая упрощает сложность современной лучевой терапии, рассчитывая дозное распределение не на одном поперечном срезе, а в объемной среде используя несколько снимков. В Eclipse физики и врачи тщательно создают, выбирают и проверяют лучшие планы облучения для больных.
Продвинутые алгоритмы в Eclipse точно и быстро высчитывают распределение дозы для фотонов, электронов и протонов. С комбинацией модульных алгоритмов и гибкой архитектурой Eclipse, врач может выбрать оптимальный алгоритм для каждого отдельного лечения.
Исходя из вышесказанного, видны следующие факты: дешевые отечественные планирующие системы являются морально устаревшими и не удовлетворяют современных потребностей врачей, а зарубежные разработки являются очень дорогостоящими и требуют постоянного финансирования и обновления оборудования. Также следует отметить, что даже в самых современных планирующих системах выделение границ пораженных тканей осуществляется вручную.
Выводы
Различные методы контурирования объектов имеют в своей основе по‑пикселные операции, то есть последовательно наложение различных фильтрующих масок на каждую точку изображения. Далее производился расчет новых значений цвета пиксела и, таким образом, на изображении оставались только границы объектов. Следует также отметить, что данные операции производятся на изображении в градациях серого.
После сравнения результатов работы приведенных методов и оценки трудности реализации был выбран метод выделения границ Робертса. Данный метод имеет самую простую математическую модель и, что более важно, получает тонкие четкие границы объектов. Также данный метод является однопроходным, что позволяет сократить время обработки одного изображения.
Анализ существующих медицинских приложений. Рассмотренные приложения относятся к системам планирования лучевой терапии. Современные системы планирования позволяют построить трехмерное изображение, рассчитать размеры пораженных тканей и необходимые параметры лечения. Однако такие системы являются очень дорогостоящими, что существенно сужает круг пользователей. Также данные системы не поддерживают национальные языки, что может негативно сказаться на процессе планирования нестандартных случаев лечения.
Отечественные системы, к сожалению, являются на сегодняшний день уже морально устаревшими, однако такие планирующие системы все еще используются на территории стран бывшего СССР, так как материально‑техническая оснащенность местных больниц не позволяет внедрять современные технически требовательные системы.
Основным заданием магистерской работы будем считать создание приложения, которое позволяет создавать трехмерное изображение органа, выделять его пораженную часть, рассчитывать геометрические и относительные параметры пораженной части. Для корректного использования данного приложения необходимо разработать проектную документацию. Также необходимым является составление рекомендаций по охране труда на рабочем месте медицинского физика. Возможно дополнение магистерской работы расширенными исследованиями в различных областях.
При написании данного реферата магистерская работа еще не завершена. Окончательное завершение: декабрь 2014 года. Полный текст работы и материалы по теме могут быть получены у автора или его руководителя после указанной даты.
Оценка величины первичной опухоли по ее максимальному размеру общепринята, она используется, например, при стадировании РМЖ по системе TNM. Однако, можно предположить, что объём опухоли, вычисленный по трем ее измерениям, может иметь большее прогностическое значение. С другой стороны, вероятно, что опухоли равного объёма у больных с разной массой тела могут иметь различные возможности для метастазирования. Эти рассуждения послужили поводом для анализа в качестве фактора прогноза не только максимального размера опухоли, но также ее абсолютного и относительного объёмов.
4.1. Литературная справка
Максимальный размер первичной опухоли до начала лечения (далее просто “размер опухоли”) — один из традиционных и наиболее сильных факторов прогноза течения РМЖ.
По данным Hauser H. с соавт. (129) увеличение размера первичной опухоли прямо коррелирует с поражением регионарных лимфатических узлов.
Stal O. с соавт. (229) было показано нарастание частота РЭ- опухолей, РП- опухолей, анеуплоидных опухолей параллельно с увеличением размера опухоли.
У больных без признаков местного распространения опухоли, относящихся к Т4, и без метастатического поражения регионарных лимфатических узлов размер опухоли — сильный клинический признак, оказывающий влияние на безрецидивную выживаемость больных (206). По данным Rosner D. & Lane W.W. (216) 10-летняя БРВ больных РМЖ c размером опухоли до 0,5 см включительно (T1aN0M0) составила 98%, от 0,6 до 1,0 см (T1bN0M0) — 94%, от 1,1 до 2,0 см (T1cN0M0) — 84%, от 2,1 до 5,0 см (T2N0M0) -71% (p=0.0002).
По данным множества исследований размер первичной опухоли является одним из сильнейших независимых клинических факторов прогноза при РМЖ I — III стадий (77, 108, 215, 54, 236, 250, 190, 181, 58 и др.)
4.2. Максимальный размер опухоли
Размер опухоли изучен у всех больных, включённых в исследование. У пациенток, оперированных без предоперационного лечения или подвергнутых крупнофракционному облучению на протяжении 2 — 4 дней с последующей без перерыва операцией, анализировался размер, зарегистрированный при морфологическом исследовании удаленного препарата. У больных, получавших предоперационное лечение в виде химиотерапии, лучевой терапии с использованием обычного фракционирования или химиолучевой терапии, анализировался размер опухоли по исходным маммограммам.
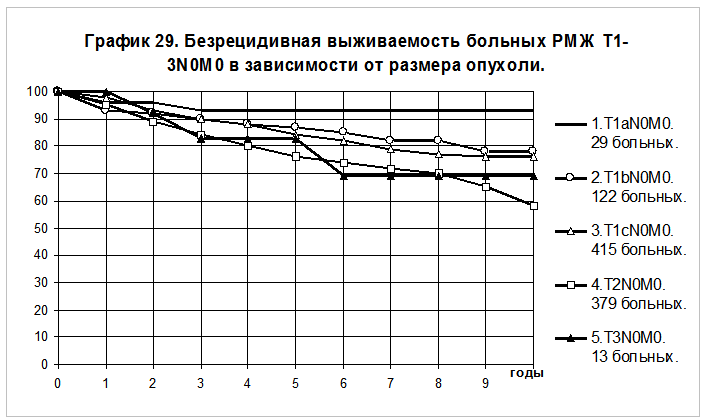
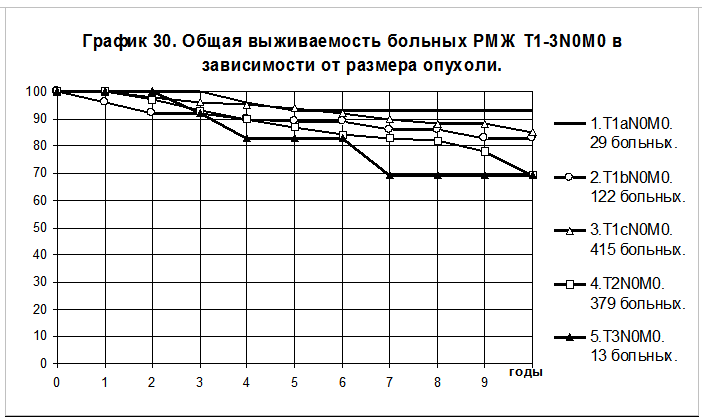
Отчетливое представление о влиянии размера опухоли на течение болезни можно получить при анализе кривых безрецидивной выживаемости и общей выживаемости у больных без признаков распространения опухоли на грудную стенку и на кожу, без поражения регионарных лимфатических узлов (N0) в группах пациенток с различным размером опухоли (графики 29 и 30). Большинство больных не получали адъювантной системной терапии. 5-летняя БРВ и 10-летняя БРВ больных РМЖ T1aN0M0 (размер опухоли до 0,5 см включительно) составили 93+/-5% и 93+/- 5%, T1bN0M0 (размер опухоли от 0,6 до1,0 см) — 87+/-3% и 78+/-5%, T1cN0M0 (размер опухоли от 1,1 до2,0 см) — 84+/-2% и 76+/-3%, T2N0M0(размер опухоли от 2,1 до 5,0 см) — 76+/-2% и 58+/-4%, T3N0M0(размер опухоли >5,0 см) — 83+/-11% и 69+/-16% соответственно. Статистически достоверны различия при сравнении групп больных РМЖ: T1aN0M0 и T2N0M0 (р = 0,006568; T1bN0M0 и T2N0M0 (р = 0,01214); T1сN0M0 и T2N0M0 (р = 0,0011).
5-летняя ОВ и 10-летняя ОВ больных РМЖ T1aN0M0 составили 92+/-6% и 92+/- 6%, T1bN0M0 — 89+/-3% и 83+/-5%, T1cN0M0- 94+/-1% и 85+/-3%, T2N0M0 — 87+/-2% и 69+/-4%, T3N0M0(размер опухоли >5,0 см) — 83+/-11% и 66+/-17% соответственно. Статистически достоверны различия при сравнении групп больных, имеющих РМЖ : T1aN0M0 и T2N0M0 (р = 0,04643); T1сN0M0 и T2N0M0 (р = 0,00018).
Слабее влияние размера на отдаленные результаты у больных с поражением лимфатических узлов, соответствующим N1 или N2. Эти больные в большинстве случаев получали адъювантную системную терапию, которая более подробно будет рассмотрена в 12 главе. 5-летняя БРВ и 10-летняя БРВ больных РМЖ T1bN1M0 составили 72+/-7% и 61+/-10%, T1cN1М0- 74+/-3% и 60+/-5%, T2N1М0 — 71+/-3% и 61+/-4% T3N1М0 — 55+/-8% и 51+/-9% соответственно (график 31). Различия не носят статистически значимый характер.
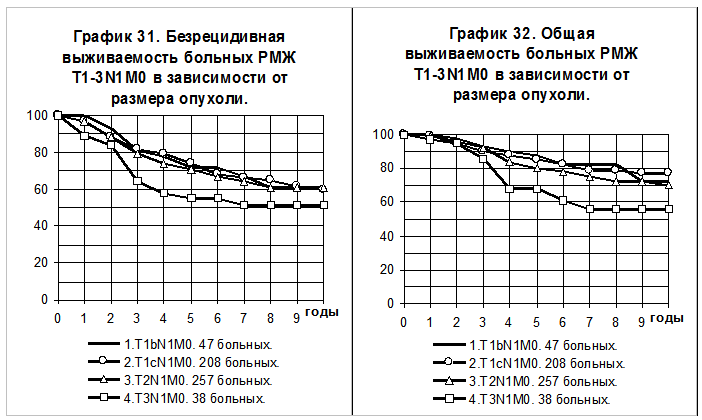
5-летняя ОВ и 10-летняя ОВ больных РМЖ T1bN1M0 составили 82+/-6% и 72+/-9%, T1cN1М0- 85+/-3% и 77+/-4%, T2N1М0 — 80+/-3% и 70+/-4%, T3N1М0 — 68+/-8% и 56+/-94% соответственно (график 32). Различия статистически значимы при сравнении групп больных РМЖ T1cN1М0 и T3N1М0 (р=0,01354).
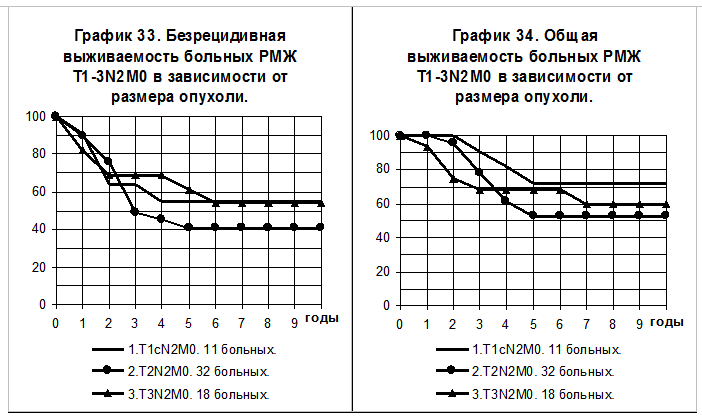
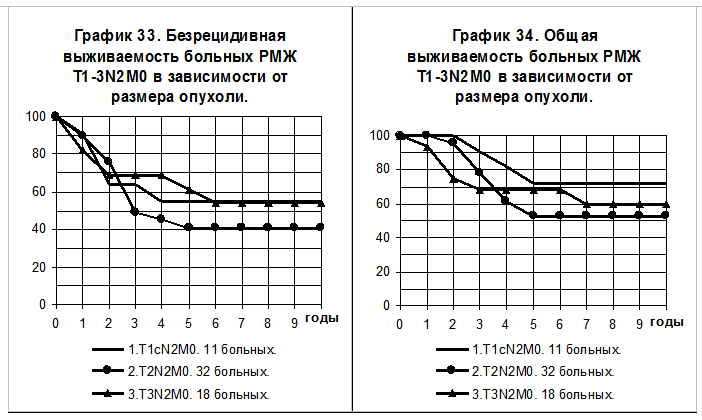
У больных с образованием конгломератов метастатически пораженных регионарных лимфатических узлов, то есть c N2, влияния размера опухоли на БРВ не прослеживается, более очевидно его влияние на ОВ (графики 33 и 34), однако все различия статистически не значимы. 5-летняя БРВ и 10-летняя БРВ больных РМЖ T1сN2M0 составили 55+/-15% и 55+/- 15%, T2N2M0 — 41+/-10% и 41+/-10%, T3N2M0 — 61+/-13% и 54+/-13% соответственно. 5-летняя ОВ и 10-летняя ОВ больных РМЖ T1сN2M0 составили 72+/-14% и 72+/- 14%, T2N2M0 — 53+/-10% и 53+/-10%, T3N2M0 — 68+/-12% и 60+/-13% соответственно.
4.3. Абсолютный объём опухоли
Абсолютный объём опухоли вычислялся на основании трех измерений опухоли, произведенных во взаимно перпендикулярных направлениях, по формуле:
где П — 3,14…, r = (a+b+c):6; a, b, c — размеры опухоли, V — абсолютный объём опухоли.
В случаях, когда были известны только два размера, третий размер вычислялся как их среднее арифметическое. При множественности зачатков опухоли под абсолютным объёмом понималась сумма объёмов всех первичных опухолей.
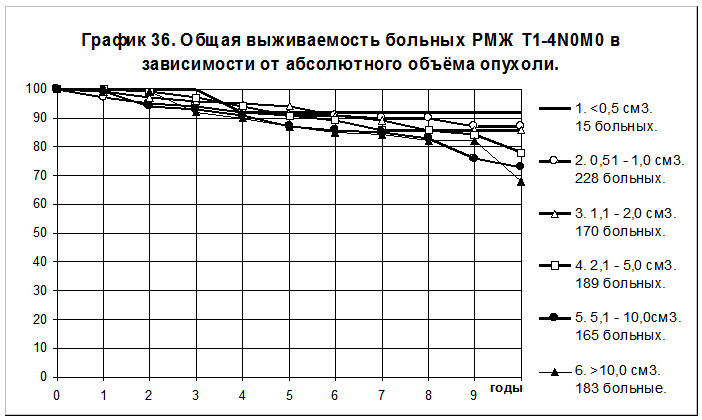
У больных с отсутствием поражения регионарных лимфатических узлов (N0) показатели БРВ и ОВ анализированы в группах со следующими градациями абсолютного объёма: 1) до 0,5 см3 включительно; 2) 0,51 — 1,0 см3 включительно; 3) 1,1 — 2,0 см3 включительно; 4) 2,1 — 5,0 см3 включительно; 5) 5,1 — 10,0 см3 включительно; 6)> 10,0 см3 (графики 35 и 36). 5-летняя БРВ и 10-летняя БРВ больных 1 группы составили 84+/-10% и 84+/- 10%, 2 группы — 86+/-2% и 75+/- 4%, 3 группы — 86+/-3% и 77+/- 4%, 4 группы — 80+/-3% и 67+/- 5%, 5 группы — 78+/-3% и 61+/-6%, 6 группы — 77+/-3% и 57+/-6%. Различия статистически значимы при сравнении следующих пар групп: 2 и 5 (р=0,02419), 2 и 6 (р=0,01267), 3 и 5 (р=0,02899), 3 и 6 (р=0,01999).
5-летняя ОВ и 10-летняя ОВ больных 1 группы составили 92+/-8% и 92+/-8%, 2 группы — 91+/-2% и 87+/-3%, 3 группы — 94+/-2% и 86+/- 4%, 4 группы — 91+/-2% и 78+/- 5%, 5 группы — 87+/-3% и 73+/-6%, 6 группы — 87+/-3% и 68+/-6% соответственно. Различия статистически значимы при сравнении следующих пар групп: 2 и 5 (р=0,04060), 2 и 6 (р=0,02190), 3 и 6 (р=0,04381).
При поражении регионарных лимфатических узлов, соответствующем N1 влияние абсолютного объёма опухоли на прогноз ослабевает. Так, при
следующей градации абсолютного объёма опухоли: 1) до 1,0 см3 включительно; 2) 1,1 — 2,0 см3 включительно; 3) 2,1 — 5,0 см3 включительно; 4) 5,1 — 10,0 см3 включительно; 5) >10,0 см3; не наблюдалось статистически значимых различий БРВ соответствующих групп больных (график 37). 5-летняя БРВ и 10-летняя БРВ больных 1 группы составили 72+/-5% и 59+/-7%, 2 группы — 73+/-6% и 59+/-8%, 3 группы — 71+/-4% и 58+/-7%, 4 группы — 71+/-5% и 53+/- 8%, 5 группы — 63+/-5% и 49+/-7% соответственно.
5-летняя ОВ и 10-летняя ОВ больных 1 группы составили 82+/-4% и 67+/-7%, 2 группы — 89+/-4% и 83+/-6%, 3 группы — 82+/-4% и 74+/- 6%, 4 группы — 82+/-4% и 69+/-8%, 5 группы — 76+/-4% и 62+/-6%, соответственно (график 38). Различия статистически значимы при сравнении групп 2 и 5 (р=0,02597).
У больных с поражением лимфатических узлов, соответствующем N2, сравниваем только две группы больных: 1) с абсолютным объёмом опухоли = 20 cм3 (графики 39 и 40). 5-летняя БРВ и 10-летняя БРВ больных 1 группы составили 42+/-11 и 36+/-11%, 2 группы — 16+/-9% и 16+/-9% соответственно (различия статистически не значимы, р=0,1348). 5-летняя ОВ и 10-летняя ОВ больных 1 группы составили 61+/-12 и 41+/-15%, 2 группы — 32+/-12% и 26+/-11% соответственно (различия статистически не значимы, р=0,1508).
При проведении многофакторного анализа оказалось, что абсолютный объём опухоли является высоко информативным фактором прогноза, однако его значимость не превышает значимость размера опухоли.
4.4. Относительный объём опухоли
Относительный объем опухоли вычислялся как частное от деления абсолютного объёма опухоли на вес тела больной. У больных с N0 сформированы 5 групп пациентов со следующими градациями относительного объёма опухоли: 1) до 0,0100 см3/кг включительно; 2) 0,0101 — 0,0500 см3/кг включительно; 3) 0,0501 — 0,1000 см3/кг включительно; 4) 0,1001 — 0,500 см3/кг включительно; 5)> 0,5 см3/кг (графики 41 и 42).
5-летняя БРВ и 10-летняя БРВ больных 1 группы составили 87+/-3% и 76+/-4%, 2 группы — 85+/-2% и 74+/-3%, 3 группы — 78+/-3% и 64+/-5%, 4
группы — 77+/-3% и 56+/- 5%, 5 группы — 81+/-8% и 68+/-11% соответственно. Различия статистически значимы при сравнении следующих пар групп: 1 и 3 (р=0,02018), 1 и 4 (р=0,01865), 2 и 3 (р=0,02054), 2 и 4 (р=0,01885). Показатели ОВ также различались в зависимости от величины относительного объёма опухоли. 5-летняя ОВ и 10-летняя ОВ больных 1 группы составили 90+/-2% и 86+/-3%, 2 группы — 94+/-2% и 85+/-3%, 3 группы — 90+/-3% и 76+/-5%, 4 группы — 87+/-2% и 69+/-5%, 5 группы — 85+/-7% и 76+/-10%, соответственно. Различия статистически значимы при сравнении групп 2 и 4 (р=0,007268).
Пять групп пациентов с идентичной градацией величины относительного объёма опухоли выделены среди больных, имевших поражение регионарных лимфатических узлов, соответствующее N1. Кривые БРВ и ОВ этих групп больных представлены на графиках 43 и 44. 5-летняя БРВ и 10-летняя БРВ больных 1 группы составили 74+/-6% и 58+/-7%, 2 группы — 73+/-4% и 62+/-5%, 3 группы — 71+/-5% и 52+/-8%, 4 группы — 68+/-4% и 53+/-6%, 5 группы — 48+/-10% и 31+/-12% соответственно. Различия статистически значимы при сравнении следующих пар групп: 1 и 5 (р=0,00450), 2 и 5 (р=0,004441), 3 и 5 (р=0,01474), 4 и 5 (р=0,009984).5-летняя ОВ и 10-летняя ОВ больных 1 группы составили 89+/-4% и 66+/-8%, 2 группы — 86+/-3% и 78+/-5%, 3 группы — 81+/-4% и 70+/-8%, 4 группы — 78+/-4% и 66+/-6%, 5 группы — 62+/-10% и 56+/-11% соответственно. Различия статистически значимы при сравнении следующих пар групп: 1 и 5 (р=0,04045), 2 и 5 (р=0,01140), 3 и 5 (р=0,04291).
Так же, как и абсолютный объём, относительный объём опухоли при многофакторном анализе проявил себя как высокоинформативный фактор прогноза для БРВ и ОВ, однако его значимость не превышала значимость максимального размера опухоли.

Резюме.
Размер первичной опухоли является сильным фактором прогноза, влияющим на БРВ и ОВ больных РМЖ как при отсутствии поражения лимфатических узлов, так и при наличии такого поражения. Метод оценки размера опухоли (максимальный размер опухоли, абсолютный объём опухоли, относительный объём опухоли) не принципиален.
Как посчитать объем простаты
Каждому зрелому мужчине следует знать, что такое простата, когда и зачем нужно ее проверять. Также не лишним будет знать, какой она должна быть в норме, как проверяется ее размер и как высчитать объем предстательной железы по результатам УЗИ.
Функция простаты у мужчин
Простата является железой мужских половых органов, ее основная функция заключается в секреции жидкости для спермы, питающей, разбавляющей и защищающей сперматозоиды. Мышцы предстательной железы помогают проталкивать семенную жидкость в уретру во время эякуляции. Вырабатываемая простатой жидкость вместе со сперматозоидами (клетками спермы из яичек) и секретами других желез, формирует сперму.
Размер простаты тесно связан с состоянием здоровья мужского организма. Но без специальных исследований, учитывая только количество эякулята, посчитать объем простаты не представляется возможным. Лишь выяснив размеры самого органа, можно рассчитать объем предстательной железы для определения ее здоровья.
Где находится простата
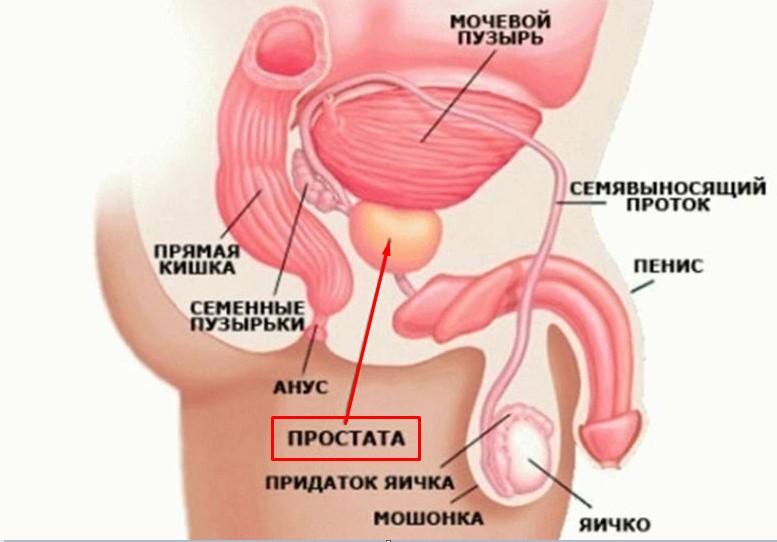
Чтобы получить реальный объем предстательной железы, формула берется из курса школьной математики: длина умножается на высоту и ширину органа. Полученное произведение умножается на соответствующий коэффициент, который позволяет вычислять объем эллипсовидных тел.
Прежде, чем определять отклонения, следует знать нормативные показатели. Так вот, средний вес нормальной простаты у взрослых мужчин составляет около 11 граммов, при этом допускаются отклонения в диапазоне от 7 до 16 граммов. По округлой форме и размеру железа напоминает средих размеров грецкий орех.
Нормальный размер простаты
Нормальная предстательная железа имеет размеры примерно 3 × 3 × 5 см или объем 25 мл. Мы видим, что на 25-мл объем простаты формула простого умножения длины, ширины и высоты не выведет, ведь форма простаты далека от геометрически правильного прямоугольника. Для точного расчета используется коэффициент, о котором поговорим позже.
Различные измерения простаты (среднее значение ± стандартное отклонение)
| Возраст | Группа 1 (40–49 лет) | Группа 3 (60–70 лет) |
| Длина (мм) | 37,55 ± 4,27 | 41,13 ± 6,18 |
| TZW (Transitional Zone Width – ширина переходной зоны), мм | 30,25 ± 4,84 | 34,21 ± 7,08 |
| Высота, мм | 21,64 ± 3,73 | 25,02 ± 6,07 |
Использование возрастных диапазонов при диагностике рака простаты помогает избежать ненужных исследований у пожилых мужчин с более крупными от природы железами (размером с крупный грецкий орех).
Почему увеличивается простата
Существуют доброкачественные (нераковые) расширения простаты, блокирующие нормальный проток мочи по мочеиспускательному каналу. Внутри простаты клетки постепенно разрастаются и начинают увеличивать паренхиму органа. Они оказывают давление на мочеиспускательный канал, через который моча и сперма выходят наружу. Когда паренхима начинает увеличиваться, она постепенно сжимает уретру и может привести к полной блокировке мочеиспускательного канала.
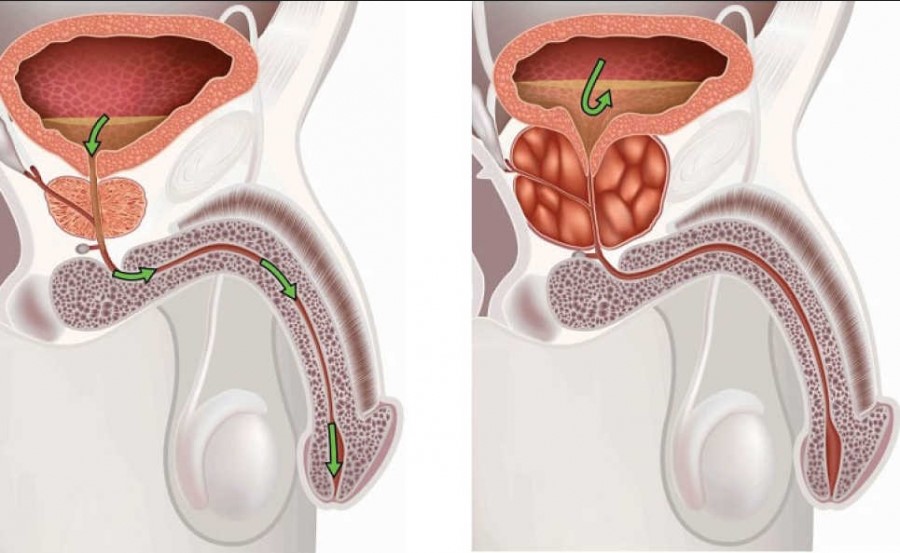
Диагностическое УЗИ увеличение объема предстательной железы показывает очень хорошо. Современные аппараты позволяют получать трехмерную картинку с высоким разрешением. Далее производится расчет объема предстательной железы по УЗИ и решается, стоит ли начинать лечение, есть ли смысл покупать тот же физиотерапевтический аппарат Смартпрост и предпринимать другие меры.
С увеличением простаты также был связан эстроген. С возрастом у мужчин в крови образуется меньше тестостерона, что приводит к увеличению относительной доли эстрогена. Этот женский гормон провоцирует изменение внешности мужчин, появляются многие женственные признаки.
В каком возрасте нужно проверять простату
После сорока лет мужчинам рекомендуется обратить внимание на состояние своей предстательной железы. Начиная примерно с 50 лет (или раньше, если этого требует семейный анамнез), всем мужчинам следует рассмотреть возможность регулярного обследования на рак простаты. Первым делом нужно сдать кровь на анализ уровня ПСА – простатического специфического антигена.
Если анализ крови показал, что уровень ПСА находится ниже отметки в 1 нанограмм на миллилитр крови и врач не находит никаких плохих изменений в простате, то еще 10 лет можно не проходить ректальное обследование. Однако, если PSA составляет от одного до двух нанограмм на миллилитр крови, то рекомендуется проверяться каждые два года. Производится расчет объема простаты по УЗИ, формула которого достоверно показывает изменения без дополнительных обследований.
Симптомы увеличения простаты
Симптоматика аденомы простаты включает:
- Слабый или медленный поток мочи.
- Ощущение недостаточного опорожнения мочевого пузыря.
- Сложность начала мочеиспускания.
- Учащенное мочеиспускание.
- Частый подъем ночью, чтобы помочиться.
- Прерывистый поток мочи, который начинается и останавливается.
- Напряженное мочеиспускание.
И простатит, и доброкачественная гиперплазия (разрастание) предстательной железы (ДГПЖ), могут вызывать боль. Однако, если ДГПЖ (раньше ее называли аденомой) вызывает боль, то это обычно происходит лишь во время мочеиспускания. При простатите боль может появляться при мочеиспускании, семяизвержении или проявляться, как генерализированная боль в животе и/или паховой области.
- Жжение или боль при мочеиспускании.
- Трудности с началом и остановкой мочеиспускания.
- Многочисленные позывы к мочеиспусканию ночью.
- Потеря контроля над мочевым пузырем.
- Снижение объема мочи или скорости потока.
- Кровавая моча (гематурия).
- Кровь в сперме.
И для дифференциации разных поражений мало выяснить объем предстательной железы, как считать этот показатель нужно знать для определения оптимального метода лечения.
Как определяют размер простаты
Для проведения трансректального УЗИ пациентов просят лечь на бок с согнутыми коленями. На датчик накладывается одноразовая защитная крышка, она смазывается, вводится в прямую кишку через задний проход. Изображения получают под разными углами, чтобы получить наилучший вид предстательной железы для точных замеров и диагностики.
Видео: как проводится УЗИ простаты.
Для ультразвукового исследования простаты использует зонд размером с палец, который вводится в прямую кишку на небольшое расстояние. Этот зонд создает безвредные звуковые волны. Человек не может слышать их, но они отскакивают от поверхности исследуемого органа. Аппарат УЗИ записывает звуковые волны и превращает их в видео или фотографии. Картинки получаются плоскими (2D) или объемными, трехмерными (3D), черно-белыми или цветными. По ним рассматривают структуру органа и наличие узлов. Специалист ищет изменения в контурах и эхогенности в каждой зоне. Одновременно небольшой образец ткани может быть взят для биопсии.
УЗИ предстательной железы является более точным, чем рентген. Это объясняется тем, что техник может видеть изображения в реальном времени, когда датчик движется по прямой кишке, а не делать снимок и потом исследовать статичные изображения. УЗИ исследования также более безопасны, чем рентген, потому что ультразвуковой аппарат не генерирует опасного излучения.
Формула расчета объема предстательной железы
Зонд перемещают под углом от одной стороны к другой. Каждый уролог, проводящий такое обследование, знает, как посчитать объем простаты в см3 по результатам замеров. После измерения высоты и длины в сагиттальной плоскости и ширины в осевой плоскости производится вычисление объема: произведение трех измеренных величин умножается на индекс 0,52.
Т.е., с помощью трансректального ультразвука (TRUS) объем оценивается с помощью традиционного математического расчета объема эллипсоида на основе полученной высоты (H), ширины (W) и длины (L) простаты.
Расчет объема предстательной железы формула:
Где точная величина индекса для расчета объема предстательной железы равна 0,523.
Как можно уменьшить размер простаты
Правильно определить размер и посчитать объем предстательной железы, провести правильное исследование и диагностировать заболевание, а затем разработать эффективную схему лечения может только доктор. Но пациенты могут помочь доктору контролировать симптомы увеличенной простаты. Чтобы сохранить здоровье, пациенты должны самостоятельно:
- Ограничить напитки вечером.
- Ограничить кофеин и алкоголь.
- Ограничить прием противозастойных и антигистаминных препаратов.
- Отправляться в туалет при первом же позыве к мочеиспусканию.
- Регулярно принимать ванну.
- Соблюдать здоровую диету.
- Оставаться физически и сексуально активным.
- Мочеиспускание нужно делать в два приема, через несколько секунд, это важный нюанс.
Оперативное лечение простаты
Стандартные хирургические процедуры
Данная операция используется для лечения проблем с мочеиспусканием из-за увеличения предстательной железы. Это самая распространенная операция по лечению ДГПЖ. Врач удаляет только части предстательной железы, которые затрудняют поток мочи. Комбинированный визуальный и хирургический инструмент (резектоскоп) вводится через кончик полового члена и в мочеиспускательный канал.
Каждый мужской доктор уролог должен владеть методиками диагностики и знать, как посчитать объем простаты по размерам. В задачи уролога входит также определение самого оптимального метода лечения, в т.ч. определение необходимости проведения хирургического вмешательства. Мужчинам же важно вовремя обращаться к доктору и внимательно следить за своим состоянием.
Читайте также:

