К вирусам индуцирующим развитие опухолей относят
Всемирной организацией здравоохранения в 1966 г. онковирусы были разделены на 3 группы: 1) мелкие (величиной 43—70 ммк) ДНК-содержащие вирусы (вирусы группы папова, аденовирусы); 2) РНК-содержащие вирусы величиной 70—100 ммк. В эту группу входят вирус куриной саркомы Рауса, вирусы лейкоза птиц и млекопитающих, вирусы рака молочных желез мышей; 3) крупные (величиной 200—250 ммк) ДНК-содержащие вирусы. К ним относятся вирусы фибромы кроликов, контагинозного моллюска и яба-вирус.
Как правило, вирусы вызывают опухолевую трансформацию, сопровождающуюся включением генома вируса в геном клетки. Часть вирусного генома в опухолевых клетках активна и определяет синтез нескольких специфических антигенов, локализующихся на поверхности клеток (специфический трансплантационный антиген) и в ядре (так называемый Т-антиген). В клетках опухолей, индуцированных ДНК-содержащими вирусами (аденовирусы и вирусы группы папова), синтеза полных вирусных частиц обычно не происходит, но такой синтез может быть индуцирован специальными экспериментальными приемами. В клетках лейкозов и опухолей, индуцированных РНК-содержащими вирусами, может иметь место синтез полных вирусных частиц.
Мелкие ДНК-содержащие вирусы. Аденовирусы человека и животных представляют собой ДНК-содержащие вирусы с частицами размером 70—75 ммк. Некоторые типы аденовирусов (типы 12 и 18), выделенные от человека, а также некоторые аденовирусы, выделенные от птиц и обезьян, вызывают опухоли через 1—2 месяца после введения новорожденным сирийским хомячкам и (реже) крысам и мышам. В культуре клеток хомячка эти вирусы вызывают опухолевую трансформацию. Данных об опухолеродной активности этих вирусов для их природных хозяев нет.
Вирусы группы папова — ДНК-содержащие вирусы размером около 45 ммк. К ним относятся вирус полиомы, вирус SV-40 и вирусы папиллом человека, кролика, рогатого скота и других животных.
Вирус полиомы содержится в тканях у большинства лабораторных мышей. В обычных условиях вирус вызывает развитие опухолей лишь в редких случаях, но при введении новорожденным мышам материала из инфицированных тканевых культур, содержащего большие количества вируса, через 4—8 месяцев у животных развиваются самые разнообразные опухоли: рак слюнных желез, рак молочных желез, рак преджелудка, остеогенные саркомы и др. Именно это разнообразие индуцируемых опухолей послужило поводом назвать этот вирус вирусом полиомы.
При введении новорожденным животным других видов вируса полиомы также развиваются опухоли, саркомы почек, подкожной соединительной ткани и других органов у хомячков, саркомы почек у крыс и др. У инфицированных этим вирусом мышей в сыворотке появляются специфические антитела к вирусу. Вирус дает реакцию гемагглютинации с эритроцитами животных разных видов.
При заражении вирусом полиомы эмбриональных культур мыши наблюдается продуктивная вирусная инфекция, завершающаяся формированием в ядре клеток большого числа вирусных частиц и разрушением большинства клеток (цитопатогенный эффект); небольшая доля выживших клеток претерпевает опухолевую трансформацию. При заражении эмбриональных клеток сирийского хомячка продуктивная инфекция не наблюдается, в большинстве клеток отмечается абортивная вирусная инфекция, при которой свойства клеток временно меняются, но через некоторое время возвращаются к норме.
У небольшой части клеток через несколько месяцев происходят включение генома в геном клетки и стойкая трансформация. Вирус SV-40 (или ОВ-40, вакуолизирующий вирус) содержится в латентном состоянии в тканях макаков резусов; данных о патогенности этого вируса для естественного хозяина нет. Вирус размножается в культурах клеток макака резуса, но не вызывает в них видимых изменений. При заражении этим вирусом культур клеток обезьяны другого вида — зеленой мартышки — он вызывает продуктивную инфекцию с выраженным цитопатогенным изменением. В культурах клеток человека, хомячка, мыши вирус вызывает опухолевую трансформацию. При подкожном заражении вирусом новорожденных хомячков на месте введения через 3—4 месяца у большинства животных возникают саркомы.
Вирус папилломы Шоупа вызывает развитие доброкачественных опухолей кожи у кроликов. Папилломы развиваются в месте инокуляции вируса через несколько недель после заражения. Через 9—12 месяцев многие папилломы подвергаются малигнизации и образуется плоскоклеточный рак. Инфекционный вирус удается выделить из папилломы некоторых пород диких кроликов, тогда как из папилломы домашних кроликов такой вирус выделяется не всегда, хотя у больных животных обнаруживаются антитела к вирусу (так называемая маскировка вируса). В ткани раковых опухолей, возникших из папиллом, вирус, как правило, не обнаруживается. В природе вирус Шоупа распространяется контактным путем.
Предполагают также, что роль переносчиков вируса могут играть некоторые клещи. Вирус папилломы Шоупа обладает строгим тропизмом к коже кролика: он не вызывает опухолей других органов кролика, нет данных о его патогенности для животных иных видов. При электронной микроскопии зрелые вирусные частицы обнаруживаются в ядрах ороговевающих клеток папилломы. В пролиферирующих недифференцированных клетках папилломы такие частицы не выявляются. Кроме вируса Шоупа, описан ряд других агентов, вызывающих папилломы: вирус папилломы слизистой оболочки рта кроликов, вирус папилломы слизистой оболочки рта собак, вирус папилломатоза рогатого скота.
РНК-co держащие опухолеродные вирусы (онкорна-вирусы, лейко-вирусы) образуют частицы диаметром 60—80 ммк: внешняя оболочка этих вирусов содержит липиды. Вирусная частица содержит ряд ферментов (так называемые обратные транскриптазы и др.), которые после попадания вируса в клетку могут вызывать биосинтез молекулы ДНК на цепи вирусной РНК. Такая вирусоспецифическая ДНК включается затем в геном клетки, соединяясь с клеточной ДНК. Некоторые вирусы этой группы (вирусы сарком кур, мышей и др.) являются дефектными: они не способны вызвать образование белков, образующих капсулу вирусной частицы. Такие вирусы могут образовывать инфекционные частицы только в том случае, если клетка одновременно инфицирована вирусом-помощником, вызывающим синтез компонентов капсулы: нуклеиновая кислота дефектного вируса одевается затем в оболочку вируса-помощника.
Во многих случаях вирусы существуют у хозяев в латентном состоянии и передаются следующему поколению животных через половые клетки или через молоко при вскармливании (вертикальная передача). Различают несколько групп РНК-содержащих вирусов. Для каждой группы характерны общий группоспецифический антиген и антигены, специфичные для каждого варианта вируса.
а) Группа вирусов лейкозов — саркомы птиц. Сюда входят вирус саркомы мышей и вирусы лейкозов кур, разные штаммы. Вирус саркомы кур Рауса вызывает в короткий срок (от 1 до 3—8 недель) опухоли на месте введения у кур. Некоторые варианты вируса Рауса вызывают саркомы также при введении новорожденным и взрослым млекопитающим (обезьяны, мыши, крысы, морские свинки, хомячки), а также при введении некоторым пресмыкающимся. Лейкозные вирусы вызывают у кур разные варианты лейкоза (миелобластоз, эритробластоз и т. д.).
б) Группа вирусов лейкозов — саркомы мышей. Вирус саркомы (MSV варианты Молони и Харвея) выделен из опухолей мышей и уже через несколько дней вызывает разрастание саркоматозных клеток у мышей, крыс, хомячков. Вирусы лейкозов мышей существуют во многих вариантах, различающихся по своей патогенности: вирус Гросса вызывает лимфатический лейкоз, патогенен лишь для новорожденных мышей. Вирус Молони вызывает также лимфатический лейкоз у новорожденных мышей, но патогенен и для взрослых мышей. Вирус Граффи, выделенный из различных перевиваемых опухолей мышей и крыс, вызывает при заражении новорожденных мышей развитие миелоидного лейкоза или ретикулеза после латентного периода, продолжающегося несколько месяцев; иногда заболевание имеет характер хлорлейкемии. У мышей, зараженных вирусом осповакцины, удалось выделить вариант лейкозного вируса, вызывающий ретикулез и гематоцитобластоз (вирус Мазуренко). Некоторые варианты лейкозных вирусов вызывают лейкоз при заражении не только мышей, по и крыс.
в) Вирусы сарком — лейкозов кошек.
г) Вирус рака молочных желез мышей (вирус Биттнера, фактор молока) содержится в тканях и крови мышей некоторых инбредных линий, отличающихся высокой частотой спонтанных опухолей молочных желез. Обычно вирус передается потомству с молоком самки-кормилицы. В эксперименте удается инфицировать им мышей путем парентерального введения материала, содержащего вирус. Возможна передача вируса самки и затем потомству через сперму самцов. Опухоли возникают при заражении вирусом в течение первых 2 недель жизни мышей. Рак молочных желез развивается после длительного латентного периода (более 6—8 месяцев). Частота опухолей в очень сильной степени зависит от генотипических особенностей инфицированных мышей, а также от их гормонального статуса. Развитию аденокардцином предшествует появление в молочных железах очаговых альвеолярных гиперплазий эпителия.
Крупные ДНК-co держащие вирусы принадлежат к особой группе. Они близки по структуре к вирусам группы оспы. Эти вирусы вызывают преимущественно доброкачественные опухоли или опухолевидные разрастания клеток, которые могут регрессировать. В клетках этих разрастаний обнаруживаются вирусные частицы. К этрй группе относятся вирусы фибромы и миксомы кроликов, а также яба-вирус обезьян.
Все сказанное относилось к опухолеродным вирусам, патогенным для животных. Что касается опухолей человека, то в настоящее время доказана вирусная природа лишь некоторых доброкачественных папиллом кожи (простые бородавки). Имеются косвенные данные о вирусной природе так называемой африканской лимфомы — лимфосаркомы с характерным поражением нижней челюсти, эндемически распространенной в некоторых районах Африки. Все многочисленные попытки доказать вирусную этиологию всех других доброкачественных и злокачественных новообразований человека, а также лейкозов человека пока не дали неоспоримых положительных результатов.
Особые случаи кацерогенеза. Здесь будут кратко рассмотрены некоторые процессы индукции экспериментальных опухолей, которые нельзя связать с действием одного из химических, лучевых или вирусных канцерогенных агентов, упомянутых в предыдущих разделах.
Саркомы, развивающиеся при имплантации инородных тел под кожу, наблюдались в опытах на крысах и на мышах. Опухоли появляются вблизи имплантированного инородного тела после длительного латентного периода (до 12—24 месяцев). Частота и сроки развития опухолей мало зависят от химической природы вводимого инородного тела: развитие сарком наблюдалось после введения самых различных синтетических полимеров (целлофан, полиэтилен, поливинилхлорид и др.), в том числе и совершенно инертных химически, а также после введения пластинок из стекла, слоновой кости, благородных металлов и т. д.
Частота опухолей в большой степени зависит от формы введенного инородного тела: один и тот же полимер может вызывать опухоли у большинства животных при имплантации его в виде неперфорированных пластинок, тогда как перфорированные пластинки того же вещества обычно оказываются менее активными, а порошок этого вещества совсем неактивен. Развитию опухоли предшествует образование вокруг имплантированного инородного тела толстой капсулы из атипичного коллагена.
Саркомы, развивающиеся из ретикулоэндотелиальных клеток, могут быть индуцированы у крыс и мышей путем многократного парентерального введения веществ, накапливающихся в клетках ретикулоэндотелиальной системы, например красителей (трипановый синий и др.) или коллоидных растворов поливинилпирролидона. По-видимому, в генезе этих опухолей имеют значение длительная пролиферация клеток ретикулоэндотелия и нарушение их метаболизма введенным веществом.
Каким должно быть питание при онкологических заболеваниях? Какие продукты абсолютно противопоказаны при той или иной форме рака?
Фитотерапия способна оказать существенную помощь не только в лечении онкологических заболеваний, но также и в их профилактике.
Многих людей, имеющих у себя или у родственников онкологическое заболевание, интересует вопрос: передается ли рак по наследству?
Лечение рака во время беременности является довольно сложным, ведь большинство лекарственных средств обладает токсичностью.
Какие перспективы у беременности после перенесенного онкологического заболевания? Следует ли выдерживать срок после лечения рака?
Профилактика является важной частью общей борьбы с онкологическими заболеваниями. Как же уменьшить вероятность возникновения рака?
Что представляет из себя паллиативное лечение рака? Как оно может повлиять на качество жизни онкологического больного и изменить ее к лучшему?
Учеными разработано достаточно много перспективных методов лечения рака, пока еще не признанных официальной медициной. Но все может измениться!
Как найти силы для борьбы с раком? Как не впасть в отчаяние от возможной инвалидности? Что может послужить надеждой и смыслом жизни?
Бытует такое мнение, что постоянные стрессовые ситуации способны привести к развитию онкологических заболеваний. Так ли это?
Многие онкологические больные часто страдают от резкой потери веса. Чем это вызвано и можно ли как-то справиться с этой проблемой?
Правила ухода за больными, вынужденными постоянно находиться в кровати, имеют свои особенности и их нужно обязательно знать.
В 1908—1911 гг была установлена вирусная природа лейкоза и саркомы кур. В последующие десятилетия была доказана вирусная этиология ряда лимфоидных и эпителиальных опухолей у птиц и млекопитающих. В настоящее время известно, что в естественных условиях, например, лейкоз вызывается вирусами у цыплят, кошек, крупного рогатого скота, мышей, обезьян-гиббонов.
В последние годы открыт первый вирусный возбудитель, вызывающий развитие лейкоза у человека,— это ATLV (adult T-cell leukemia virus — вирус Т-клеточного лейкоза взрослых) Т-клеточный лейкоз взрослых — эндемичное заболевание, встречающееся в двух районах земного шара иа островах Клуши и Шихоку в Японском море и у негритянского населения стран Карибского бассейна. Больные с этой лимфомой встречаются спорадически н в других регионах, но у многих из них выявлена та или иная связь с эндемическими областями.
Заболевание это встречается обычно у людей старше 50 лет, протекает с кожными поражениями, гепатомегалией, спленомегалией, лимфаденопатией и имеет неблагоприятный прогноз Вирус ATLV или HTLV является экзогенным для человека, отличается от других известных ретровирусов животных, передается Т-клеткам горизонтально от матери к ребенку, от мужа к жене (но не наоборот), при лереливании крови, не обнаруживается ни при каких других формах лейкозов или лимфом человека. Таким образом, Т-клеточный лейкоз взрослых — это типичное инфекционное заболевание (вертикальная передача вируса через половые клетки исключена специальными исследованиями). В эндемичных очагах более 20% практически здоровых людей, главным образом родственники больных, являются носителями вируса.
В других частях земного шара антитела к вирусу обнаруживают редко. Считается, что заболевает 1 из 2000 инфицированных людей. Вирус, неотличимый от ATLV, обнаружен в Африке у обезьяи. Помимо лимфомы (лейкоза), указанный вирус может вызывать СПИД, при котором нарушен Т-клеточный иммунитет.
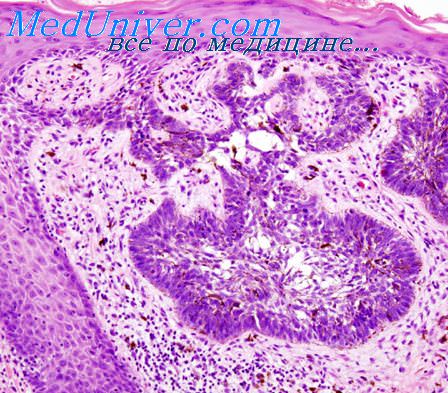
Вирусную этиологию подозревают и по отношению к некоторым другим опухолям человека Вирус Эпстайна — Барр (EBV), входящий в группу вирусов герпеса, является весьма вероятным этиологическим фактором лимфомы Беркитта. В клетках этой лимфомы в эндемических очагах в Африке постоянно обнаруживают ДНК EBV. Однако лимфома Беркитта встречается и за пределами Африки, но ДНК EBV обнаруживается лишь в меньшей части таких случаев. Общим для EBV-положительиых и EBV-отрицательных опухолей являются характерные перестройки хромосом (транслокация между хромосомами 8 и 14), что рассматривают как доказательство единой этиологии этих опухолей.
ДНК этого вируса находят в геноме клеток недифференцированной назофарингеальиой карциномы, но не в опухолях носоглотки другого гистогенеза. У больных с этими опухолями отмечают высокий титр антител к различным компонентам EBV, значительно превышающий эти показатели в популяции — EBV имеет широкое распространение, и антитела к нему обнаруживаются у 80—90% здоровых людей. Высокий титр антител обнаружен у больных лимфогранулематозом. Подавление иммунитета и активация EBV являются, по мнению ряда авторов, основной причиной развития лимфом и иммуиобластных сарком у больных с трансплантированными почками, подвергавшихся действию иммуноделрессивных средств; в пользу этого свидетельствует высокий титр антител к EBV и обнаружение ДНК EBV в геноме опухолевых клеток.
Существуют данные, позволяющие предполагать инфекционную (вирусную) этиологию рака шейки матки частота возникновения этого рака выше при раннем начале половой жизни с частой сменой партнеров, повышена она у вторых жен мужчин, первые жены которых также страдали тем же заболеванием. На основании сероэпидемиологических данных думают о роли вируса герпеса II типа как инициатора; подозревают также вирус кондилом.
В районах с высокой частотой возникновения вирусного гепатита В повышена также и заболеваемость гепатоцеллюлярным раком. С другой стороны, больные с этой опухолью чаще дают серопозитивную реакцию на вирус гепатита В, чем здоровые индивидуумы; но есть и серонегативные случаи рака. Получены линии опухолевых клеток, содержащие ДНК вируса и продуцирующие его антиген. В целом роль вируса гепатита В в индукции гепатоцеллюляриого рака остается невыясненной.
Из бородавок человека (verrucae vulgaris) выделено несколько типов вирусов папиллом, которые, как считают, вызывают лишь доброкачественные опухоли, не склонные к озлокачествлению. Лишь один из этих вирусов (5-го типа) выделен из папиллом, развивающихся при наследственной бородавчатой эпидермодисплазии и имеющих тенденцию к малигнизации.
Онкогены ныне идентифицированы, определена их химическая структура, локализация в хромосомах. Идентифицированы также белки — продукты деятельности этих генов, каждый из них синтезирует свой специфический белок.
Одна из причин возникновения злокачественной опухоли. Вирусы вызывают рак: до 15% всех злокачественных опухолей формируются при непосредственном участии микробной инфекции.
Вирусная инфекция провоцирует возникновение опухоли
Вирусы вызывают рак
Один из важных факторов для злокачественного перерождения в тканях. Да, вирусы вызывают рак, но – только опухоли определенных локализаций. Пока к абсолютным канцерогенам относятся всего лишь 7 вирусов:
- EBV (вирус Эпштейн-Барр или герпес-вирус 4 типа);
- HPV (онкогенные виды папилломавируса);
- HBV, HCV (вирусы хронического гепатита);
- KSHV (герпетический вирус 8 типа);
- HTLV 1 (вирус клеточного лейкоза 1 типа);
- MCPV (полиомавирус 5-го типа).
Не только вирусы вызывают рак: из бактериальной инфекции к онкогенным микробам относится Хеликобактер Пилори, который провоцирует появление раковой опухоли в желудке.
Вирусный канцерогенез: какие виды опухолей возникают?
Больше всех проблем создает вирус папилломы человека (ВПЧ), который является причиной для возникновения следующих видов опухолей:
- Рак шейки матки;
- Вульвовагинальная карцинома;
- Рак полового члена;
- Опухоль прямой кишки;
- Злокачественные новообразования ротоглотки.
Как правило, ВПЧ передается при контакте и половым путем, длительное время может никак не проявляться. При снижении иммунной защиты повышается активность папилломавируса, который вызывает воспаление и онкогенные мутации в клетках.
Вирусные гепатиты создают условия для рака печени. Вирус Эпштейна-Барр является основным провоцирующим фактором для некоторых видов лимфом. Полиомавирус вызывает карциному Меркеля (кожная опухоль). Герпес-вирус 8 типа может стать причиной саркомы и новообразований в лимфатической системе. HTLV 1 – это лейкозы и лимфомы.
Как вирусы это делают?
Вирусный канцерогенез происходит медленно и поэтапно. Выделяют 2 варианта негативного воздействия на здоровые клеточные структуры:
- Прямое (вирус проникает внутрь клетки и вызывает мутации, запускающие злокачественное перерождение);
- Непрямое или опосредованное (многолетнее по длительности хроническое бессимптомное воспаление приводит к снижению иммунной защиты, создающее условия для выживания раковых клеток).
Скрытно протекающая инфекция на протяжении нескольких лет и/или десятилетий становится основой для клеточной атипии: появившиеся первые раковые клетки без особых сложностей преодолевают иммунный барьер и – начинается рост карциномы.
Вирус-ассоциированные опухоли: как предотвратить?
HPV 16 и 18 типа – это самые значимые факторы формирования цервикального рака (в 100% случаев при гистологическом исследовании тканей карциномы выявляются вирусные частицы в опухоли, в 88% – при анальном раке). Оптимальная мера защиты – вакцинация (всем детям и подросткам от 9 до 16 лет надо поставить прививку от ВПЧ), но пока эта профилактическая мера широко не распространена (государство и Минздрав ничего не делает для введения этой прививки в стандартный график, родители не знают о том, что это надо сделать).
Вирусы гепатита и HTLV 1 чаще всего попадают в организм человека при половых контактах и инъекциях (нужен непосредственный контакт с зараженным биологическим материалом).
Герпетическая вирусная инфекция (EVB, KSHV) и полиомавирус есть почти у всех, поэтому важно поддерживать нормальное состояние иммунной системы, чтобы не создавать условий для злокачественных новообразований: вирусы вызывают рак у людей с выраженным иммунодефицитом.
Вирус-ассоциированные опухоли – это значимая группа злокачественных новообразований, возникновение которых можно и нужно предотвращать с помощью стандартных мер профилактики.
В.А. Матусевич, И.В. Стукалова
Рак – бич человечества. По смертности он занимает второе место после сердечно-сосудистых заболеваний, по страху, который внушает людям – первое. Тысячи исследователей стремятся понять его причины, найти пути к его профилактике и лечению. Десятки институтов и сотни лабораторий во всем мире работают над этой проблемой, пытаясь достичь успеха в ее понимании и прогресса в профилактике и лечении этого заболевания.
Современной науке известны некоторые факторы, вызывающие развитие злокачественных опухолей и, вместе с тем, ученые вынуждены констатировать, что основная часть злокачественных опухолей возникает спонтанно, то есть без видимой связи с индуцирующими агентами. К факторам, способным вызывать развитие опухоли, относятся: различные канцерогенные вещества, наследственная предрасположенность, ионизирующее излучение и опухолеродные вирусы.
Вирусно-генетическая теория возникновения опухолей, предложенная еще в 40-х годах ХХ века Л.И. Зильбером, получила за прошедшие годы многочисленные подтверждения. В настоящее время, очевидно, что хотя вирусы и не являются единственной причиной рака, но они играют большую роль в возникновении злокачественных заболеваний как у человека, так и у животных. Характерной особенностью опухолевых заболеваний, ассоциированных с вирусами, является длительный латентный период, от момента инфекции до проявления заболевания могут пройти годы и даже десятилетия.
Согласно современным данным, этиологическими агентами около 15% опухолевых новообразований человека являются вирусы. К таким вирусам относятся: вирус Т-клеточного лейкоза/лимфомы (human T-leukemia/lymphoma virus), вирус иммунодефицита человека (ВИЧ), вирус папилломы человека (ВПЧ), вирусы гепатита В и С, вирус Эпштейна-Барр (ВЭБ) и другие. Важно отметить, что некоторые вирусы ассоциированы с опухолями только одной локализации, тогда как другие — с разными злокачественными новообразованиями, что, вероятно, обусловлено тропизмом вирусов к клеточным системам определенного типа.
Вирус Т-клеточного лейкоза/лимфомы (HTLV-1). HTLV-1 – это онкогенный вирус, способный вызывать Т-клеточный лейкоз/лимфому у взрослых, а также тропический спастический парапарез и ряд других неонкологических заболеваний.
Существуют 3 основных пути передачи инфекции от инфицированных лиц:
- с молоком матери;
- при половом контакте;
- с переливаемой кровью при гемотрансфузиях.
Вирусы гепатита В и С (Hepatitis B virus и Hepatitis C virus, HBV/HCV). В настоящее время доказано, что из общего числа зарегистрированных случаев рака печени, возникновение более половины связано с инфицированием гепатитом В, четверть – с инфицированием гепатитом С и в 22% случаев причина другая. Смертность от рака печени на планете среди всех смертностей от онкологических заболеваний занимает 3-е место после смертности от рака легкого и желудка. При этом каждая пятая диагностируемая в мире опухоль – это рак печени.
Основными методами диагностики вирусов гепатита В и С являются методы иммуноферментного анализа и полимеразной цепной реакции.
Вирус папилломы человека (ВПЧ, human papilloma virus). В середине 70-х гг. прошлого века было высказано предположение, что вирус папилломы человека является этиологическим агентом рака шейки матки, и эта область онкологии и вирусологии получила стремительное развитие. Действительно, к настоящему моменту роль ВПЧ в развитии рака шейки матки не вызывает сомнений. Многочисленные исследования доказали, что не менее 95% злокачественных опухолей шейки матки содержат разновидности ВПЧ, принадлежащие к так называемым типам "высокого онкогенного риска" (ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типов). Среди них максимальной онкогенной активностью обладают ВПЧ 16 и 18 типов. Действительно, ВПЧ достаточно часто (примерно в 30% случаев) выявляется у абсолютно здоровых женщин. Однако не у всех женщин, зараженных вирусом папилломы человека, возникает дисплазия шейки матки и рак шейки матки. Примерно у 80% женщин иммунная система организма в течение 2 лет после инфицирования сама избавляется от вируса. Таким образом, носительство этих вирусов свидетельствует не о злокачественном процессе как таковом, а о многократно повышенном риске его возникновения.
Диагностика ВПЧ-инфекции обладает очень высокой клинической значимостью. Она позволяет выявить тех пациенток, для которых жизненно необходимы активные, комплексные меры, направленные на профилактику и раннюю диагностику рака шейки матки. Самым надежным диагностическим тестом по выявлению всех 12 онкогенных типов вируса папилломы человека в настоящее время является метод полимеразной цепной реакции в режиме реального времени.
Вирус Эпштейна-Барр (ВЭБ). Известен широкий спектр патологических состояний, представленный опухолями лимфоидного и эпителиального происхождения, в возникновении которых ВЭБ принимает непосредственное участие. Доказано, что этот вирус причастен к возникновению не только лимфомы Беркитта, но и ряда других злокачественных и доброкачественных новообразований, таких, как рак носоглотки, лимфома Ходжкина, инфекционный мононуклеоз и многие другие.
Согласно некоторым исследованиям, ВЭБ широко циркулирует среди населения, о чем свидетельствует высокий процент людей, имеющих в крови антитела к ВЭБ - 50% детей и 85% взрослых. Но поскольку инфекция, как правило, протекает бессимптомно, сложилось ошибочное мнение о невысокой заболеваемости ВЭБ-инфекцией.
Вирус герпеса человека 8 типа (HHV-8). В настоящее время считается доказанной его роль в возникновении саркомы Капоши, выпотной лимфомы полостей тела и болезни Кастельмана. В геноме HHV-8 содержится ряд генов, продукты которых играют важную роль в регуляции размножения и жизнеспособности клеток; повышение их активности приводит к возникновению опухоли.
Следует понимать, что HHV-8 является всего лишь фактором риска развития вышеуказанных заболеваний. Если человек инфицирован HHV-8, то это не означает, что у него обязательно разовьётся саркома Капоши или лимфома.
Сам по себе вирус герпеса 8 типа опасности для здорового человека практически не представляет. Большинство людей с нормальным иммунитетом, инфицированных этим вирусом, не отмечают каких-либо проявлений, и он не оказывает на них никакого вредного влияния.
Свое негативное действие HHV-8 может проявить только в случае стойкого снижения иммунитета (иммунодепрессии), и то лишь у больных СПИДом (зараженных вирусом ВИЧ) или при длительном лечении, снижающем иммунитет (после пересадки органов и тканей, лучевой терапии). По данным статистики у 45% людей, имеющих HHV-8 и ВИЧ в течение 10 лет развилась саркома Капоши. У людей с нормальным иммунитетом вирус герпеса человека никак себя не проявляет. Он не влияет на состояние здоровья.
Вирус иммунодефицита человека (ВИЧ). ВИЧ может создавать необходимые условия (иммунодефицит) для возникновения рака. Этот вирус был открыт в 1983 г. и его ассоциация с синдромом приобретенного иммунодефицита (СПИД) доказана в 1984 г. Инфицированные им клетки не подвергаются усиленному делению, а разрушаются, вызывая у инфицированного лица нарастающую степень иммунодефицита, и создавая тем самым состояние, при котором организм не в силах противостоять развитию опухоли. Доказано, что у больных СПИДом примерно 50% новообразований, ассоциировано с вирусом Эпштейна-Барр или герпесвирусом человека 8-го типа. Чаще всего у таких больных диагностируют саркому Капоши либо одну из разновидностей неходжкинских лимфом.
Таким образом, несмотря на различную организацию онкогенных вирусов человека они обладают рядом общих биологических свойств, а именно:
- вирусы лишь инициируют патологический процесс, усиливая процессы деления клеток и генетическую нестабильность инфицированных ими клеток;
- у инфицированных онкогенными вирусами лиц возникновение опухоли, как правило, событие нечастое: один случай новообразования возникает среди сотен, иногда тысяч инфицированных;
- от момента инфицирования до возникновения опухоли имеет место продолжительный латентный период, длящийся годами, иногда десятилетиями;
- у большинства инфицированных лиц возникновение опухоли не является обязательным, но они могут составить группу риска, с более высокой вероятностью ее возникновения;
- для злокачественной трансформации инфицированных клеток необходимы дополнительные факторы и условия, приводящие к прогрессированию наиболее агрессивного опухолевого клона.
Такими дополнительными факторами, играющими роль сопутствующих канцерогенов, могут быть: злоупотребление алкоголем, табакокурение, коинфекция генитальным герпесом, малярия, нитрозамины в продуктах питания, пестициды.
На сегодняшний день основными методами лабораторной диагностики являются метод иммуноферментного анализа (ИФА) и метод полимеразной цепной реакции (ПЦР). Первый позволяет выявить белок вируса либо антитела к нему, которые выделяет организм в ответ на инфицирование. При помощи метода ПЦР мы можем выявить генетический материал самого вируса.
Метод иммуноферментного анализа является стандартным методом лабораторной диагностики.
Следует также отметить, что не всегда возможно определение вирусных белков в плазме крови. В таких случаях методом ИФА можно диагностировать только наличие антител в плазме крови пациента. Однако, важно помнить, что антитела могут вырабатываться в довольно длительный срок. Так, например, при инфицировании ВИЧ антитела вырабатываются в течение 6 месяцев, в случае гепатита С этот период может длиться до года, а антитела к вирусу Эпштейна-Барр (иммуноглобулины класса G) присутствуют у большого количества практически здоровых людей и их диагностика обладает низкой прогностической значимостью.
Полимеразная цепная реакция (ПЦР) — метод молекулярной биологии, позволяющий обнаружить возбудителя заболевания на основе его генетической информации.
ПЦР диагностика дает возможность существенно ускорить и облегчить диагностику различных заболеваний, в частности, вирусов гепатита В, С, D, цитомегаловирусной инфекции, вируса Эпштейна-Барр, вируса простого герпеса, а также хламидиоза, микоплазмоза, уреаплазмоза и т.п. При помощи данного метода вирусные инфекции можно обнаружить уже через 5–7 дней после заражения, за недели или месяцы до того, как появятся антитела или первые симптомы. Метод ПЦР позволяет выявить даже единичные клетки возбудителя, благодаря многократному увеличению последовательностей ДНК.
Полимеразная цепная реакция - это один из самых точных методов лабораторной диагностики. Его чувствительность составляет 95–99%, а специфичность достигает 100%.
Таким образом, достижения науки в области онкологии внесли определенную ясность в понимание механизмов возникновения некоторых злокачественных новообразований и все же большую часть из них не удается увязать с инфицированностью тем или иным вирусом, что создает большое поле деятельности современным онкологам в направлении дальнейшего изучения механизмов развития онкологических заболеваний.
Все вышеуказанные методы диагностики существуют у нас в РНПЦ онкологии и медицинской онкологии им. Н.Н.Александрова. В лаборатории клинической молекулярной генетики и иммунологических методов диагностики можно пройти обследование на вирусы герпеса,цитомегаловируса, Эпштена-Барра, вирусы гепатита В и С, а также пройти обследование на инфицирование вирусом папилломы человека, данные исследования может пройти любой человек обратившийся в центр.
Читайте также:

