Избыток алюминия с хлором
Рассчитайте массу хлорида алюминия, образующегося при взаимодействии избытка алюминия с 2,24 л (н.у.) хлора.
Запишем уравнение реакции алюминия с хлором:
2Al+3Cl2=2AlCl3
Рассчитаем количество вещества с хлором, разделив объём газа на молярный объём:
2.24/22.4=0.1 моль
Рассчитаем количество вещества хлорида алюминия, используя данные из уравнения реакции. Для этого необходимо количество вещества умножить на молярную массу:
0.1*(2/3)*133.5=9 грамм
![]()
![]()

![]()
![]()
![]()
![]()


Добавил Anton , просмотры: ☺ 14867 ⌚ 19.10.2015. химия 10-11 класс
![]()
![]()
Вычитаем из первого уравнения второе:
Подставляем y=x в любое уравнение данной системы:
При [b]a=-3[/b] уравнение принимает вид: -6х-3=0 ⇒ [b] x=-1/2 [/b] - [b]одно[/b] решение [b]y=x=-1/2[/b]
Если D=0 квадратное уравнение имеет один корень
D=0 ⇒ -12a=0 ⇒ [b]a=0[/b]
[b]При а=0[/b] cистема принимает вид:
Cистема имеет одно решение [b]x=0; y=0[/b]
подставим в первое уравнение:
![]()
![]()
Если выплаты 2030 и 2031 года равные, то
A=338 000/2=169 000,
уравнение принимает вид:
169 000+1,3·(1,3S–169 000)=338 000 ⇒
Cумма выплат: 0,3S+0,3S+0,3S+338 000= 0,9·230 000+338 000=
![]()
Пусть сумма кредита равна S руб.
В январе 2021 года начислены проценты: 0,35*S руб.
Сумма долга составила S + 0,35S=1,35*S руб
Пусть ежегодные [i] равные[/i] выплаты равны А руб.
[b](1,35*S- A )[/b] руб. -[i] остаток[/i] на конец первого года
В январе 2022 года начислены проценты [i]на остаток[/i]:
0,35*(1,35*S-А) руб.
Сумма долга составила (1,35*S- A )+0,35*(1,35*S-А)=
[b]1,35*(1,35*S-А) руб[/b]
(1,35*(1,35*S- A ) - А ) =(1,35^2*S-1,35*A-A) руб.- остаток на конец второго года
Аналогично получаем:
1,35*(1,35^2*S-1,35*A-A) -А= (1,35^3*S-1,35^2*A-1,35*A-A) руб. - остаток на конец третьего года, который по условию равен 0 ( кредит выплачен)
Условие "общая сумма выплат на 78 030 рублей больше суммы, взятой в кредит" позволяет составить второе уравнение:
Решаем систему двух уравнений с двумя неизвестными S и А:
\left\ <\begin
Удобнее считать в обычных дробях:
Решаем первое уравнение:
S\cdot 25669=1669\cdot 60\cdot 26010
[b]Для случая 30% :[/b]
Решаем систему двух уравнений с двумя неизвестными S и А:
\left\ <\begin
Решаем первое уравнение:
2,197\cdot S-3,99\cdot\frac<3>=3,99\cdot 26010
Извлеченный из ванн алюминий содержит металлические, неметаллические и газообразные примеси. Металлические примеси (железо, кремний, натрий, калий, титан, магний) переходят в алюминий из сырья или попадают в него в результате небрежного обслуживания электролизных ванн (железо, медь, кремний и др.). Неметаллические примеси обычно увлекаются из ванны при выливке алюминия или попадают в него из футеровки ковша (глинозем, электролит, карбид алюминия, частички угля и др.).
Водород попадает в алюминий при электролизе, а также из футеровки ковша и другого разливочного оборудования.
Все эти примеси значительно влияют на механические и литейные свойства металла, а также снижают его электропроводность и коррозионную стойкость.
Согласно ГОСТ 11069—74, металлический алюминий может быть отнесен к одной из указанных в табл. марок.
Алюминий технической чистоты получают либо электролитическим методом, либо переплавкой вторичного металла (обычно низших марок). Перед разливкой в чушки этот металл подвергают несложной очистке переплавкой и хлорированием, для получения металла пяти высших марок требуется дополнительное рафинирование. Алюминий особой чистоты можно получить путем последовательного применения нескольких способов рафинирования.
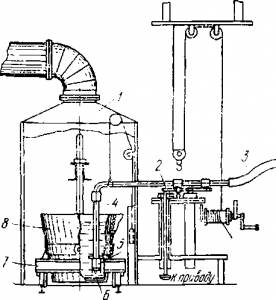
Рафинирование алюминия хлором, применяют в настоящее время не на всех заводах. Процесс ведут непосредственно в ковшах, доставляемых из цеха электролиза. Установка для хлорирования показана на рис. Ковш с металлом ставят под специальный колпак. Через окно в колпаке в ковш вводят трубку, соединенную с баллонами, содержащими хлор. Хлорирование 1 т металла ведут при перемешивании в течение 10—15 мин.
Рис. Установка для хлорирования алюминия в ковше:
1 — камера для хлорирования; 2 — столик с механизмом для вращения; 3 — резиновый шланг; 4 —труба для хлора; 5 —барботер; 5 — отверстия для хлора; 7 —вагонетка; 8 — ковш
Две голубые полосы
Одна белая полоса
Три белые полосы-
Две белые полосы
Одна красная полоса
Одна желтая полоса
Для предохранения обслуживающего персонала от вредного действия хлора, согласно правилам техники безопасности, баллоны с хлором держат снаружи цеха в отдельном помещении. Газы, выделяемые при хлорировании, удаляются из-под колпака вентиляционной установкой. Хлорирование ведут при 720—750° С. Через графитовую или кварцевую трубку с барботером хлор равномерно распределяется по ковшу и энергично реагирует с некоторой частью алюминия, образуя хлористый алюминий. Пары хлористого алюминия (температура кипения 180° С) флотируют взвешенные в металле неметаллические примеси. Кроме того, хлорируется водород, растворенный в алюминии, и некоторые металлические примеси.
Исследования и термодинамические расчеты показывают, что при 700—1000° С могут образовать хлориды в присутствии больших количеств алюминия только кальций, натрий (калий) и магний. Всплывающие на поверхность металла примеси представляют собой серый рыхлый порошок, который снимают дырчатыми ложками.
Электролизный алюминий, предназначенный для разливки в чушки, переплавляется в отражательных электрических печах сопротивления типа САН (печи сопротивления алюминиевые наклоняющиеся). Эти печи (рис.) одеты в металлический кожух, имеющий в нижней части форму полуцилиндра. Печи установлены на четырех опорах и имеют механизм для плавного наклона. Рабочее пространство печи состоит из двух форкамер и сборной ванны. Внутри печь выложена шамотным огнеупорным кирпичом. В своде печи располагаются нихромовые спирали. В продольной стороне печи помещена летка, через которую выливается металл при наклоне печи, осуществляемом с помощью гидравлического домкрата. Выпускают печи типа САН, вмещающие от 800 кг до 25 т алюминия.
Назначение переплавки: а) дополнительно очистить металл от неметаллических примесей и газов путем спокойного длительного отстаивания при необходимой температуре; б) получить путем смешения алюминия из различных ванн большую партию однородного по качеству металла нужной марки.
Статья на тему Рафинирование алюминия хлором
Реакция взаимодействия алюминия с хлором.










Уравнение реакции взаимодействия алюминия с хлором:
Алюминий взаимодействует с хлором. Реакция взаимодействия алюминия с хлором представляет собой сгорание порошка алюминия в атмосфере хлора.
Реакция алюминия с хлором протекает при обычных условиях.
В результате реакции происходит образование хлорида алюминия .
В ходе реакции алюминия с хлором при стандартных условиях выделяется тепловая энергия (теплота) 1408,4 кДж .
Термохимическое уравнение этой реакции имеет следующий вид:
2Al + 3Cl2 → 2AlCl3 + 1408,4 кДж; ΔH = -704,2 кДж/моль.
Таким образом, реакция алюминия с хлором носит экзотермический характер.










- ← Реакция цинка с водой
- Реакция калия и хлора →
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (105 879)
- Экономика Второй индустриализации России (101 437)
- Программа искусственного интеллекта ЭЛИС (22 597)
- Метан, получение, свойства, химические реакции (15 871)
- Мотор-колесо Дуюнова (15 082)
- Гидротаран – самодействующий энергонезависимый водяной насос (14 437)
- Природный газ, свойства, химический состав, добыча и применение (13 907)
- Крахмал, свойства, получение и применение (13 489)
- Прямоугольный треугольник, свойства, признаки и формулы (13 040)
- Целлюлоза, свойства, получение и применение (11 891)
- Пропилен (пропен), получение, свойства, химические реакции (11 632)
- Этилен (этен), получение, свойства, химические реакции (11 145)
- Бутан, получение, свойства, химические реакции (9 829)
- Оксид алюминия, свойства, получение, химические реакции (9 353)
- Оксид железа (III), свойства, получение, химические реакции (9 129)
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.

Бинарные соединения алюминия
Алюминий расположены в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 
2s 
2p 
3s 
3p 
Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 
2s 
2p 
3s 
3p 
Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.

Температура плавления 660 о С, температура кипения 1450 о С, плотность алюминия 2,7 г/см 3 .
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Бокситы Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3) — гидрат оксида алюминия

Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.

Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → 4Al + 3KCl
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами . При этом образуется белый аморфный осадок гидроксида алюминия.
Например , хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl

При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Обратите внимание , если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
1. Алюминий – сильный восстановитель . Поэтому он реагирует со многими неметаллами .
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al +N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки . А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , алюминий бурно реагирует с соляной кислотой :
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами . При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑

Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → NaAlO2 + 3H2↑ + Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов . Процесс восстановления металлов из оксидов называется алюмотермия .
Например , алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3
Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
Алюминий – ценный промышленный металл, который подвергается вторичной переработке. Узнать подробнее о приеме алюминия на переработку, а также об актуальных ценах на данный вид металла можно здесь.
Оксид алюминия можно получить различными методами :
1. Горением алюминия на воздухе:
2. Разложением гидроксида алюминия при нагревании :
3. Оксид алюминия можно получить разложением нитрата алюминия :
Оксид алюминия — типичный амфотерный оксид . Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида алюминия с основными оксидами образуются соли-алюминаты.
Например , оксид алюминия взаимодействует с оксидом натрия:
2. Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом оксид алюминия проявляет кислотные свойства.
Например , оксид алюминия взаимодействует с гидроксидом натрия в расплаве с образованием алюмината натрия и воды:
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействует с кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Например , оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
5. Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей.
Например , оксид алюминия реагирует с серной кислотой:
6. Оксид алюминия проявляет слабые окислительные свойства .
Например , оксид алюминия реагирует с гидридом кальция с образованием алюминия, водорода и оксида кальция:
Электрический ток восстанавливает алюминий из оксида (производство алюминия):
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия:
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например , хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например , хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
1. Гидроксид алюминия реагирует с растворимыми кислотами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например , гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом гидроксид алюминия проявляет кислотные свойства.
Например , гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
4. Г идроксид алюминия разлагается при нагревании :
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
Нитрат алюминия при нагревании разлагается на оксид алюминия, оксид азота (IV) и кислород:
Сульфат алюминия при сильном нагревании разлагается аналогично — на оксид алюминия, сернистый газ и кислород:
Для описания свойств комплексных солей алюминия — гидроксоалюминатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоалюминат на две отдельные молекулы — гидроксид алюминия и гидроксид щелочного металла.
Например , тетрагидроксоалюминат натрия разбиваем на гидроксид алюминия и гидроксид натрия:
Na[Al(OH)4] разбиваем на NaOH и Al(OH)3
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы алюминия реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид алюминия не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоалюминат калия реагирует с углекислым газом:
По такому же принципу тетрагидроксоалюминаты реагирует с сернистым газом SO2:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид алюминия реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида алюминия кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид алюминия:
Комплекс разрушается при взаимодействии с хлорной водой (водным раствором хлора) Cl2:
2Na[Al(OH)4] + Cl2 → 2Al(OH)3↓ + NaCl + NaClO
При этом хлор диспропорционирует.
Также комплекс может прореагировать с избытком хлорида алюминия. При этом выпадает осадок гидроксида алюминия:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-алюминат:
Растворимые соли алюминия и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Al 3+ + H2O = AlOH 2+ + H +
II ступень: AlOH 2+ + H2O = Al(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты алюминия и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Более подробно про гидролиз можно прочитать в соответствующей статье.
Соли, в которых алюминий является кислотным остатком (алюминаты) — образуются из оксида алюминия при сплавлении с щелочами и основными оксидами:
Для понимания свойств алюминатов их также очень удобно разбить на два отдельных вещества.
Например, алюминат натрия мы разделим мысленно на два вещества: оксид алюминия и оксид натрия.
NaAlO2 разбиваем на Na2O и Al2O3
Тогда нам станет очевидно, что алюминаты реагируют с кислотами с образованием солей алюминия :
KAlO2 + 4HCl → KCl + AlCl3 + 2H2O
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O
Под действием избытка воды алюминаты переходят в комплексные соли:
Сульфид алюминия под действием азотной кислоты окисляется до сульфата:
либо до серной кислоты (под действием горячей концентрированной кислоты):
Сульфид алюминия разлагается водой:
Карбид алюминия также разлагается водой при нагревании на гидроксид алюминия и метан:
Нитрид алюминия разлагается под действием минеральных кислот на соли алюминия и аммония:
AlN + 4HCl → AlCl3 + NH4Cl
Также нитрид алюминия разлагается под действием воды:
Этот сайт использует Akismet для борьбы со спамом. Узнайте как обрабатываются ваши данные комментариев.
Читайте также:

