Инвазия рака в миометрий
Страница 1 из 4
Новообразования эндометрия с признаками глубокой инвазии миометрия.
Добрый день, Алексей Михайлович!
О себе: 57 лет, инвалид 1-й группы (миопатия тазово-плечевая форма). Чувствую себя хорошо, только не ходят ноги уже 7 лет, а инвалидность дали в 97 году, раньше ходила, даже работала.
Минопауза наступила в 52-53 года, год назад начались кровянистые выделения. Заключение УЗИ: Постменопауза, интрамурально-субсерозная миома тела матки с центрипетальным ростом с дистрофическими изменениями в узле. ПГЭ.
07.06.17 года сделали диагностическое выскабливание, результат: слизь, кровь.
Выскабливание сделали с большим трудом. Первый день дали внутривенный наркоз, но врач не могла открыть матку. На следующий день делала заведующая. также сказала, что очень трудный доступ, цирк. канал очень сомкнут и что получилось - то получилось. Выписали без назначения лечения.
Через 2 месяца опять закровило. Позвонила заведующей, сказала: терпи, может пройдет. Терпела пока кровь не пошла как месячные и пока не поднялся СА-125 и стал колебаться от 60 до 100.
07.02.18г. опять сделали диагностическое выскабливание, результат: Кровь, слизь, слущенный зрелый многослойный плоский эпителий.
Заведующая сказала, что опять кое-как сделала выскабливание, гистероскопия не получилась. По УЗИ: Миома матки небольших размеров. Выписала домой без лечения со словами: живите так. если будет кровотечение, пейте кровоостанавливающие препараты. и помните про свое основное заболевание.
Долго жить так не смогла и 13.04.18 сделала МРТ.
Описание:
Матка в положении fnteversio, anteflexio, размеры (без шейки): длинник - 7,2см, поперечник - 9,1см, передне-задний - 6,0см, полость матки деформирована.
Эндометрий по передней стенке и в дне трансформирован в новообразование (низкий сигнал на картах ИКД, раннее накопление контрастного препарат) размером - поперечный--3,3см, передне-задний - 2,5см, кранио-каудальный-1,3см, при констатировании - глубокая инвазия миометрия (более 1/2 его толщины), наиболее по передней стенке, без распространения на серозный слой. Расстояние от края образования до внутреннего зева - 1,0см.
В наружном миометрии регистрируются лейомиомы с гиалиновым типом дегенерации:
- в области правого трубного угла субсерозные узлы (количеством 2), размером 3,7 и 5,8см, деформируют полость и наружный контур матки;
- по левому ребру субсерозный узел размером 2,5см
Шейка матки не увеличена, стенки не утолщены, зональное строение сохранено. Эндоцерквикс не утолщен.
Яичники локализуются типично, размерами до 2,0см, представлены стромой.
Маточные трубы не расширены.
Стенки влагалища без особенностей.
Мочевой пузырь достаточного наполнения, стенки не утолщены. Тазовые сегменты мочеточников не расширены.
Тазовые лимфатические узлы не увеличены.
Кости таза и прямая кишка не изменены. В стенке сигмовидной кишки многочисленные дивертикулы без признаков дивертикулита.
ЗАКЛЮЧЕНИЕ: МР- признаки:
- новообразования эндометрия с признаками глубокой инвазии миометрия;
- лейомаим матки;
- дивертикулов сигмовидной кишки.
Рекомендована консультация онколога.
Как я поняла, это новообразование и есть рак эндометрия.
Онколог назначила сделать биопсию эндометрия либо гистол. выскабливание, либо гистероскопию. Заведующая в больнице от меня отказалась, в частных клиниках тоже отказывают, ссылаясь на мою инвалидность. Онкологам нужны стекла с раком. Я в тупике.
Вопросы Алексею Михайловичу:
1. По описанию МРТ рак какой стадии на ваш взгляд?
2. Если каким -либо способом удастся сделать биопсию информативно, либо нет, после нарушения новообразования, я так понимаю, что раковые клетки начнут делиться быстрее и при выскабливании могут попасть в шейку и влагалище, то есть растрясутся по всей матке и не только. А операцию вдруг онкологи откажутся делать по моему основному заболеванию, либо из-за неинформативности биопсии, то это быстрая смерть? Может вообще тогда не трогать опухоль, а искать альтернативные методы и хотя бы протянуть какое-то время на этом свете? Как вы думаете?
3. И вообще, какой может быть выход в моей ситуации? Были ли у нас в практике инвалиды и ситуации, подобные моей?
Здравствуйте.
1. По МРТ- описанию процесс укладывается в 1b стадию.
2. Биопсия никак не повлияет на рост опухоли.
3. Наиболее оптимальный вариант лечения - операция. И если нет абсолютных противопоказаний к ее выполнению, то стоит решать вопрос о ее выполнении.
По мнению М.А. Чекаловой и соавт., поскольку преобладающее большинство женщин с диагнозом рака эндометрия страдают ожирением, трансабдоминальное ультразвуковое исследование внутренних половых органов у них малоинформативно. Применение трансвагинальной эхографии у данного контингента наиболее целесообразно. В. Coleman и соавт. считают, что при трансабдоминальном доступе у женщин в периоде постменопаузы визуализация М-эхо возможна только в 27% случаев, тогда как при трансвагинальном — в 100%.
Эхографическое исследование при раке эндометрия имеет целью оценку размеров первичной опухоли, ее формы, структуры, локализации, глубины инвазии в миометрий, определение распространенности процесса на шейку и яичники, а также выявление региональных и отдаленных метастазов.
Толщина М-эхо
При диагностике рака эндометрия многие авторы сейчас уделяют особое внимание толщине М-эхо матки. При определении этого параметра следует строго соблюдать следующие правила.
1. Измерять толщину М-эхо при продольном сканировании матки с одновременной визуализацией цервикального канала.
2. Толщиной эндометрия считать максимальное значение переднезаднего размера М-эхо (два слоя эндометрия).
3. Измерение проводить по наружным контурам М-эхо перпендикулярно продольной оси матки.
Несмотря на определенные различия, толщина М-эхо матки при раке эндометрия составляет в среднем около 20 мм. У 90% пациенток толщина эндометрия при карциноме превышает 10 мм.
В то же время, согласно результатам проведенных исследований, толщина М-эхо при атрофии эндометрия у пациенток с постменопаузальным кровотечением достоверно меньше.
По мнению большинства авторов, наиболее ценным эхографическим показателем при раке эндометрия является величина переднезаднего размера М-эхо более 8 мм. D. Dordoni и соавт., F. Aleem и соавт., С. Exacoustos и соавт. при толщине М-эхо менее 8 мм ни у одной из пациенток с кровотечением в постменопаузе не констатировали рака эндометрия при гистологическом исследовании.
Однако есть сообщения об обнаружении карциномы при толщине М-эхо менее 8 мм. Так, согласно полученным группой немецких исследователей результатам ультразвукового обследования 159 пациенток в постменопаузальном периоде, включая 62 женщин с карциномой эндометрия, при толщине М-эхо матки до 5 мм карцинома имелась в 1 (3%) случае, 6—10 мм — в 10 (31%), 11-15 мм - в 14 (43%) и более 15 мм — в 37 (67%) наблюдениях.
В мультицентровом исследовании, осуществленном в 18 клиниках Италии и охватившем 930 пациенток с кровянистыми выделениями из половых путей в постменопаузальном периоде, рак эндометрия диагностирован у 107 женщин. Его частота при толщине эндометрия до 4 мм составила 0,6%, 5—8 мм — 5,4%, 9—11 мм - 12,5%, более 11 мм - 33,5%.
Суммированные нами ранее данные литературы свидетельствуют о том. что большинство исследователей в качестве порогового диагностического критерия гиперпластических процессов эндометрия в постменопаузальном периоде выбирают толщину М-эхо 4 или 5 мм. При этом чувствительность трансвагинальной эхографии для всех нозологических форм патологии эндометрия составляла 78,2— 100%, специфичность — 60—100%, точность — 82—96,2%.
Однако, несмотря на достаточно высокие показатели и то, что при раке эндометрия значения толщины М-эхо наиболее высоки, карцинома была констатирована и при толщине эндометрия менее 5—6 мм. По данным A. Kurjak и S. Kupesic, при карциноме эндометрия у 10% женщин значения толщины М-эхо находятся в диапазоне 5—10 мм.
При обследовании пациенток с подозрением на рак эндометрия необходимо учитывать их возраст. Так, Н.В. Харченко, взяв за основной критерий толщину М-эхо 6 мм в ранней, первой фазе менструального цикла при обследовании женщин в репродуктивном и перименопаузальном периодах, обнаружила низкую информативность этого ультразвукового признака в диагностике рака эндометрия: точность диагностики в репродуктивном возрасте была 48,3%, в перименопаузальном периоде — 56,8%. В то же время в постменопаузальном периоде ее точность составила 96,5% (!), чувствительность — 90,9%, специфичность — 92,3%. Поэтому чрезвычайно важным представляется выбор порогового значения диагностического критерия, учет которого обеспечивает высокие показатели не только специфичности, но и чувствительности.
В качестве иллюстрации целесообразно привести данные R. Osmers и coaвт. Если в качестве критерия для отбора пациенток в постменопаузальном периоде с подозрением на рак эндометрия выбрать толщину М-эхо 8 мм и более, то в 2,2% случаев карцинома эндометрия может быть не замечена. С другой стороны, при толщине М-эхо 5 мм и более риск ложно-отрицательных заключений практически отсутствует, но существенно возрастает частота неоправданных диагностических выскабливаний. Конечно, количество инвазивных манипуляций можно уменьшить до 5,4% при выборе в качестве диагностического критерия толщину М-эхо 12 мм, но процент недиагностированных случаев карциномы эндометрия возрастет с 2,2 до 4,6.
Кроме этого, следует учитывать отсутствие достоверных различий в толщине М-эхо при разных нозологических формах патологии эндометрия.
Так, по данным R. Auslender и соавт., в случаях полипов эндометрия у пациенток с постменопаузальным кровотечением толщина М-эхо составила в среднем 14,3 мм, при кистозной гиперплазии — 15,8 мм, при карциноме — 17,8 мм.
Структура М-эхо
При раке эндометрия нередко изменяется его эхоструктура. По данным В.Н. Демидова и А.Й. Гуса, наиболее характерными признаками являются: 1) неоднородность внутренней структуры образования; 2) неровность контуров; 3) более высокая эхогенность по сравнению с мышцей матки; 4) большие размеры образования — половина толщины матки и более; 5) повышенная звукопроводимость; 6) наличие жидкостных включений неправильной формы и разной величины; 7) заметное увеличение размеров образования при динамическом наблюдении; 8) нечеткость контуров матки вследствие перехода опухолевого процесса на смежные органы.
Е. Andolf и соавт. при изучении М-эхо матки у женщин с неосложненным течением постменопаузального периода установили, что в 85% случаев эндометрий более эхогенен, чем миометрий, в 9% обладает меньшей эхогенностью и в 6% имеет смешанную эхогенность. При карциноме эндометрия значительно (до 45%) возрастает частота случаев смешанной эхогенности М-эхо, в таком же проценте наблюдений отмечается гиперэхогенная структура эндометрия, а на долю гипоэхогенного М-эхо приходится 10% случаев. Н.А. Максимова выявила при раке эндометрия неоднородность структуры М-эхо в 57% наблюдений. При этом не обнаружена зависимость эхогенности опухоли от ее дифференцировки и гистологического типа.
В среднем у каждой второй пациентки с карциномой эндометрия обнаруживается жидкость в полости матки: у 25% в минимальном, у 25% в значительном количестве.
В то же время отсутствие жидкости в полости матки не дает основания исключить малигнизацию эндометрия.
По нашим данным, при клинически выраженном раке эндометрия возможности ультразвукового исследования достаточно широки. Эхография позволяет определить достоверные размеры и локализацию опухоли.

Так, наименьший размер выявленного нами новообразования составил 0,6 х 0,3 см. однако следует заметить, что визуализация подобных новообразований, как правило, возможна на фоне жидкости в полости матки. Вместе с тем только у 16,9% больных раком эндометрия в ней была обнаружена жидкость.
Вариабельность ультразвукового изображения раковой опухоли эндометрия достоверно обусловлена ее размерами и степенью дифференцировки.
Следовательно, с увеличением размеров опухоли увеличивается гетерогенность ультразвукового изображения рака эндометрия.
Прослеживается также четкая зависимость характера ультразвукового изображения раковой опухоли тела матки от ее морфологического типа.
В наших наблюдениях высоко- и умеренно дифференцированную аденокарциному характеризовала гиперэхогенная структура, в то время как для низкодифференцированного рака были специфичны только отражения средней и пониженной интенсивности, неоднородная, смешанная структура.
Оценка степени инвазии
Оценка степени инвазии в миометрий является одной из основных задач при раке эндометрия. К эхографическим признакам инвазивного характера роста опухоли относятся нарушение целости ореола вокруг слизистой, резкое истончение и исчезновение нормального изображения ткани миометрия. По данным И.С. Назаровой, характерные эхографические признаки инвазии, как правило, выявляются при поражении 1/3 толщины миометрия. Точность трансвагинальной эхографии в оценке степени инвазии при карциноме эндометрия колеблется от 68 до 97%.
По мнению I. Szabo и соавт, трансвагинальная эхография позволяет оценивать степень инвазии при карциноме эндометрия с чувствительностью 86%, специфичностью 90%, предсказательной ценностью положительного результата 92%, отрицательного 83%.
При оценке степени инвазии в миометрий большинство авторов используют такой критерий, как распространение процесса на глубину до 50% и более 50%.
Результаты исследований, проведенных В. Karlsson и соавт., свидетельствуют, что чувствительность трансвагинальной ультразвуковой диагностики инвазии миометрия менее половины его толщины при карциноме эндометрия составляет 79%, специфичность — 100%.
Как полагают М. Coute и соавт., возможности трансвагинальной эхографии, компьютерной и ЯМР-томографии одинаковые в предоперационной оценке инвазии рака эндометрия в миометрий.
Наиболее высокие результаты в оценке степени инвазии карциномы эндометрия при использовании эхографии приводят S. Kupesic и A. Kurjak: чувствительность — 100%, специфичность — 94,4%, предсказательная ценность положительного результата — 83,3%, отрицательного результата — 100%. Столь высокие показатели авторами получены при использовании трехмерной сосудистой энергетической допплерографии.
Вместе с тем до сих пор отсутствуют четкие ультразвуковые признаки инвазивного роста рака эндометрия в миометрий. В основном специалисты в этом вопросе исходят из субъективных восприятий. И здесь на первый план выступают опыт исследователя, глубокое знание анатомии, особенностей злокачественного процесса и другие факторы. Клиницистов же интересуют достаточно определенные диагностические критерии инвазии рака тела матки в плане предоперационной уточняющей диагностики.
Проведенное нами исследование дало возможность выявить некоторые достоверные ультразвуковые признаки, позволяющие судить о наличии инвазии опухоли в миометрий.
По нашему мнению, перспективно дальнейшее исследование диагностических возможностей ультразвукового метода в определении глубины инвазии в миометрий и выявлении микроинвазивного рака эндометрия.
В последние годы в клинической практике стала использоваться внутриматочная эхография. Расположение ультразвукового датчика в полости матки увеличивает разрешающую способность метода. Поскольку внутриматочная эхография позволяет четко визуализировать функциональный слой эндометрия, она открывает новые перспективы в оценке инвазии в миометрий. По данным А. Кikuchi и соавт., при применении трансвагинальной эхографии диагностировать степень инвазии в миометрий при раке эндометрия удается с точностью 77%, а при использовании внутриматочной эхографии — 87%.
Согласно мнению Н. Tsuda и соавт., внутриматочная эхография обладает одинаковыми с ЯМР-томографией возможностями при оценке инвазии рака эндометрия в миометрий. При этом точность обоих методов составила 85%. Однако внутриматочная эхография является достаточно дорогостоящим и технически сложным диагностическим методом, использование которого требует соблюдения всех условий, необходимых для выполнения внутриматочного вмешательства.
Рак эндометрия составляет 9% всех раковых опухолей у женщин. Занимает 7 место среди причин смерти от злокачественных новообразований у женщин. Преобладающий возраст -50-60 лет.
✎ Генетические аспекты: Злокачественные опухоли эндометрия отмечают при мутациях гена Е-кадгерина, одного из белков межклеточных взаимодействий (см. также Приложение 2. Наследственные болезни: каптированные фенотипы>.
❐ Факторы риска
● Длительная аденоматозная гиперплазия эндометрия (см. Фибромиома татки>
● Поздняя менопауза и нарушения менструального цикла
● Ожирение. У женщин с массой тела, превышающей норму на 10-25 кг, риск развития рака эндометрия в 3 раза больше, чем при нормальной массе тела, У женщин с превышением массы тела более чем на 25 кг риск заболевания в 9 раз выше
● Хроническая ановуляция или поликистоз яичников. Повышенный риск связывают с несбалансированной стимуляцией эндометрия эстрогенами
● Грану-лёзоклеточные опухоли яичников. Гормонально активные опухоли
яичников, секретирующие эстрогены, в 25% случаев сопровождаются раком эндометрия
● Поступление экзогенных эстрогенов. Между пероральным применением эстрогенов и раком эндометрия существует значительная корреляция, если терапию эстрогенами проводят без дополнительного назначения прогестерона.
❐ Патоморфология
● Основные гистологические подтипы рака эндометрия — аденокарцинома (60%) и аденоакантома (22%)
● Гораздо реже наблюдают папиллярный серозный рак, светлоклеточный рак и железисто-плоскоклеточный рак — связаны с худшими показателями 5-летней выживаемости в I стадии заболевания. Патогенез
● Превращение в периферической жировой ткани яичникового или надпочечникового андростендиона (андрогенного предшественника эстрогенов) в эстрон (слабый эстроген), который нарушает нормальную циклическую функцию гипоталамо-гипофизарно-яичниковой системы. В результате прекращаются овуляция и последующая секреция прогестерона — мощного антиэстрогенного гормона. Поэтому происходит хроническая, ничем не ослабленная стимуляция эндометрия эстроном, ведущая к гиперплазии (предопухолевое поражение) и раку эндометрия. Несбалансированное поступление экзогенных эстрогенов, поликистоз или эстрогенсекретирующие опухоли яичника стимулируют эндометрий сходным образом
● Выделяют 2 патогенетических варианта:
● На фоне предраковых заболеваний отмечают гиперэстрогенный ановуляторный цикл, бесплодие, ожирение, артериальную гипертёнзию, сахарный диабет — развивается высокодифференцированный железистый рак (прогноз относительно благоприятный)
● Отсутствуют эндокринно-обменные нарушения, наблюдают атрофию эндометрия, фиброз яичников — развивается низкодифференцированный железисто-солидный или солидный рак с менее благоприятным прогнозом. Классификация (см. также Опухоль, стадии).
● Стадия 0 — рак in situ
● Стадия I — опухоль ограничена телом матки
● Стадия IA — опухоль ограничена эндометрием, длина полости матки 8 см или менее
● Стадия Ш — инвазия в миометрий до 1 см, длина полости матки более 8 см
● Стадия IB -инвазия в миометрий более 1 см, но опухоль не прорастает в серозную оболочку
● Стадия II — вовлечение тела и шейки матки
● Стадия III — рост опухоли ограничен пределами малого таза
● Стадия IIIA — опухоль инфильтрирует серозную оболочку матки, метастазы обнаружены в придатках матки или в регионарных лимфатических узлах таза
● Стадия ШБ — опухоль инфильтрирует клетчатку таза, метастазы во влагалище
● Стадия IV — опухоль выходит за пределы малого таза или распространяется на слизистую оболочку мочевого пузыря или прямой кишки
● Стадия IVA — опухоль прорастает в мочевой пузырь и прямую кишку
● Стадия IVB -отдалённые метастазы.
● Классификация Международной федерации акушеров и гинекологов (FIGO, 1988)
● IA — опухоль ограничена эндометрием f IB — инвазия менее чем на 1 /2 толщины миометрия
● 1C -инвазия более чем на 1/2 толщины миометрия
● ИА — опухоль захватывает только эндоцервикальные железы
● ИВ — инвазия в строму шейки
● IIIA — распространение опухоли на серозную оболочку и/или придатки, а также (или) положительные результаты перитонеального цитологического исследования
● IIIB — метастазы во влагалище
● IIIC — метастазы в тазовые и/или парааортальные лимфатические узлы
● IVA — распространение опухоли на мочевой пузырь и/или слизистую оболочку кишечника
● IVB — отдалённые метастазы, в т.н. в брюшные и/или паховые лимфатические узлы
● Для стадий IA-IVB дополнительно вводят параметр G
● -G1 -неплоскоклеточный или неморулоподобный солидный рост менее 5%
● 02 — неплоскоклеточный или неморулоподобный солидный рост 6
● 03 — неплоскоклеточный или неморулоподобный солидный рост 50%.
● Вниз из полости матки в церви-кальный канал, что может привести к стенозу шейки матки и
● Через миометрий на серозную оболочку и в брюшную полость
● Через просвет маточных труб к яичнику
● Гематогенный путь, приводящий к возникновению отдалённых метастазов
❐ Клиническая картина
● Наиболее ранний признак — жидкие водянистые бели, нерегулярные менструации или кровотечения в постменопаузе
● Боли — более поздний симптом, возникающий в результате вовлечения в процесс серозного покрова матки, соседних органов или сдавления нервных сплетений параметрия.
✎ Диагностика
● Частичное расширение и выскабливание шейки и полости матки
● Выскабливание шеечного канала для выявления скрытого эндоцервикального поражения
● Измерение глубины полости матки
● Расширение шейки матки
● Альтернативные методы диагностики — биопсия эндометрия в качестве самостоятельной процедуры во время гистероскопии
● Обследование до лечения — анализы крови, мочи, рентгенография грудной клетки, гистероскопия и гистерография
● При наличии признаков дисфункции мочевого пузыря необходимо выполнить внутривенную пиелографию, КТ и цистоскопию
● Больным с нарушениями функций кишечника следует провести ректороманоскопию и ирригографию
● При высоком риске метастазирования опухоли проводят лимфангиографию для выявления поражённости парааортальных лимфатических узлов.
❐ Лечение:
● Предоперационная лучевая терапия на ранних стадиях заболевания (стадии I и II со скрытым эндоцервикальным поражением)
● Тотальная абдоминальная гистерэктомия и двусторонняя сальпингоофорэктомия с биопсией периаортальных лимфатических узлов, цитологическим исследованием перитонеального содержимого, оценкой состояния рецепторов эстрогенов и прогестерона и патогистоло-гической оценкой глубины проникновения в миометрий
● Женщинам с высоким риском местного рецидива может оказаться необходимым последующее проведение послеоперационной лучевой терапии. Лечение в зависимости от стадии.
● Рак стадии I, 1 степени гистопатологической дифференцировки
● Оптимальный метод лечения — хирургический: тотальная абдоминальная гистерэктомия и двусторонняя сальпингоофорэктомия
● В случае глубокого проникновения в миометрий можно дополнительно назначить облучение тазовых органов.
● Рак стадии IA или 1Б, 2-3 степени гистопатологической диф-ференцировки. Дополнительную послеоперационную лучевую терапию тазовых органов применяют при инвазии, затрагивающей более половины миометрия, и вовлечении в процесс тазовых лимфатических узлов.
● Рак стадии II с выявленным при выскабливании шеечного канала скрытым эндоцервикальным поражением
● Псевдоположительные результаты выскабливания шеечного канала наблюдают более чем в 60% случаев
● Хирургическое определение стадии
● Показания к дополнительной послеоперационной лучевой терапии
● Выраженное поражение шейки матки
● Поражение более половины миометрия
● Вовлечение тазовых лимфатических узлов.
● Рак стадии II с очевидным распространением на шейку матки
● Опухоли 3 степени очень часто дают метастазы в тазовые
лимфатические узлы, отдалённые метастазы и имеют плохой прогноз
● Существует два подхода к лечению. Первый подход — радикальная гистерэктомия, двусторонняя саль-пингоофорэктомия и удаление парааортальных и тазовых лимфатических узлов. Второй подход — наружная и внут-риполостная лучевая терапия с проведением через 4 нед тотальной абдоминальной гистерэктомии и двусторонней сальпингоофорэктомии
● Радикальная гистерэктомия показана только соматически здоровым, преимущественно молодым женщинам с опухолями низкой степени гистопатологической дифференцировки. Этот лечебный подход предпочтителен для больных, имеющих в анамнезе обширное хирургическое вмешательство на органах брюшной полости и таза или хроническое воспалительное заболевание органов таза, способствующее образованию внутрибрюшных спаек; предпочтение этому методу отдают из-за высокого риска повреждения тонкого кишечника у таких больных после лучевой терапии
● Комбинация лучевой терапии и хирургического вмешательства. Комбинированный подход предпочтительнее для больных с опухолями стадии II и выраженным распространением на шейку матки. Необходимо учитывать, что многие женщины, больные раком эндометрия, — пожилые, страдающие ожирением, артериальной гипертензией, сахарным диабетом и др.
● Аденокарцинома, стадии III и IV — индивидуальный подход в выборе лечебной тактики. В большинстве случаев схемы лечения включают хирургическое вмешательство с химиотерапией, гормональную терапию и облучение.
● Рецидивы заболевания. Лечение рецидивов зависит от распространённости и локализации рецидива, состояния гормональных рецепторов и здоровья пациентки. Схемы лечения могут включать экзентерацию, облучение, химиотерапию и гормональную терапию.
✎ Прогноз
● Стадия болезни в момент диагностики опухоли — самый важный прогностический фактор. 5-летняя выживаемость варьирует от 76% в I стадии до 9% в IV стадии заболевания
● Другие важные прогностические факторы: поражение шейки матки и лимфатических узлов (особенно тазовых и/или парааортальных), инвазия миометрия, гистопатологическая дифференцировка. Меньшее значение имеют возраст больной, клеточный тип опухоли, её размер, наличие раковых клеток в асцитической жидкости.
❐ Синонимы
● Карцинома дна матки
● Карцинома тела матки
✎ См. также: Опухоль, лучевая терапия; Опухоль, маркёры; Опухоль,
методы лечения; Опухоль, стадии, Рак шейки матки
✎ МКБ: С54.1 Злокачественное новообразование эндометрия
✎ Литература: Минимальный рак эндометрия. Бохман ЯВ ред. СПб.:
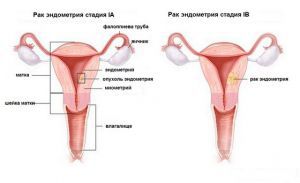
Эндометриоидный рак тела матки.
Рак в пределах эндометрия
Интраэндометриальной аденокарциному называют в случае, если рак располагается в пределах эндометрия и не распространяется в миометрий. Данные опухоли в классификации FIGO относят к стадии IA. При высокодифференцированных аденокарциномах инвазию в миометрий бывает трудно распознать, поскольку опухоль формирует очень зрелые железистые структуры, по степени ядерной атипии не отличающиеся в ряде случаев от атипической гиперплазии, на фоне которой чаще всего и развивается аденокарцинома эндометриоидного типа. К тому же граница слизистой оболочки тела матки зачастую не представляет собой прямой четкой линии, имеются пальцеобразные или пилообразные инвагинации эндометрия в миометрий, которые могут симулировать микроинвазию эндометриальной аденокарциномы. Достоверным признаком отсутствия инвазии в миометрий является наличие тонкой прослойки цитогенной стромы между опухолевыми железами и миометрием. При этом следует различать инвазию в цитогенную строму (в пределах слизистой оболочки), в пользу которой свидетельствуют формирование сложных ветвящихся сосочков, криброзных или солидных структур, отчетливые пальцевидные выпячивания в железах, изредка — десмопластическая реакция стромы.
Рак в пределах эндометрия имеет очень хороший прогноз, 10-летняя выживаемость пациенток составляет 98%.
Инвазивная эндометриоидная аденокарцинома
Эндометриоидный тип аденокарциномы составляет около 60% рака тела матки. В большинстве случаев связан с ановуляторными циклами или терапией эстрогенами в анамнезе. В 75 % случаев — это 6-7-я декада жизни, лишь около 5% больных моложе 40 лет. Опухоль рано манифестирует аномальными кровянистыми выделениями, редко возникает во время беременности.
Опухоль чаще локализуется на задней стенке полости матки. Представлена сероватым сосочковым экзофитным образованием на широком основании, мягкой консистенции, заполняющим иногда всю полость матки. Установлено, что глубина инвазии в миометрий не коррелирует с размерами экзофитного компонента.
Микроскопически аденокарцинома построена из плотно прилежащих друг к другу желез, напоминающих эндометрий пролиферативного типа, однако отмечается ядерная атипия, ядра имеют округлую форму и четко различимые ядрышки, расположены в эпителиальном пласте в несколько рядов. Некоторые эндометриоидные аденокарциномы секретируют большое количество внутрипросветного муцина, однако в отличие от муцинозных аденокарцином в цитоплазме опухолевых клеток он не обнаруживается.
Строма эндометрия может претерпевать реактивные изменения в виде накопления в цитоплазме липидов. В результате клетки цитогенной стромы становятся похожими на ксантомные, они выявляются в 20% эндометриоидных аденокарцином. Появление ксантомных клеток никак не связано со степенью дифференцировки опухоли и прогнозом. Однако присутствие их в соскобе с атипической гиперплазией должно настораживать патолога в отношении рака. Обычно опухоли высокодифференцированные, с хорошим прогнозом.
Дифференциальный диагноз включает атипическую гиперплазию, атипическую полипоидную аденомиому, карциносаркому, доброкачественные мета-пластические изменения, эндометриоидную аденокарциному шейки матки.
Глубина инвазии измеряется от нижней границы эндометрия, поэтому особенно важно проводить вырезку материала на границе опухоли и окружающей неизмененной слизистой оболочки тела матки.
Пациентки с опухолевой инвазией на глубину более 1/2 толщины миометрия имеют повышенный риск появления отдаленных метастазов, включая тазовые и парааортальные лимфатические узлы. Они нуждаются в более агрессивной лечебной тактике, а именно в проведении лимфаденэктомии, а также адъювантной химиотерапии.
Максимальная глубина инвазии измеряется в миллиметрах от границы эндометрия и миометрия и выражается в процентах от общей толщины миометрия. Однако при определении глубины инвазии зачастую возникают проблемы, самая распространенная из которых — точное определение границы эндометрия и миометрия, особенно когда граница разрушена опухолью или смещена субмукозной лейомиомой. Ориентироваться следует на участки прилежащей к опухоли слизистой оболочки или на единичные оставшиеся эндометриальные железы. Трудности также создает выраженный экзофитный компонент опухоли. В таких случаях необходимо сопоставление результатов микроскопического исследования с макроскопическими данными.
Эндометриоидный рак (как и атипическая гиперплазия) может локализоваться в очагах аденомиоза, в этом случае он не рассматривается как инвазивный рак. Однако при инфильтративном росте аденокарциномы из очага аденомиоза в окружающий миометрий глубину инвазии необходимо измерять от границы эндометрия и миометрия до нижней точки инфильтрации аденокарциномы.
Определение степени дифференцировки имеет важное прогностическое значение и необходимо при всех вариантах эндометриоидной аденокарциномы тела матки.
Наиболее распространена система градации, предложенная FIGO и рекомендуемая ВОЗ. Данная система применяется для эндометриоидных и муцинозных аденокарцином и включает в себя 3 степени дифференцировки рака эндометрия: высокодифференцированный (G1), умеренно дифференцированный (G2) и низкодифференцированный (G3). Степень дифференцировки зависит от количества солидных структур в опухоли и определяется только в железистом компоненте, исключая участки плоскоклеточной дифференцировки.
Высокодифференцированные опухоли (G1) характеризуются железистыми структурами, напоминающими нормальный эндометрий с небольшим количеством стромы и клеточной атипией. Солидные участки отсутствуют или составляют не более 5% площади новообразования. При определении количества солидных структур из оценки исключаются структуры с плоскоклеточной дифференцировкой.
Умеренно дифференцированные опухоли (G2) характеризуются уменьшением размеров железистых структур, появлением криброзных участков. Солидный компонент занимает более 5, но менее 50% площади опухоли. Ядерный полиморфизм более выражен.
В низкодифференцированных опухолях (G3) солидные структуры составляют более 50% площади опухоли. Ядерный полиморфизм обычно значительно выражен. Митотическая активность не является определяющей для оценки степени дифференцировки, но, как правило, с повышением степени злокачественности она увеличивается.
Следует отметить, что система градации FIGO учитывает в первую очередь структурную организацию опухоли, однако, по мнению ряда авторов, при определении степени дифференцировки следует принимать во внимание и ядерную атипию. Согласно классификации ВОЗ 2014 г., при наличии выраженной ядерной атипии более чем в 50% клеток опухоли степень дифференцировки должна быть увеличена на 1 пункт. Обычно степень ядерной атипии совпадает со структурными изменениями в опухоли, однако если они различаются, то ядерная градация служит более надежным прогностическим фактором. В случае, когда степень дифференцировки опухоли изменена из-за выраженной ядерной атипии, это необходимо указывать в заключении.
Эндометриоидная аденокарцинома с плоскоклеточной дифференцировкой
Степень дифференцировки опухоли определяется железистым компонентом, что коррелирует со статусом лимфатических узлов и 5-летней выживаемостью. Плоскоклеточный компонент при градации не учитывается.
FIGO предложены следующие критерии идентификации плоскоклеточной дифференцировки в эндометриоидной аденокарциноме:
Железисто-ворсинчатый вариант
Характеризуется наличием хрупких тонких длинных сосочков в высокодифференцированной опухоли, представленной преимущественно эндометриоидным раком типичного или целиком папиллярного строения. Псаммомные тельца выявляются редко. Цитологические характеристики опухоли ничем не отличаются от типичной эндометриоидной аденокарциномы. Опухоли имеют благоприятный прогноз. Железисто-ворсинчатый вариант важно отличать от серозной аденокарциномы, в которой, как правило, выявляется высокая степень ядерной атипии, характерны псаммомные тельца.
Секреторный вариант
Секреторная аденокарцинома — вариант эндометриоидного рака с наличием морфологических признаков, характерных для ранней или средней фазы секреции. Выявляются секреторные субнуклеарные вакуоли, клетки полигональные, но не перстневидные. Опухоль может целиком состоять из секреторных участков, однако чаще они выявляются фокально. Характеризуется благоприятным прогнозом. Важно отметить, что в секреторном варианте сохраняются структурные особенности эндометриоидной аденокарциномы и цилиндрическая форма клеток, что отличает ее от светлоклеточной аденокарциномы. Секреторная аденокарцинома у молодых женщин может подвергаться циклическим гормональным изменениям. Нередки ситуации, когда в соскобе обнаруживают секреторную аденокарциному, а в материале после гистерэктомии выявляется только эндометриоидная аденокарцинома типичного строения. В постменопаузе опухоль теряет способность циклически изменяться под действием гормонов.
Реснитчатоклеточный вариант
Описаны и другие, более редкие варианты эндометриоидной аденокарциномы, такие как сертолиформный и микрожелезистый.
Читайте также:

