Интраперитонеальная химиотерапия при раке желудка
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
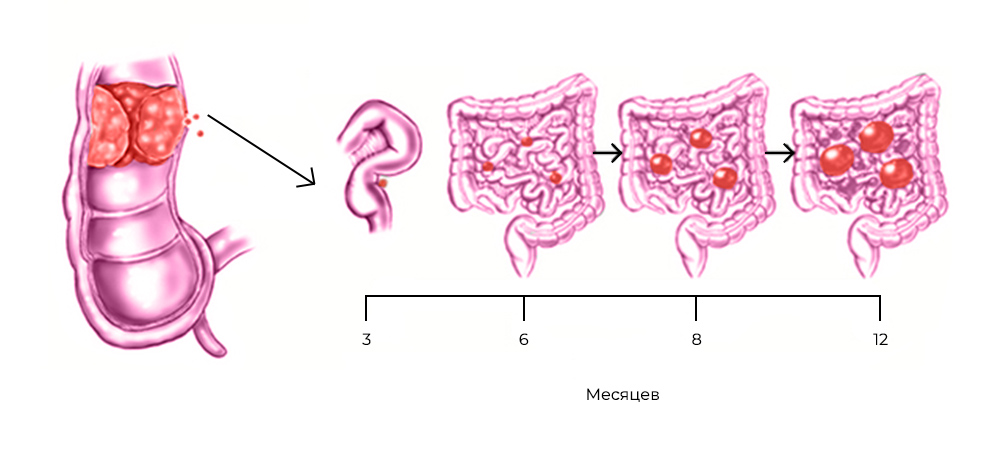
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
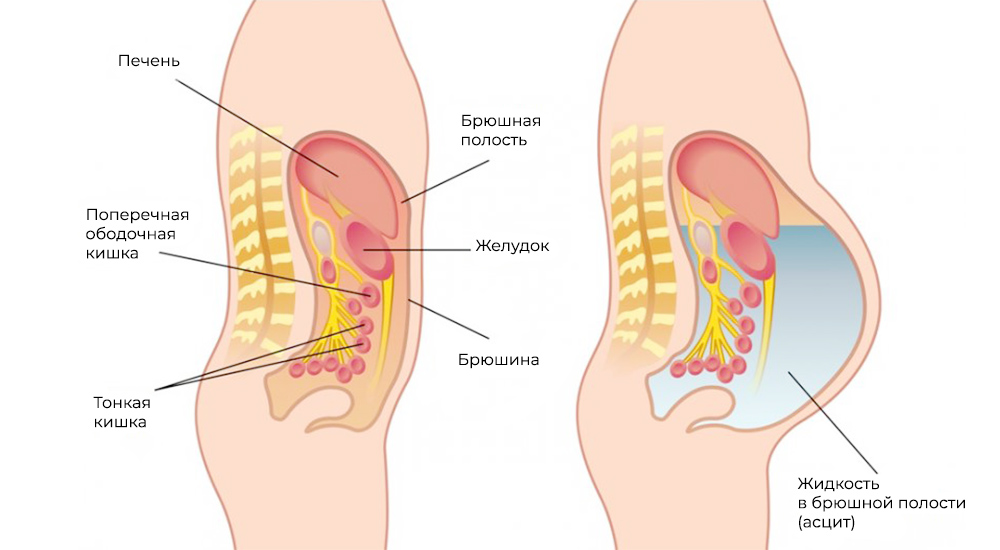
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
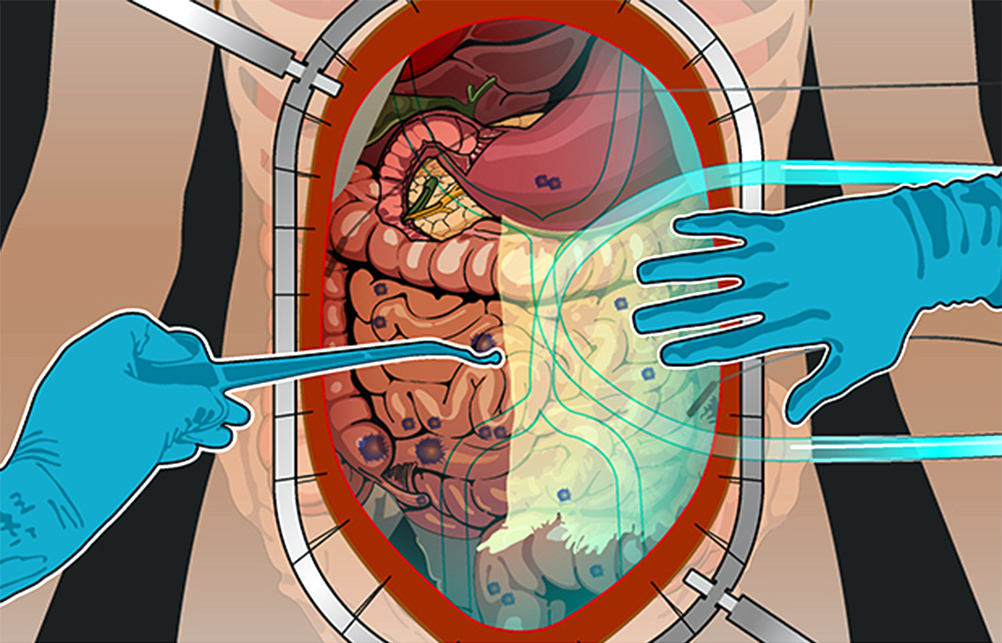
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
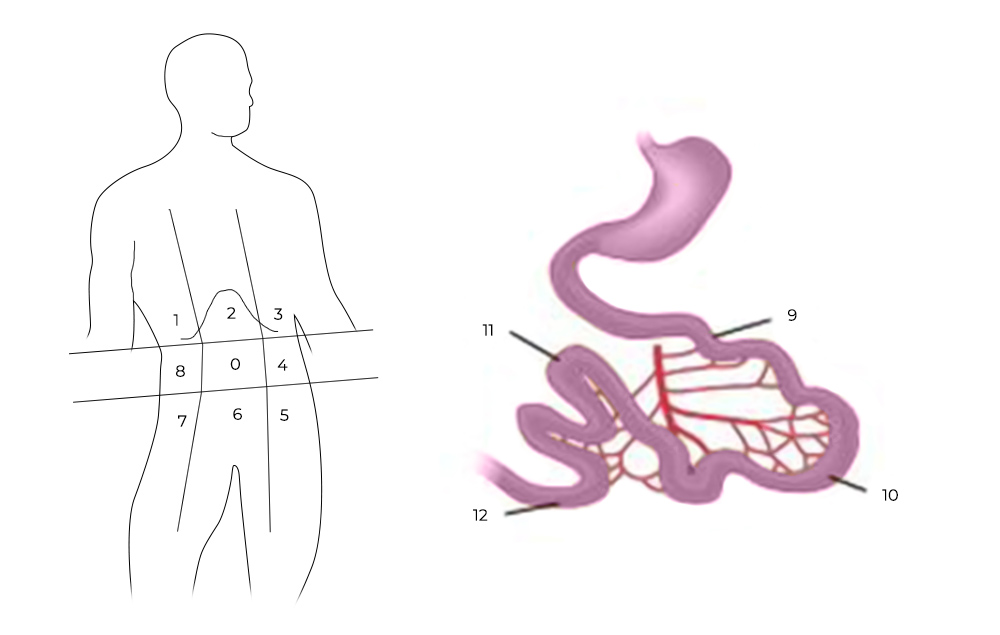
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
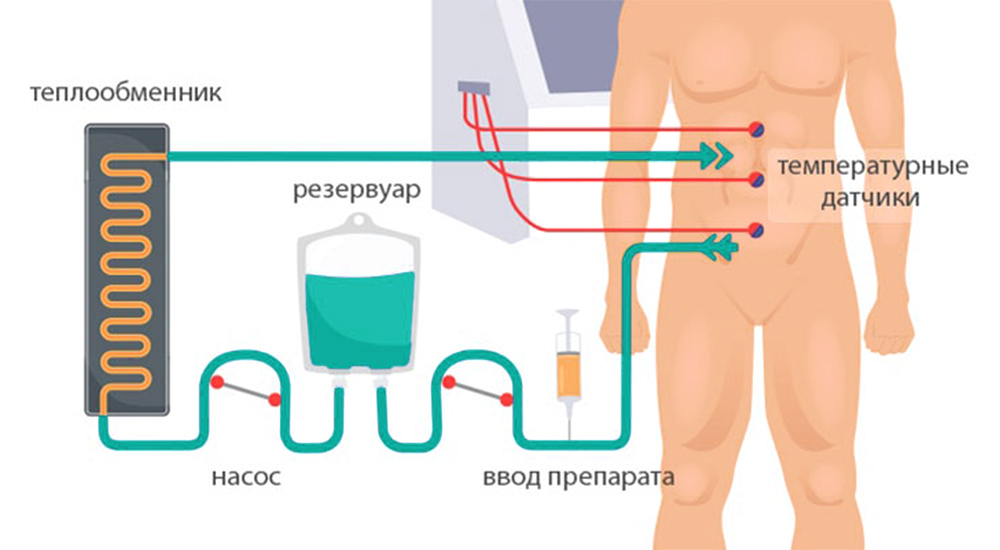
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.

- Почему возникает канцероматоз брюшины?
- В чем преимущества гипертермической интраперитонеальной химиотерапии?
- Как проводят процедуру?
- Ревизия
- Циторедуктивная операция
- Гипертермическая интраперитонеальная перфузия
- Какие химиопрепараты применяют для HIPEC?
- Реконструкция
- Риски и возможные осложнения
- При каких других типах рака применяют методику?
- Насколько хорошо изучена HIPEC? Доказана ли эффективность?
- Каков прогноз?
Гипертермическая интраперитонеальная химиотерапия (HIPEC — от англ. Hyperthermic IntraPeritoneal Chemotherapy) — инновационный метод лечения в онкологии, который предполагает введение в брюшную полость химиопрепарата, нагретого до 42–43 °C. Ее применяют при канцероматозе (поражении раковыми клетками) брюшины.
Благодаря появлению HIPEC, стало возможным лечение злокачественных опухолей, которые ранее считались неоперабельными.
Почему возникает канцероматоз брюшины?
Брюшина представляет собой тонкую пленку из соединительной ткани. Она выстилает изнутри брюшную полость, покрывает внутренние органы. Некоторые органы покрыты брюшиной со всех сторон (расположены интраперитонеально), другие — частично (мезоперитонеально) или только с одной стороны (экстраперитонеально).
На поздних стадиях некоторых онкологических заболеваний раковые клетки могут распространяться в брюшину и проникать в брюшную полость, давать начало вторичным очагам. При этом резко ухудшается прогноз, снижается эффективность противоопухолевого лечения, так как многие препараты при внутривенном введении плохо проникают через брюшину.
Наиболее распространенные причины поражения брюшины раковыми клетками:
- Колоректальный рак (аденокарцинома толстой и прямой кишки) приводит к канцероматозу брюшины в 15% случаев.
- Рак желудка — в 50% случаев.
- Рак яичника — в 60% случаев.
- Рак аппендикса (аппендикулярная карцинома).
- Рак молочной железы.
- Рак поджелудочной железы.
- Псевдомиксома брюшины — редкая злокачественная опухоль, которая, как правило, начинается в аппендиксе. Реже первичный очаг может находиться в кишечнике, яичнике, мочевом пузыре. Опухолевые клетки производят желеобразную жидкость — муцин — которая со временем накапливается в брюшной полости. При отсутствии лечения больной погибает от кишечной непроходимости, истощения.
- Перитонеальная мезотелиома — редкая злокачественная опухоль, которая изначально развивается в брюшине.
Асцит брюшины, который часто сопровождает канцероматоз, проявляется увеличением объёма и болями в животе, потерей аппетита, тошнотой и рвотой. Из-за нарастания асцита (скопления жидкости в брюшной полости) нарушается работа кишечника и других органов, возникает одышка. Зачастую поражение брюшины не вызывает каких-либо симптомов и обнаруживается только во время хирургического вмешательства.
В диагностике канцероматоза брюшины помогают такие исследования, как компьютерная томография, ПЭТ-КТ, биопсия, диагностическая лапароскопия, анализ крови на онкомаркеры.
В чем преимущества гипертермической интраперитонеальной химиотерапии?
Ранее пациентов, у которых был диагностирован канцероматоз брюшины, часто признавали безнадежными. Классические методы лечения рака (хирургия, системная химиотерапия, лучевая терапия) не могли продлить жизнь таких больных. Выживаемость измерялась неделями и месяцами. За последние два десятилетия ситуация изменилась.
HIPEC обладает преимуществами, которые помогли существенно повысить эффективность борьбы с поражением брюшины раковыми клетками:
Как проводят процедуру?
Лечение состоит из четырех этапов:
- Ревизия (осмотр) брюшной полости.
- Циторедуктивная операция.
- Собственно HIPEC.
- Реконструкция.
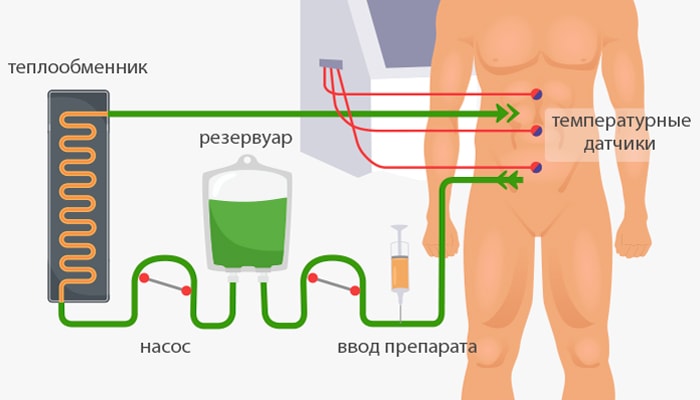
Вмешательство сложное и длительное, оно может продолжаться до 16 часов (в среднем — 3–9 часов).
Ревизия
Во время ревизии хирурги тщательно осматривают брюшную полость. Оценивают перитонеальный индекс рака (peritoneal cancer index, сокращенно — PCI). Брюшную полость условно делят на 13 областей. В каждой из них оценивают размеры самого большого узла. В зависимости от этого каждая область получает определенное количество баллов:
- узел не визуализируется — 0 баллов;
- менее 0,5 см — 1 балл;
- 0,5–5 см — 2 балла;
- узел более 5 см или несколько сливающихся более мелких узлов — 3 балла.
Врачи должны убедиться, что смогут удалить все видимые узлы. Прогноз оценивают в зависимости от общей суммы баллов и типа опухоли. Если сумма превышает критическое значение, лечение признают нецелесообразным. Операцию завершают, HIPEC отменяют. Перитонеальный индекс рака можно также оценить в ходе диагностической лапароскопии на этапе обследования.
Циторедуктивная операция
Во время циторедуктивной операции нужно удалить все видимые очаги размерами более 1–2 мм. От того, насколько качественно это сделано, зависит эффективность всего лечения и прогноз для пациента. Удаляют орган, в котором находится опухоль, или его пораженную часть, париетальную (выстилающую стенки брюшной полости) и часть висцеральной (покрывающей внутренние органы) брюшины, соседние пораженные органы.
Гипертермическая интраперитонеальная перфузия
После операции все видимые опухоли удалены, но в брюшной полости все еще остались раковые клетки. Если эти клетки не будут уничтожены, они дадут начало новым очагам, произойдет рецидив, и весь эффект от лечения будет сведен на нет. Эту задачу и помогает решить HIPEC.
Через катетеры, подсоединенные к специальному аппарату, брюшную полость пациента промывают раствором химиопрепарата, подогретым до 42–43 °C. Процедура продолжается 30–90 минут, после чего раствор полностью удаляют из брюшной полости. Постоянно контролируют скорость потока, давление, объем раствора. В теле пациента во время процедуры установлены температурные датчики.
Какие химиопрепараты применяют для HIPEC?
Чаще всего в брюшную полость вводят митомицин C, оксалиплатин и цисплатин. Нагревание повышает эффективность таких химиопрепаратов, как карбоплатин, митоксантрон, доксорубицин, эпирубицин, ифосфамид.
Реконструкция
После того как все очаги удалены, хирург восстанавливает целостность кишечника, если это невозможно — накладывает еюно-, цеко- или колостому: подшивает к коже подвздошную, слепую или ободочную кишку и формирует отверстие для отхождения стула.
Пациент перенес серьезное хирургическое вмешательство, поэтому на некоторое время его помещают в палату интенсивной терапии.

Риски и возможные осложнения
Циторедуктивная операция в сочетании с HIPEC — сложное вмешательство. Оно несет определенные риски. Смертность от осложнений после лечения составляет 3%. Это ниже, чем при многих других сложных операциях.
После хирургического вмешательства возможны некоторые осложнения:
- Инфекции легких и мочевого пузыря.
- Осложнения в месте операционной раны.
- Сложности с приемом пищи и жидкости в течение нескольких дней.
- Редко встречаются инфекции брюшной полости и выпадение волос.
Срок госпитализации в среднем составляет 2–4 недели. Спустя несколько недель проводится контрольное обследование. Затем его повторяют через каждые 3 месяца, постепенно частоту уменьшают до 1 раза в год.
При каких других типах рака применяют методику?
Подогретые растворы химиопрепаратов можно вводить не только в брюшную полость. Существует такая процедура, как изолированная гипертермическая перфузия (LIMB). Химиопрепарат вводят в артерию ноги или руки. LIMB помогает спасти конечность от ампутации при меланомах, саркомах мягких тканей.
Насколько хорошо изучена HIPEC? Доказана ли эффективность?
HIPEC помогает существенно увеличить продолжительность жизни и улучшить состояние пациентов — это доказано в ходе научных исследований.
Семьдесят два ведущих хирурга-онколога из 55 онкологических центров в 14 странах мира, включая США, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих раком толстой и прямой кишки.

Каков прогноз?
Если лечение при канцероматозе брюшины не проводится, средняя выживаемость пациентов составляет всего 2–6 месяцев. HIPEC в сочетании с циторедуктивной операцией помогает существенно улучшить прогноз. Средняя выживаемость после лечения измеряется годами. Фактически HIPEC способна полностью уничтожить опухоль, но впоследствии может возникнуть рецидив.
С целью предотвращения рецидива и метастазирования через 4–6 недель после хирургического лечения и HIPEC может быть назначен курс адъювантной химиотерапии.
Гипертермическая химиотерапия представляет собой введение лекарственного средства высокой температуры в опухолевый очаг. Впервые исследования гипертермической химиотерапии проводились ещё в 80-90 годы прошлого века, однако тогда не была доказана её эффективность по сравнению с традиционными методами лечения (хирургия, лучевая и традиционная химиотерапия). Новые перспективы появились в связи с разработкой таргетной терапии – сегодня гипертермическая химиотерапия в основном рассматривается с точки зрения создания ферромагнитных таргетных препаратов (накапливаются в раковых клетках и при воздействии на них внешнего магнитного поля прогревают клетки до высоких температур, что приводит к распаду опухоли) и независимых от температуры гипертермических методов лечения. На сегодня один из таких перспективных методов – воздействие высокочастотных электромагнитных излучений, которое сопровождается нагревом тканей в диапазоне температур, не оказывающем негативного влияния на здоровые клетки. Также проводятся клинические исследования различных комбинаций гипертермии и радиотерапии.
Благодаря сотрудничеству с мировыми учёными-онкологами врачам Юсуповской больницы удается достигнуть хороших результатов в борьбе с раком. Хотя гипертермическая химиотерапия всё ещё проходит клинические испытания, эффективность её находится на высоком уровне – излечиваются пациенты с метастатическими формами онкологии.

Показания к гипертермической интраперитонеальной химиотерапии
Ещё несколько лет назад данная методика широко использовалась многими онкологами мира. Наиболее распространённой является интраперитонеальная гипертермическая химиотерапия. Считалось, что методика почти в 2,5 раза повышает эффективность лечения злокачественных новообразований. Гипертермическая интраперитонеальная, или внутрибрюшинная, химиотерапия успела получить довольно широкое распространение в России. С её помощью онкологи спасали жизни пациентов в тех случаях, которые казались безнадёжными (диссеменированное внутрибрюшинное метатстазирование). Наилучшие результаты давала гипертермическая химиотерапия при перитонеальном карцинозе в сочетании с колоректальным раком, некоторых разновидностях опухолей желудка, тонкой кишки. В целом, результат гипертермической интраперитонеальной химиотерапии зависит от вида злокачественного новообразования, степени распространения патологического процесса по поверхности брюшины. В отличие от классической химиотерапии, гипертермическая химия более избирательно действует на патологические клетки.
Известно, что в случае стандартной химиотерапии гематоперитонеальный барьер препятствует проникновению противоопухолевых препаратов в брюшную полость, тем самым ухудшая результат лечения. Разработка и внедрение в практику комплексных мероприятий по борьбе с атипичными клетками (циторедуктивная хирургия и интраоперационная антибластика) позволяет снизить степень поражения злокачественными клетками внутрибрюшного пространства. Проведение комплексных мероприятий, направленных на снижение численности злокачественных очагов во внутрибрюшном пространстве, является одним из основных условий профилактики рецидива опухоли.
Отечественными онкологами были проведены исследования, в ходе которых определялось влияние горячей химиотерапии на поражённую брюшину и здоровые участки. Выяснилось, что лекарственные препараты, используемые при внутрибрюшной гипертермической химиотерапии, не оказывают значительного губительного действия на здоровые ткани. На основе статистических данных подтвердилось, что выживаемость после лечения горячей химиотерапией выше, чем при использовании классической химиотерапии. Таким образом, считается, что интраперитонеальная химиотерапия обеспечивает высокий уровень терапевтического воздействия на злокачественные очаги. Также подтверждено, что терапия с использованием горячих химиопрепаратов усиливает их терапевтический эффект. Поскольку гипертермическая химиотерапия – метод местного лечения, которое фокусируется на злокачественном очаге, это позволяет специалистам использовать более высокие дозы лекарственных средств без вреда для больного. Однако не следует забывать, что данные выводы не были подтверждены в рандомизированных исследованиях.
Как проходит процедура
Онкопатология органов брюшной полости считается самой тяжелой из всех видов рака. Если от первичного патологического очага можно избавиться хирургическим путём, то ликвидировать множественные метастазы невозможно, особенно на поздних стадиях. Традиционная химиотерапия опухолей брюшной полости не оказывает выраженного клинического эффекта, поэтому специалистам необходима была методика непосредственного воздействия на опухоль. Гипертермическая интраперитонеальная химиотерапия казалась грандиозным прорывом в онкологической практике, направленным на спасение обречённых пациентов.
Обычно процедура внутрибрюшной гипертермической химиотерапии выполняется после открытого хирургического вмешательства. В ходе операции удаляются видимые патологические очаги рака, а иногда и органы, пораженные опухолевой тканью. После того, как опухоль удалена, стерильный горячий раствор лекарственного средства помещается в брюшную полость, где омывает всё пространство и воздействует на злокачественные клетки. Время инстилляции раствора – полтора часа. Затем раствор извлекают и зашивают разрез.
В последнее время онкологи выполняют гипертемическую химию не только после открытых хирургических операций, но и после лапароскопии. В этих случаях лекарственный химиотерапевтический препарат вводится через разрезы, в которые вводились троакары – специальные инструменты для лапароскопии. В те же разрезы помещаются дренажи для оттока препарата. Такого рода операции эффективны, когда процесс метастазирования не выражен.
Главное преимущество метода – короткий период реабилитации. Если после обширной операции пациенту необходимо провести к клинике не менее четырнадцати дней, то после лапароскопии – не более пяти дней. Для снижения отрицательного влияния химиотерапии на организм онкологами разработаны специальные программы реабилитации.
Показания к интраперитонеальной химиотерапии
Такое химическое воздействие проводится после радикальных операций с целью снижения риска рецидива в случае распространения злокачественного процесса на область висцеральной брюшины, а также для устранения метастазов в региональных лимфоузлах.
- рецидив опухолевого процесса;
- гигантские опухоли в любой стадии.
При гипертермической химиотерапии происходит:
- снижение риска осложнений в 4 раза;
- быстрое восстановление перистальтики кишечника;
- возвращение к обычному режиму уже через год;
- возможность выполнять легкую домашнюю работу;
- минимальный срок пребывания в стационаре.
Врачи Юсуповской больницы участвуют в клинических испытаниях, посвящённых разработке методов гипертермической химиотерапии, которые будут безопасны для пациентов и эффективны при устранении атипичных клеток. Записаться на приём к онкологу, обсудить возможность госпитализации в Юсуповскую больницу, можно по телефону.
Читайте также:

