Интервенционная радиология в онкологии презентация
Презентация была опубликована год назад пользователемВячеслав Дударев
2 Анатомия желчных путей
3 Методы исследования желчных протоков -чрескожная чреспеченочная холангиография(ЧЧПХ) -ретроградная панкреатохолангиография(РПХГ) -бесконтрастная МР-холангиопанкреатография
6 Чрескожная чреспечёночная холангиография (определение) Диагностическая процедура, заключающаяся в установке иглы калибром 21G и меньше в периферические желчные протоки в стерильных условиях и с использованием визуализационного контроля с последующим введением контрастного вещества для определения билиарной анатомии. Полученные данные документируются на снимках в различных проекциях. Quality improvement guidelines for percutaneous transhepatic cholangiography and biliary drainage DR Burke, et al., JVIR 1997;8:
7 Чрескожная чреспечёночная холангиография (показания) 1. Определение уровня обструкции у больных с расширением желчных протоков. 2. Исследование при подозрении на предмет наличия камней в желчных протоках. 3. Определение этиологии холангита. 4. Исследование при подозрении на воспалительные расстройства желчных протоков. 5. Определение места желчь истечения, когда РХПГ оказалась неэффективной или противопоказана. 6. Исследование на предмет наличия кист холедоха и их протяжённости. Quality improvement guidelines for percutaneous transhepatic cholangiography and biliary drainage DR Burke, et al., JVIR 1997;8:
8 Чрескожная чреспечёночная холангиография (осложнения) (2%) Сепсис Холангит Желчеистечение Кровотечение Пневматоракс
9 Чрескожное чреспечёночное билиарное дренирование (определение) Лечебная процедура, заключающаяся в стерильной каннюляции периферического желчного протока после чрескожной пункции с последующими манипуляциями проводником и катетером под контролем средств лучевой диагностики. Quality improvement guidelines for percutaneous transhepatic cholangiography and biliary drainage DR Burke, et al., JVIR 1997;8:
10 Чрескожное чреспечёночное билиарное дренирование (показания) 1. Декомпрессия при обструкции желчных путей. 2. Расширение билиарных стриктур. 3. Удаление камней желчных путей, когда РХПГ оказалась неэффективной или противопоказана. 4. Перераспределение тока желчи от места желчь истечения и стентирование билиарного дефекта. 5. Лечение острого билиарного сепсиса. Quality improvement guidelines for percutaneous transhepatic cholangiography and biliary drainage DR Burke, et al., JVIR 1997;8:
11 Чрескожное чреспечёночное билиарное дренирование (осложнения) Сепсис 2,5% Кровотечение 2,5% Воспалительные или инфекционные, локализованные (абсцесс, перитонит, холецистит, панкреатит) 1,2% Плевральные 0,5% Смертность 1,7%
12 Чрескожная чреспечёночная холангиография и чрескожное чреспечёночное билиарное дренирование (противопоказания) Коагулопатия является относительным противопоказанием. Перед процедурой должны быть предприняты любые попытки скорректировать или улучшить это состояние.У больных с продолжающейся коагулопатией процедура всё-же показана, если при альтернативных методах лечения или диагностики ожидается большая вероятность осложнений.
Химиоэмболизация при ГЦР и метастазах в печень
Количество пациентов с ГЦР и метостазами в печень в г.Киеве на 1 год:
ранее выявленые - 15000-18000,
вновь выявленые 5000-6000.
Всего 20000- 24000 в год.
(Основні показники здоров’я населення за 2005-2006 р. Київ 2007. 372 с. Укр.база медикостатистичної інформ.Центру мед.статистики МОЗ України за 1990-2006)
- Хирургические:
- пересадка печени. До 6 человек в год.
- Сегментэктомия и лобэктомия. 50- 60 человек в год.
- Криодеструкция, аргоновая коагуляция, ультрозвукавая деструкция- аспирация. До 150 человек в год.
- Химиотерапия в/а (селективно). До 15- 25 человек в год.
- Химиотерапия- химиоэмболизация (суперселективно). До 100 человек в год.
- Химиотерапия в/в 98-99% (?)
Большинство исследователей отмечают 2-3 кратное увеличение частоты ответов на ХЭПА, у пациентов с метастазами в печень, по сравнению с системной химиотерапией.
При удаленной первичной опухоли прямой кишки и последующей ХЭПА метастазов в печени 5-летняя выживаемость достигает 70% (при в/в системной терапии – 18-28%)
Гистохимические исследования показывают , что после ХЭПА в клетках ГЦР концентрация доксорубицина в 10-15, а цисплатина в 25-95 раз выше, чем в участках нормальной ткани печени.
(Schell S.R et all Hepatic artery embolization for control of symptoms,octreotide reguirements, and tumor progression in metastatic carcinoid tumors // J.Gastrointest.Surg.-2002.-Vol.75,Suhhl.200.-P.91-95.
Ymamoto K. et all. Intraarterial infusion chemotherapy with lipiodol-CDDP suspension for hepatocellular carcinoma // Cardiovasc.Intervent.Radiol.-2000.-Vol.23, № 1.-P.26-39. )



Эмболизация селезеночной артерии (при гиперспленизме)
Установка КАВА-фильтра
Профизиологической основой эмболии легочной артерии и последующих осложнений является обтурация легочной артерии эмболом или тромбом с последующим развитием гипоксемии и легочной артериальной гипертензии. Вследствие этого возникает перегрузка правой половины сердца,развивается острая недостаточность правого желудочка.
Обеднение крови кислородом ведет к развитию метаболических расстройств миокарда, вызывает развитие легочной артериальной гипертензии , которая развивается в случае облитерации просвета артерии не менее чем на 50%.
Одним из направлений профилактики ТЭЛА является порциальная окклюзия НПВ , заключающаяся в разделении просвета вены на несколько каналов, сохраняющих магистральный кровоток и препятствующих за счет своего малого диаметра проксимальной миграции тромбов.
В США за год имплантируется более 90 000 кава-фильтров.
- эмболоопасные (флотирующие) тромбы НПВ, подвздошной и бедренной вен;
- массивная ТЭЛА или повторные ТЭЛА , источник которых не установлен;
- невозможность проведения или неэффективность антикоагулянтной терапии.
(Ипатов П.В. Тромбоэмболия легочной артерии и тромбофилические состояния : современные принципы диагностики и лечения.// М.-2010 г.- ГВКГ им.Бурденко .-119 с.)
Стентирование периферических артерий


Эмболизация маточных артерий (фибромиома , миома)
Россия – Ленинградская областная б-ца - 2005-2010 г. - 624 операций
Казахстан – Национальный институт материнства и детства – 2007-2010 г. -220 операций
Украина – НИИ экспериментальной хирурги и трансплантологии – с 2000 г. – более 500 операций
Послеоперационные осложнения – 1%


Эмболизация почек
Паллиативная эмболизация у больных неоперабельным раком почки увеличивает медиану 1-,3 -летней выживаемости с 3% до 10%.
У больных категории Т3- Т4N0M0 показана предоперационная химиожировая эмболизация, преследующая цель профилактики интраоперационной диссиминации опухолевых клеток из первичного очага так как эти стадии характеризуются прорастанием первичной опухоли в капсулу и распространением опухолевого тромба по венозному коллектору.
Гранов А.М.,Карелин М.И.,Таразов П.Г.и др. Рентгенэндоваскулярная хирургия в онкоурологии. //Вестник рентгоенологии .- 1996 г.- №1.- С.35-37.
Гранов А.М.,Гершанович М.Л. и др. Результаты применения эндоваскулярных вмешательств иоэмболизаций) в лечении операбельного и распространенного рака почки. // Вопросы онкологии.-1998 г. - №6.- С.11-14.
Гранов А.М. Интервенционная радиология в онкологии.//Санкт-Петербург.- 2007 г.- с.342

Предоперационная (неоадьювантная) катетарная в/а химиотерапия при раке мочевого пузыря
Комбинированное лечение (артериальная химиотерапия, облучение , ТУР) у больных раком мочевого пузыря стадий Т2-Т4NхM0 позволило Н.Оgawa и соавт. (1997) добиться 68% 5-летней и 54% 10-летней выживаемости при сохраненном мочевом пузыре.
Показатели 10-летней выживаемости в группах Т2, Т3А и Т3В составили 84 , 59 и 51% соответственно, что оказалось даже несколько лучше , чем при цистэктомии с пред- и послеоперационной химиотерапией и облучением.
- 5-летняя ПЖ: 70-80%
- 10-летняя ПЖ: 40-43%
- Риск перехода в инвазивную форму: 40-80%

Предоперационная (неоадьювантная) в/а химиотерапия при раке прямой кишки
- 5-летняя ПЖ: 50-60%
- 10-летняя ПЖ: 30-40%
- Рецидивирование: 25-50%
(I – 88%, II -67%, III -30%, IV -4%)
После использования в комбинированном лечении больных РПК предоперационной (неоадьювантной) селективной в/а полихимиотерапии в течение первых 2 лет частота возникновения местных рецидивов и отдаленных метастазов уменьшилась в 2 раза, двухлетняя выживаемость увеличилась на 22% по сравнению с показателями контрольной группы, где пациентов лечили хирургическими методами с послеоперационной в/в полихимиотерапией.
- Главная
- Медицина
- Интервенционная радиология в онкологии
Слайды и текст этой презентации

Интервенционная радиология в онкологии
Подготовила: Терещенко Е.Н 503 группа

ВНУТРИСОСУДИСТЫЕ ИНТЕРВЕНЦИОННЫЕ РАДИОЛОГИЧЕСКИЕ ВМЕШАТЕЛЬСТВА
В поисках эффективного лечения неоперабельных
опухолевых процессов интервенционные радиологи
предложили использовать технические возможности
селективной катетеризации артериальных сосудов,
питающих опухоль, для прицельного введения проти-
воопухолевых препаратов и эмболов для ишемизации
новообразований.

-внутриартериальная регионарная химиотерапия;
-ишемическая/гемостатическая эмболизация
питающих опухоль артериальных сосудов;
-химиоэмболизация, использующая замедление
и/или остановку кровотока в сосудистой сети при по-
мощи эмболов для пролонгированного воздействия
на опухоль растворенных в них противоопухолевых
препаратов.

I.Что такое регионарная химиотерапия (РХТ)?
Регионарная химиотерапия (РХТ) определяется как местная химиотерапия, воздействующая на часть/область тела или орган. При этом препарат (цитостатик или химиотерапевтический препарат) вводится в артерию, снабжающую кровью саму опухоль или ее область. За счет регионарной терапии при первом прохождении через опухоль в ткань всасывается большое количество цитостатика. Непосредственно после этой терапии кровь промывается путем химиофильтрации, в ходе которой удаляется избыток препарата.

Каков принцип действия регионарной химиотерапии?
Некоторые опухоли требуют чрезвычайно высокой концентрации противоракового препарата, в то время как для других эффект достигается при меньшей концентрации. Как правило, для полного разрушения солидной опухоли требуется приблизительно шестикратная концентрация по сравнению с традиционной системной химиотерапией. Различные методики регионарной химиотерапии позволяют достигать в 3—10 раз более высокой концентрации цитостатиков в опухоли, а в экстремальных случаях и в 80 раз более высокой.

Какие существуют методики применения РХТ?
I. Внутриартериальное вливание через ангиокатетер
Для осуществления артериального вливания необходимо под местным наркозом ввести катетер в область паха, при рентгеноконтроле продвинуть его кончик в зону опухоли и установить там.
Преимущества: Незначительное вмешательство
Недостатки: Во время лечения пациенту показан постельный режим (3-4 дня)
Рисунок: Введение ангиокатетера в чревный ствол (truncus coeliacus) при регионарной химиотерапии печеночных метастазов карциноидной опухоли тонкой кишки. Эти метастазы так хорошо снабжаются кровью, что могут быть выявлены путем введения в артерию контрастного вещества.

II. Артериальное вливание через хирургически установленный порт-катетер
При использовании этой методики во время операции непосредственно в артерию, питающую кровью опухоль, имплантируется порт-катетер. Такой способ позволяет обрабатывать опухоль с максимально возможной периодичностью без необходимости повторного выполнения операции.
Преимущества: После операции пациент полностью мобилен, поскольку каждое артериальное вливание осуществляется путем проникновения через порт артериального катетера. Операция дает лучшее представление о распространении опухоли.
Недостатки. Необходимость операции и соответствующий риск

Внутриартериальное вливание При карциноме молочной железы справа через порт быстрого доступа универсального подключичного катетера. Процедура позволяет проводить артериальную терапию с подачей высококонцентрированного цитостатического препарата в области правой грудной стенки, подмышек и боковой части шеи. Тем самым охватываются также все области дренирования лимфы.


При каких разновидностях рака РХТ особенно эффективна?
Новообразования с хорошей реакцией
Рак груди (карцинома молочной железы и метастазы)
Опухоли головного и шейного отдела
Рак желудка
Рак мочевого пузыря
Рак простаты
Рак яичника
Холангиоцеллюлярный рак
Рак анального канала
Гипернефрома
Рак щитовидной железы
Рак пищевода
Карциноидные опухоли

Новообразования с реакцией от средней до хорошей
Бронхиальная карцинома
Рак поджелудочной железы
Гепатоцеллюлярный рак печени
Саркомы мягких тканей
Злокачественная меланома
Рак шейки матки
Новообразования с реакцией от слабой до средней
Рак толстой и прямой кишки
Рак желчного пузыря

II. Методика гемостатической эмболизации сосудов
Методика гемостатической эмболизации сосудов
внутренних органов предупреждает возникновение
либо обеспечивает надежный гемостаз при кровоте-
чениях из сосудов распадающейся опухоли, предупре-
ждает возникновение внутренних ятрогенных кро-
вотечений при интервенционных вмешательствах,
может быть эффективно применена с превентивной
целью для уменьшения объема кровопотери во вре-
мя предстоящего хирургического вмешательства

Процедура механической остановки кровотока в злокачественном новообразовании преследует следующие цели:
1)Развитие ишемии (нарушение кровопитания) мутированных тканей, что приводит к стойкой ремиссии или распаду новообразования. В некоторых случаях такой вариант развития событий может уберечь пациента от радикального вмешательства.
2)Профилактика спонтанного кровотечения во время хирургической операции по иссечению опухоли.
3)Уменьшение размера онкоформирования, что в перспективе позволяет точнее удалить онкологию.
4)Паллиативная помощь тяжелобольным за счет снижения роста патологии и, как следствие, облегчение раковых болей. Улучшение самочувствия онкобольного при этом носит кратковременный характер.

На чем основано проведение катетерной эмболизации?
Для визуализации кровеносного сосуда используется рентгенологическое обследование на фоне введения контрастного материала. Под рентгеновским контролем врач вводит катетер через кожу в сосуд и продвигает его до необходимой точки. После этого в сосуд или сосудистую мальформацию через катетер вводится синтетический материал или лекарственное вещество (эмболизирующий препарат).

В онкологической практике принято различать следующие типы эмболизации:
Предоперационная — она же считается начальным этапом радикального вмешательства.
Самостоятельная методика противоракового воздействия — этот тип наиболее часто применяется при новообразованиях печени и почек.
Паллиативная помощь, которая основывается на остановке кровотечения, устранении боли и стабилизации злокачественного роста.

Преимущества эмболизации опухоли для онкологических больных
Процедура не оказывает механического повреждения соседних к опухоли тканей.
Быстрая реабилитация и восстановление онкобольного.
Простота выполнения манипуляции.
Минимальное количество постоперационных осложнений.
Точечное воздействие на злокачественное новообразование.
Отсутствие швов и разреза мягких тканей.

Недостатки эмболизаци при лечении раковых больных
Позитивный результат терапии во многом зависит от опыта и квалификации хирурга-онколога.
Высокая вероятность внедрения эмболов в близлежащие физиологически здоровые ткани.
Нередко клиническая картина онкозаболевания исключает эмболизацию опухоли.
После успешного лечения часто могут возникать рецидивы.
Наличие постоперационных болей в зоне роста опухоли.

Опухоли костей и мягких тканей

Масляная химиоэмболизация печеночной артерии. Целиакография

III. Методика регионарной химиоэмболизации
обеспечивающая создание в опухолевой ткани высокой,
достаточной для достижения терапевтического эф-
фекта, концентрации противоопухолевых препаратов
и уменьшение их системного токсического влияния
на организм больного, нашла применение при неопе-
рабельных опухолях печени, поджелудочной железы,
почек и др.

КАКИМ ОБРАЗОМ ДЕЙСТВУЕТ ХИМИОЭМБОЛИЗАЦИЯ?
Химиоэмболизация действует против опухоли двумя путями:
Во-первых, прицельное введение химиопрепарата в сосуды, которые питают опухолевое образование, позволяет достичь попадания высоких концентраций химиопрепарата непосредственно в опухоль.
Во-вторых, при помощи введения в просвет сосудов, непосредственно питающих опухоль, эмболов (специальных мелких частиц) происходит прекращение кровоснабжения(питания кровью) опухоли.

Химиоэмболизация обычно применяется в тех случаях, когда заболевание ограничено, в основном, печенью. Это может быть первичная опухоль или распространение на печень рака других органов (метастазирование).
Химиоэмболизация подходит при следующих видах рака:
Гепатома или печеночно-клеточная карцинома (первичный рак печени)
Метастазы в печень при:
Раке толстого кишечника
Раке молочной железы
Карциноидных опухолях и других нейроэндокринных опухолях
Опухолях из островковых клеток поджелудочной железы
Меланоме сетчатки глаза
Саркомах
Других первичных сосудистых опухолях

Преимущества и риски проведения химиоэмболизации
Преимущества:
-В 2/3 случаев химиоэмболизация обеспечивает временное прекращение роста опухоли печени или вызывает сокращение ее объема. В зависимости от типа опухоли этот эффект сохраняется в течение 10-14 месяцев, причем после возобновления роста опухоли в большинстве случаев процедуру можно повторить.
-Для контроля роста опухоли химиоэмболизацию можно сочетать с другими методами противоопухолевого лечения: химио- и радиотерапией, абляцией опухоли.
-Летальные исходы при раке, ограниченном одной лишь печенью, обычно обусловлены развитием печеночной недостаточности при росте опухоли, но не ее распространением на другие органы. Химиоэмболизация в таких случаях останавливает рост опухоли, что позволяет сохранить функцию печени и обеспечивает относительно нормальное качество жизни.

Любая процедура, которая подразумевает нарушение целостности кожи, несет риск развития инфекции. Тем не менее, в данном случае вероятность развития инфекции, которая требует антибиотикотерапии, составляет меньше 1 на 1000 случаев.
Любая процедура, которая сопровождается введением катетера внутрь кровеносного сосуда, сопряжена с некоторыми рисками. К ним относится риск повреждения стенки сосуда, кровоизлияние или кровотечение в месте введения катетера и инфицирование.
Всегда существует вероятность попадания эмболизирующего вещества в здоровые ткани, что сопровождается нарушением их кровотока и питания.

Поскольку частью процедуры является ангиография, отмечается крайне невысокий риск развития аллергической реакции на контрастный материал.
Поскольку частью процедуры является ангиография, отмечается невысокий риск повреждения почек контрастным материалом, особенно у пациентов с сахарным диабетом или на фоне уже имеющегося заболевания почек.
К побочным реакциям на химиопрепараты относится тошнота, облысение, лейкопения (снижение количества лейкоцитов), тромбоцитопения (снижение количества тромбоцитов), анемия. Поскольку при ХЭ основная доза химиопрепарата остается в печени, данные реакции выражены незначительно.
Серьезные осложнения при проведении ХЭ отмечаются в одном случае из 20. Самыми опасными из них являются инфекция печени и повреждение печеночной ткани. Исследования показывают, что в 1% случаев ХЭ сопровождается летальным исходом, что обусловлено развитием тяжелой печеночной недостаточности.
- Главная
- Разное
- Диагностическая и лечебная интервенционная радиология в онкологии

Диагностическая и лечебная интервенционная радиология в онкологии
Докладчик:
Чехранов Владислав Алексеевич 501 группа
Авторы:
Рыбникова Алина Вячеславовна 616 группа
Чехранов Владислав Алексеевич 501 группа
Рубанова Евгения Сергеевна 608 группа

Интервенционная радиология – это субдисциплина радиологии, которая включает в себя способы диагностики и лечения различных заболеваний путём использования чрескожных доступов, катетеров и других малотравматичных инструментов, обычно под локальной анестезией, под контролем методов визуализации.

Этапы развития интервенционной радиологии
Ангиографическая методика лечения и диагностики ЖКК
Использование ультразвука и РКТ для контроля аспирационной игольной биопсии и дренирования жидкость-содержащих образований
Расширение баллонными катетерами стриктур сосудов (ангиопластика)
Методы сосудистой эмболизации и эмболотерапии
Чрескожные пункционные технологии для манипуляции на желчном и мочевом трактах.
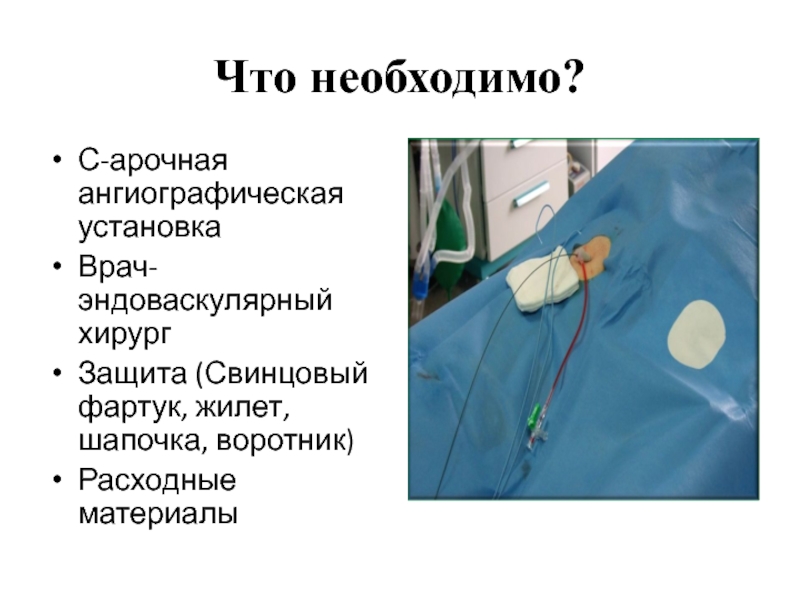
С-арочная ангиографическая установка
Врач-эндоваскулярный хирург
Защита (Свинцовый фартук, жилет, шапочка, воротник)
Расходные материалы
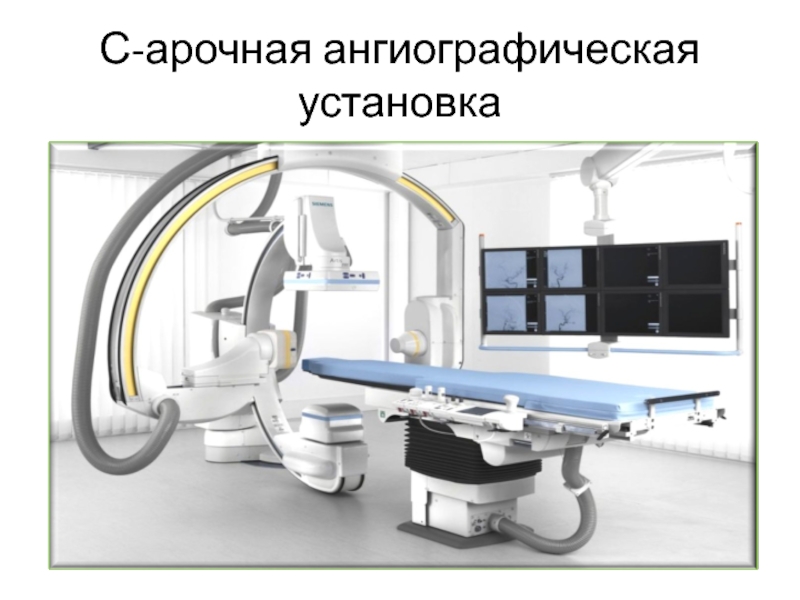
С-арочная ангиографическая установка

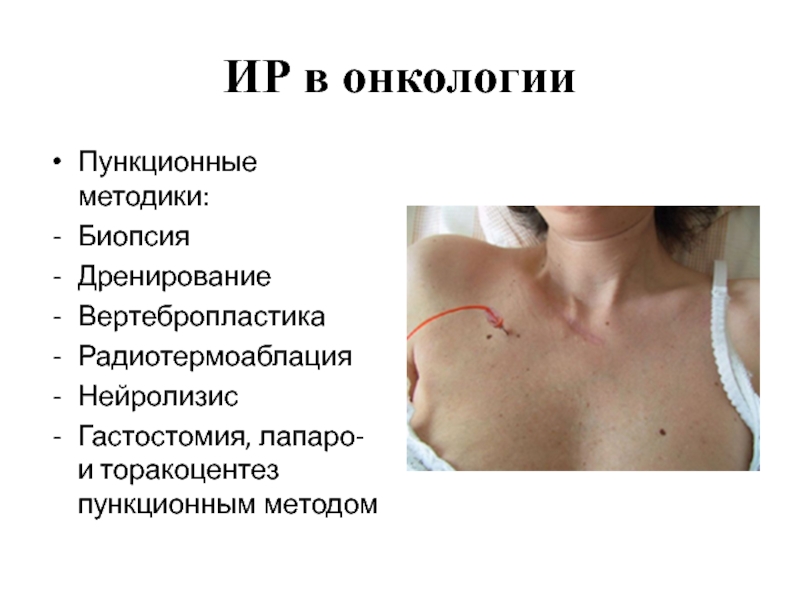
Пункционные методики:
Биопсия
Дренирование
Вертебропластика
Радиотермоаблация
Нейролизис
Гастостомия, лапаро- и торакоцентез пункционным методом
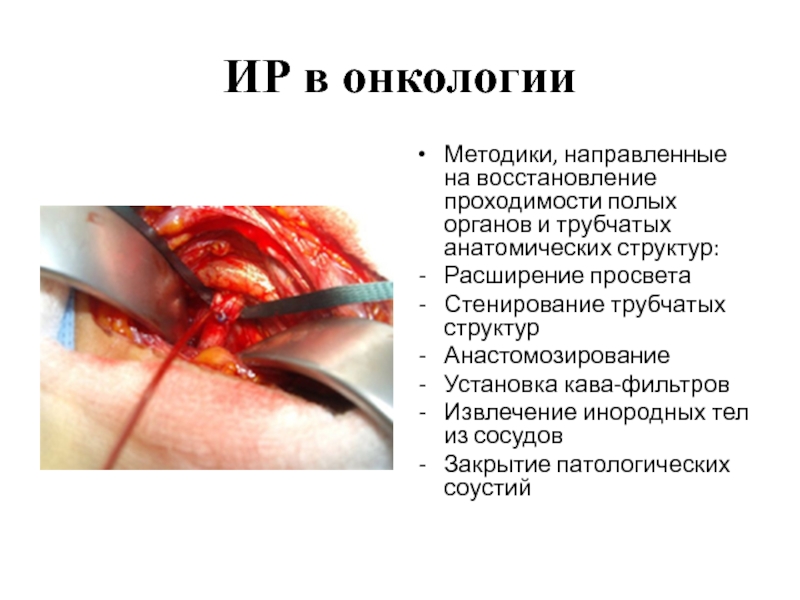
Методики, направленные на восстановление проходимости полых органов и трубчатых анатомических структур:
Расширение просвета
Стенирование трубчатых структур
Анастомозирование
Установка кава-фильтров
Извлечение инородных тел из сосудов
Закрытие патологических соустий

Лечебная ИР в онкологии
- внутриартериальная регионарная химиотерапия;
-ишемическая/гемостатическая эмболизация питающих опухоль артериальных сосудов;
-химиоэмболизация, использующая замедление и/или остановку кровотока в сосудистой сети при помощи эмболов для пролонгированного воздействия на опухоль растворенных в них противоопухолевых препаратов.

Регионарная химиотерапия (РХТ) определяется как местная химиотерапия, воздействующая на часть/область тела или орган. При этом препарат (цитостатик или химиотерапевтический препарат) вводится в артерию, снабжающую кровью саму опухоль или ее область.
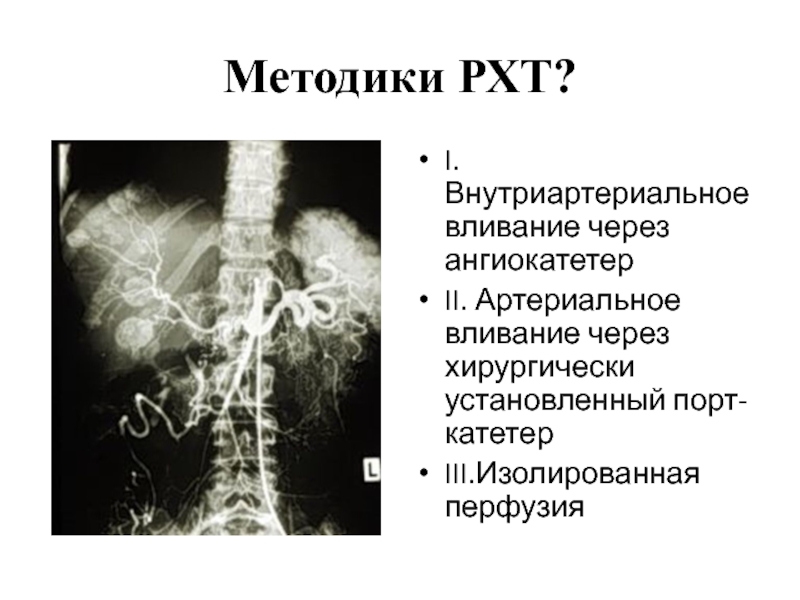
I. Внутриартериальное вливание через ангиокатетер
II. Артериальное вливание через хирургически установленный порт-катетер
III.Изолированная перфузия

Гемостатическая эмболизация сосуда
Методика гемостатической эмболизации сосудов внутренних органов предупреждает возникновение либо обеспечивает надежный гемостаз при кровотечениях из сосудов распадающейся опухоли, предупреждает возникновение внутренних ятрогенных кровотечений при интервенционных вмешательствах, может быть эффективно применена с превентивной целью для уменьшения объема кровопотери во время предстоящего хирургического вмешательства

В онкологической практике принято различать следующие виды эмболизации:
Предоперационная — она же считается начальным этапом радикального вмешательства.
Самостоятельная методика противоракового воздействия — этот тип наиболее часто применяется при новообразованиях печени и почек.
Паллиативная помощь, которая основывается на остановке кровотечения, устранении боли и стабилизации злокачественного роста.

Преимущества и недостатки
+
1. Процедура не оказывает механического повреждения соседних к опухоли тканей.
2. Быстрая реабилитация и восстановление онкобольного.
3. Простота выполнения манипуляции.
4. Минимальное количество постоперационных осложнений.
5. Точечное воздействие на злокачественное новообразование.
6. Отсутствие швов и разреза мягких тканей.
-
1. Позитивный результат терапии во многом зависит от опыта и квалификации хирурга-онколога.
2. Высокая вероятность внедрения эмболов в близлежащие физиологически здоровые ткани.
3. Нередко клиническая картина онкозаболевания исключает эмболизацию опухоли.
4. После успешного лечения часто могут возникать рецидивы.
5. Наличие постоперационных болей в зоне роста опухоли.
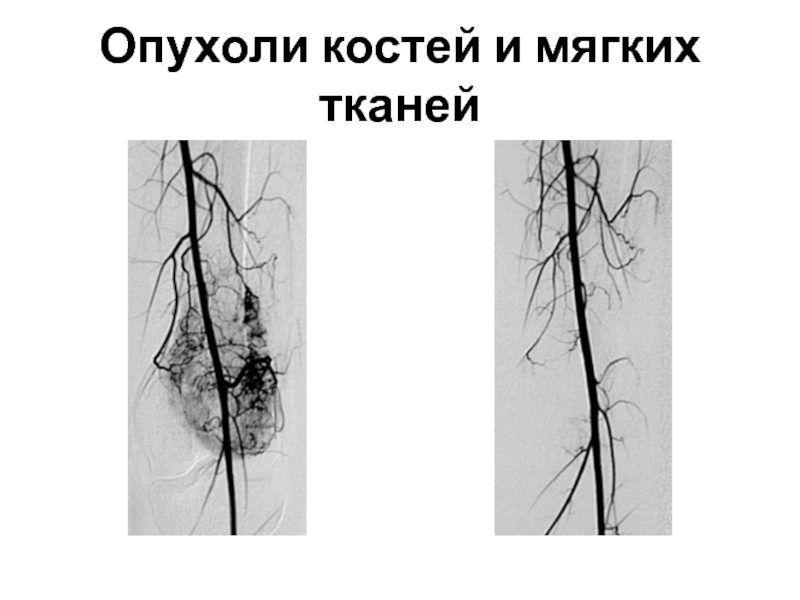
Опухоли костей и мягких тканей

Что такое химиоэмболизация?

Преимущества и недостатки
+
- У 75% пациентов, прошедших через эту сложную, хотя и малотравматичную, операцию, злокачественная опухоль печени либо на некоторое время прекращает свой рост, либо существенно уменьшается в размерах.
- Химиоэмболизация прекрасно сочетается с другими методиками противоопухолевой терапии (это может быть абляция опухоли, радио- и химиотерапия). Комплексное использование этих методов лечения позволяет контролировать рост злокачественного новообразования.
- Процедура химиоэмболизации позволяет во многом улучшить качество жизни больных людей.
-
- Будучи процедурой, требующей нарушения целостности кожных покровов, химиоэмболизация сопряжена с риском занесения инфекции.
- Еще одна категория рисков при химиоэмболизации обусловлена необходимостью введения катетера в просвет кровеносного сосуда.
- Достаточно велик риск проникновения эмболизирующего препарата в клетки здоровых тканей: это чревато нарушением их кровоснабжения и питания.
- Риск инфицирования операционной раны достаточно высок даже при условии назначения антибиотиков.
- У некоторых пациентов (такие случаи довольно редки) может возникнуть аллергическая реакция на контрастирующее вещество, вводимое при выполнении ангиографии – неотъемлемого компонента процедуры химиоэмболизации.
- Это же контрастное вещество в редких случаях может стать виновником повреждения почек у пациентов, страдающих выраженной патологией этого органа или у больных сахарным диабетом.


За сравнительно короткий период существования интервенционная радиология сегодня стала неотъемлемой составляющей современной онкологии. В арсенале интервенционного радиолога имеется широкий выбор высокоэффективных малоинвазивных радиологических и гибридных технологий различной направленности, включая диагностические и лечебно-диагностические, специальные противоопухолевые и сопроводительные, которые могут применяться как в самостоятельном варианте, так и сочетаться с другими способами лечения онкологических больных, зачастую сопоставимых по результатам с традиционной хирургией.(2)
Читайте также:

