Инфильтрат в брюшной полости при онкологии
- Брюшная полость и брюшина — что это такое?
- Виды рака брюшной полости
- Симптомы
- Осложнения
- Диагностика рака брюшной полости
- Лечение
- Прогноз и профилактика
Брюшная полость и брюшина — что это такое?
Брюшная полость — это пространство в животе, заполненное кишечником и другими внутренними органами. Сверху она ограничена диафрагмой, снизу — тазом, по бокам и спереди — мышцами брюшного пресса, сзади — позвоночником и поясничными мышцами.
Изнутри полость живота выстилает тонкая пленка из соединительной ткани — брюшина. Ее висцеральный листок, покрывает внутренние органы, париетальный — стенки брюшной полости. Между листками брюшины находится замкнутое щелевидное пространство, а в нем — минимальное количество жидкости, выполняющей функцию смазки и обеспечивающей свободное скольжение органов. В некоторых местах брюшина образует складки: брыжейки, на которых подвешены органы, сальники.
Внутренние органы могут быть расположены по отношению к брюшине по-разному:
- Интраперитонеально — покрыты брюшиной со всех сторон.
- Мезоперитонеально — покрыты частично.
- Ретроперитонеально (забрюшинно) — покрыты только с одной стороны.
Виды рака брюшной полости
Первичные опухоли брюшной полости встречаются редко. Они бывают разных типов: мезотелиальные, эпителиальные, гладкомышечные неопределенные. Особая разновидность злокачественных опухолей брюшины — псевдомиксома. Она развивается из клеток, которые продуцируют большое количество желеобразной жидкости. Чаще всего такие опухоли распространяются на брюшину из аппендикса.
Зачастую первичные злокачественные опухоли брюшной полости имеют строение и ведут себя, как рак яичников. Они вызывают сходные симптомы, и врачи применяют для борьбы с ними примерно одни и те же методы лечения.
Известно, что в целом вероятность развития первичного рака брюшной полости выше у женщин, чем у мужчин. Риски повышаются с возрастом. Есть связь между вероятностью развития заболевания и изменениями в генах BRCA1, BRCA2.
При разных типах рака на поздних стадиях опухолевые клетки отделяются от первичного новообразования, распространяются по организму и образуют новые очаги в различных органах, в том числе в брюшной полости. Этот процесс называется метастазированием. Чаще всего в брюшину метастазирует рак толстой и прямой кишки (в 15% случаев), желудка (в 50% случаев), яичника (в 60% случаев), поджелудочной железы. Иногда метастазы распространяются из органов, которые находятся за пределами брюшной полости: молочной железы, плевры (пленки из соединительной ткани, покрывающей легкие и выстилающей стенки грудной полости), легкого.

Симптомы
Зачастую в течение длительного времени симптомы при раке брюшной полости отсутствуют, поэтому нередко его диагностируют на поздних стадиях. Проявления патологии неспецифичны, их можно легко принять за признаки других заболеваний:
- Дискомфорт, спазмы, вздутие живота.
- Повышенное газообразование в кишечнике.
- Жидкий стул.
- Запоры.
- Тошнота.
- Снижение аппетита.
- Частые мочеиспускания.
- Одышка.
- Быстрый набор или потеря массы.
- Кровотечения из прямой кишки, у женщин — из влагалища.
Если канцероматоз брюшины возник в результате метастазирования злокачественной опухоли из другого органа, сильно ухудшается прогноз. Противоопухолевая терапия начинает работать хуже, потому что многие препараты плохо проникают через брюшину.
Осложнения
Главное осложнение данного заболевания — асцит. Этим термином называют состояние, при котором в животе скапливается жидкость. В норме между листками брюшины ежедневно вырабатывается и всасывается около 1,5 жидкости. При канцероматозе нарушается отток лимфы, и жидкость всасывается хуже. Она начинает скапливаться внутри живота.
Пока жидкости немного, больной не испытывает каких-либо симптомов. Затем начинают беспокоить тяжесть, тупые боли в нижней части живота. Затрудняется дыхание, возникает одышка. Из-за того что жидкость сдавливает органы, больной жалуется на отрыжку, тошноту, проблемы со стулом и мочеиспусканием. Живот увеличивается в размерах, может возникать пупочная грыжа. При выраженном асците развивается сердечная недостаточность, отеки.
Диагностика рака брюшной полости
Злокачественную опухоль помогают выявить следующие методы диагностики:
- Ультразвуковое исследование. Зачастую его назначают в первую очередь, как простой, доступный, безопасный и в то же время информативный метод диагностики.
- Компьютерная и магнитно-резонансная томография помогают оценить состояние брюшины и внутренних органов, выявить патологические образования, оценить степень распространения рака.
- ПЭТ-сканирование в настоящее время является золотым стандартом для поиска отдаленных метастазов.
- Биопсия — самый точный метод диагностики злокачественных опухолей. Врач может получить образец опухолевой ткани во время диагностической лапароскопии — процедуры, во время которой через проколы в брюшной стенке в живот вводят миниатюрную видеокамеру и специальные инструменты. Образец отправляют в лабораторию, проводят его гистологическое, цитологическое исследование, молекулярно-генетический анализ. Это помогает не только диагностировать рак, но и установить природу опухолевых клеток, разобраться, какими препаратами с ними лучше бороться.
- Рентгеноконтрастные исследования помогают оценить состояние пищеварительного тракта, выявить опухолевые очаги и другие патологии.
- Анализ на онкомаркер CA-125 (углеводный антиген 125). Уровень этого вещества повышается в крови при раке брюшины и яичников. Но для диагностики этих заболеваний данный анализ недостаточно точен. Как правило, его применяют для контроля течения рака и эффективности лечения.
- Женщины должны пройти осмотр у гинеколога.
Обычно врачи-онкологи устанавливают диагноз на основании таких признаков, как асцит, утолщение брюшины, появление на ней узелков, смещение, сдавление петель кишки, патологические изменения со стороны печени и складок брюшины — сальников.

Лечение
Выбор тактики лечения зависит от локализации, размеров, стадии злокачественной опухоли, количества узлов. Врач также должен учитывать общее состояние больного, его возраст, наличие сопутствующих заболеваний.
Зачастую при поражении брюшины опухолевых очагов очень много, многие из них мелкие, и полностью их удалить невозможно. Хирургическое лечение направлено на удаление как можно большего числа очагов, как правило, оно предшествует химиотерапии. Обычно удаляют матку, яичники, участки кишечника, — словом, всё, что поражено злокачественной опухолью. Если злокачественное новообразование вызывает кишечную непроходимость или другие осложнения, проводят паллиативные хирургические вмешательства.
Для того чтобы уничтожить опухолевые клетки при первичном раке в полости живота, применяют химиопрепараты, зачастую те же, что при раке яичников. Лекарства вводят внутривенно или в брюшную полость — такая химиотерапия называется интраперитонеальной (внутрибрюшинной).
С 2018 года врачи Европейской клиники практикуют инновационный метод лечения канцероматоза брюшины — гипертермическую интраперитонеальную химиотерапию (HIPEC). Суть ее заключается в том, что хирург удаляет все достаточно крупные опухолевые очаги, а затем промывает полость живота подогретым раствором химиопрепарата. Это помогает уничтожить максимальное количество опухолевых клеток и существенно продлить жизнь больного.
При асците наши доктора проводят лапароцентез (прокол в брюшной стенке и выведение жидкости), устанавливают перитонеальные катетеры для постоянного оттока, проводят хирургические вмешательства, которые препятствуют дальнейшему накоплению асцитической жидкости.
На поздних стадиях проводится паллиативное лечение, которое помогает уменьшить симптомы и продлить жизнь больного.

Прогноз и профилактика
Прогноз при первичном раке брюшины напрямую зависит от того, удалось ли удалить все опухолевые очаги во время хирургического вмешательства. К сожалению, зачастую заболевание диагностируют на поздней стадии, поэтому после лечения часто развиваются рецидивы. Обычно пациентам требуется более одного хирургического вмешательства, курса химиотерапии.
Канцероматоз брюшины при метастазах других типов рака резко ухудшает прогноз. Обычно продолжительность жизни таких больных измеряется месяцами. Но HIPEC может ее существенно продлить, до нескольких лет — в случае, если проведение такого лечения возможно у конкретного пациента.
Специальных мер профилактики данного заболевания не существует. Нужно в целом вести здоровый образ жизни, женщинам — регулярно проходить осмотры у гинеколога. Мера профилактики метастазов в брюшину — своевременная диагностика и лечение злокачественных опухолей.
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
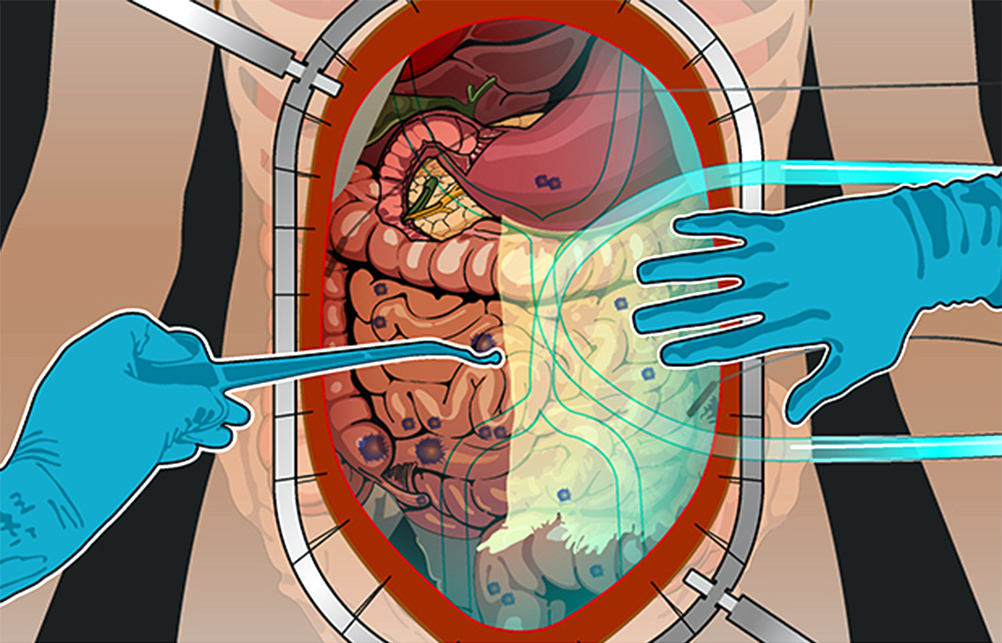
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
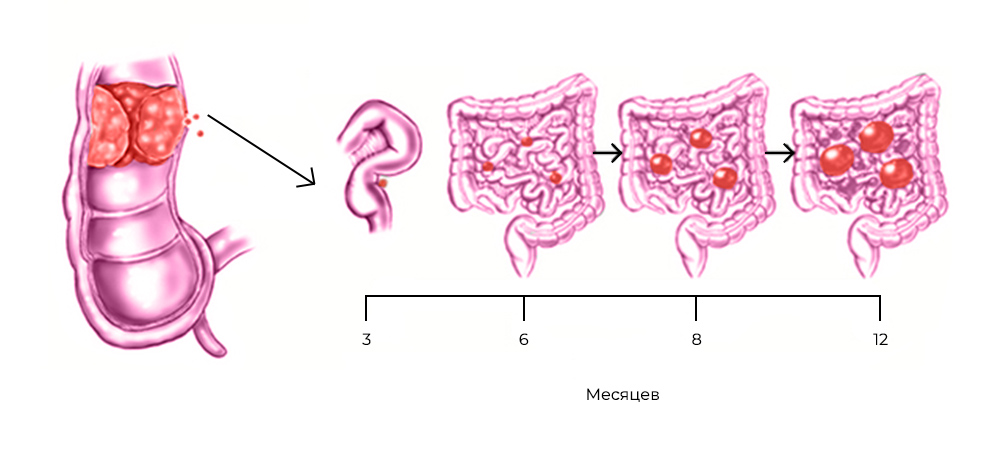
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
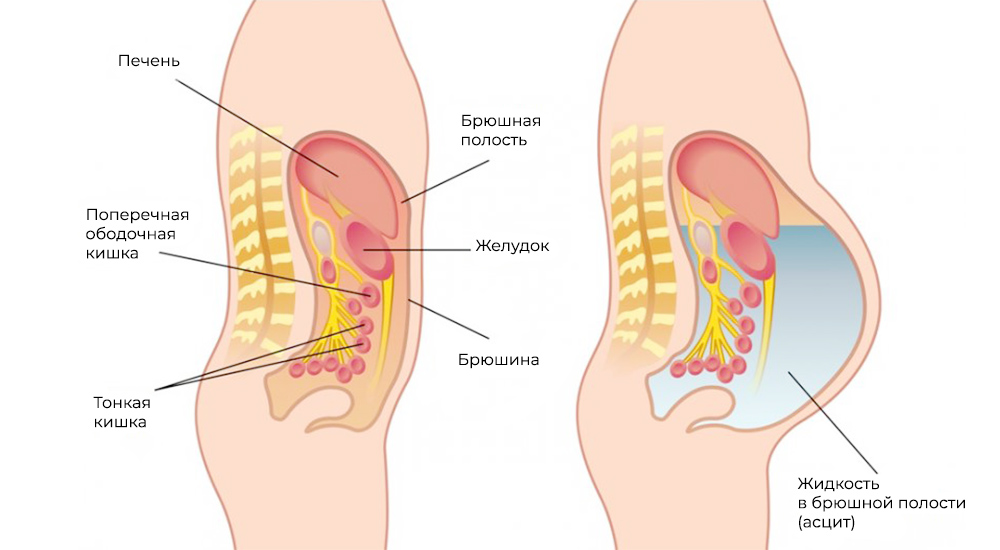
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
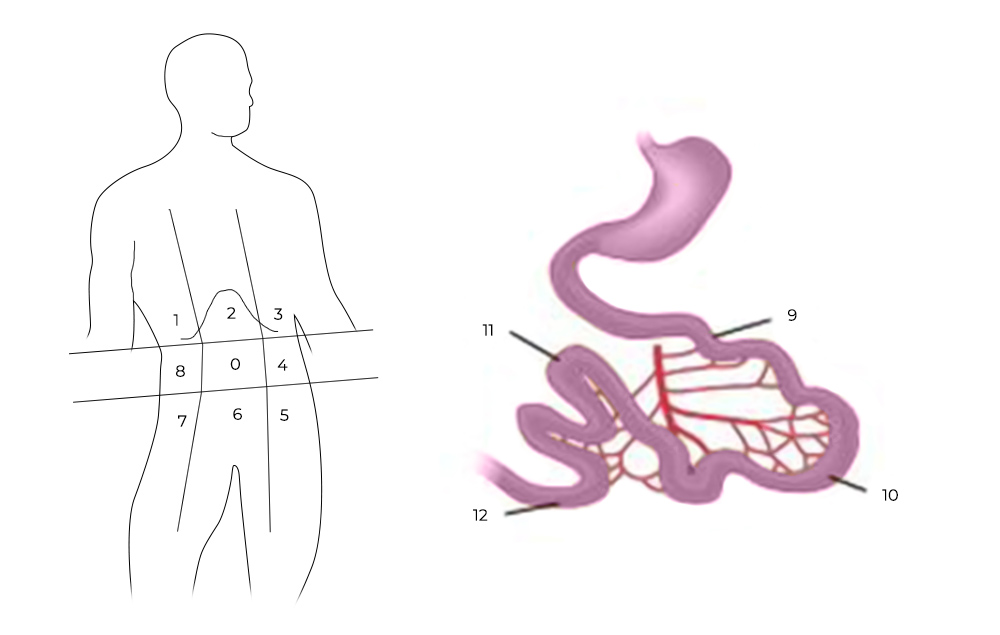
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
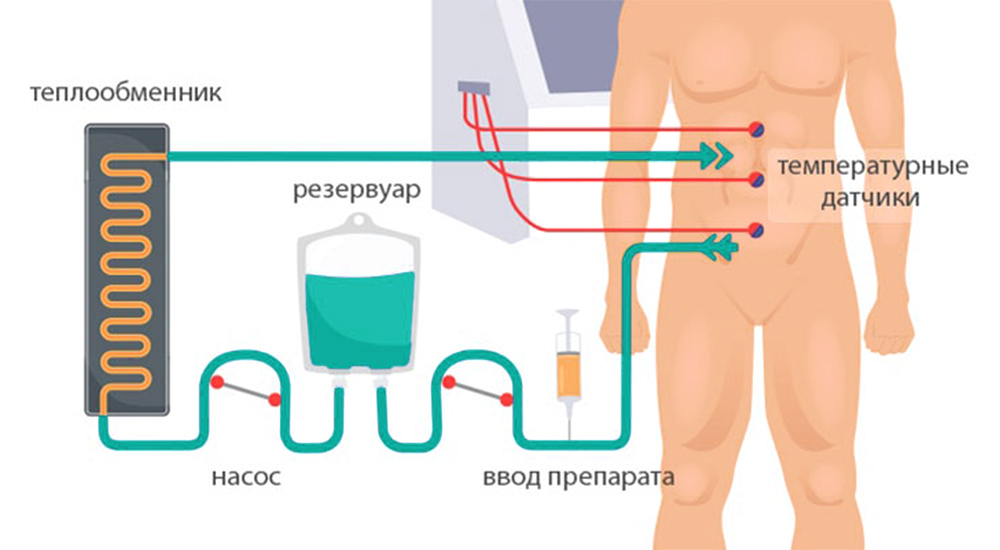
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
Рак брюшины – это злокачественное поражение мембраны, выстилающей внутреннюю полость брюшины. Рак брюшины может развиться на любой части листа брюшины и быть как первичным, так и имплантационным.
Первичный рак брюшины
Патологическая анатомия и микроскопическая картина злокачественных мезотелиом брюшины довольно однообразны. Опухоли имеют вид множественных узлов различных размеров белесоватого цвета или больших плоских инфильтратов, занимающих большие или меньшие участки париетальной и висцеральной брюшины и сальника. В ряде случаев органы брюшной полости бывают связаны опухолевым инфильтратом в один сплошной конгломерат. В брюшной полости скапливается геморрагический, реже серозный выпот. При гистологическом исследовании обнаруживаются гнезда мелких или более крупных клеток, напоминающих раковые клетки. Иногда они имеют вид кубических, цилиндрических или полигональных клеток. Нередко возникают трубчатые железистые образования с гигантскими многоядерными клетками. В клеточных элементах могут отмечаться то более, то менее ясно выраженные явления фагоцитоза. Клеточные группы разделены прослойками из плотной, реже рыхлой, соединительной ткани.
Метастатические опухоли брюшины характеризуются наличием опухолевого очага в соответствующем органе (главным образом в желудке, поджелудочной железе или в яичниках) и множественными мелкими просовидными узелками, как бы рассыпанными по париетальной и висцеральной брюшине или сливающимися между собой, либо в виде различной величины бляшек и инфильтратов. Обычно при этом имеет место метастатическое поражение сальника, превращенного в мешкообразный инфильтрат. Нередки метастазы в пупок.
Симптомы и клиническая картина
Клиническая картина злокачественных мезотелиом брюшины не имеет характерных особенностей. Больные жалуются на нарастающую слабость, периодические боли в различных участках брюшной полости, увеличение размеров живота, нарушения функций кишечника. Быстро нарастает кахексия и появляются отеки конечностей.
Диагностика в связи с отсутствием характерных признаков первичного рака брюшины трудна. Правильный диагноз обычно может быть установлен лишь при лапаротомии и гистологическом исследовании удаленного узелка из сальника или париетальной брюшины, а иногда лишь на аутопсии. В некоторых случаях диагноз мезотелиомы основывается на данных цитологического исследования осадка выпущенной перед операцией асцитической жидкости, хотя это удается далеко не всегда.
Дифференциальная диагностика основана главным образом на исключении асцита на почве цирроза печени и туберкулезного перитонита.
Выяснение первичного или метастатического характера поражения брюшины имеет весьма важное значение. Но еще существеннее установление источника метастатического поражения брюшины, так как при раке желудка, поджелудочной железы, толстой или прямой кишки с диссеминацией по брюшине приходится отказаться от попыток оперативного лечения или прибегать к весьма ограниченным паллиативным мероприятиям; метастатические поражения брюшины при раке яичника не останавливают хирурга от удаления основных опухолевых очагов и резекции сальника, особенно при папиллярных опухолях. Последующая внутрибрюшинная химиотерапия или рентгенотерапия в комбинации с облучением гипофиза и андрогенотерапией позволяют продлить и улучшить жизнь ряду таких больных на сроки от 1 до 3 лет.
Самое эффективное лечение первичного рака брюшины – радикальное, но оно достижимо только при условии своевременного диагностирования, так как быстрота метастазирования и обширность поражения к моменту установления правильного диагноза исключают успешность оперативного лечения.
Имплантационный рак брюшины
Примером имплантационного рака брюшины могут служить псевдомиксомы, как наиболее важные в клиническом отношении.
Псевдомиксомы брюшины встречаются более часто, чем другие имплантационные опухоли, хотя в общем являются тоже весьма редким заболеванием. Причинами развития псевдомиксом брюшины являются разрыв псевдомуцинозной кисты яичника или обсеменение брюшинного покрова при миксоглобулезе червеобразного отростка.
При разрыве кисты яичника, помимо попадания слизистых масс в брюшную полость, эпителий стенки кисты продолжает секретировать и выделять новые количества слизи, вызывая прогрессирование процесса. В результате реактивного воспаления брюшины слизистые массы могут частично инкапсулироваться, в них может прорастать соединительная ткань. При миксоглобулезе червеобразного отростка не обязательна даже перфорация аппендикса: в результате полного замещения стенки отростка слизистыми массами последние вместе с эпителиальными клетками могут попасть на брюшину, где в результате имплантации эпителия возникают новые очаги, продуцирующие слизь.
Патологоанатомически имплантационный рак брюшины характеризуется наличием в брюшной полости студенистых желеподобных масс, иногда в очень больших количествах. Различают ограниченные и диффузные формы псевдомиксом. При гистологическом исследовании псевдомиксом клеточные элементы не определяются, массы состоят из свертков фибрина и бесструктурной слизи, брюшинный покров резко утолщен и гиперемирован.
Симптомы и клиническая картина
Клиника имплантационного рака брюшины не отличается яркостью симптомов. Болезнь годами может протекать незаметно, не вызывая значительных расстройств у больных. В других случаях больные жалуются на увеличение размеров живота, вздутия, боли.
При диффузных формах, когда имеет место обильное скопление желеподобных масс и значительное увеличение живота, клиническая картина напоминает цирроз печени с асцитом. Диагностическое значение имеет неизменность результатов перкуссии живота при горизонтальном и вертикальном положении больного. Скопления большого количества студенистых масс в брюшной полости вызывают своеобразную напряженность и малую податливость брюшной стенки при ощупывании.
Производимая пункция брюшной полости позволяет поставить правильный диагноз, при ограниченных формах окончательный диагноз может быть установлен лишь путем лапаротомии.
Лечение псевдомиксом – только оперативное, преследующее цель удаления первичного источника имплантационного рака брюшины и как можно большего количества кистозных полостей со слизистыми массами. Даже при яичниковом происхождении псевдомиксом необходима аппендэктомия, так как возможно одновременное существование кисты яичника и миксоглобулеза отростка.
Читайте также:

