Иммунокомпетентные клетки при онкологии
Иммунотерапия – это способ лечения различных заболеваний с помощью иммунокомпетентных клеток, иммунных препаратов, сывороток или антител. При этом вводимые вещества либо активируют собственный иммунитет организма, либо сами влияют на патологический очаг.
Иммунокомпетентными клетками называют зернистые лейкоциты, Т- и В-лимфоциты и макрофаги. Они призваны бороться с чужеродными агентами, попадающими в организм.

Фото 1. Иммунотерапия - новый этап в борьбе с серьезными заболеваниями. Источник: Flickr (harie.m).
Это интересно! Антитела являются белковыми структурами, которые атакуют чужеродные антигены и способствуют их выведению из организма. Некоторые чужеродные агенты, например, опухолевые клетки, вовсе не вызывают иммунной реакции, что делает организм беззащитным перед ними.
Показания к назначению иммунотерапии
Данный способ лечения применяют при различных заболеваниях и патологических состояниях, например, таких, как:
- Аллергические реакции;
- Инфекционные заболевания бактериальной, вирусной и грибковой природы;
- Паразитарные заболевания;
- Иммунодефицитные состояния;
- Аутоиммунные заболевания;
- Онкология 1 и 2 стадии в комплексе с хирургическим лечением;
- Онкология 3 и 4 стадии самостоятельно или в комплексе с лучевой терапией.
Обратите внимание! Последние два показания появились сравнительно недавно и на данный момент находятся в стадии клинических исследований. Врачи считают, что иммунотерапия может стать основным способом лечения рака.
Принципы и суть иммунотерапии
Суть данного метода лечения заключается в активной стимуляции собственных иммунных сил организма или пассивном введении иммунных препаратов.
Например, введение антител против раковых клеток является пассивным способом борьбы с онкологией, поскольку антитела воздействуют на очаг, не влияя при этом на собственный иммунитет. Если вводимые препараты, например, модуляторы, активируют иммунные клетки организма, а те в свою очередь начинают бороться с раковыми клетками, то этот процесс называют активным.
Иммунитет – это основное звено защиты организма от чужеродных агентов. В случае онкологического заболевания собственный иммунитет не может распознать патологический очаг. Проще говоря, иммунокомпетентные клетки не видят опухоль и не знают, что ее следует уничтожить.
Иммунотерапия в этом случае направлена на обучение собственных клеток атаковать данный вид ткани или введение иммунных препаратов, которые уже умеют это делать.
Методы проведения иммунотерапии
Существует несколько методов:
- Моноклональные антитела. Это пассивный способ, при котором в организм вводят антитела, направленные на конкретный вид опухоли.
- Клеточная терапия. У больного производят забор иммунокомпетентных клеток, затем активируют их на борьбу с раковыми клетками и снова вводят в организм.
- Вакцины. В организм пациента вводят антигены, схожие с опухолевыми. При этом иммунные клетки сами обучаются их атаковать и вместе с антигенами вакцины уничтожают и раковую опухоль.
- Ингибиторы контрольных точек. Контрольные точки – это рецепторы на поверхности клеток, при активации которых, происходит снижение иммунного ответа. Раковые клетки путем активации этих контрольных точек маскируют себя и иммунитет их не распознает. Существуют препараты, которые ингибируют (выключают) эти контрольные точки и возобновляют иммунный ответ. - Модуляторы. Это вещества, которые в целом укрепляют иммунную систему и улучшают ее работу, например, интерлейкины и интерфероны. На данный момент их польза в борьбе с опухолевыми клетками ставится под сомнение.
Противопоказания к проведению иммунотерапии
Список противопоказаний к иммунотерапии постоянно пересматривается, появляются новые исследования и более безопасные способы введения. На данный момент к основным противопоказаниям относятся:
- Декомпенсированная сердечная, почечная или печеночная недостаточность;
- Сахарный диабет в стадии декомпенсации;
- Кома и прекоматозные состояния;
- Тиреотоксикоз;
- Бронхиальная астма;
- Хронические заболевания в стадии обострения;
- Прием бета-блокаторов;
- Психические заболевания.
Это интересно! До недавнего времени онкологические заболевания также были противопоказанием к назначению иммунотерапии. Считалось, что препараты, стимулирующие иммунитет, способствуют росту опухолевых клеток. Однако в начале 2000-х годов ученые сумели обучить иммунные клетки атаковать опухоли, что позволило пересмотреть данное противопоказание.
Преимущества иммунотерапии
Главное преимущество такого способа лечения – высокая эффективность при относительной безопасности. Иммунитет является естественной защитой организма. Его активная стимуляция или пассивная имитация не нарушают биологическое равновесие организма.
Например, при использовании лучевой и химиотерапии вместе с опухолевыми клетками погибают клетки красного костного мозга и эпителий, снижается иммунитет и наступает анемия, что негативно влияет на общее состояние организма.
Фото 2. Иммунотерапия дает высокие шансы на излечение при раковых опухолях. Источник: Flickr (Robin Linares Olaya).
Иммунотерапия является высокоселективной. Она воздействует только на определенные клетки, для борьбы с которыми создан данный конкретный препарат. Это значительно уменьшает количество как побочных эффектов, тки противопоказаний.
Стоит помнить, что этот вид лечения еще мало изучен. Терапия показывает хорошие результаты, но об отдаленных прогнозах говорить еще рано.
Побочные эффекты
Еще не все побочные эффекты иммунотерапии изучены. На данный момент известны следующие:
- Значительное повышение концентрации глюкозы в крови;
- Снижение артериального давления;
- Потеря сознания;
- Тошнота и рвота;
- Головная боль;
- Аллергические реакции;
- Отеки;
- Интоксикация.
Это исследование включает в себя комплексную оценку субпопуляционного состава лимфоцитов (см. Иммунологическое обследование первичное), уровня циркулирующих иммунных комплексов, основных классов иммуноглобулинов периферической крови, а также упор сделан на расширенную оценку малых субпопуляций NK- и NK-T-клеток (Natural killers – "натуральные киллеры") , изменения со стороны которых косвенно отражают состояние противоопухолевого иммунитета. Наряду с этим проводится анализ Т-регуляторных клеток, связанных с развитием опухолевого процесса.
* Результаты исследования выдаются с заключением врача – аллерголога-иммунолога, доктора медицинских наук.
Набор тестов:
Иммунограмма, иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии.
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens.
Какой биоматериал можно использовать для исследования?
Как подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования.
- Полностью исключить прием лекарственных препаратов в течение 24 часов перед исследованием (по согласованию с врачом).
- Исключить физическое и эмоциональное перенапряжение в течение 24 часов до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
В современном понимании иммунный статус человека – это совокупность лабораторных показателей, характеризующих количественную и функциональную активность клеток иммунной системы в данный момент времени. Оценка иммунного статуса проводится с помощью иммунологического лабораторного обследования – иммунограммы. Иммунограмма крови не отражает избирательно состояние патологически измененного органа или системы, но позволяет оценить иммунную систему в целом (суммарный эффект изменения активности иммунной системы в ответ на чужеродный антиген).
Определение клеточного состава (иммунофенотипирование) лимфоцитов крови – основной компонент в оценке иммунного статуса – выполняется методом проточной цитофлюориметрии.
Иммунофенотипирование – это характеристика клеток, полученная при помощи моноклональных антител или каких-либо других зондов, позволяющих судить об их типе и функциональном состоянии по наличию того или иного набора клеточных маркеров.
Иммунофенотипирование лейкоцитов заключается в обнаружении на их поверхности маркеров дифференциации, или CD-антигенов. Лейкоциты экспрессируют ряд поверхностных и цитоплазматических антигенов, уникальных для своей субпопуляции и стадии развития.
CD-антигены (англ. cluster of differentiation antigens) – это антигены на поверхности клеток, маркеры, отличающие одни типы клеток от других. Дифференциации этих антигенов изучены и стандартизованы, им присвоены определенные номера. CD могут быть распознаны с помощью соответствующих моноклональных антител. Используя флюоресцентно меченные моноклональные антитела, связывающиеся с определенными CD, можно с помощью метода проточной цитометрии рассчитать содержание лимфоцитов, относящихся к различным по функции или стадии развития субпопуляциям.
В основе проточной цитофлюориметрии лежит фотометрическое и флюоресцентное измерение отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
Метод позволяет не только определить количественное соотношение основных популяций лимфоцитов –
- Т-лимфоциты (CD3 +CD19 - ),
- Т-хелперы/индукторы (CD3 +CD4 + CD45 + ),
- Т-цитотоксические лимфоциты (Т-ЦТЛ) (CD3 +CD8 + CD45 + ),
- истинные натуральные "киллеры" (NK-клетки) (CD3 -CD56 +CD45 + ),
- В-лимфоциты (CD19 +CD3 - ), –
но и оценить малые клеточные популяции, а также изучить их функциональную активность:
- Т-лимфоциты, экспрессирующие маркеры NK-клеток (Т-NK-клетки) (CD3 +CD16 +56 +CD45 + ),
- NK-клетки цитолитические (CD3 -CD16 +(orhigh)CD56dimCD45 + ),
- NK-клетки цитокинпродуцирующие (CD3 -CD16 -(orlow)CD56brightCD45 + ),
- NK-клетки, экспрессирующие альфа-цепь антигена CD8 (CD3 - СD8 + CD45 + ),
- активированные В-лимфоциты (CD3 -CD25 + CD45 + ),
- активированные Т-лимфоциты (CD3 +HLA-DR + CD45 + ) и активированные цитотоксические лимфоциты (CD8 +HLA-DR + CD45 + ),
- В-лимфоциты и активированные NK-клетки (CD3 -HLA-DR + CD45 + ),
- активированные Т-лимфоциты, экспрессирующие альфа-цепь рецептора ИЛ-2 (CD3 +CD25 + CD45 + ),
- регуляторные Т-хелперные клетки (CD4 +CD25brightCD127negCD45 + ), выполняющие иммуносупрессорную функцию.
Такое всестороннее изучение клеточного состава лимфоцитов в совокупности с результатами других тестов, входящих в состав исследования, позволяет установить более тонкие механизмы иммунологических нарушений. Они проводятся для уточнения степени и глубины поражения иммунной системы и подбора препарата для проведения последующей адекватной иммунокорригирующей терапии, оценки эффективности проводимого лечения, определения прогноза течения заболевания.
Когда назначается исследование?
Исследование рекомендовано для комплексного обследования пациентов, входящих в группу риска с инфекционным иммунопатологическим синдромом:
- частые ОРВИ, хронические инфекции ЛОР-органов: гнойные синуситы, отиты, периодически встречающиеся лимфадениты, вирусные пневмонии с тенденцией к рецидивированию;
- урогенитальные инфекции;
- рецидивирующий герпес различной локализации;
- гастроэнтеропатия с хронической диареей неясной этиологии, дисбактериозом;
- длительный субфебрилитет, лихорадка неясной этиологии;
- генерализованные инфекции: сепсис, гнойные менингиты и т.д.
Что означают результаты?
Уровень различных клеточных популяций лимфоцитов может повышаться или понижаться при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
8 февраля 2019 11:11
Человеку, оказавшемуся беспомощным в сложной жизненной ситуации, свойственно цепляться за самые эфемерные надежды. Время от времени распространялись слухи о необъяснимых исцелениях — вопреки прогнозам врачей, почти чудесным образом опухоль исчезала. Эти редчайшие случаи как бы намекали, что человек все же не полностью беззащитен перед болезнью. Есть в его распоряжении какая-то сила, неизвестная и неподконтрольная медицине.
Ключевой игрок — лимфоциты. В этих кровяных клетках происходят случайные перестройки особых генов, в результате чего в каждом лимфоците вырабатывается белок-иммуноглобулин, способный узнавать какую-то специфическую загогулину на других белковых молекулах. Когда такая загогулина — например, в составе оболочки зловредного вируса — появляется в поле зрения лимфоцита, он получает сигнал на размножение, производя множество потомков, готовых атаковать этот белок.
Тем не менее иммунной системе можно помочь — подтолкнуть ее к правильному выбору, слегка подрегулировать контрольные механизмы в сторону чуть меньшей толерантности, чуть большей ксенофобии. На этой идее и основаны методы иммунотерапии рака, которые начали развиваться в начале этого столетия.
Несмотря на исключительную важность проблемы рака для человечества и потраченные на эту проблему миллиарды, за победы в этой борьбе присуждено не так уж много Нобелевских премий. За вычетом тех, которыми были отмечены открытия по вирусной природе некоторых онкозаболеваний, их было всего три. Две из них присуждены за последнее десятилетие, и обе — за разные варианты иммунотерапии.
В 2011 году премию решили присудить Ральфу Штайнману, который разработал одну из самых сложных и дорогих методик иммунотерапии — дендритные вакцины. По воле судьбы именно эта терапия продлила его собственную жизнь на пару лет, которых едва хватило на то, чтобы номинироваться на премию (хотя присуждена она была через два дня после его смерти).
Тасуку Хондзё прославился исследованиями белка PD-1. Аббревиатура PD зловеща, и означает она Programmed Death — программируемую смерть. При хорошем варианте развития событий это вовсе не смерть пациента, а напротив, его благополучие. В конце 1990-х Хондзё и его коллеги из Токийского университета получили линию мышей, у которых белка PD-1 не было. Мышки эти были довольно несчастными: ужасно страдали от целого букета аутоиммунных расстройств. Стало быть, смекнули японцы, их белок как-то участвует в системе контроля иммунитета — тормозит иммунный ответ в тех ситуациях, когда он только все портит.
Сперва казалось, что PD-1 — ключ к аутоиммунным заболеваниям, но он оказался фрагментом еще одного пазла. Белок этот делает вот что: передает лимфоциту сигнал о том, что антитела, которые тот производит, никому не нужны, поскольку направлены на собственные клетки тела. А стало быть, такому лимфоциту следует немедленно совершить сеппуку, что он послушно делает.
Раковые клетки умеют казаться своими: они показывают на своих мембранах белковые сигналы, которые побуждают белок PD-1 считать их друзьями. Но если этот белок удастся блокировать, их старания будут тщетны: T-лимфоциты разыщут их и убьют.

Онколог Евгений Витальевич Ледин, к. м. н., руководитель Центра химиотерапии Клинической больницы МЕДСИ в Боткинском проезде, начал работать с чекпойнт-ингибиторами, а именно с пембролизумабом, еще на стадии клинических испытаний препарата. К нему мы и обратились за комментарием, чтобы он исправил наши ошибки и скорректировал (только, пожалуйста, не слишком!) наш чрезмерный оптимизм.
Я не могу отнести иммунотерапию к области чудес: это не более чем очередной шаг. Это появление дополнительных возможностей, которые никакого отношения к чудесам не имеют, лишь одна из опций, занимающая строго определенное место в общей системе лечения онкологических заболеваний.
Ɔ. А вообще бывают чудесные исцеления, когда вопреки прогнозам опухоль вдруг начинает сама собой исчезать?
Ɔ. Как на практике происходит терапия? Есть ли побочные действия?
Сама процедура — это просто получасовая капельница, которая, как правило, хорошо переносится. Сутки пациент может находиться в стационаре. Что касается побочных эффектов, они бывают у любого препарата. Я в своей практике видел такие побочные эффекты при приеме анальгина, что это было пострашнее любой иммунотерапии. Но иммунотерапия хороша еще и тем, что побочные эффекты в ней по сути разделены на черное и белое: либо все хорошо, либо плохо. В химиотерапии много промежуточных серых тонов: кто-то полностью теряет дееспособность, а большая часть пациентов находится в среднем состоянии. В иммунотерапии очень большая доля пациентов вообще никак не ощущает лечение. А у тех, кто переносит терапию плохо, онкологи научились отслеживать эти побочные эффекты и вовремя их останавливать. В целом иммунотерапия значительно комфортнее, чем другие виды противоопухолевой терапии.
То же самое с иммунотерапией: есть подтип опухолей, где работает данный механизм ускользания от иммунного ответа, и там чекпойнт-ингибиторы оказываются эффективны. Чаще это происходит при меланоме или, к примеру, при раке почки. На фоне прочих достижений это кажется чудесным: люди, которые раньше умирали в течение 6–8 месяцев, теперь стали долго жить: четверть пациентов переживают пятилетний рубеж, что в онкологии приравнивается к излечению. Но это не чудо: просто у этой четверти найденный ключик подходит к тому механизму, который лежит в основе их заболевания.
Но, конечно, такое открытие дает новую надежду пациентам и новую мотивацию онкологам. Когда я начинал работать, онкология была другой. Если сравнить ситуацию сейчас и 20 лет назад, то сейчас пациент в значительно более выгодном положении. Новых возможностей колоссальное количество.
Ɔ.

Во время деления клеток в нашем организме периодически возникают ошибки. Это неизбежно. Если что-то пошло не так, после деления дочерние клетки имеют неправильное строение, могут становиться раковыми. Иммунная система всегда настороже и готова их уничтожить.
Однако, иммунитет справляется со своей функцией не всегда — в противном случае ни у кого бы не возникали злокачественные опухоли.
Раковые клетки коварны, они могут обзавестись разными видами защиты:
- Если раковая клетка вырабатывает недостаточно много чужеродных веществ, иммунитет её не замечает.
- Некоторые опухоли умеют вырабатывать вещества, которые подавляют работу иммунных клеток.
- Иногда ведущая роль принадлежит микроокружению опухоли — клеткам и молекулам, которые окружают раковые клетки. Микроокружение тоже может подавлять иммунитет.
Для того чтобы иммунная система начала расправляться с опухолью, её нужно активировать, либо предоставить ей необходимые компоненты. Современные врачи и ученые знают, как это сделать. Такое направление лечения рака называется иммунотерапией. Существует несколько её разновидностей.
Какие бывают разновидности иммунотерапии?
На данный момент онкологам доступны разные виды иммунотерапии:
Многие ученые считают, что за иммунотерапией будущее в лечении рака. Исследования в этом направлении продолжаются, в лабораториях разрабатывают и тестируют новые препараты.
Моноклональные антитела
Чужеродные вещества в организме человека называют антигенами. В ответ на их внедрение иммунная система вырабатывает специфические белковые молекулы — антитела. Каждое антитело связывается с соответствующим ему антигеном, после чего происходит ряд событий, приводящий к уничтожению чужеродного агента.
Моноклональные антитела — по сути искусственные заменители собственных антител человека. Каждое из них находит в организме свою молекулу-мишень и связывается с ней. В случае с онкологическими заболеваниями такой мишенью является определенное вещество, которое раковые клетки вырабатывают в достаточно большом количестве, а здоровые — в очень малом, или не вырабатывают вообще.
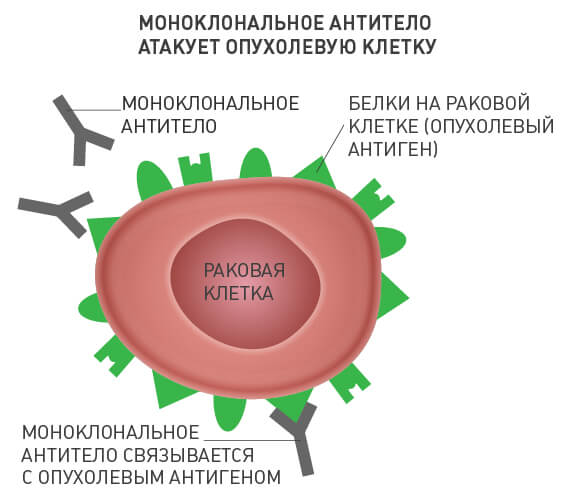
Различные моноклональные антитела действуют по-разному:
Моноклональные антитела можно использовать для доставки к раковым клеткам других лекарств. Например, можно прикрепить к молекуле антитела радиоактивную частицу или химиопрепарат.
За последние годы в мире было одобрено и внедрено в клиническую практику более десятка разных моноклональных антител. Они применяются для лечения ряда злокачественных опухолей, обладающих определенными молекулярно-генетическими характеристиками. В настоящее время ученые работают над созданием новых препаратов, некоторые лекарства проходят испытания и, возможно, вскоре будут введены в клиническую практику.
Кейтруда (Пембролизумаб)
PD-1 – это рецептор, который находится на поверхности T-клеток. Когда он взаимодействует с белком PD-L1, замедляется размножение иммунных клеток, они перестают выделять цитокины и атаковать опухолевую ткань. Кейтруда разрывает эту связь и снимает блок с лимфоцитов:
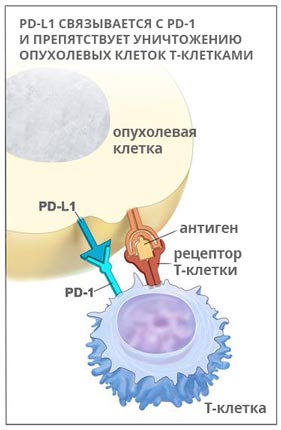
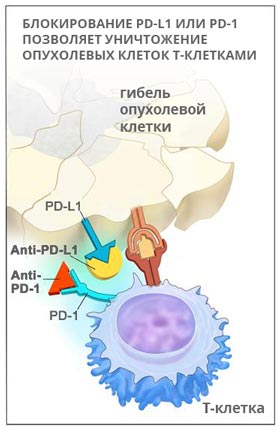
Пембролизумаб был одобрен к применению в Америке в сентябре 2014 года. В настоящее время его используют для лечения меланомы, немелкоклеточного рака легких, опухолей головы и шеи. Кейтруду обычно назначают при некурабельных опухолях, которые невозможно удалить хирургически, если другие методы лечения не помогают.
Ниволумаб (Опдиво)
Ниволумаб, как и Кейтруда, является ингибитором белка-рецептора PD-1. В декабре 2014 года этот препарат был одобрен в Америке для лечения меланомы. В настоящее время основными показаниями к применению Ниволумаба являются: метастатическая и неоперабельная меланома, местнораспространенный или метастатический мелкоклеточный и немелкоклеточный рак легких, почечно-клеточный рак на поздних стадиях. В ряде случаев ниволумаб сочетают с другим ингибитором контрольных точек – ипилимумабом (Ервой).

Ритуксимаб (Мабтера, Ритуксан)
Мишень для ритуксимаба — рецептор CD20, который находится на поверхности B-лимфоцитов. Соединяясь с рецептором, препарат заставляет NK-клетки (натуральные киллеры — разновидность иммунных клеток) атаковать B-лимфоциты, как злокачественные, так и нормальные. После курса лечения организм производит новые нормальные B-лимфоциты, их количество восстанавливается.
Ритуксимаб был одобрен к применению достаточно давно — еще в 1997 году. В настоящее время его используют для лечения аутоиммунных и онкологических заболеваний: хронического лимфолейкоза, вульгарной пузырчатки, неходжкинской лимфомы, идиопатической тромбоцитопенической пурпуры.
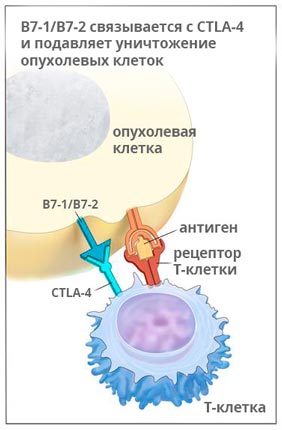
Ипилимумаб (Ервой)
Ервой связывается с молекулой CTLA-4 и активирует иммунную систему, для того чтобы она могла бороться с раком. Исследования показывают, что препарат помогает надолго остановить рост опухоли, а в 58% случаев способствует уменьшению её размеров, как минимум, на треть.
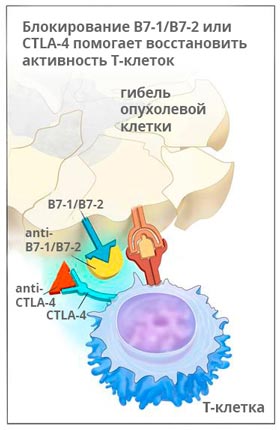
Ипилимумаб применяют у пациентов, страдающих меланомой на поздних стадиях, раком легкого, простаты.
Цитокины
Цитокины – это неспецифические стимуляторы иммунитета. Они активируют иммунную систему не против какого-то определенного антигена, а в целом. В настоящее время в онкологии главным образом применяют два препарата – интерлейкин-2 (ИЛ-2) и интерферон-альфа.
Интерлейкин-2 представляет собой молекулу, которая переносит биохимические сигналы между лейкоцитами. Он ускоряет рост и размножение иммунных клеток. Этот препарат находит применение при распространенном раке почек, метастатической меланоме. Иногда ИЛ-2 сочетают с химиотерапией и другими цитокинами. При этом его действие усиливается, но повышается риск серьезных побочных эффектов.
В настоящее время ведутся исследования по возможности применения в онкологии других типов интерлейкинов, таких как ИЛ-7, ИЛ-12, ИЛ-21.
Интерфероны – вещества, которые принимают участие в борьбе с вирусами и раковыми клетками. Существует три типа интерферона, названных по буквам греческого алфавита – альфа, бета и гамма. Для лечения рака применяют препараты интерферона-альфа. Они помогают усилить противоопухолевый иммунный ответ, непосредственно замедлить рост раковых клеток и кровеносных сосудов, которые обеспечивают опухоль кислородом и питательными веществами.
Интерферон-альфа применяют при раке почек, меланоме, волосатоклеточном лейкозе, некоторых типах лимфомы, саркоме Капоши.
Иммунотерапия при раке легкого
Рак легких — одно из самых распространенных онкологических заболеваний. По заболеваемости и уровню смертности он занимает первое место у мужчин и третье место у женщин. Почти 20% пациентов, умерших от злокачественных опухолей, погибли от рака легкого. В группе повышенного риска находятся курильщики в возрасте старше 50 лет. На каждые 3–4 миллиона выкуренных сигарет приходится одна смерть от рака легких.
Заболевание часто диагностируют на поздних стадиях, когда многие виды лечения оказываются неэффективны. В таких случаях пользу может принести иммунотерапия.
При раке легкого применяют такие препараты, как ниволумаб (Опдиво), ипилимумаб (Ервой), пембролизумаб (Кейтруда), атезолизумаб (Тецентрик).
В Европейской клинике применяются наиболее современные методы лечения рака легкого, меланомы и других онкологических заболеваний. Благодаря сотрудничеству с зарубежными коллегами, мы может предоставить пациентам возможность пройти курс иммунотерапии, персонализированного лечения в нашем центре иммунотерапии. Мы знаем, как продлить жизнь и избавить от мучительных симптомов при запущенном раке. Мы знаем, как помочь.
Иммунотерапия при меланоме
Меланома — далеко не самая распространенная (всего 2%) форма рака кожи, но она очень агрессивна и чаще других опухолей приводит к смерти. Так, в 2012 году в мире было диагностировано 232 000 новых случаев меланомы, 55 000 больных погибли. Меланома рано метастазирует, после чего многие методы лечения становятся неэффективны.
На поздних стадиях для лечения меланомы применяют пембролизумаб (Кейтруда), ипилимумаб (Ервой), ниволумаб (Опдиво).
Отзыв пациента о лечении меланомы иммунотерапией:
Мне 41, я бывший спортсмен-байдарочник, волосы черные, глаза карие — то есть, я нормально переношу загар, кожа смуглеет быстро, а ожогов у меня не бывает. Я, конечно, слышал, что длительное пребывание на солнце чревато всякими проблемами, а так как основную часть времени я проводил как раз на солнце, регулярно проверялся у дерматолога. От него и узнал, что есть такая беда, как меланома — рак кожи. Но, по его словам, мне она не грозит, как раз ввиду особенностей моей кожи.
Ну, и, конечно, у меня нашли меланому. Причем, что обидно, не на спине или плечах, что было бы логично — эти места постоянно под лучами, а на бедре.
В первую очередь, по совету дерматолога, отправился в одну небезызвестную клинику. Приняли охотно, сказали, что вероятность хорошего исхода большая, так как обнаружена она достаточно рано.
Но, этот выигрыш они благополучно спустили на недельные обследования. По результатам мне назначили операцию ещё через неделю, а потом Интерферон. Я обратился к тому же дерматологу, который послушал меня, и несколько удивился. Ничего толком не сказал, но намекнул на то, что можно бы получить и второе мнение, да побыстрее.
Иммунотерапия при раке желудка
При раке желудка I–III стадии основным методом лечения является хирургическое удаление опухоли, нередко его дополняют курсом химиотерапии и лучевой терапии. На IV стадии, когда опухоль распространяется за пределы органа и дает метастазы, шансы на полную ремиссию стремятся к нулю. В таких случаях проводят лечение, направленное на замедление роста опухоли, сокращение её размеров, продление жизни пациента.
Именно на IV стадии, когда рак желудка не реагирует на другие виды лечения, может принести пользу иммунотерапия. Эффективны такие препараты, как трастузумаб и рамуцирумаб. В настоящее время исследования в отношении иммунотерапии при раке желудка ведутся в четырех основных направлениях: ингибиторы контрольных точек, таргетная иммунотерапия моноклональными антителами, противораковые вакцины и клеточная иммунотерапия.
Иммунотерапия при раке почки
При лечении рака почек иммунотерапией применяет две группы иммунопрепаратов:
- Цитокины — белки, которые активируют иммунную систему и заставляют её бороться с раком. Для лечения применяют искусственно синтезированные аналоги этих белков: интерлейкин-2 (IL-2) и интерферон-альфа.
- Ингибиторы контрольных точек. Контрольные точки — это особые молекулы иммунной системы, которые она использует, чтобы сдерживать себя от атаки здоровых клеток. Иногда они мешают бороться против опухолевых клеток. При раке почек применяют Ниволумаб (Опдиво) — он блокирует PD-1, белок, который находится на поверхности T-лимфоцитов.
Иммунотерапия при раке яичников
В последние годы хирургическое лечение и химиотерапия при раке яичников значительно продвинулись вперед, и все же ситуация пока еще далека от идеальной. У многих женщин опухоль рецидивирует, перестает реагировать на препараты, которые помогали ранее. Из иммунопрепаратов при раке яичников в настоящее время применяется Бевацизумаб (Авастин) — представитель группы моноклональных антител, который блокирует фактор роста эндотелия сосудов. Раковые клетки синтезируют это вещество в большом количестве, чтобы стимулировать рост новых сосудов, обеспечить себя кислородом и питательными веществами. Некоторые методы иммунотерапии при раке яичников в настоящее время находятся на стадии разработки и тестирования: моноклональные антитела, ингибиторы контрольных точек, иммуномодуляторы, противораковые вакцины, иммуноклеточная терапия, онколитические вирусы.
Побочные эффекты иммунотерапии
Лечение иммунотерапевтическими препаратами имеет некоторые общие моменты с химиотерапией. Такое сходство заключается в том, что клетки опухоли погибают в пределах органов и тканей тела, и организму приходится избавляться от них, как от чужеродного вредоносного материала. Это очень ресурсоёмкая задача, поэтому пациент может испытывать симптомы, вызванные перенапряжением различных систем организма.
Иногда иммунотерапия активирует иммунные клетки чрезмерно, и они начинают атаковать нормальные ткани организма. Из-за этого могут возникать некоторые побочные эффекты:
- При поражении слизистой оболочки полости рта и глотки на ней возникают болезненные язвы, которые могут инфицироваться. Обычно они проходят в течение 5–14 дней после окончания лечения.
- Кожные реакции: покраснение, отечность, сухость, повышение чувствительности к свету, трещины на кончиках пальцев.
- Симптомы, напоминающие грипп: слабость, разбитость, повышенная температура, озноб, кашель.
- Тошнота и рвота.
- Головные боли, головокружения.
- Повышение или снижение артериального давления.
- Мышечные боли.
- Одышка.
- Отеки на ногах.
- Увеличение веса из-за задержки жидкости в организме.
- Диарея.
У разных иммунопрепаратов побочные эффекты выражены по-разному. Лучше заранее поговорить с врачом и спросить, каких проблем можно ожидать во время курса лечения, как с ними бороться.
Иммунотерапия: за и против
Однако, не всё так гладко. У иммунопрепаратов есть и минусы. Они работают далеко не у всех пациентов. Иногда опухоль удается уничтожить полностью, а иногда — лишь замедлить её рост. Ученые пока не могут объяснить, почему результаты лечения бывают такими разными. Несмотря на то, что побочные эффекты встречаются не так часто, как при химиотерапии, иногда они могут быть весьма серьезными.
Иммунотерапия — это всегда длительное лечение. Со временем иммунопрепарат, который помогал пациенту ранее, может перестать работать. К минусам можно отнести и достаточно высокую стоимость иммунотерапии при раке. Таким образом, в каждом случае решение нужно принимать индивидуально. Прежде чем назначить иммунотерапию, врач обязательно взвесит все возможные преимущества и риски.
Ещё один минус иммунотерапии — она подходит не для всех типов рака. Существует не так много онкологических диагнозов, для которых разработан препарат, способный точно и эффективно воздействовать на клетки данного рака. Однако это путь, по которому онкология продолжает идти, открывая всё новые и новые препараты и их комбинации, способные воздействовать на новые виды опухоли. Всё остальное — это исключительно преимущества, которые могут отменить остальные виды лечения уже в обозримом будущем.
Сколько стоит иммунотерапия?
Иммунотерапия — это самый современный медикаментозный метод лечения рака. Стоимость иммунотерапии рака немаленькая. Особенно в сравнении с другими известными методами. Стоимость лечения зависит от вида применяемого иммунопрепарата, типа и стадии опухоли, ее степени агрессивности. Высокая цена иммунотерапии связана с тем, что производство иммунопрепаратов — сложный и дорогой процесс.
В России очень немного клиник, которые проводят лечение иммунотерапией. В большинстве случаев, чтобы пройти курс иммунотерапии, россиянину приходится обращаться к посредникам для лечения за границей. В основном это Израиль, Германия и США. В таком случае стоимость перелёта и лечения составит огромную сумму. Но теперь в России есть возможность пройти иммунотерапевтическое лечение рака в Европейской клинике, что делает его доступным для многих пациентов.
Читайте также:

