Иммуногистохимическое исследование при раке прямой кишки

Карциномы ЖКТ
Колоректальный рак является третьим по частоте диагностируемым раком в Соединенных Штатах (за исключением рака кожи) среди мужского и женского населения. Показатели заболеваемости колоректальным раком снижаются на протяжении последних двух десятилетий (с 66,3 случаев на 100000 человек в 1985 году до 45,5 случаев в 2006 году). Это связывают с увеличением использования колоректальных скрининг-тестов, которые позволяют обнаруживать и удалять полипы ЖКТ до их перерождения в рак. В отличие от общего сокращения, среди взрослого молодого населения в возрасте до 50 лет, для которого скрининг не рекомендуется из-за средней степени риска, заболеваемость раком ободочной и прямой кишки увеличивались с 1994 года примерно на 2% в год у мужчин и женщин.
Смертность
В 2016 году США смертность от колоректального рака ожидается на уровне 49500 случаев. Смертность от колоректального рака снизились в обоих группах мужчин и женщин за последние несколько десятилетий, с более крутым снижением в последний период времени. Это снижение отражает снижение показателей заболеваемости и улучшение ранней диагностики и лечения.
Признаки и симптомы
Ранние стадии рака ободочной и прямой кишки обычно не имеют симптомов, поэтому, чтобы выявить заболевание на этой ранней стадии часто необходим скрининг. Прогрессирование болезни может вызвать кровотечение из прямой кишки, появление крови в кале, изменение в опорожнении кишечника, схваткообразные боли в нижней части живота.
Иммуногистохимия (ИГХ) при раке толстой кишки
Применение ИГХ при раках толстого кишечника рассматривается на нескольких уровнях: для характеристики опухолей (эндокринный или эпителиальный тип), наследственной предрасположенности и для целей прогноза. Преобладающее использование ИГХ это определение возможных или предполагаемых метастазов, в которых толстой кишки является возможным первичным. Типичной локализацией для метастазов толстой кишки являются печень и легкие, оба органа, которые могут производить морфологию рака идентичную метастазам из толстой кишки. ИГХ, ( класс I правил регулирования FDA), используется после первичной диагностики опухоли путем гистопатологического исследования и не включается для клиницистов как независимое исследование.
Метастатическая карцинома
Наиболее часто применение иммуногистохимии в изучени опухолей печени – это определение источника метастаза, когда первичная локализация опухоли не известна. Развитие и применение панели для иммунных окрашиваний может помочь решить почти все диагностические проблемы. 2-6 Цитокератины (CK) 7 и CK 20 – первая ступень в идентификации многих опухолей и с дополнительными иммунными реакциями относительно специфичными для опухолей женского и мужского полового тракта, нередко дает возможность идентифицировать первичную локализацию метастатической опухоли.
Желудок
Иммуногистохимические исследования (ИГХ) , как правило, не требуются для оценки доброкачественных и злокачественных эпителиальных опухолей желудка, так как гистопатология, как правило, обеспечивает диагностику, но ИГХ нужна при изучении метастатического рака желудка, когда источник происхождения опухоли не ясен, или когда макроскопические / рентгенологическое проявления опухоли сбивают с толку (например, рак желудка напрямую и широко прорастает в печень и гистологически неотличим от холангиокарциномой). К тому же, ИГХ может быть полезна для идентификации некоторых вариантов желудочных карцином, включая гепатоидную аденокарциному, в которой печеночная дифференцировка может быть подтверждена позитивной реакцией на альфа-фетопротеин AFP.
Аденокарцинома
Нейроэндокринная карцинома
Нейроэндокринная карцинома характеризуется положительным окрашиванием на синаптофизин, хромогранин, виллин и CD57.17-18 В отличие от аденокарциномы желудка, раки, происходящие во второй части двенадца-типерстной кишки могут быть отрицательными для обоих маркеров- синаптофизина и хромогранина, но часто вступают в реакцию с антителами против соматостатина. Маркер пролиферации Ki-67 и молекула адгезии Е-кадгерин, были использованы для оценки агрессивности нейроэндокринных carcinoma.19 Увеличение индекса пролиферации Ki-67 ( 20% для G1, G2, G3 и поражений соответственно) 20 предсказывает агрессивное поведение, и потеря Е-кадгерина может предсказать развитие метастазов в лимфатических узлах.
Желудочно-кишечная аденокарцинома с нейроэндокринной дифференцировкой
Аденокарцинома желудка, как кишечного типа, так и типа перстневидноклеточной карциномы, могут иметь нейроэндокринную дифференцировку и что может быть не очевидно по гистологической картине, но проявляться по окрашиванию хромогранином и /или синаптофизином.
ГИСТ - гастроинтестинальные стромальные опухоли
Антитело против CD117 окрашивает большинство случаев гастроинтестинальных стромальных опухолей (ГИСТ), в том числе метастазов.21-25 Хотя могут быть вариации в распределении CD117(+) клеток в пределах данной опухоли, в большинстве случаев окрашивание является диффузным. Когда реакция на CD117 положительна в опухолях отличных от ГИСТ, окрашивание почти всегда неоднородно. Окрашивание на CD34 также можно увидеть в ГИСТ. ГИСТ негативны на CD117 в 10 -15% случаев. Антитело Dog1, как было показано, маркирует большинство CD117 отрицательных ГИСТ.26 Кроме того, потеря SDHB, как было доказано, - постоянный признак ГИСТ с дефицитом SDHB, что ,таким образом, может быть полезным для выявления особого варианта этого заболевания.
Толстый кишечник. Аденома и аденокарцинома.
Аденомы (трубчатые аденомы, тубулярные аденомы, аденомы ворсинок) демонстрируют те же иммуногистохимические реакции, что и аденокарцинома кишки. Почти все они реагируют с антителами, направленными против CK 20 и меньшинство также окрашивается очагово с CK 7, в отличие от панкреатических аденокарцином, большинство из которых являются CK 20 отрицательными и положительными по СК 7. Дифференциальная диагностика метастатической колоректальногй аденокарциномы и аденокарциномы, возникающей в других местах зачастую представляет из себя сложную задачу.
Легочная аденокарцинома может напоминать колоректальную. CK 7 и CK 20 могут быть полезными в этой ситуации, поскольку CK 7, как правило, сильно положителен в аденокарциноме легкого, а CK 20 обычно отрицателен; обратная картина наблюдается с колоректальными аденокарциномами. Кроме того, транскрипционный фактор щитовидной железы 1 (TTF-1) обычно положителен в раковых заболеваниях легких, а CDX-2 и бета-катенин как правило положительны в колоректальном раке. Карциномы эндометриоидного типа могут также гистологически быть неотличимы от колоректальной карциномы. Здесь, опять же, CK 7 положителен почти во всех эндометриоидных аденокарциномах и лишь слегка реактивен в колоректальной аденокарциноме. CK 20, как правило, негативен для первичных опухолей легких, но дает положительный результат на ободочной и прямой кишке.
Аденокарцинома аппендикса
Аденокарциномы аппендикса, как правило, показывают окрашивание на MUC5AC, в отличие от аденокарциномы ободочной кишки, в которой данное антитело редко реактивно. Это особенно полезно при изучении муцинозных аденокарцином, которые образуют метастазы в брюшной полости. Бета-катенин является еще одной мишенью дифференцировочных антител, положительных почти во всех ободочных аденокарциномах и отрицательных в аденокарциноме аппендикса.
У женщин с абдоминальным муцинозным карциноматозом, различие ободочной и аппендикулярной аденокарциномы из яичников играет важную роль. В ободочной опухоли, часто экспрессируются виллин и бета-катенин; в метастазах в аппендиксе часто экспрессирован виллин, но бета-катенин является редким и в овариальных муцинозных аденокарциномах ни виллин, ни бета-катенин не выявляются.
Подобно поражениям аппендикса, аденокарциномы экспрессируют MUC5AC и подобно колоректальным аденокарциномам, яичниковые муцинозные аденокарциномы экспрессируют CDX-2. Полезными добавками к основным панелям для неизвестных первичных опухолей, в которых подозреваются аппендикулярные или муцинозные опухоли яичников, являются MUC5AC и бета-катенин. Виллин также может быть полезным, поскольку он обычно имеет “brush-border” картину окрашивания и в ободочной и в аппендикулярной аденокарциномах и, как правило, цитоплазматическую в поражениях яичников и поджелудочной железы.
Инвазивная аденокарцинома протоков
Аденокарциномы поджелудочной железы, как правило, происходят из предшествующих стадий дисплазии протока поджелудочной железы. Иммуногистохимический паттерн высокодифференцированных панкреатических интраэпителиальных неоплазий такой же, как у инвазивной аденокарциномы поджелудочной железы и не может быть использован для их дифференциальной диагностики.
Аденокарцинома протока поджелудочной железы напоминают аденокарциному желчных протоков и желчного пузыря по картине световой микроскопии, а также по иммунофенотипическим проявлениям. Панкреатические аденокарциномы реагируют с антителами к различным цитокератинам, в том числе CK 8, CK 17, CK 18, CK 19, CAM 5.2 и AE1 & AE3.5,32. Аденокарциномы поджелудочной железы, как правило, являются CK 7 и CK 20 положительными. Поджелудочная аденокарцинома также может быть слабо позитивной по CDX-2.
Почти все аденокарциномы поджелудочной железы являются CEA и СА-125 положительными. Они также могут иметь незначительную составляющую нейроэндокринных клеток, которые будут реагировать с антителами к соматостатину, синаптофизину, хромогранину или другим нейроэндокринным маркерам. Терапия также может быть предсказана при положительном окрашивании на фактор роста эндотелия сосудов и отрицательном - на SMAD4 (DPC4). Потеря экспрессии SMAD4 в эпителии желчных протоков также была показана в случае хронической желчнокаменной болезни. Хорошо дифференцированные метастатические аденокарциномы поджелудочной железы в печени могут быть сложно отличимы от доброкачественных поражений желчных протоков при исследовании биопсийного материала. Тем не менее, в отличие от доброкачественных поражений, они как правило, экспрессируют р53, цитоплазматический mCEA, и другие маркеры, включая CA-125.
Нейроэндокринные опухоли и опухоли из эндокринных клеток, низкодифференцированные и высокодифференцированные.
Низко- и высокого дифференцированные нейроэндокринные опухоли, как правило, оцениваются по иммунофенотипическим проявлениям, однако в целом, интенсивность окрашивания меньше у полноценных опухолей.
Они могут быть сгруппированы по преобладанию секретируется гормона (например: соматостатин, гастрин), но, как правило, также окрашиваются антителами к синаптофизину и хромогранину, а также к различным кератинам, в том числе CK 8, CK 18, CK и 35betaH11. CK 7 и CK 20, как правило, негативны. CD56 и CD57, как правило, окрашиваются более интенсивно в высокодифференцированных нейроэндокринных опухолях, чем в низкодифференцированных; в мембранном рисунке CD56 также будет положительным в большей степени, нежели SATB2. Поэтому SATB2 является хорошим маркером идентификации рака ободочного происхождения при работе с опухолью неизвестного происхождения. Другим потенциальным полезным свойством полезность SATB2 является выявление нейроэндокринных опухолей и карцином левой толстой и прямой кишки, так как SATB2 как правило, отрицателен в других нейроэндокринных новообразованиях ЖКТ, поджелудочной железы и легких.
Новость от 26/04/2017
Толстая кишка – это конечный сегмент пищеварительного тракта, она делится на ободочную и прямую. Ободочная кишка расположена по периметру брюшной полости и имеет следующие отделы: слепая кишка, восходящая ободочная, поперечно-ободочная, нисходящая ободочная и сигмовидная. Длина толстого кишечника 1,5 — 2 метра.
Колоректальный рак занимает третье место по частоте среди всех онкологических заболеваний. Количество больных с таким диагнозом увеличивается с каждым годом.
Опухоли толстой кишки развиваются достаточно медленно, поздно метастазируют. Выявленные на ранних стадиях, имеют большие шансы быть полностью излеченным. Однако начальные этапы развития носят бессимптомный характер, вследствие чего пациенты поздно обращаются за медицинской помощью. Мотивировать человека, которого ничего не беспокоит, пройти такое неприятное обследование, как колоноскопия, достаточно сложно.
Эта проблема актуальна во всем мире. Существуют рекомендации по скрининговому обследованию населения на колоректальный рак.
Клиническая картина
При злокачественных новообразованиях толстой кишки пациенты чаще всего предъявляют жалобы на следующие симптомы: нарушения стула (поносы, запоры), периодические боли в животе, выделения крови, слизи при дефекации. При карциноме правой половины ободочной кишки на первый план выходят анемический и интоксикационный синдромы: слабость, одышка, головокружение, тошнота, потеря веса.
Большое значение имеет возраст. Заболеваемость резко возрастает после 50 лет.
В анамнезе возможны случаи рака кишечника у кровных родственников (у таких лиц шанс иметь тот же диагноз возрастает в 3-4 раза).
В ряде случаев, опухоли ободочной кишки могут быть пропальпированы через переднюю брюшную стенку. При локализации новообразования в прямой кишке — опухоль может быть обнаружена при ректальном исследовании.
Лабораторная диагностика
- Общий анализ крови. Характерные изменения: снижение показателей эритроцитов, гемоглобина, повышение количества лейкоцитов, скорости оседания эритроцитов (СОЭ).
- Анализ кала на скрытую кровь, бензидиновая проба и гваяковый тест. Группа исследований, направленная на выявления макроскопически незаметных кровотечений, к которым склонны опухоли ободочной и прямой кишки. В ряде случаев служит как метод для выявления бессимптомных злокачественных и доброкачественных новообразований колоректальной локализации. Недостатками данных исследований являются: низкая специфичность:
1. существует значительный риск получения ложноположительных результатов (например, при наличии десневых кровотечений);
2. необходимость соблюдения диеты с исключением продуктов животного происхождения перед обследованием.
- Иммунохимический тест на скрытую кровь. Является наиболее совершенным лабораторным методом исследования, который лишен вышеописанных недостатков.
- Онкомаркеры кишечника. Группа белковых соединений, которые образуются в процессе метаболизма опухоли или же вырабатываются организмом в ответ на неоплазию. Они могут быть обнаружены в крови иммунохимическими методами. 100% специфичных онкомаркеров кишечника и прямой кишки не существует. Определение их не рекомендовано в качестве достоверного метода диагностики ранних форм рака. Однако исследование имеет ценность в определении прогноза заболевания, контроля эффективности лечения, а также выявления рецидивов. При раке кишечника наиболее часто определяют РЭА (раково-эмбриональный антиген), СА 19.9, СА 242, TIMP-1.
- В процессе экспериментальных разработок в крупных центрах внедряют так называемую жидкую биопсию: инновационный генетический метод, при котором в крови выявляют обрывки опухолевой ДНК, определяющейся уже на ранних, бессимптомных стадиях роста карциномы.
Инструментальные методы обследования

- УЗИ брюшной полости и малого таза. Проводится с целью выявления патологии в паренхиматозных органах и лимфоузлах. С помощью УЗИ можно выявить инвазию опухоли в соседние структуры и метастазы в лимфоузлы.
- КТ брюшной полости с контрастом — метод визуализации, позволяющий высокоинформативно диагностировать метастазы в печени и лимфоузлах, прорастание опухоли в окружающие ткани. Для исследования патологии малого таза (при раке прямой кишки) предпочтительно выполнение МРТ.
Морфологические методы
Окончательное заключение невозможно без патоморфологического подтверждения. Именно на данном этапе выставляется или опровергается диагноз злокачественного новообразования. Для анализа берется соскоб или отщипывается кусочек ткани.
- Цитологическое исследование – это метод выявления атипичных клеток. С поверхности, подозрительной на карциному, выполняется забор материала, наносится на предметное стекло, которое в последующем исследуют врачи-цитологи на наличие злокачественных клеток.
- Гистологический метод. Для этого исследования во время колоноскопии щипцами берутся образцы тканей (не менее 3-5) и отсылаются в патологоанатомическую лабораторию. На гистологическую экспертизу отправляются иссеченные при эндоскопии полипы, а также удаленные во время операции ткани и органы. Ответ приходит через 7-10 дней.
- Иммуногистохимическое исследование (ИГХ). Уточняющий метод диагностики злокачественных опухолей, при котором проводится анализ антигенных свойств присланной ткани. Выполняется при сомнениях в гистологической принадлежности опухоли.
Основные рекомендации по ранней диагностике колоректального рака
Исследование кала на скрытую кровь. Такой анализ рекомендовано делать ежегодно всем лицам начиная с 50 лет. При положительном результате теста пациент направляется на колоноскопию.
Диагностическую ФКС рекомендуется проводить лицам после 50 лет с интервалом в 5 лет, а людям с отягощенным наследственным анамнезом эту процедуру следует выполнять уже в возрасте 40 — 45. Альтернативой обычной эндоскопии может стать виртуальная КТ-колоноскопия (МСКТ).
График контрольного обследования в послеоперационном периоде
Любое злокачественное новообразование опасно прогрессией и рецидивами. После радикального лечения пациент осматривается онкологом в первый год – каждые 3 месяца, затем – полгода. После 3-х лет частота осмотров – ежегодно.
Колоноскопия после операции выполняется через год и через 3 года, затем – каждые 5 лет. При обнаружении полипов это обследование выполняется ежегодно.
Исследование онкомаркеров рака кишечника РЭА и С 19.9 проводится первые 2 года каждые 3 месяца, в последующие 3 года – каждые 6 месяцев. Повышение уровня онкомаркеров – повод для тщательного обследования.
КТ или МРТ органов грудной клетки и брюшной полости проводится в срок 1-1,5 года после операции.
Если в течение 5 лет у пациента нет данных за прогрессию или рецидив, то он считается полностью излеченным и снимается с диспансерного учета.
Заключение
Колоректальный рак, выявленный на ранних стадиях, в 80-90% полностью излечим. Чем выше клиническая стадия, тем меньше шансов. Диагностика рака кишечника не так сложна. Трудность заключается в недостаточной информированности, отсутствии настороженности и самомотивации у населения. Все, что требуется от человека – это решиться на колоноскопию. Проверка кишечника на онкологию должна стать рутиной процедурой, такой как прохождение флюорографии или осмотр стоматолога.

Иммуногистохимия, или иммуногистохимический анализ — исследование, во время которого в образцах ткани с помощью антител выявляют определенные молекулы. Этот метод диагностики нашел широкое применение в онкологии.

Немного теории и истории. Для того чтобы обнаруживать и уничтожать чужеродные вещества, иммунная система использует особые молекулы — антитела. Они отличаются специфичностью: каждое антитело может связываться строго с определенным антигеном.
В 1994 г. С. Тэйлор применил иммуногистохимический анализ, чтобы проверить 20 000 опухолей, и обнаружил, что диагнозы в половине случаев были ошибочными. Иммуногистохимия зарекомендовала себя как эффективный метод диагностики.
Какие задачи в онкологии помогает решать иммуногистохимия?
Иммуногистохимический анализ помогает врачам-онкологам:
- Отнести злокачественную опухоль к тому или иному типу.
- Выяснить, в каких генах опухолевых клеток произошли мутации, какие белки способствуют прогрессированию рака.
- Выявить первичную опухоль и ее метастазы.
- Определить, произошла ли злокачественная трансформация клеток.
- Определить прогноз для пациента.
- Разобраться, поможет ли в данном случае таргетная терапия.
- Определить, чувствительны ли опухолевые клетки к химиотерапии, лучевой терапии.
Как это работает?
Иммуногистохимия бывает прямой и непрямой. В первом случае используют один вид антител, которые должны вступить в связь с определенной молекулой-мишенью. Если молекула-мишень присутствует в ткани, и реакция произошла, опухолевая ткань окрашивается:
- Чаще всего к антителу присоединяют фермент, например, пероксидазу. Этот фермент катализирует химическую реакцию, которая приводит к изменению цвета.
- Иногда к антителу присоединяют флюоресцин или родамин, при этом окрашивание выявляют с помощью флюоресцентной микроскопии.
- всего применяют непрямую иммуногистохимию. При этом используют два антитела. Одно соединяется с антигеном, второе — с полученным комплексом антиген-антитело. Маркер, который вызовет изменение цвета, связывают со вторым антителом.
Непрямой метод имеет некоторые преимущества:
Как проводят исследование?
Для того чтобы выполнить иммуногистохимический анализ, нужно получить опухолевую ткань, то есть провести биопсию. В качестве материала можно использовать столбик ткани, полученный во время трепан-биопсии, фрагмент тканей или даже целый орган, удаленный во время операции.
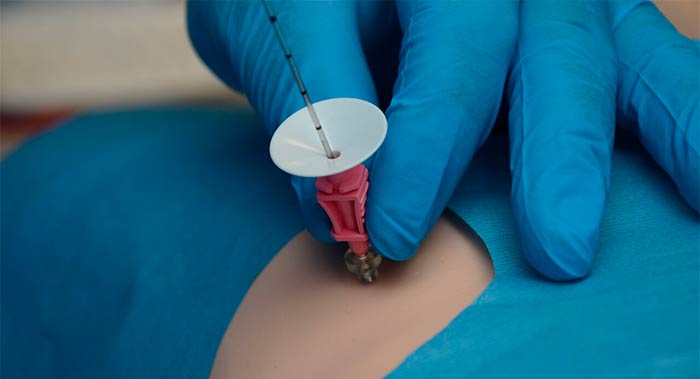
Образец ткани фиксируют с помощью формальдегида (иногда используют метанол, ацетон и другие фиксаторы — это зависит от того, какой антиген нужно выявить, и реагирует ли он с теми или иными фиксаторами) и погружают в парафин. Парафинизация помогает законсервировать ткань, сохранить ее структуру на длительное время.
Затем ткань, помещенную в парафин, нарезают с помощью специального инструмента — микротома — на слои толщиной 3–5 мкм. Эти тонкие срезы помещают на стекло, покрытое, специальным клеем.
Некоторые образцы слишком чувствительны к реагентам, которые применяют во время вышеописанной процедуры. Их нельзя помещать в парафин. Такие ткани замораживают жидким азотом. Этим альтернативным методом пользуются редко, только в случае необходимости, так как у заморозки есть некоторые недостатки: она делает изображение под микроскопом не таким четким, требует специальных условий хранения образцов. Фиксацию ткани в таких случаях проводят уже после нанесения на стекло и размораживания, ацетоном или формальдегидом.
После того как срезы нанесены на стекло, из них нужно удалить весь парафин, иначе антитела не прореагируют с антигеном. Эта процедура называется депарафинизацией. Ее проводят с помощью ксилола. Затем выполняют еще некоторые подготовительные процедуры, чтобы антитела могли успешно прореагировать с нужными антигенами, и, наконец, проводят непосредственно иммуногистохимический анализ. Обработанную антителами ткань рассматривают под микроскопом, чтобы проверить, окрасилась ли она.
Какие молекулы-мишени выявляют во время иммуногистохимии?
Количество возможных мишеней измеряется сотнями. Перед исследованием врач должен понимать, что он ищет, и использовать соответствующие антитела. В онкологии мишенями являются опухолевые маркеры — вещества, которые в здоровых клетках отсутствуют вообще или присутствуют в значительно меньшем количестве. Вот некоторые примеры:
- Рецепторы к эстрогенам и прогестерону помогают идентифицировать гормонально-позитивный рак молочной железы и разобраться, помогут ли женщине гормональные препараты.
- Простатспецифический антиген (ПСА) имеет значение в диагностике рака простаты.
- Альфа-фетопротеин — присутствует в гепатоцеллюлярной карциноме (рак печени).
- Цитокератины помогают в диагностике рака и некоторых сарком (злокачественных опухолей соединительной ткани).
- Фермент CD10 (CALLA) связан с карциномой почек, лимфобластным лейкозом.
Какова роль иммуногистохимии в современной онкологии?
Иммуногистохимический анализ помогает изучить характеристики злокачественной опухоли, которые не могут выявить другие методы диагностики. Зачастую это играет важную роль в уточнении диагноза и назначении правильного лечения. Врач может определить, какие комбинации препаратов будут наиболее эффективны для конкретного больного, иными словами, реализуется принцип персонализированного лечения. Зачастую это помогает улучшить результаты, подобрать эффективное лечение для пациентов, которым не помогает стандартная терапия.
РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Архив - Клинические протоколы МЗ РК - 2012 (Приказы №883, №165)
Общая информация
Рак прямой кишки - злокачественное новообразование прямой кишки.
Код протокола: РH-S-036 "Рак прямой кишки"


Классификация
Клиническая классификация TNM (ICD-O C18-20):
Т – размеры первичной опухоли и степень ее инвазии в стенку кишки
Тх – недостаточно данных для оценки первичной опухоли.
Т0 – первичная опухоль не определяется.
Tis – интраэпителиальная-преинвазивная карцинома (carcinomainsitu): внутрислизистая или инвазия в собственную пластинку слизистой оболочки (включает раковые клетки до базальной мембраны или в слизистом слое без распространения в подслизистый слой).
Т1 – опухоль инфильтрирует подслизисгую основу.
Т2 – опухоль инфильтрирует мышечный слой стенки кишки.
Т3 – опухоль инфильтрирует в субсерозную основу или в не покрытые брюшиной ткани вокруг толстой либо прямой кишки.
Т4 – опухоль распростаняется на соседние органы или структуры/ткани: влагалище, мочеиспускательный канал, мочевой пузырь (вовлечение одного мышечного сфинктера не классифицируется как Т4).
N – региональные лимфатические узлы
Nх – недостаточно данных для оценки региональных лимфатических узлов N0 Нет метастазов в региональных лимфатических узлах.
N0 – нет признаков метастатического поражения регионарных лимфатических узлов.
N1 – метастазы в 1-3 региональных лимфатических узлах.
N1а – метастаз в 1 региональном лимфатическом узле.
N1b – метастазы в 2-3 региональных лимфатических узлах.
N1с – опухолевые депозиты* в подсерозной основе или в не покрытых брюшиной мягких тканях вокруг толстой кишки и прямой кишки без метастазов в региональных лимфатических узлах.
N2 – метастазы в 4 и более региональных лимфатических узлах.
N2a – метастазы в 4-6 региональных лимфатических узлах.
N2b – метастазы в 7 и более региональных лимфатических узлах.
* Опухолевые депозиты (сателлиты) - макроскопически или микроскопически выявляемые гнезда или очаги опухолевой ткани в жировой ткани вокруг толстой и прямой кишки, находящейся в области лимфатического дренирования от первичной карциномы, при отсутствии ткани лимфатических узлов в этих участках, подтверждаемом при гистологическом исследовании, могут рассматриваться как прерывистое распространение опухоли, инвазия в венозные сосуды с внесосудистым распространением (V1/2) или полное замещение лимфатических узлов (N1/2). Если такие депозиты выявляют при наличии опухоли, то их следует классифицировать.
рTNM патоморфологическая классификация
Категории pT, pN и рМ отвечают категориям Т, N и М.
Гистологически должны быть исследованы не менее 12 регионарных лимфатических узлов. Если исследованные лимфоузлы без опухолевого роста, то категория N классифицируются как pN0.
Гистологическая классификация опухолей прямой кишки:
2. Слизистая аденокарцинома.
3. Перстневидно-клеточная карцинома.
4. Плоскоклеточная карцинома.
5. Железисто-плоскоклеточная карцинома.
6. Недифференцированная карцинома.
7. Неклассифицируемая карцинома.
Группировка по стадиям
Диагностика
Ирригоскопия позволяет при полуциркулярных или циркулярных опухолях со стенозом оценить протяженность опухоли по длиннику, форму роста, выявить вторую опухоль, крупные полипы, дивертикулы, в известной степени судить о прорастании в окружающие ткани.
Рентгенологическая картина рака прямой кишки разнообразна и диагноз можно установить только на основании нескольких рентгенологических признаков при соблюдении правильной методики исследования. К ним относят: дефект наполнения, ригидность, нечеткость и неровность контуров стенки кишки, сужение просвета, тень внутрипросветного образования, стойкое депо бариевой взвеси, деформацию кишки, локальные изменения рельефа слизистой оболочки. О прорастании рака прямой кишки в окружающие ткани можно предположить при выявлении отчетливого увеличения пресакрального пространства, если оно сочетается с оттеснением кишки в области опухоли.
Дифференциальный диагноз
Существует ряд заболеваний прямой кишки, которые но своей клинической картине могут напоминать рак этого органа. К ним относятся: геморрой, аденоматозные полипы, ворсинчатая опухоль, саркома, болезнь Никола-Фавра, сифилис, актиномикоз и эндометриоз.
Сходство рака с геморроем заключается в выделении крови со стулом. Однако если кровь при геморрое завершает акт дефекации, при раке она открывает его. Кроме того, геморроидальная кровь имеет неизменный вид, а при раке кровь обычно перемешана со слизью, гноем и нередко с калом, часто обладает неприятным запахом.
Железистые полипы прямой кишки, особенно на широком основании, могут давать повод для смешения с полиповидным раком. Уточнение диагноза нередко возможно только после гистологической верификации.
Ворсинчатые опухоли в большинстве случаев распознаются по экзофитному росту, мягкой консистенции, бархатистой поверхности, покрытой тонким слоем липкой слизи, легкой ранимости. Вместе с тем склонность их к малигнизации настойчиво побуждает производить микроскопическое исследование для исключения рака.
Проктит при болезни Никола-Фавра (паховом лимфогранулематозе) отличается от рака прямой кишки на основании анамнеза (заражение половым путем), длительности течения, реакции Фрея и связывания компонента. В сомнительных случаях показана биопсия.
Туберкулезное поражение прямой кишки, как и рак, сопровождается болями, особенно во время дефекации, выделением слизи, гноя и крови. При обследовании выявляется проктит с образованием единичных или множественных эрозий и язв, склонных к периферическому росту. Комплексное исследование с дополнительным привлечением бактериологических, биологических и микроскопических методов лежит в основе дифференциальной диагностики.
Сифилитический проктит относится к редким заболеваниям. Он может возникать в любом периоде болезни. Существенную роль в распознавании этой патологии, помимо общепринятых, играют серологические методы.
Читайте также:


