Иммунофенотип острого миелоидного лейкоза
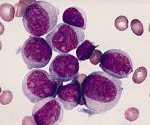
Острый миелоидный лейкоз – злокачественное заболевание системы крови, сопровождающееся неконтролируемым размножением измененных лейкоцитов, снижением количества эритроцитов, тромбоцитов и нормальных лейкоцитов. Проявляется повышенной склонностью к развитию инфекций, лихорадкой, быстрой утомляемостью, потерей веса, анемией, кровоточивостью, образованием петехий и гематом, болями в костях и суставах. Иногда выявляются изменения кожи и припухлость десен. Диагноз устанавливается на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, трансплантация костного мозга.
МКБ-10
- Причины острого миелоидного лейкоза
- Классификация острого миелоидного лейкоза
- Симптомы острого миелоидного лейкоза
- Диагностика и лечение острого миелоидного лейкоза
- Прогноз острого миелоидного лейкоза
- Цены на лечение
Общие сведения
Острый миелоидный лейкоз (ОМЛ) – злокачественное поражение миелоидного ростка крови. Неконтролируемая пролиферация лейкозных клеток в костном мозге влечет за собой подавление остальных ростков крови. В результате количество нормальных клеток в периферической крови уменьшается, возникают анемия и тромбоцитопения. Острый миелоидный лейкоз является самым распространенным острым лейкозом у взрослых. Вероятность развития болезни резко увеличивается после 50 лет. Средний возраст пациентов составляет 63 года. Мужчины и женщины молодого и среднего возраста страдают одинаково часто. В старшей возрастной группе наблюдается преобладание лиц мужского пола. Прогноз зависит от вида острого миелоидного лейкоза, пятилетняя выживаемость колеблется от 15 до 70%. Лечение осуществляют специалисты в области онкологии и гематологии.

Причины острого миелоидного лейкоза
Непосредственной причиной развития ОМЛ являются различные хромосомные нарушения. В числе факторов риска, способствующих развитию таких нарушений, указывают неблагоприятную наследственность, ионизирующее излучение, контакт с некоторыми токсическими веществами, прием ряда лекарственных препаратов, курение и болезни крови. Вероятность возникновения острого миелоидного лейкоза увеличивается при синдроме Блума (низкий рост, высокий голос, характерные черты лица и разнообразные кожные проявления, в том числе гипо- или гиперпигментация, кожная сыпь, ихтиоз, гипертрихоз) и анемии Фанкони (низкий рост, дефекты пигментации, неврологические расстройства, аномалии скелета, сердца, почек и половых органов).
Острый миелоидный лейкоз достаточно часто развивается у больных с синдромом Дауна. Прослеживается также наследственная предрасположенность при отсутствии генетических заболеваний. При ОМЛ у близких родственников вероятность возникновения болезни повышается в 5 раз по сравнению со средними показателями по популяции. Самый высокий уровень корреляции выявляется у однояйцевых близнецов. Если острый миелоидный лейкоз диагностируется у одного близнеца, риск у второго составляет 25%. Одним из важнейших факторов, провоцирующих ОМЛ, являются заболевания крови. Хронический миелоидный лейкоз в 80% случаев трансформируется в острую форму болезни. Кроме того, ОМЛ нередко становится исходом миелодиспластического синдрома.
Ионизирующее излучение вызывает острые миелоидные лейкозы при превышении дозы 1 Гр. Заболеваемость увеличивается пропорционально дозе облучения. На практике имеет значение пребывание в зонах атомных взрывов и аварий на атомных электростанциях, работа с источниками излучения без соответствующих защитных средств и радиотерапия, применяемая при лечении некоторых онкологических заболеваний. Причиной развития острого миелоидного лейкоза при контакте с токсическими веществами является аплазия костного мозга в результате мутаций и поражения стволовых клеток. Доказано негативное влияние толуола и бензола. Обычно ОМЛ и другие острые лейкозы диагностируются спустя 1-5 лет после контакта с мутагеном.
В числе лекарственных средств, способных провоцировать острые миелоидные лейкозы, специалисты называют некоторые препараты для химиотерапии, в том числе ингибиторы ДНК-топоизомеразы II (тенипозид, этопозид, доксорубицин и другие антрациклины) и алкилирующие средства (тиофосфамид, эмбихин, циклофосфамид, хлорамбуцил, кармустин, бусульфан). ОМЛ также может возникать после приема хлорамфеникола, фенилбутазона и препаратов мышьяка. Доля лекарственных острых миелоидных лейкозов составляет 10-20% от общего количества случаев заболевания. Курение не только повышает вероятность развития ОМЛ, но и ухудшает прогноз. Средняя пятилетняя выживаемость и продолжительность полных ремиссий у курильщиков ниже, чем у некурящих.
Классификация острого миелоидного лейкоза по версии ВОЗ очень сложна и включает в себя несколько десятков разновидностей заболевания, разделенных на следующие группы:
- ОМЛ с типичными генетическими изменениями.
- ОМЛ с изменениями, обусловленными дисплазией.
- Вторичные острые миелоидные лейкозы, возникшие в результате лечения других заболеваний.
- Болезни с пролиферацией миелоидного ростка при синдроме Дауна.
- Миелоидная саркома.
- Бластная плазмацитоидная дендритноклеточная опухоль.
- Другие виды острого миелоидного лейкоза.
Тактика лечения, прогноз и продолжительность ремиссий при разных видах ОМЛ могут существенно различаться.
Симптомы острого миелоидного лейкоза
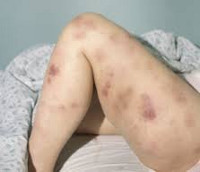
Клиническая картина включает в себя токсический, геморрагический, анемический синдромы и синдром инфекционных осложнений. На ранних стадиях проявления острого миелоидного лейкоза неспецифичны. Отмечается повышение температуры без признаков катарального воспаления, слабость, утомляемость, потеря веса и аппетита. При анемии присоединяются головокружения, обморочные состояния и бледность кожных покровов. При тромбоцитопении наблюдаются повышенная кровоточивость и петехиальные кровоизлияния. Возможно образование гематом при незначительных ушибах. При лейкопении возникают инфекционные осложнения: частые нагноения ран и царапин, упорные повторные воспаления носоглотки и т. д.
В отличие от острого лимфобластного лейкоза при остром миелоидном лейкозе отсутствуют выраженные изменения со стороны периферических лимфатических узлов. Лимфоузлы небольшие, подвижные, безболезненные. Иногда выявляется увеличение лимфатических узлов в шейно-надключичной области. Печень и селезенка в пределах нормы или незначительно увеличены. Характерны признаки поражения костно-суставного аппарата. Многие больные острым миелоидным лейкозом предъявляют жалобы на боли различной степени интенсивности в области позвоночника и нижних конечностей. Возможны ограничения движений и изменения походки.
В числе экстрамедуллярных проявлений острого миелоидного лейкоза – гингивит и экзофтальм. В отдельных случаях наблюдаются припухлость десен и увеличение небных миндалин в результате инфильтрации лейкозными клетками. При миелоидной саркоме (составляет около 10% от общего количества случаев острого миелоидного лейкоза) на коже пациентов появляются зеленоватые, реже – розовые, серые, белые или коричневые опухолевидные образования (хлоромы, кожные лейкемиды). Иногда при поражениях кожи обнаруживается паранеопластический синдром (синдром Свита), который проявляется воспалением кожных покровов вокруг лейкемидов.
В развитии острого миелоидного лейкоза выделяют пять периодов: начальный или доклинический, разгара, ремиссии, рецидива и терминальный. В начальном периоде острый миелоидный лейкоз протекает бессимптомно или проявляется неспецифической симптоматикой. В периоде разгара токсический синдром становится более выраженным, выявляются анемический, геморрагический и инфекционный синдромы. В период ремиссии проявления острого миелоидного лейкоза исчезают. Рецидивы протекают аналогично периоду разгара. Терминальный период сопровождается прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика и лечение острого миелоидного лейкоза
Основой лечения острого миелоидного лейкоза является химиотерапия. Выделяют два этапа лечения: индукцию и консолидацию (постремиссионную терапию). На этапе индукции выполняют лечебные мероприятия, направленные на уменьшение количества лейкозных клеток и достижение состояния ремиссии. На этапе консолидации устраняют остаточные явления болезни и предотвращают рецидивы. Лечебную тактику определяют в зависимости от вида острого миелоидного лейкоза, общего состояния больного и некоторых других факторов.
Программы индукции позволяет добиться ремиссии у 50-70% пациентов с острым миелоидным лейкозом. Однако без дальнейшей консолидации у большинства больных наступает рецидив, поэтому второй этап лечения рассматривается, как обязательная часть терапии. План консолидационного лечения острого миелоидного лейкоза составляется индивидуально и включает в себя 3-5 курсов химиотерапии. При высоком риске рецидивирования и уже развившихся рецидивах показана трансплантация костного мозга. Другие методы лечения рецидивных ОМЛ пока находятся в стадии клинических испытаний.
Прогноз определятся разновидностью острого миелоидного лейкоза, возрастом больного, наличием или отсутствием миелодиспластического синдрома в анамнезе. Средняя пятилетняя выживаемость при разных формах ОМЛ колеблется от 15 до 70%, вероятность развития рецидивов – от 33 до 78%. У пожилых людей прогноз хуже, чем у молодых, что объясняется наличием сопутствующих соматических заболеваний, являющихся противопоказанием для проведения интенсивной химиотерапии. При миелодиспластическом синдроме прогноз хуже, чем при первичном остром миелоидном лейкозе и ОМЛ, возникшем на фоне фармакотерапии по поводу других онкологических заболеваний.
В рамках франко-американско-британской морфологической классификации (ФАБ, FAB) выделяют 8 основных вариантов ОМЛ.
Некоторые очень редкие разновидности ОМЛ не включены в этот список. Варианты ОМЛ с М3 по М7, имеющие собственные названия и некоторые специфические особенности, более подробно рассмотрены в отдельных разделах нашего справочника.
ОМЛ составляет у детей около 15% всех случаев онкологических заболеваний кроветворной системы, то есть встречается у них заметно реже, чем острый лимфобластный лейкоз. Среди детей до 14 лет частота ОМЛ составляет приблизительно 0.6-0.8 случаев на 100 тысяч человек в год, однако в возрасте после 40-45 лет происходит резкий подъем заболеваемости. Большинство больных ОМЛ – пожилые люди. В отличие от острого лимфобластного лейкоза, наиболее характерного для детского возраста, при ОМЛ дети составляют всего 10% больных.
В большинстве случаев ОМЛ невозможно назвать непосредственную причину заболевания. Однако некоторые факторы повышают вероятность возникновения ОМЛ: воздействие ряда химических препаратов, ионизирующей радиации (в том числе в ходе предшествующего лечения других онкозаболеваний), иногда – случаи заболевания ОМЛ среди ближайших родственников, что говорит об определенной роли генетической предрасположенности.
Развитию ОМЛ могут предшествовать некоторые заболевания кроветворной системы, такие как миелодиспластический синдром. Наконец, риск ОМЛ повышен при определенных генетически обусловленных аномалиях, включая синдром Дауна, анемию Фанкони и некоторые другие состояния.
Так как большинство симптомов может быть связаны и с другими заболеваниями и не специфично для ОМЛ, перед началом лечения необходимо уточнение диагноза на основании лабораторных методов, которое в срочном порядке производится в больничных условиях.
При ОМЛ возникают изменения в обычном клиническом анализе крови: недостаток эритроцитов и тромбоцитов, чаще всего избыток лейкоцитов, причем многие из них представлены незрелыми формами. Но надежно поставить диагноз можно только при исследовании образца костного мозга. Согласно критериям Всемирной организации здравоохранения, диагноз ОМЛ ставится, если содержание миелобластов в костном мозге не менее 20% (согласно франко-американо-британской классифиции FAB, пороговым значением является 30%).
Точная диагностика ОМЛ и его вариантов иногда представляет собой сложную задачу, требующую участия высококвалифицированных гематологов и гемопатологов в диагностическом процессе.
Как и при остром лимфобластном лейкозе, результаты диагностических исследований при ОМЛ используются для отнесения пациента к той или иной группе риска. Это необходимо для того, чтобы определить тактику лечения, оценить как вероятность ответа на химиотерапию, так и риск последующего рецидива. У пациентов, принадлежащим к группе низкого риска, больше шансов достичь долговременной ремиссии при стандартном химиотерапевтическом лечении, а при высоком риске для успеха терапии может понадобиться трансплантация костного мозга.
Группу риска определяют многие факторы. Перечислим некоторые из них:
- Возраст: у больных среднего и пожилого возраста прогноз в среднем хуже, чем у детей и молодых людей.
- Хромосомные изменения в лейкемических клетках. Так, транслокации t(15;17) или t(8;21) определяют у больных более низкий риск. В то же время, например, определенные изменения хромосом 5 и 7 связаны с ухудшением прогноза.
- Вариант лейкоза. Некоторые варианты ОМЛ (такие как М0, М6, М7) связаны с высоким риском, а некоторые, напротив, сравнительно хорошо поддаются современной терапии (ОМЛ М3).
- С более высоким риском связан вторичный лейкоз, возникший на фоне другого гематологического заболевания – такого как миелодиспластический синдром или анемия Фанкони, – или после прохождения лечения (химиотерапия, облучение) по поводу какой-либо злокачественной опухоли. Риск также резко повышается при рецидиве лейкоза.
Главным методом лечения ОМЛ является химиотерапия. Как в случае острого лимфобластного лейкоза, лечение включает фазы индукции ремиссии и консолидации; иногда применяется также поддерживающая терапия.
Специфической особенностью терапии при остром промиелоцитарном лейкозе (ОМЛ М3) является использование лекарства ATRA (полностью транс-ретиноевая кислота, третиноин).
Если в результате терапии индукции оказывается, что в костном мозге стало менее 5% бластных клеток и у пациента нет других проявлений болезни (в том числе признаков нейролейкемии), то констатируется достижение ремиссии.
В результате курсов индукции удается достичь ремиссии у подавляющего большинства пациентов. Однако достигнутая ремиссия не может быть стойкой без терапии консолидации, то есть закрепления ремиссии. В фазе консолидации уничтожаются остаточные количества аномальных бластных клеток во избежание рецидива заболевания. Важнейшим препаратом в фазе консолидации при лечении ОМЛ является цитарабин, часто в высоких дозах; в разных сочетаниях используются также даунорубицин, 6-меркаптопурин, ифосфамид, митоксантрон, этопозид и др.
На этапах индукции и консолидации внутривенное введение химиотерапевтических препаратов производится в условиях больничного стационара.
Поддерживающая терапия используется далеко не во всех случаях (в отличие от острого лимфобластного лейкоза), однако при варианте ОМЛ М3 она важна. Эта терапия менее интенсивна, чем терапия индукции и консолидации, и не требует пребывания в больнице.
Нейролейкемия менее характерна для ОМЛ, чем для острого лимфобластного лейкоза. Чаще всего она встречается при вариантах ОМЛ М3, М4 и М5. Для ее лечения и профилактики могут использоваться цитарабин, метотрексат и глюкокортикостероиды, вводимые интратекально, посредством люмбальной пункции спинномозгового канала. Изредка может использоваться также облучение головы (краниальное облучение). У детей риск распространения лейкоза в центральную нервную систему выше, чем у взрослых, поэтому профилактическая химиотерапия для его предотвращения используется чаще.
Для снижения вероятности рецидива пациентам из группы высокого риска может быть показана трансплантация костного мозга. Показаниями к трансплантации могут служить, например,
- транслокации и другие цитогенетические изменения в лейкемических клетках, связанные с высоким риском,
- рецидив лейкоза,
- развитие ОМЛ на фоне миелодиспластического синдрома или другой болезни крови, а также после предшествующего лечения злокачественных опухолей.
Вероятность успеха трансплантации максимальна, если проводить ее после достижения первой ремиссии. У детей трансплантации производятся чаще, чем у взрослых, и в среднем более успешны.
В ходе интенсивной химиотерапии ОМЛ практически всегда в той или иной мере подавляется нормальное кроветворение. Поэтому многим больным ОМЛ необходимы переливания компонентов крови: тромбоцитов во избежание кровотечений и эритроцитов для лечения анемии. Переливания донорских лейкоцитов (гранулоцитов) нужны только в случаях тяжелых инфекционных осложнений.
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения часто необходимы эффективные антибактериальные, противогрибковые и противовирусные лекарства для профилактики и терапии инфекционных осложнений. Опасность представляют как обычные, так и оппортунистические инфекции. В частности, серьезную проблему представляют такие грибковые инфекции, как кандидоз и аспергиллез.
Лечение ОМЛ накладывает ограничения на образ жизни больного. В ходе интенсивной химиотерапии необходимо соблюдать диету и строгие правила гигиены, а также минимизировать контакты с внешним миром во избежание инфекций. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
Общая продолжительность лечения при различных формах ОМЛ составляет от нескольких месяцев до 2-3 лет.
Без лечения ОМЛ, как правило, приводит к гибели больного в течение нескольких месяцев, иногда даже нескольких недель. Однако при современном лечении многих можно спасти. Прогноз зависит от конкретной разновидности миелолейкоза, цитогенетических особенностей (т.е. хромосомной структуры лейкемических клеток), возраста, общего состояния больного и других факторов.
В настоящее время порядка 50-60% детей, заболевших ОМЛ, выздоравливают. В среднем и пожилом возрасте, к сожалению, результаты хуже.
Следует отметить, что большинство пациентов с ОМЛ – это именно пожилые больные. По сравнению с молодыми они тяжелее переносят лечение и хуже на него отвечают. Всего у 5-15% пациентов старше 60 лет удается достичь длительной ремиссии. Для остальных зачастую основным становится поддерживающее лечение (борьба с инфекциями, переливания компонентов крови, обезболивание) для некоторого продления жизни и улучшения ее качества.
Острый миелоидный лейкоз
Острый миелоидный лейкоз (ОМЛ) является редкими, злокачественными заболеваниями кроветворной системы. Во-первых, здесь затрагивается костный мозг (мозговой оссиум), в котором образуются красные (эритроциты) и белые (лейкоциты) клетки крови.
В костном мозге происходит так называемый блок дифференциации. Незрелые клетки крови (бласты) накапливаются в крови и костном мозге, что (в простых выражениях) приводит к подавлению нормального формирования крови.
Контроль уровня крови в лейкемии
- Острый миелоидный лейкоз является злокачественным заболеванием гемопоэтической системы.
- При отсутствии лечения эта болезнь вызывает смерть.
- Симптомы острый миелоидного лейкоза: первые признаки — неспецифические симптомы, такие как увеличение физической слабости, бледности и восприимчивости к инфекции.
- Острый миелоидный лейкоз в первую очередь лечится химиотерапией и трансплантацией стволовых клеток.
- Курс при остром миелоидном лейкозе: шансы на ремиссию снижаются с возрастом.
В результате из-за недостатка мощности новые незрелые клетки все чаще высвобождаются в кровоток, которые не могут или недостаточно выполняют свои фактические задачи. Таким образом, кратковременные и среднесрочные функциональные клетки крови отсутствуют. Это заболевание встречается примерно у трех четвертей всех случаев в зрелом возрасте. Оставленный без лечения, он приводит к смерти.
Острый курс миелоидного лейкоза и формы заболевания
Острый миелоидный лейкоз и его формы подразделяются по-разному, в зависимости от издательского общества.
Необходимым условием для набора являются соответствующие обширные лабораторные анализы крови. Были широко использованы предложения Французско-Американско-Британской кооперативной группы (FAB), которая различает острый миелоидный лейкоз, например, в соответствии с дифференциацией, созреванием и другими формами.
В последние годы определение Всемирной организации здравоохранения (ВОЗ), в котором более четко учитываются характеристики БД и дифференциации, становится все более распространенным явлением.

Острые симптомы миелоидной лейкемии
Первоначально острый миелоидный лейкоз показывает симптомы, которые расположены в более обобщенной области.
Может случиться, что эти симптомы изначально неверно истолкованы. Признаки заболевания возникают из-за нарушения кровообращения (гемопоэза) и результирующего процесса репрессий.
Острый миелоидный лейкоз показывает симптомы или может быть выражен следующим образом:
- Те, кто пострадал, часто замечают неспецифические признаки, такие как усталость, слабость, снижение работоспособности, одышка, ночной пот, диффузные проблемы с пищеварением и потеря аппетита. Иногда из-за анемии возникает заметная бледность.
- Особенно у детей есть явное нежелание играть и общее отсутствие интереса.
- Из-за отсутствия функционирующих белых кровяных клеток (лейкоцитов) возникает общая восприимчивость к инфекции, которая характеризуется появлением грибковых инфекций во рту (молочница). Эти грибковые инфекции, в свою очередь, могут быть обобщены и распространены на другие органы. Часто эта восприимчивость к инфекции связана с темпиратурой. Нередко возникает тонзиллит.
- В качестве дальнейших признаков инфекции может развиться пневмония.
Кроме того, видимым симптомом является повышенная склонность к кровотечению, длительные кровотечения из носа, точечные или пятнистые кровотечения под кожей (петехии, синяки), кровотечение десен и слизистых оболочек, а также увеличение или удлинение менструаций у женщин. Они вызваны расстройством свертывания крови из-за отсутствия тромбоцитов. - По мере развития болезни существует вероятность того, что незрелые лейкоциты в крови значительно возрастут. Это может привести к неврологическим симптомам (ощущение дискомфорта, боли, сильного зуда и покалывания, головная боль, жесткость шеи, помутнение зрения), к общей недостаточности организма с кислородом и кровотечением сетчатки.
- Опухоль лимфатических узлов, а также увеличение печени, яичек и селезенки являются дальнейшими возможными побочными эффектами.
Из-за распространения патологических типов клеток (бластов) в суставах и костях возможна соответствующая болевая симптоматика.
Симптомы острого миелоидного лейкоза — Интерпретация симптомов
Важно: значительная часть описанных выше симптомов также присутствует во многих других, относительно безвредных заболеваниях. Определенно требуется правильный диагноз врача или онколога.
Курс острой миелоидной лейкемии
Как описано, AML (острый миелоидный лейкоз) является острым заболеванием с соответствующим быстрым началом заболевания, которое требует немедленного начала лечения (обычно это химиотерапевтический подход и / или трансплантация стволовых клеток).
Острый миелоидный лейкоз демонстрирует такие симптомы, как увеличение количества бластов в крови за короткий промежуток времени. Они могут соответственно оседать в органах (печени, селезенке).
Процесс болезни всегда фатален без терапии из-за выраженного ослабления иммунной системы организма, это может произойти через несколько недель после появления первых симптомов.
Основываясь на нескольких исследованиях, долгосрочная выживаемость людей с ПОД, зависит от возраста.
У пациентов в возрасте до 60 лет, она не выше 40 процентов у пациентов старше 60 лет не более чем 20 процентов.
После обнаружения лейкемии необходимы регулярные и обширные проверки для своевременного обнаружения любого возможного возврата болезни (рецидива) и обеспечить соответствующий ответ.
Специфические факторы риска рецидива включают пожилой возраст на момент первого заболевания (55 или старше) или доказательства так называемого вторичного ОМЛ. Органы управления включают в себя исследования костного мозга и пострадавших органических мест.
Несмотря на полную морфологическую ремиссию (CR) после первичной терапии, подавляющее большинство пациентов рецидивирует. В зависимости от исследования упоминается от 50 до 80 процентов.
Рецидивы чаще возникают либо в первые 12 месяцев после ЧР, либо в первые 2 года после первого диагноза. Повторение также требует лечения AML с помощью химиотерапии или трансплантации стволовых клеток, часто в сочетании.
В случае отказа этих терапевтических вариантов указывается паллиативный подход, включая профилактику инфекции и поставку продуктов крови.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
При остром миелобластном лейкозе злокачественная трансформация и неконтролируемая пролиферация аномально дифференцированных, долгоживущих клеток-предшественников миелоидного ряда вызывает появление бластных клеток в циркулирующей крови, замещение нормального костного мозга злокачественными клетками.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
Код по МКБ-10
Симптомы и диагностика острого миелобластного лейкоза
Симптомы включают утомляемость, бледность, лихорадку, инфекции, кровоточивость, легко образующиеся подкожные кровоизлияния; симптомы лейкозной инфильтрации имеются только у 5 % больных (часто в виде кожных проявлений). Для установления диагноза необходимо исследование мазка периферической крови и костного мозга. Лечение включает индукционную химиотерапию для достижения ремиссии и пост-ремиссионную терапию (с трансплантацией стволовых клеток или без нее) с целью профилактики рецидива.
Заболеваемость острым миелобластным лейкозом повышается с возрастом, это наиболее распространенный лейкоз у взрослых с медианой возраста развития заболевания, равного 50 годам. Острый миелобластный лейкоз может развиваться как вторичное онкологическое заболевание после проведения химиотерапии или лучевой терапии при различных видах рака.
Острый миелобластный лейкоз включает ряд подтипов, которые отличаются друг от друга по морфологии, иммунофенотипу и цитохимии. На основании преобладающего типа клеток описано 5 классов острого миелобластного лейкоза: миелоидный, миелоидномоноцитарный, моноцитарный, эритроидный и мегакариоцитарный.
Острый промиелоцитарный лейкоз является особенно важным подтипом и составляет 10-15 % всех случаев острого миелобластного лейкоза. Он встречается у наиболее молодой группы больных (медиана возраста 31 год) и преимущественно в конкретной этнической группе (латиноамериканцы). Этот вариант часто дебютирует нарушениями свертываемости крови.
К кому обратиться?
Лечение острого миелобластного лейкоза
Целью начальной терапии острого миелобластного лейкоза является достижения ремиссии, и, в отличие от острого лимфобластного лейкоза, при остром миелолейкозе ответ достигается при использовании меньшего количества препаратов. Базисный режим индукции ремиссии включает продолжительную внутривенную инфузию цитарабина или цитарабин в высоких дозах в течение 5-7 дней; на протяжении этого времени в течение 3 дней внутривенно вводят даунорубицин или идарубицин. Некоторые режимы включают 6-тиогуанин, этопозид, винкристин и преднизолон, но эффективность данных лечебных схем неясна. Лечение обычно приводит к выраженной миелосупрессии, инфекционным осложнениям и кровоточивости; до восстановления костного мозга обычно проходит длительное время. В течение этого периода жизненно важна тщательная профилактическая и поддерживающая терапия.
При остром промиелоцитарном лейкозе (ОПЛ) и некоторых других вариантах острого миелобластного лейкоза на момент постановки диагноза может присутствовать диссеминированное внутрисосудистое свертывание (ДВС), усугубляемое в результате высвобождения лейкозными клетками прокоагулянтов. При остром промиелоцитарном лейкозе с транслокацией t (15; 17) применение АТ-РА (трансретиноевая кислота) способствует дифференцировке бластных клеток и коррекции диссеминированного внутрисосудистого свертывания в течение 2-5 дней; в сочетании с даунорубицином или идарубицином этот режим может индуцировать ремиссию у 80-90 % больных с долговременной выживаемостью 65-70 %. Триоксид мышьяка также эффективен при остром промиелоцитарном лейкозе.
После достижения ремиссии проводится фаза интенсификации этими или другими препаратами; режимы с применением цитарабина в высоких дозах могут увеличивать длительность ремиссии, особенно у больных до 60 лет. Профилактика поражения центральной нервной системы обычно не проводится, так как при достаточной системной терапии поражение центральной нервной системы является редким осложнением. У больных, получивших интенсивное лечение, не было продемонстрировано преимуществ поддерживающей терапии, но в других ситуациях она может быть полезна. Экстрамедуллярное поражение в качестве изолированного рецидива встречается редко.
Прогноз при остром миелобластном лейкозе
Частота индукции ремиссии составляет от 50 до 85 %. Долговременная выживаемость без заболевания достигается у 20-40 % всех больных и у 40-50 % молодых больных, лечение которых включало трансплантацию стволовых клеток.
Прогностические факторы помогают определить протокол лечения и его интенсивность; больные с явно неблагоприятными прогностическими факторами обычно получают более интенсивное лечение, потому что потенциальное преимущество такого лечения предположительно оправдывает более высокую токсичность протокола. Наиболее важным прогностическим фактором является кариотип лейкозных клеток; неблагоприятными кариотипами являются t (15; 17), t (8;21), inv16(p13; q22). Другими неблагоприятными прогностическими факторами являются более старший возраст, миелодиспластическая фаза в анамнезе, вторичный лейкоз, высокий лейкоцитоз, отсутствие палочек Ауэра. Использование только классификаций FAB или ВОЗ не позволяет предсказать ответ на лечение.

[12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23]
Читайте также:

