Иммунная система рак мозга
Иммунная система в принципе для того и существует, чтобы удалять из организма все чужеродное, каковым есть также и раковая опухоль, поэтому функция контроля опухолевого роста это одна из главных задач иммунитета. Наиболее убедительные онкологические исследования показали, что количество иммунных клеток, находящихся внутри опухоли часто соответствует хорошим результатам лечения рака. Но, к сожалению, этого явления не наблюдается в центральной нервной системе (головном и спинном мозге), где иммунный ответ более жестко контролируется для избежания одновременного поражения нервной системы.
Недавно в журнале "Oncoimmunology" команда ученых во главе с Эндрю Донсоном и Николасом Форманом опубликовала исследования по посвященные оценке роли инфильтрации опухоли иммунными клетками для прогнозирования течения рака мозга и его ответа на лечение. При анализе более 50 независимых исследований, было выявлено прогностически благоприятное влияние инфильтрации иммунными клетками при 14 типах разных опухолей. Примечательно, что ни один из этих типов опухолей не был характерен для центральной нервной системы. Предшествующее изучение инфильтрации наиболее распространенной опухоли головного мозга взрослых - глиобластомы, было неубедительным из-за разнородности результатов.
Два недавних лабораторных исследования авторов обзора косвенно предоставили данные об активности противоопухолевого иммунитета при двух типах опухолей центральной нервной системы - астроцитоме и эпендимоме. После лечения характерной для детского возраста опухоли - эпендимомы, примерно у 50% пацентов отмечаются рецидивы. Авторы идентифицировали наиболее активные гены в рецидивирующих и не рецидивирующих опухолях. Неожиданно оказалось, что иммунная функция имеет влияние на гены, связанные с хорошим прогнозом.
Эти результаты были обобщены в последующих анализах генов астроцитомы, часто встречающейся опухоли взрослых и в редких случаях - у детей, с очень плохим прогнозом и средней выживаемостью в полтора года. Менее 10% пациентов с астроцитомой переживают пятилетний рубеж, и эта часть больных была очень интересной для аналогичного изучения генов, связанных с благоприятным клиническим исходом.
Опять же, в двух независимых анализах иммунная функция имела влияние на гены, связанные с долгосрочной выживаемостью при астроцитоме. С помощью иммуногистохимического исследования измерялась степень инфильтрации опухоли различными иммунными клетками - цитотоксическими Т-клетками, Т-хелперами. Было обнаружено, что высокая степень инфильтрации показала ценность для прогнозирования продолжительности жизни. Вообще инфильтрация иммунными клетками была независимым прогностическим фактором высокой продолжительности жизни даже тогда, когда в анализ включили клиническую картину - традиционный важный прогностический фактор при астроцитоме.
Вместе эти исследования показывают, что интенсивная инфильтрация иммунными клетками связана с лучшим прогнозом при обоих типах опухолей головного мозга. Из этого исследователи сделали вывод, что иммунная система активно управляет ростом опухоли при этих вариантах опухолей нервной системы.
Обнаружение предполагаемого противоопухолевого иммунитета в нервной системе имеет очень большое значение для онкологии, предоставляя логическое обоснование для развития иммунотерапии опухолей головного и спинного мозга.
Задать вопрос врачу онкологу
Диагностка и лечение онкологии в медицинских центрах Израиля подробная информация
Подпишитесь на рассылку Новости онкологии и будьте в курсе всех событий и новостей в мира онкологии.
8 февраля 2019 11:11
Человеку, оказавшемуся беспомощным в сложной жизненной ситуации, свойственно цепляться за самые эфемерные надежды. Время от времени распространялись слухи о необъяснимых исцелениях — вопреки прогнозам врачей, почти чудесным образом опухоль исчезала. Эти редчайшие случаи как бы намекали, что человек все же не полностью беззащитен перед болезнью. Есть в его распоряжении какая-то сила, неизвестная и неподконтрольная медицине.
Ключевой игрок — лимфоциты. В этих кровяных клетках происходят случайные перестройки особых генов, в результате чего в каждом лимфоците вырабатывается белок-иммуноглобулин, способный узнавать какую-то специфическую загогулину на других белковых молекулах. Когда такая загогулина — например, в составе оболочки зловредного вируса — появляется в поле зрения лимфоцита, он получает сигнал на размножение, производя множество потомков, готовых атаковать этот белок.
Тем не менее иммунной системе можно помочь — подтолкнуть ее к правильному выбору, слегка подрегулировать контрольные механизмы в сторону чуть меньшей толерантности, чуть большей ксенофобии. На этой идее и основаны методы иммунотерапии рака, которые начали развиваться в начале этого столетия.
Несмотря на исключительную важность проблемы рака для человечества и потраченные на эту проблему миллиарды, за победы в этой борьбе присуждено не так уж много Нобелевских премий. За вычетом тех, которыми были отмечены открытия по вирусной природе некоторых онкозаболеваний, их было всего три. Две из них присуждены за последнее десятилетие, и обе — за разные варианты иммунотерапии.
В 2011 году премию решили присудить Ральфу Штайнману, который разработал одну из самых сложных и дорогих методик иммунотерапии — дендритные вакцины. По воле судьбы именно эта терапия продлила его собственную жизнь на пару лет, которых едва хватило на то, чтобы номинироваться на премию (хотя присуждена она была через два дня после его смерти).
Тасуку Хондзё прославился исследованиями белка PD-1. Аббревиатура PD зловеща, и означает она Programmed Death — программируемую смерть. При хорошем варианте развития событий это вовсе не смерть пациента, а напротив, его благополучие. В конце 1990-х Хондзё и его коллеги из Токийского университета получили линию мышей, у которых белка PD-1 не было. Мышки эти были довольно несчастными: ужасно страдали от целого букета аутоиммунных расстройств. Стало быть, смекнули японцы, их белок как-то участвует в системе контроля иммунитета — тормозит иммунный ответ в тех ситуациях, когда он только все портит.
Сперва казалось, что PD-1 — ключ к аутоиммунным заболеваниям, но он оказался фрагментом еще одного пазла. Белок этот делает вот что: передает лимфоциту сигнал о том, что антитела, которые тот производит, никому не нужны, поскольку направлены на собственные клетки тела. А стало быть, такому лимфоциту следует немедленно совершить сеппуку, что он послушно делает.
Раковые клетки умеют казаться своими: они показывают на своих мембранах белковые сигналы, которые побуждают белок PD-1 считать их друзьями. Но если этот белок удастся блокировать, их старания будут тщетны: T-лимфоциты разыщут их и убьют.

Онколог Евгений Витальевич Ледин, к. м. н., руководитель Центра химиотерапии Клинической больницы МЕДСИ в Боткинском проезде, начал работать с чекпойнт-ингибиторами, а именно с пембролизумабом, еще на стадии клинических испытаний препарата. К нему мы и обратились за комментарием, чтобы он исправил наши ошибки и скорректировал (только, пожалуйста, не слишком!) наш чрезмерный оптимизм.
Я не могу отнести иммунотерапию к области чудес: это не более чем очередной шаг. Это появление дополнительных возможностей, которые никакого отношения к чудесам не имеют, лишь одна из опций, занимающая строго определенное место в общей системе лечения онкологических заболеваний.
Ɔ. А вообще бывают чудесные исцеления, когда вопреки прогнозам опухоль вдруг начинает сама собой исчезать?
Ɔ. Как на практике происходит терапия? Есть ли побочные действия?
Сама процедура — это просто получасовая капельница, которая, как правило, хорошо переносится. Сутки пациент может находиться в стационаре. Что касается побочных эффектов, они бывают у любого препарата. Я в своей практике видел такие побочные эффекты при приеме анальгина, что это было пострашнее любой иммунотерапии. Но иммунотерапия хороша еще и тем, что побочные эффекты в ней по сути разделены на черное и белое: либо все хорошо, либо плохо. В химиотерапии много промежуточных серых тонов: кто-то полностью теряет дееспособность, а большая часть пациентов находится в среднем состоянии. В иммунотерапии очень большая доля пациентов вообще никак не ощущает лечение. А у тех, кто переносит терапию плохо, онкологи научились отслеживать эти побочные эффекты и вовремя их останавливать. В целом иммунотерапия значительно комфортнее, чем другие виды противоопухолевой терапии.
То же самое с иммунотерапией: есть подтип опухолей, где работает данный механизм ускользания от иммунного ответа, и там чекпойнт-ингибиторы оказываются эффективны. Чаще это происходит при меланоме или, к примеру, при раке почки. На фоне прочих достижений это кажется чудесным: люди, которые раньше умирали в течение 6–8 месяцев, теперь стали долго жить: четверть пациентов переживают пятилетний рубеж, что в онкологии приравнивается к излечению. Но это не чудо: просто у этой четверти найденный ключик подходит к тому механизму, который лежит в основе их заболевания.
Но, конечно, такое открытие дает новую надежду пациентам и новую мотивацию онкологам. Когда я начинал работать, онкология была другой. Если сравнить ситуацию сейчас и 20 лет назад, то сейчас пациент в значительно более выгодном положении. Новых возможностей колоссальное количество.
Ɔ.

Наш мозг — это наше все. Нарушение работы этого важнейшего органа приводит к ужасным, а порой и фатальным последствиям. Сложность мозга и его нейронной организации колоссальна, что сильно усложняет процесс лечения того или иного заболевания. Как правило, когда мы что-то лечим, то пытаемся избавиться от дефектов, которые вызывает болезнь. Но, что если использовать эти дефекты для борьбы с тем, что их создает? Именно это и решили сделать авторы рассматриваемого нами сегодня исследования. Как ученые применили нарушение работы гемато-энцефалического барьера, зачем нужен доступ к внеклеточному матриксу мозга и какую роль в этом сыграла паразитирующая на рыбах минога? Об этом нам поведает доклад исследовательской группы. Поехали.
Прежде всего стоит разобраться с действующими лицами в этой лабораторной пьесе.
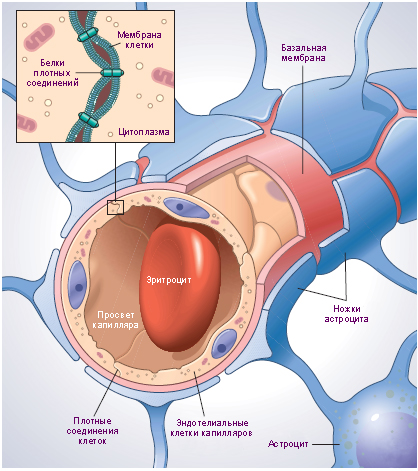
Гемато-энцефалический барьер
Одну из главных ролей исполняет гемато-энцефалический барьер (ГЭБ) — физиологическая преграда между центральной нервной системой (ЦНС) и кровеносной системой. Этот барьер предотвращает контакт нервных тканей с различными компонентами циркулирующей крови, среди которых могут быть токсины, микроорганизмы, клеточные/гуморальные факторы иммунной системы, которые могут отреагировать на клетки мозга, как на чужеродные. ГЭБ можно сравнить с вышибалой в очень дорогом клубе, пропускающим в ЦНС исключительно питательные вещества. Но вышибала этот не особо разборчивый, он часто не пропускает лекарственные препараты, необходимые для лечения ЦНС. Получается, система, нацеленная на благо нашего здоровья, может быть преградой для его лечения. Вот вам и ирония в физиологии.
Однако гемато-энцефалический барьер не всегда работает как швейцарские часы. В случаях инсульта, опухолей, различных травм головы, хронических заболеваний ГЭБ начинает сбоить, то есть пропускать в ЦНС то, что ранее он бы отсеял. Помимо естественных причин сбоя есть и антропогенный: фокусированный ультразвук высокой интенсивности и осмотические агенты, которые нарушают работу ГЭБ. Зачем ломать то, что обеспечивает нормальную работу мозга, спросите вы. Затем, чтобы доставить лекарства, которые полноценный ГЭБ отфильтрует. Все равно что вышибала не пустит в клуб врача для упавшего в обморок посетителя, ибо у того нет клубной карты.
Основным и общим для всех случаев результатом нарушения работы ГЭБ является патологическое обнажение внеклеточного матрикса (extracellular matrix, ECM) мозга, который в нормальных условиях изолирован.
Внеклеточный матрикс — это основа соединительной ткани, обеспечивающей механическую поддержку клеток и транспорт химических веществ.
Следовательно, считают ученые, нацелившись на определенные участки мозга с патологически нарушенным ГЭБ, можно доставлять лекарственные препараты в те участки поврежденной ЦНС, которые ранее были недоступны именно из-за ГЭБ.
Таким образом, можно создать лиганд, нацеленный на ECM, который будет эффективен в борьбе с разными болезнями ЦНС, а не с одной конкретной, как ранее разработанные методы.
Для проверки теории на практике ученые решили применить свой метод доставки лекарств к неизлечимой глиобластоме (рак мозга). Данный тип заболевания достаточно редкий, но его крайне сложно победить. Даже после проведения химиотерапии, лучевой терапии и хирургического вмешательства выживаемость составляет примерно 1-2 года.
Недавние исследования показали, что применение иммунотерапии посредством нацеленных на интерлейкин-13* химерных антигенных рецепторов* является достаточно перспективным методом лечения глиобластомы.
Интерлейкины* — пептидные информационные молекулы, вырабатываемые лейкоцитами, в меньшей степени фагоцитами и другими тканями. Интерлейкины являются частью иммунной системы.
Интерлейкин-13* (IL13) является основным медиатором физиологических изменений, вызванных аллергическим воспалением во многих тканях.
Химерный антигенный рецептор* — рекомбинантный гибридный белок, соединяющий фрагмент антитела, способный избирательно связываться с конкретными антигенами, и сигнализирующие домены, активирующие Т-клетки.
Также достаточно эффективным методом борьбы с глиобластомой может быть применение химерных антигенных рецепторов, нацеленных на белок CSPG4.
Кроме того, МРТ анализ показал наличие нарушения работы гемато-энцефалического барьера внутри глиобластомы. Следовательно, методы лечения, связанные с внеклеточным матриксом, должны быть эффективны.
И вот тут на сцену выходит необъятное воображение и креативность ученых. Дело в том, что в качестве ECM-нацеленных реагентов, можно использовать стандартные пептиды и антитела, но это не так весело. Посему ученые решили применить вариабельные рецепторы лимфоцитов (VLR), то есть рецепторы антигена миног.

Класс миноги насчитывает порядка 40 видов, большинство из которых являются паразитами, питающимися кровью рыб, к которым те присасываются.
VLR это серповидные, богатые лейцином белки, которые распознают антигенные мишени со специфичностью и аффинностью*, сравнимыми с антителами на основе иммуноглобулина.
Аффинность* — термодинамическая характеристика силы взаимодействия веществ, таких как антиген и антитело.
Почему именно миноги и их VLR? Дело в том, что между млекопитающими и миногами существует эволюционная пропасть в 500 миллионов лет. Таким образом, VLR миноги может с большей вероятностью распознать консервативные белки и гликаны в ECM, чем антитела млекопитающих.
Для идентификации VLR, которые связывают ECM головного мозга, ученые провели пэннинг — метод отбора определенных био-элементов (белков, петитов и т.д.) из VLR библиотек биомолекул. В результате был получен пул ECM-связывающих клонов*.
Клон* — группа идентичных клеток, которые обладают общим предком (первоисточником), то есть происходят от одной и той же клетки.
Липосомы* — сферические внутриклеточные органеллы, используемые для доставки препаратов в определенные ткани.
Как мы уже узнали ранее, ECM-связывающие VLR были идентифицированы посредством пэннинга VLR библиотек. Сама же библиотека была получена из совокупности VLR миноги, иммунизированных механически изолированными препаратами плазматической мембраны микрососудов головного мозга мыши, которые содержали ассоциированный ECM мозга.
В первую очередь библиотека была обогащена ECM-связующими с помощью двух циклов пэннинга на децеллюляризованном* ЕСМ, генерируемом культивируемыми эндотелиальными клетками головного мозга мыши (клеточная линия bEnd.3).
Децеллюляризация* — метод очистки аллографтов от клеточного компонента для получения неиммуногенной, эффективной и безопасной конструкции на основе естественного внеклеточного матрикса.
Далее необходимо было идентифицировать именно те ECM-связывающие клоны, которые преимущественно связывают bEnd.3 ECM, а не с контрольной группой из ECM фибробластов мыши (клеточная линия 3T3).
Далее отдельные клоны были помещены в 96-ячеечные планшеты, после чего были расширены и индуцированы для отображения VLR. После удаления лишних клонов (чтобы не было субклонирования) ученые смогли провести сравнительную оценку связывания VLR с bEnd.3 и 3T3 ECM с помощью скрининга ELISA (1а).
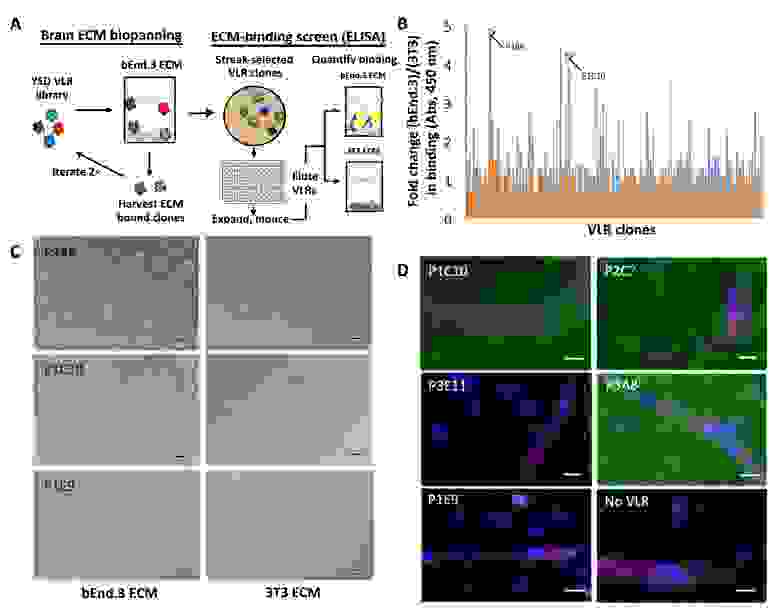
Изображение №1
Суммарно было проанализировано 285 клонов. В результате видно, что сигналы связи с bEnd.3 ECM примерно в 5 раз сильнее, чем сигналы связи с 3T3 ECM (1b).
Далее результаты ELISA проверили с помощью сравнения снимков светлопольной микроскопии клонов, связанных с bEnd.3 и 3T3 ECM (1с).
Как видно на изображении 1с, клоны P1C10 и P2C7 связываются исключительно с bEnd.3 ECM, а не связывающий клон P1E9 практически не демонстрирует каких либо связей с ECM любого типа.
Далее ученые провели сравнительный анализ более практическим методом — на срезе мозга мыши. Восемь из 10 VLR клонов, показавших наилучший результат связывания в предыдущих наблюдениях, в данном анализе также продемонстрировали связывание (1d).
Все связывающие клоны демонстрировали диффузную паренхиматозную схему ЭМС без какого-либо дополнительного обогащения (сосудистого или клеточного).
Ученые выделили 2 лидера по результатам всех вышеописанных наблюдений — P1C10 и P3A8. Именно эти клоны и будут рассматриваться в дальнейшем.
P1C10 и P3A8 были функционализированы флуоресцентным красителем Cy5. Прямое иммунноокрашивание мышиных тканей с использованием конъюгатов VLR-Cy5 показало, что P1C10-Cy5 обладает значительной избирательностью в сторону ЕСМ головного мозга по сравнению с тканями почек, сердца и печени (2а).

Изображение №2а
Иммунноокрашивание* — процесс, позволяющий определить и локализовать антиген в определенном участке клетки, ткани или органа.
А вот P3A8-Cy5 связывается с ECM мозга и печени с одинаковой интенсивностью, но так же как и P1C10-Cy5 не проявляет интереса к ECM почек и сердца.
Далее ученые проверили перекрестную реактивность P1C10 и ЕСМ головного мозга человека (применялись криосрезы). Связывание P1C10-Cy5 с ЕСМ мозга человека напоминает картину того же процесса, но с участием мозга мыши (2b). Также P1C10-Cy5 успешно связался с ЕСМ в криосрезах образца глиобластомы человека (2с).
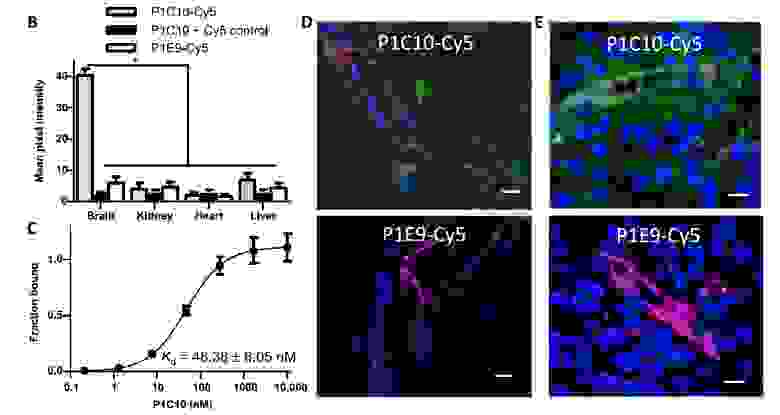
Изображение №2b-e
Учитывая эти наблюдения, ученые измерили аффинитет* P1C10.
Аффинитет* — способность клетки захватывать и связывать определенные химические вещества.
В результате константа диссоциации (Kd) для связывания с bEnd.3 ECM составила 48.38 ± 6.05 нM (2d).
Следом за этим ученые решили проверить будет ли P1C10 накапливаться в местах разрушения ГЭБ в мозгу мыши.
Модифицированный красителем ближнего инфракрасного излучения IR800 клоны P1C10 или RBC36 вводились здоровым лабораторным мышам в объеме 1 мг/кг. RBC36 представляет собой VLR, который распознает трисахарид человеческого антигена H, потому использовался в качестве контроля изотипа.
Далее мышам внутривенно вводили маннит (шестиатомный спирт) для временного раскрытия ГЭБ. После чего были сделаны снимки мозга мышей для идентификации сигналов IR800 (изображение ниже).
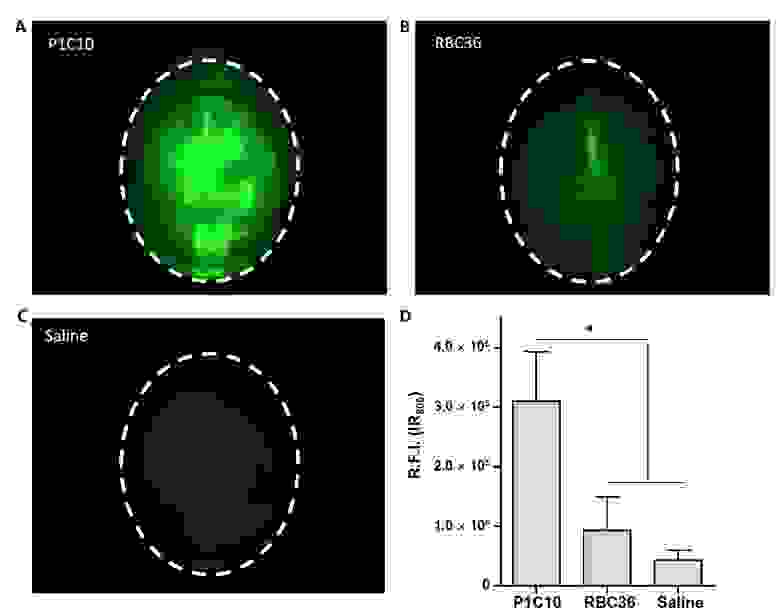
Изображение №3
Сравнительный анализ показал, что накопление флуоресценции в мозге (сосредоточение исследуемого вещества, отмеченного красителем IR800) при использовании P1C10-IR800 в 3,3 раза выше, чем при RBC36-IR800, и в 7,6 раза выше, чем при использовании физраствора. Следовательно, P1C10 избирательно накапливается в мозге после нарушения работы гемато-энцефалического барьера.
Далее ученые решили проверить будет ли VLR нацеливаться на обнаженный внеклеточный матрикс. Для этого было создано две модели с применением мышиных GL261 и клеток глиобластомы U87 человека, которые внедрялись в мозг подопытных мышей. В результате образовывались опухоли с хаотичной сосудистой сетью и точечными нарушениями гемато-энцефалического барьера.
P1C10 или RBC36 в объеме 1 мг/кг вводили внутривенно мышам с внедренной глиобластомой GB261. Спустя 30 минут были взяты образцы мозга для анализа и визуализации сигнала IR800 (краситель для P1C10 или RBC36).

Изображение №4
Средняя интенсивность флуоресценции в опухолевой области GL261 у мышей, которым вводили P1C10-IR800, была в 112 раз выше, чем в контралатеральной (противоположной) области мозга (4а). А вот при использовании RBC36-IR800 интенсивность флуоресценции опухолевой области лишь в 9 раз превышала интенсивность в противоположной области.
Помимо этого было выявлено, что накопление P1C10-IR800 в самой опухоли в 13 раз превышает накопление RBC36-IR800.
Эти наблюдения подтвердили способность P1C10 избирательно нацеливаться на ECM в опухолях мышей. Теперь необходимо было проверить этот талант на опухолях мозга человека.
VLR вводили мышам с U87 (опухоль мозга человека). Ученые проверяли не только P1C10, но и 192, который демонстрировал избирательную привязку с базолатеральной стороной сосудистой сети головного мозга в дополнение к сосудам почек и печени, а также к ECM.
P1C10, 192 или RBC36 в объеме 3 мг/кг вводили внутривенно и давали свободно циркулировать в течение 30 минут. После этого были взяты образцы интересующих органов для визуализации результатов.
Оба VLR клона (P1C10 и 192) продемонстрировали накопление в границах опухоли, при этом P1C10 распределялся по всему ECM опухоли (4b). А вот 192 по большей части концентрировался вне крупных опухолевых сосудов.
Ни один из VLR клона не накапливался в здоровом контралатеральном полушарии мозга мыши. А RBC36 и вовсе отсутствовал как в здоровой, так и в содержащей опухоль части мозга.
Количественный анализ показал, что P1C10 накапливается в U87 опухоли в 21.2 раза больше, чем в контрлатеральной области мозга, в 21.2 раза — почек, в 15.9 раз — печени и в 29.6 раза — сердца.
Накопление P1C10 и 192 в опухолевых областях было в 25.4 и 11.9 раза больше, чем накопление RBC36. При этом оба VLR клона преимущественно накапливались в областях сосудистых дефектов опухоли.
Эти наблюдения подтверждают эффективность P1C10 и его избирательную нацеленность относительно ECM мозга. Осталось увидеть, сможет ли P1C10 эффективно доставлять лекарственные вещества туда, куда нужно.
Ученые применили VLR в совокупности с липосомами, нагруженными доксорубицином, который отлично визуализируется благодаря собственной флуоресценции, что сильно упрощает процесс анализа эффективности применения VLR. Были получены липосомы со средним диаметром в 94.2 нм и содержанием доксорубицина от 1 до 2 мг/мл. Далее к липосомам были присоединены VLR клоны, которые сохранили свою связывающую активность после объединения (изображение №5).

Изображение №5
Чтобы продемонстрировать возможность проведения лечения липосомами, нагруженными доксорубицином, нацеленными на VLR, клетки U87 опухоли (культивированные на bEnd.3 ECM) были инкубированы липосомами, нагруженными доксорубицином, нацеленными на P1C10 или RBC36.
Наблюдения показали значительный рост уничтоженных клеток липосомами, нацеленными на P1C10. Полумаксимальная эффективная концентрация составила 199.0 ± 1.7 нМ у P1C10 и 3312.0 ±- 2.6 у RBC36.
Изображение №6
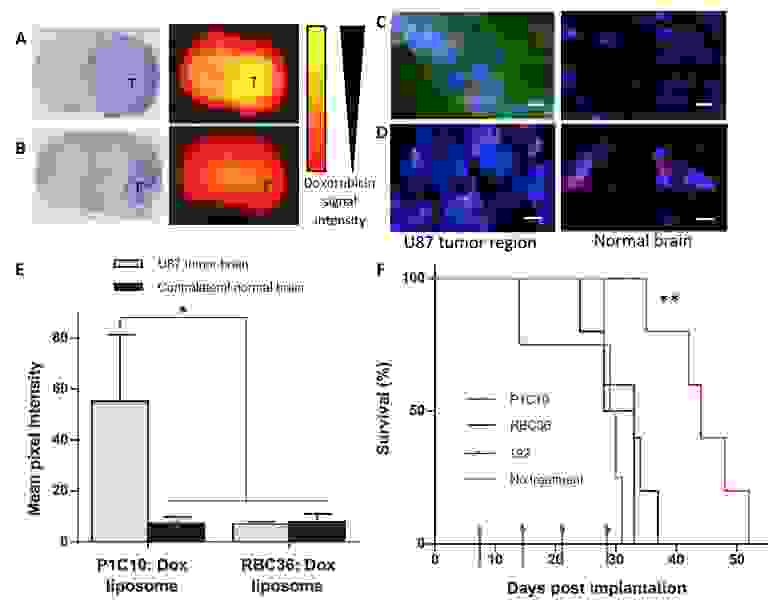
И напоследок, ученые проверили потенциальную терапевтическую полезность нацеливания на патологически поврежденный внеклеточный матрикс мозга. Для этого к подопытным мышам с раковыми клетками U87 применили липосомы, нагруженные доксорубицином, в совокупности с P1C10, 192 или RBC36.
Как видно на снимках 6а и 6b, сигнал от доксорубицина значительно сильнее при использовании P1C10. При этом видно, что этот сигнал достаточно локализован в пределах опухоли и не затрагивает контралатеральную (здоровую) область мозга.
Снимки 6с и 6d демонстрируют, что накопления P1C10 в опухолевой области в 7.6 раза выше, чем в здоровой области. Если же сравнивать степень накопления P1C10 с RBC36, то разница составляет 7.9 раза в пользу именно P1C10.
В течение 4 недель (на 7, 14, 21 и 28 день) подопытным мышам с U87 вводили 12 мг/кг доксорубицина с применением P1C10, 192 или RBC36.
После внедрения опухоли медиана выживаемости составила: 43 дня для P1C10, 30 дней для 192 и 28 дней для RBC36.
Группа подопытных с P1C10 показала значительный рост выживаемости по сравнению с двумя другими группами. При этом показатели 192 и RBC36 не сильно отличаются от показателей контрольных групп, которые не получали лечения вообще.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых.
Не было бы счастья, да несчастье помогло. Этой фразой можно вполне точно описать данное исследование. Ученые применили патологические нарушения работы гемато-энцефалического барьера в качестве инструмента для доставки лекарственных препаратов в определенные участки мозга, пораженные опухолью, избегая при этом здоровых участков. А помощь в этом сложном и благородном начинании ученые получили, как говорится, откуда не ждали. Вариабельные рецепторы лимфоцитов (VLR) миног стали основой сего труда. Теперь можно с уверенностью заявить, что даже от паразитов бывает польза.
Лечение опухолей головного мозга сопряжено с огромным перечнем сложностей, а успешность этого процесса не так велика, как того бы хотелось. Создание новых методов и средств для борьбы с такими серьезными заболеваниями — это действительно то, ради чего существует наука. Познавая мир вокруг и внутри себя, мы не идем против воли природы, мы лишь начинаем лучше ее понимать, находим новые знания и применяем их во благо.
Благодарю за внимание, оставайтесь любопытствующими и отличных всем выходных, ребята! :)
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас оформив заказ или порекомендовав знакомым, 30% скидка для пользователей Хабра на уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2650 v4 (6 Cores) 10GB DDR4 240GB SSD 1Gbps от $20 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
VPS (KVM) E5-2650 v4 (6 Cores) 10GB DDR4 240GB SSD 1Gbps до лета бесплатно при оплате на срок от полугода, заказать можно тут.
За последние десятилетия наука серьезно продвинулась вперед в лечении рака. И хотя полная победа над этим заболеванием еще довольно далека, у врачей с каждым годом становится все больше эффективных инструментов для борьбы с опухолями.
Один из них – активизация собственного иммунитета человека против раковых клеток. Именно в иммуноонкологии сегодня проводится максимальное количество исследований и разрабатывается наибольшее число противоопухолевых препаратов.
В чем плюсы и методы механизма, за открытие которого была присвоена Нобелевская премия, беседуем с заведующей дневным стационаром №3 Алтайского краевого онкологического диспансера, кандидатом медицинских наук Еленой Россохой.

Заведующая дневным стационаром №3 Алтайского краевого онкологического диспансера, кандидат медицинских наук Елена Россоха. Фото: Юлия КОРЧАГИНА
- Елена Ивановна, расскажите, как в норме действует иммунный ответ на возникновение злокачественных клеток?
- Иммунитет – это уникальная способность организма защищать себя от губительного воздействия внешних и внутренних потенциально опасных факторов, каковыми являются, в том числе, и раковые клетки.
Давайте разберемся, что такое рак? В норме все клетки организма проходят строго определенные стадии развития, выполняют заданные функции, размножаются по установленным правилам, а со временем стареют и умирают. Эта запрограммированная обязательная смерть нормальных клеток называется апоптоз. Но иногда у обычной клетки в силу ряда причин происходит сбой в программе деления – она приобретает способность делиться очень быстро и бесконечное количество раз, становится потенциально бессмертной - злокачественной.
Опухолевые клетки ежедневно появляются в организме любого человека и отличаются от здоровых наличием аномального белка - ракового антигена. Но в норме иммунитет вовремя распознает угрозу и уничтожает чужеродные элементы с помощью Т-лимфоцитов и других компонентов.
Кстати
Доказано, что если иммунитет подавлен ( ВИЧ , терапия иммуносупрессорами после пересадки органов), то риск развития онкологических заболеваний высок. И наоборот, раковые опухоли могут проходить сами собой без какого-либо специального лечения. Это явление получило название синдрома Перегрина по имени молодого священника, жившего в Италии в конце XIII века. У него была саркома (костная опухоль), требующая ампутации ноги. Хирургия тех времен не могла ему помочь, и юноше оставалось только уповать на Бога. Спустя некоторое время опухоль чудесным образом исчезла, а Святой Перегрин прожил долгую жизнь и умер в возрасте 80 лет без признаков рецидива.
- Почему же в какой-то момент иммунитет ослабляет свою защиту?
-В настоящее время механизмы взаимодействия опухолей и иммунной системы активно изучаются.

В иммуноонкологии сегодня проводится максимальное количество исследований и разрабатывается наибольшее число противоопухолевых препаратов. Фото: Юлия КОРЧАГИНА
Кстати
За открытие иммунных контрольных точек PD-1 и CTLA-4, американцу Джеймсу Эллисону и японцу Тасуко Хондзё в 2018 году была вручена Нобелевская премия. Это открытие позволило совершить прорыв в лечении некоторых ранее смертельных опухолей.
- В чем отличие иммунотерапии от других видов лекарственного противоопухолевого лечения?
- Можно сказать, что открытие принципов иммунотерапии изменило саму парадигму противоопухолевой терапии. Раньше в ее основе лежало воздействие на опухолевую клетку. Сейчас в центре внимания онкологов находится иммунная система человека, возможности ее перепрограммирования и восстановления способности самостоятельно противостоять злокачественным опухолям.
- Какие виды опухолей можно лечить с помощью иммунотерапии, и какова эффективность такого лечения?
- В первую очередь, это распространенные метастатические процессы, 3 и 4 стадии рака, когда удалить злокачественное новообразование с помощью операции невозможно. Что касается видов опухолей, то иммунотерапию можно применить практически ко всем из них. Рак легкого, мочеполовой системы у мужчин и женщин, молочной железы, различные виды лимфом, опухоли головы и шеи, меланома.
Кстати, впервые подобные препараты начали использовать именно при меланоме. Это очень агрессивные опухоли, характеризующиеся быстрым ростом и метастазированием. Еще несколько лет назад такие пациенты, даже получая специальное противоопухолевое лечение, жили максимум шесть месяцев. Сейчас благодаря иммунотерапии, медиана выживаемости для них выросла до нескольких лет.
В лечении злокачественной меланомы достигнут самый высокий прогресс. Пожалуй, самый известный онкобольной, излечившийся благодаря иммунотерапии, бывший презедент США Джимми Картер. В возрасте 90 лет он сообщил об успешно перенесенной операции по удалению опухоли печени. Однако вскоре стало известно, что это - метастаз меланомы, тогда же были выявлены и метастазы в головной мозг. Немедленно начатая иммунотерапия дала результаты - уже через год лечения сообщалось, что у экс- президента не обнаружено никаких следов онкологических образований.
Вообще, в последние годы темпы появления новых лекарств для борьбы с опухолями, ускорились в геометрической прогрессии. Сейчас любая уважающая себя фармацевтическая компания одновременно разрабатывает десятки молекул. Не факт, что из каждой из них на выходе появится новый противоопухолевый препарат, но, тем не менее, благодаря такой высокой заинтересованности производителей, в мире регулярно появляются новые эффективные лекарства.
- Если механизм иммунотерапии так эффективен, прост и органичен замыслу самой природы, почему одним пациентам назначают такие препараты, а другим, с таким же диагнозом, - нет?
- Рак настолько сложное заболевание, что вряд ли когда-нибудь будет придумано универсальное лекарство от этой болезни. Поэтому и иммунотерапия – это не панацея, а всего лишь еще одна очень хорошая лекарственная опция.
Почему мы не назначаем одинаковые препараты пациентам с одинаковыми диагнозами - а что вы считаете одинаковым диагнозом? Это раньше мы лечили рак легкого, рак груди, рак почки и так далее. Сейчас пациента с таким определением статуса болезни ни один врач не сможет лечить эффективно.

Иногда у обычной клетки в силу ряда причин происходит сбой в программе деления – она приобретает способность делиться очень быстро и бесконечное количество раз, становится потенциально бессмертной - злокачественной. Фото: Юлия КОРЧАГИНА
Ученые давно доказали, что не существует абсолютно одинаковых раков. Поэтому мы сейчас лечим не опухоли, а их особенности - наличие определенных биомаркеров. В иммунотерапии это уровень экспрессии рецептора PD-L1 на опухолевых клетках. И чем этот уровень этот выше, тем более результативным будет лечение. Вот почему персонализация - тренд современной онкологии.
Онкологи уже научились применять иммунопрепараты не только в монорежиме, но и эффективно использовать их в сочетании с химиопрепаратами, таргетными и даже другими иммунными препаратами. Причем, комбинация двух или нескольких средств, как правило, имеет синергетический эффект, они многократно усиливают действие друг друга.
Полностью излечить метастатический процесс, к сожалению, нельзя. Наша задача, чтобы пациент жил долго и в хорошем качестве. И сегодня мы научились переводить рак в длительное хроническое течение, назначая последовательную терапию при прогрессировании заболевания.
- Может ли человек сам, не дожидаясь лечения в стационаре, купить иммунологический препарат и начать его использовать самостоятельно? Ведь многие из них выпускаются в форме таблеток – ничего сложного.
- Ни в коем случае! Любой иммунологический препарат должен приниматься под контролем врача, имеющего опыт работы с подобными средствами.
Иммунологические препараты при неграмотном применении могут вызывать тяжелые побочные явления. Например, у пациента появилась высокая температура, кашель одышка. Что это – аутоиммунная или обычная пневмония? Знать это крайне важно, ведь при схожем названии тактика лечения будет принципиально различной.
Токсичная реакция на иммунологический препарат может развиться как через несколько дней, так и через несколько лет после его применения, может пройти почти сразу, а может сохраняться годами. Понимание первопричин каждого из явлений крайне важно для его успешного лечения.
Конечно, такие тяжелые побочные эффекты развиваются редко, поэтому мы успешно лечим наших пациентов в условиях дневного стационара, однако быть готовыми к ним просто необходимо. Тем более не понятно, зачем так рисковать собственным здоровьем, ведь все препараты есть в наличии в диспансере, и пациенты получают их абсолютно бесплатно. А это отнюдь немалые деньги – одно введение такого препарата может стоить 500 тысяч рублей, а общий курс составляет до 18 процедур.
- Почему так дорого?
- Разработка нового иммунологического препарата стоит порядка миллиарда долларов. Это многоуровневый процесс, в ходе которого сначала изучаются общие и специфические свойства препарата, потом его тестируют на животных, затем на добровольцах, следующим этапом изучают степень его токсичности, и так далее.
На входе может стартовать десять потенциальных лекарств, а лет эдак через двадцать к финишу придет лишь один препарат. И только семь лет после разработки формула защищается патентом, по истечении этого срока буквально на следующий день заранее скопированный препарат начинает продаваться гораздо дешевле. Вот производители и успевают отбить затраты и заработать на своем изобретении.
- Можно ли профилактически укрепить иммунитет конкретно против онкологии?
- К сожалению, это невозможно. Иммунитету все равно, против кого бороться, для него и раковая клетка и вирус гриппа – одинаково опасны. Он либо работает, либо нет. Чтобы увереннее противостоять, в том числе развитию злокачественных патологий, нужно укреплять свой иммунный ответ в целом. Рекомендации тут стандартные: здоровый образ жизни, отказ от вредных привычек, правильное питание, постоянный контроль за хроническими болезнями высокого онкориска. Кроме этого существуют и специфические меры профилактики, например, вакцинация против рака шейки матки.
Ну а если есть выраженные проблемы с иммунитетом – частые простуды, головные боли, усталость, упадок сил, сонливость, раздражительность – то лучше обратиться к врачу.
- Ваше мнение: действительно ли иммунотерапия – это прорыв в онкологии, как об этом сейчас говорят?
- Это несомненный прорыв. Появление современных иммунных препаратов коренным образом изменило подход к терапии злокачественных опухолей. У этой категории лекарств есть важная особенность: однажды получив полный ответ на иммунотерапию, мы сохраняем его на годы. У цитостатиков и таргетных препаратов такого нет, там этот эффект длится в среднем от полугода до года. То, что новые препараты дают возможность превратить ра нее считавшееся смертельным заболевание в контролируемую хроническую болезнь или полностью от нее излечиться, вселяет надежду в миллионы больных.
Да, мы пока не можем вылечить всех. Но можем выделить иммунозависимую популяцию и полечить ее. Например, для рака легкого это около 25% всех пациентов. Это уже немало!
Бывает, что опухоли уходят полностью, как в случае со Святым Перегрином, однако следует признать, что это случается крайне редко. Чаще – они значительно уменьшаются в размерах или полностью регрессируют и такое состояние при назначении иммунотерапии может длиться очень долго. Сейчас все эти эффекты изучаются более активно, и я уверена, что ученых ждет еще масса революционных открытий.
Читайте также:

