Холодный раствор щелочи с хлором
Продолжение. Cм. в № 12, 16, 17, 19, 21, 23/2008
| Ч а с т ь А |
7.1. Окислители и восстановители
А1. Вещество с наиболее выраженными окислительными свойствами – это:
А2. Соединение, в котором марганец имеет степень окисления +7, – это:
А3. Верны ли следующие суждения о меди?
а) Медь проявляет степени окисления +2, +1;
б) медь не вытесняет водород из растворов кислот.
1) Верно только суждение а;
2) верно только суждение б;
3) верны оба суждения;
4) оба суждения неверны.
А4. И окислительные, и восстановительные свойства проявляет фосфор в следующем соединении:
А5. Хлор реагирует с холодным раствором щелочи с образованием:
А6. В какой из представленных ниже реакций наиболее вероятно образование NO2?
А7. Какая из реакций приведет к образованию соли двухвалентного железа?
А8. Медные стружки можно растворить в растворе:
А9. Протекание реакции диспропорционирования сопровождается увеличением и уменьшением степени окисления одного и того же элемента. К данному типу реакций нельзя отнести реакцию:
A10. Формула частицы, способной быть и окислителем, и восстановителем, – это:
1) H2; 2) S 2– ; 3) Pb 2+ ; 4) 
.
1) глюкоза и формальдегид;
2) глюкоза и глицерин;
3) сахароза и глицерин;
4) сахароза и формальдегид.
А12. C концентрированной серной кислотой реагирует при комнатной температуре:
1) сахароза; 2) бензол;
3) хром; 4) алюминий.
А13. Формула продукта полного восстановления азотной кислоты – это:
А14. В каком случае пероксид водорода проявляет окислительные свойства?
А15. Что происходит при действии окислителя?
1) Нейтральные атомы превращаются в положительно заряженные ионы;
2) положительный заряд иона уменьшается;
3) отрицательный заряд иона увеличивается;
4) степень окисления атома уменьшается.
А16. Водород при нагревании способен окислить:
1) хлор; 2) азот; 3) ртуть; 4) натрий.
А17. Сумма коэффициентов в уравнении реакции, схема которой
H2SO4 (конц.) + Cu 
CuSO4 + SO2 + H2O,
1) 7; 2) 8; 3) 9; 4) 10.
А18. Реакция, протекающая с изменением степеней окисления, – это взаимодействие:
1) железа с раствором сульфата меди;
2) кристаллического хлорида натрия с концентрированной серной кислотой;
3) оксида кальция с оксидом углерода(IV);
4) нитрата бария с концентрированной серной кислотой.
А19. Разложение бертолетовой соли (KClO3) – окислительно-восстановительная реакция:
А20. Сильная кислота, обладающая восстановительными свойствами, – это:
1) йодоводородная; 2) хлорная;
3) хлорноватистая; 4) азотная.
7.2. Электролиз
А21. Электролиз – это:
1) окислительно-восстановительный процесс, протекающий в растворах и расплавах электролитов при пропускании электрического тока;
2) окислительно-восстановительная реакция, проходящая при смешивании растворов электролитов;
3) разложение электролитов под действием воды;
4) распад электролитов на ионы.
А22. Во время электролиза водного раствора хлорида натрия среда у катода становится:
1) щелочная; 2) сильнокислая;
3) слабокислая; 4) нейтральная.
А23. На аноде ионы:
4) ассоциируются в молекулы.
А24. При полном электролизе раствора нитрата серебра с медными электродами образуется:
А25. Соль, электролиз раствора которой приводит к окислению аниона, – это:
А26. При электролизе водного раствора нитрата калия массовая доля растворенного вещества:
3) не изменяется;
4) сначала уменьшается, а затем увеличивается.
А27. При электролизе водного раствора Na2SO4 на катоде образуется:
1) водород; 2) кислород;
3) серная кислота; 4) оксид серы(IV).
А28. Формула соли, при электролизе водного раствора которой на катоде одновременно будут восстанавливаться катионы и металла, и водорода, – это:
А29. Соль, при электролизе водного раствора которой не меняется ее масса, – это:
1) хлорид калия; 2) бромид магния;
3) нитрат железа(II); 4) нитрат лития.
А30. С помощью электролиза можно проводить очистку металлов. При электролитической очистке меди подвергают электролизу раствор сульфата меди. При этом используют анод, изготовленный из:
1) меди; 2) никеля; 3) графита; 4) платины.
| Ч а с т ь В |
В1. Установите соответствие между формулой соединения и значением степени окисления хлора в нем.
В2. Установите соответствие между символом химического элемента и значением его возможных степеней окисления
В3. Установите соответствие между схемой окислительно-восстановительной реакции и веществом-восстановителем.
В4. Установите зависимость между средой и продуктом восстановления перманганата калия.
В5. Установите соответствие между раствором соли и продуктом, выделяющимся на аноде.
| Ф о р м у л а с о л и | А н о д н ы й п р о д у к т |
| а) HCOONa; | 1) CO2; |
| б) Na2CO3; | 2) SO2; |
| в) K2S; | 3) O2; |
| г) BaI2. | 4) S; |
| 5) I2. |
B6. Какие из приведенных ниже реакций протекают в водном растворе?
В7. Оксид меди можно восстановить до меди:
1) этиловым спиртом; 2) аммиаком;
3) водородом; 4) ртутью;
5) серебром; 6) фенолом.
В8. Кислород выделяется при электролизе водных растворов:
1) хлорида кальция;
2) сульфата меди;
3) бромида железа(II);
4) ацетата натрия;
5) гидроксида стронция;
6) нитрата натрия.
В9. В результате погружения медной пластинки в раствор нитрата серебра ее масса увеличилась на 0,304 г. Чему равна масса серебра, отложившегося на пластинке? (Ответ приведите с точностью до тысячных.)
В10. Сколько килограмм алюминия можно получить при электролизе 1 центнера оксида алюминия, содержащего 10% примесей?
Ответы на тестовые задания главы 7
Задача 812.
Составить схему цепной реакции хлора с водородом. Какую роль в ней играет освещение? Имеет ли значение частота света?
Решение:
Синтез HCl из Н 2 и Cl 2 протекает на свету:
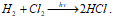
Эта реакция относится к неразветвлённым цепным реакциям. Поглощение кванта света или другой лучистой энергии (hv) молекулой Cl2 приводит к её возбуждению – к появлению в ней энергичных колебаний атомов. И, как только энергия колебаний атомов превышает энергию связи между атомами, то молекула распадается. Формирование цепи начинается с образования радикалов:
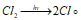
Образующиеся атомы хлора легко реагируют с молекулой водорода с образованием молекулы хлороводорода и атома водорода:
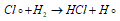
Атом водорода, в свою очередь, легко реагирует с молекулой хлора с образованием молекулы хлороводорода и атома хлора:
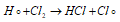
Эта последовательность процесса продолжается дальше, в рассматриваемом случае число звеньев может достигать 100000. При данной фотохимической реакции частота света играет существенную роль, поскольку количество энергии кванта света определяется произведением постоянной Планка (h) и частотой света (v), получим: (hv). От численного значения частоты света зависит величина количества энергии кванта. Для распада молекулы Cl2 на 2 необходима частота света чуть больше 550 ммк. Под действием получаемого при данной частоте кванта света разрушается связь Cl — Cl, а не Н — Н, так как Е(Cl — Cl) = 243 кДж/моль, а Е(Н — Н) = 436 кДж/моль.
Таким образом, под действием света энергии кванта света (Е = hv) достаточно только для разрыва связей Cl — Cl в молекуле Cl2, а не для разрыва связей Н — Н в молекуле Н2. Именно свет является фактором, который определяет начало цепной реакции - образование свободных атомов хлора.
Задача 813.
Написать уравнения реакций взаимодействия галогенов с водой и растворами щелочей (холодными и горячими).
Решение:
а) Уравнения реакций взаимодействия галогенов с водой:
б) Уравнения реакций взаимодействия галогенов с холодным раствором щёлочи:
Cl2 + 2OH- ↔ Cl - + OCl - + H2O.
в) Уравнения реакции взаимодействия галогена с горячим раствором щёлочи:
3Cl2 + 6OH - ↔ 5Cl - + OCl3 - + 3H2O.
Таким образом, при растворении галогенов в холодной воде и в холодных растворах щелочей происходит восстановление хлора до степени окисления его атома +1 и окисление галогена до степени окисления -1. В горячих растворах щелочей галоген самоокисляется и самовосстанавливается соответственно до степени окисления -1 и до степени окисления +5.
Задача 814.
Привести примеры возможных реакций галогенов друг с другом. Указать степени окисленности галогенов в продуктах реакций.
Решение:
Известны соединения галогенов друг с другом (галоиды), например: BrCl, ICl3, BrF5, IF7, ClF, ClF5 IBr и другие. Все соединения галоидов могут быть получены прямым синтезом, например:
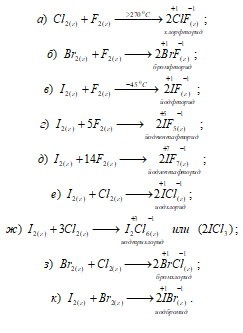
Некоторые из галоидов могут существовать в обычных условиях и не разлагаться, например ClF (газ), BrF (жидкость), IF5 (жидкость), IF7 (газ).
Задача 815.
При 300°С степень термической диссоциации НI составляет 20%. Каковы при этой температуре равновесные концентрации Н2 и I2 в системе
Н2 +12 ↔ 2НI, если равновесная концентрация НI равна 0,96 моль/л?
Решение:
Обозначим начальную концентрацию HI через х (моль/л). Если к моменту наступления равновесия из каждых х молей йодоводорода диссоциировано х молей,
то при этом, согласно уравнению реакции, образовалось 0,5х; моля Н2 и 0,5х моля I2.
Находим начальную концентрацию HI (х) с учетом того, что термическая диссоциация ее составляет 20% (0,2), составив соотношение:
0,96 = х - (0,96 . 0,2);
х = 0,96 + 0,192 = 1,152 моля.
Тогда равновесные концентрации Н2 и I2 с учётом того, что степень термической диссоциации НI составляет 20%, получим:
[H2] =[I2] = 0,5x . 0,2 = 0,5 . 1,152 . 0,2 = 0,1152 моля.
Хлор образует четыре кислородсодержащие кислоты: хлорнотистую, хлористую, хлорноватую и хлорную.
Хлорноватистая кислота НСlO образуется при взаимодействии хлора с водой, а также ее солей с сильными минеральными кислотами. Она относится к слабым кислотам, очень неустойчива. Состав продуктов реакции ее разложения зависит от условий. При сильном освещении хлорноватистой кислоты, наличии в растворе восстановителя, а также длительном стоянии она разлагается с выделением атомарного кислорода: НСlO = HСl + O
В присутствии водоотнимающих веществ образуется оксид хлора (I): 2 НСlO = 2 Н2О + Сl2O
Поэтому при взаимодействии хлора с горячим раствором щелочи образуется соли не соляной и хлорноватистой, а соляной и хлорноватой кислот: 6 NаОН + 3 Сl2 = 5 NаСl + NаСlО3 + 3 Н2О
Соли хлорноватистой кислоты - г и п о х л о р и т ы - очень сильные окислители. Они образуются при взаимодействии хлора со щелочами на холоду. Одновременно образуются соли соляной кислоты. Из таких смесей наибольшее распространение получили хлорная известь и жавелевая вода.
Хлористая кислота НСlO2 образуется при действии концентрированной серной кислоты на хлориты щелочных металлов, которые получаются как промежуточные продукты при электролизе растворов хлоридов щелочных металлов в отсутствие диафрагмы между катодным и анодным пространствами. Это слабая, неустойчивая кислота, очень сильный окислитель в кислой среде. При взаимодействии ее с соляной кислотой выделяется хлор: НСlO2 + 3 НС1 = Сl2 + 2 Н2О
Хлорноватая кислота НСlO3 образуется при действии на ее соли -х л о р а т ы - серной кислоты. Это очень неустойчивая кислота, очень сильный окислитель. Может существовать только в разбавленных растворах. При упаривании раствора НСlO3 при низкой температуре в вакууме можно получить вязкий раствор, содержащий около 40 % хлорной кислоты. При более высоком содержании кислоты раствор разлагается со взрывом. Разложение со взрывом происходит и при меньшей концентрации в присутствии восстановителей. В разбавленных растворах хлорная кислота проявляет окислительные свойства, причем реакции протекают вполне спокойно:
НСlO3 + 6 НВr = НСl + 3 Вr2 + 3 Н2О
Соли хлорноватой кислоты - хлораты - образуются при электролизе растворов хлоридов в отсутствие диафрагмы между катодным и анодным пространствами, а также при растворении хлора в горячем растворе щелочей, как показано выше. Образующийся при электролизе хлорат калия (бертолетова соль) слабо растворяется в воде и в виде белого осадка легко отделяется от других солей. Как и кислота, хлораты - довольно сильные окислители:
КСlO3 + 6 НСl = КСl + 3 Сl2 + 3 Н2О
Хлораты применяются для производства взрывчатых веществ, а также получения кислорода в лабораторных условиях и солей хлорной -кислоты - п е р х л о р а т о в. При нагревании бертолетовой соли в присутствии диоксида марганца МпО2, играющего роль катализатора, выделяется кислород. Если же нагревать хлорат калия без катализатора, то он разлагается с образованием калиевых солей хлороводородной и хлорной кислот:
2 КСlО3 = 2 КСl + 3 O2
4 КСlO3 = КСl + 3 КСlO4
При обработке перхлоратов концентрированной серной кислотой можно получить хлорную кислоту:
КСlO4 + Н2SO4 = КНSO4 + НСlO4
Это самая сильная кислота. Она наиболее устойчива из всех кислород содержащих кислот хлора, однако безводная кислота при нагревании, встряхивании или контакте с восстановителями может разлагаться со взрывом. Разбавленные растворы хлорной кислоты вполне устойчивы и безопасны в работе. Хлораты калия, рубидия, цезия, аммония и большинства органических оснований плохо растворяются в воде.
В промышленности перхлорат калия получают электролитическим окислением бертолетовой соли:
2 Н+ + 2 е- = Н2 (на катоде)
СlО3- - 2 е- + Н2О = СlO4- + 2 Н+ (на аноде)
Биологическая роль.
он относится к жизненно необходимым незаменимым элементам. В организме человека 100 г.
Ионы хлора играют весьма важную биологическую роль. Входя вместе с ионами К+, Mg2+, Са2+, НСО
, Н3Р04 и белками играют главенствующую роль в создании определенного уровня осмотического давления (осмотический гомеостаз) плазмы крови, лимфы, спиномозговой жидкости и т. д.
Хлор-ион участвует в регуляции водно-солевого обмена и объема жидкости, удерживаемой тканями, подержании рН внутриклеточной жидкости и мембранного потенциала, создаваемого работой натрий-калиевого насоса, что объясняется (как и в случае его участия в осмосе) способностью диффундировать через клеточные мембраны подобно тому, как это делают ионы Na+, К+. Ион хлора - необходимый компонент (совместно с ионами Н2Р04, HSO4, ферментами и др.) желудочного сока, входящий в состав соляной кислоты.
Способствуя пищеварению, соляная кислота уничтожает и разнообразные болезнетворные бактерии.
Степени окисления. Все галогены в галогенидных соединениях имеют степень окисления - 1. Такое состояние окисления для фтора в соединениях вообще является единственно возможным. Другие галогены могут существовать еще в состояниях с положительными степенями окисления. Эти состояния возникают в результате промотирования электронов с -орбиталей атомов галогенов на их вакантные (незанятые электронами) d-орбитали (рис. 16.2). В атомах галогенов d-орбитали имеют сравнительно низкую энергию и поэтому оказываются легко доступными для заселения промотированными электронами.
У хлора и брома возможны устойчивые состояния со следующими степенями окисления: Иод обнаруживает степени окисления .
Рис. 16.2. Промотирование -электронов хлора в состояниях с высокими степенями окисления.
В табл. 16.12 приведены систематические и традиционные названия кислородсодержащих кислот хлора и их солей. Чем выше степень окисления хлора в этих кислотах, тем выше их термическая устойчивость и сила кислоты:
Сильные кислоты, причем одна из самых сильных среди всех известных кислот. Остальные две кислоты лишь частично диссоциируют в воде и
Таблица 16.12. Кислородсодержащие кислоты хлора и их анионы
существуют в водном растворе преимущественно в молекулярной форме. Среди кислородсодержащих кислот хлора только удается выделить в свободном виде. Остальные кислоты существуют только в растворе.
Окислительная способность кислородсодержащих кислот хлора уменьшается с возрастанием его степени окисления:
Особенно хорошие окислители. Например, кислый раствор :
1) окисляет ионы железа (II) до ионов железа (III):
2) на солнечном свету разлагается с образованием кислорода:
3) при нагревании приблизительно до 75 °С он диспропорционирует на хлорид-ионы и хлорат -ионы:
Эти соли обычно более устойчивы, чем сами кислоты. Исключением являются твердые соли хлораты (III), которые детонируют при нагревании и при соприкосновении с горючими материалами. В растворах окислительная способность кислородсодержащих солей хлора тем больше, чем больше в этих солях степень окисления хлора. Однако они не являются столь хорошими окислителями, как соответствующие кислоты.
Натриевые и калиевые соли имеют важное промышленное значение. Их производство и применения описаны в следующем разделе. Хлорат (V) калия обычно используют для лабораторного получения кислорода, в присутствии оксида в качестве катализатора:
При нагревании этой соли до более низкой температуры в отсутствие катализатора происходит образование калия:
Иодат (V) калия калия сильные окислители, и в качестве окислителей они используются в количественном анализе.
Итак, повторим еще раз
1. Свойства галогенидов различных элементов при перемещении слева направо в пределах одного периода изменяются следующим образом:
а) характер химической связи становится все более ковалентным и все менее ионным;
б) водные растворы галогенидов становятся все более кислыми из-за гидролиза.
2. Свойства различных галогенидов одного и того же элемента при перемещении к нижней части VII группы изменяются следующим образом:
а) характер химической связи галогенидов становится все более ковалентным:
б) прочность связи в молекулах галогеноводородов уменьшается;
в) кислотность галогеноводородных кислот уменьшается;
г) легкость окисления галогеноводородов возрастает.
3. По мере возрастания степени окисления галогена происходят следующие изменения:
а) термическая устойчивость его кислородсодержащих кислот возрастает;
б) кислотность его кислородсодержащих кислот возрастает;
в) окислительная способность его кислородсодержащих кислот уменьшается;
г) окислительная способность солей его кислородсодержащих кислот возрастает.
4. Галогениды можно получать прямым синтезом из образующих их элементов.
5. Для получении галогеноводородов может использоваться реакция вытеснения из галогенидной соли менее летучей кислотой.
6. Аномальные свойства соединений фтора:
а) фторид серебра растворим в воде, а фторид кальция нерастворим;
б) фтороводород имеет аномально высокие температуры плавления и кипения;
в) водный раствор фтороводорода имеет низкую кислотность;
г) фтор обнаруживает только одно устойчивое состояние окисления. Другие галогены обнаруживают множество состояний окисления, что объясняется промотированием их -электронов на легко доступные -орбитали, обладающие низков энергией.
Хлорная кислота (формула HClO4) - это одноосновная безводная кислота. Содержит в себе хлор (Cl) в высшей степени окисления, по этой причине является сильнейшим окислителем. Взрывоопасна.
Свойства хлорной кислоты
1. Это летучая жидкость без цвета, в воздухе сильно дымит, мономерна в парах. Неустойчива и очень реакционна. Для этой кислоты характерна автодегидратация:
3HClO4 = H3O+ (катион) + ClO- (анион) + Cl2O7 (оксид хлора)
2. Данное вещество хорошо растворимо в хлор- и фторорганических растворителях, таких как CH2Cl2 (хлористый метилен), CHCl3 (хлороформ) и другие. Смешивается и с другими растворителями, проявляет восстановительные свойства, при неосторожном обращении может привести к взрыву или воспламенению.
3. Хорошо смешивается с водой (H2O) в любых соотношениях. Образует несколько гидратов. Концентрированные растворы данной кислоты обладают немного маслянистой консистенцией. Растворы водные данной кислоты обладают хорошей устойчивостью и низкой окислительной способностью. С водой рассматриваемое нами вещество образует азеотропную смесь, которая при температуре 203 градуса кипит и содержит 72 процента HClO4.
4. Хлорная кислота (формула HClO4) является одной из Из-за этого в ее среде некоторые кислотные соединения ведут себя подобно основаниям.
5. В условиях пониженного давления при слабом нагревании смеси кислоты хлорной с фосфорным ангидридом образуется маслянистая бесцветная жидкость - ангидрид хлорный:
2HClO4 (кислота хлорная) + P4O10 (ангидрид фосфорный) = Cl2O7 (ангидрид хлорный) + H2P4O11
Способы получения
1. Водные растворы данного вещества можно получить двумя способами. Первый заключается в электрохимическом окислении хлора или соляной кислоты в концентрированной соляной кислоте, а второй - в обменном разложении перхлоратов натрия или калия неорганическими сильными кислотами.
2. Хлорную безводную кислоту можно получить тоже двумя способами. Первый заключается во взаимодействии перхлоратов калия (K) или натрия (Na) с серной кислотой в концентрированной виде, а второй - во взаимодействии олеума с водным раствором хлорной кислоты:
KClO4 (водный раствор хлорной кислоты) + H2SO4 = KHSO4 (калия гидросульфат) + HClO4 (хлорная кислота)
Применение хлорной кислоты
Концентрированные растворы широко используют для получения перхлоратов (соли данной кислоты) и в аналитической химии;
Хлорная кислота используется при разложении руд, в качестве катализатора и при анализе минералов;
Перхлорат калия (формула: KClO4), соль данной кислоты, применяется при создании а магния перхлорат (ангидрон, Mg(ClO4)2) используется в качестве осушителя.
Безопасность при работе
Хлорную безводную кислоту нельзя долго хранить и перевозить, так как при стандартных условиях она быстро разлагается и может впоследствии самопроизвольно взорваться.
1. (формула: HCl) - одноосновная едкая, дымящая на воздухе жидкость. Применяют в гальванопластике (декапирование, травление) и в гидрометаллургии, для очистки металлов при лужении и паянии, для получения хлоридов марганца, цинка, железа и других металлов. В пищевой промышленности данное вещество зарегистрировано в качестве пищевой добавки Е507.
2. Хлорноватистая кислота (формула: HClO) - одноосновная очень слабая кислота. Может существовать только в растворах. Используется для санитарных целей, а также для отбеливания тканей и целлюлозы.
3. Хлористая кислота (HClO2) - кислота одноосновная средней силы. Неустойчива в свободном виде, в разбавленном водном растворе обычно быстро разлагается. Ангидрид этой кислоты до сих пор неизвестен.
4. Хлорноватая кислота (HClO3) - одноосновная сильная кислота. Не получена в свободном виде, так как распадается в В водных растворах существует при концентрации ниже 30 процентов. Довольно устойчива при низких температурах.
Производство хлора

Это процесс получения электролизом из растворов хлорида натрия в результате которого образуется газообразный хлор и щелочь.
Второй способ получения хлора и щелочи осуществляют в ваннах с ртутным катодом.
В лабораторных условиях хлор получают действием на оксид марганца соляной кислотой:
MnO2 + 4НСl → МnСl2 + Сl2 + 2 Н2O
Хлор и щелочь применяются в целом ряде областей промышленности. Особенно быстро растет потребность в хлоре в связи с бурным развитием хлорорганического синтеза. В технологии неорганических хлоропродуктов широкое распространение получило производство синтетического хлористого водорода сжиганием водорода в хлоре, производство четырех хлористого кремния, хлоридов цинка и алюминия, хлорной извести, гипохлорита и ряда других соединений. В металлургии некоторых цветных металлов (никель, кобальт и др.) хлор применяется в качестве сильного окислителя.
Большое развитие в технологии органических хлоропродуктов получило производство дихлорэтана, трихлорэтилена и гексахлор-этана, хлороформа, хлорвинила, перхлорвиниловой смолы, ядохимикатов и многих других ценных продуктов.
Области применения едкой щелочи также весьма разнообразны. Ее используют в мыловарении, производстве искусственного шелка и целлюлозы, в нефтяной промышленности, химии и металлургии.
Существует два принципиально различных способа получения хлора и щелочи электролизом растворов хлорида натрия, или, реже, калия. Первый из них, так называемый способ с твердым катодом, предложенный Н., Г. Глуховым и Ф. Ващуком в 1879 г., заключается в электролизе с железным катодом и анодом, стойким в отношении хлора. В этом случае на катоде выделяется водород и образуется щелочь, а на аноде выделяется в основном хлор.
Второй способ получения хлора и щелочи осуществляют в ваннах с ртутным катодом. Этот способ был изобретен А. П. Лидовым и В. А. Тихомировым в 1882—1883 гг. и получил промышленное применение благодаря работам Кастнера и Кельнера (1892 г.) почти одновременно с диафрагменным способом.
В СНГ существуют заводы, вырабатывающие хлор и щелочь как по первому, так и по второму способам. Способ с ртутным катодом будет развиваться лишь в той мере, в какой необходимо получение щелочи высокой чистоты, не могущей быть полученной в способе с твердым катодом.
При получении хлора и щелочи электролизом хлорида натрия с ртутным катодом на жидком ртутном катоде выделяется натрий, образуя амальгаму, а анодный процесс идет так же, как и в способе с твердым катодом. Таким образом, в ванне с жидким ртутным катодом образуются амальгама натрия и хлор. Переработка амальгамы натрия возможна несколькими путями.
В настоящее время амальгаму разлагают водой и получают щелочь и ртуть. Можно осуществить возгонку ртути и получать металлический натрий. Имеются также предложения использовать амальгаму как восстановитель при синтезе органических соединений. Возможность получения хлора без эквивалентного количества щелочи является важной особенностью способа с ртутным катодом, так как рост потребления хлора превышает рост потребления щелочи. Поэтому может наступить такой момент, когда необходимо будет получать хлор без щелочи.
Сырьем для производства хлора и щелочи электролитическим методом как с твердым, так и с ртутным жидким катодом является поваренная соль. Чистая поваренная соль содержит 39,4% натрия и 60,6%) хлора. В природной поваренной соли содержатся примеси — хлориды кальция и магния, сульфаты этих же элементов и другие.
Поваренная соль встречается в природе в виде залежей (каменная соль), самосадочной соли и рапы соляных озер, в виде естественных—подземных рассолов и в морской воде. Мощные запасы каменной соли известны во многих странах. В СНГ имеют промышленное значение месторождения Славянское, Артемовское, Илецкое, Соликамское и др. Соль, добываемая таким способом, содержит в большинстве случаев небольшой процент примесей. Например, каменная соль Артемовского месторождения содержит: 97,7—99,6% NaCl; 0,08% MgCl2; 0,3—1,4% CaSO4; до 1 % Н 2O. В тех случаях, когда электролизные заводы находятся вблизи месторождений каменной соли, для удешевления процесса ее добычи применяют подземное приготовление рассола.
При этом в буровую скважину, доходящую до пласта соли, накачивается вода и на поверхность извлекают рассол, близкий к насыщению. Метод этот, однако, не является совершенным, так как позволяет извлекать только несколько процентов от содержащейся в пласте соли (
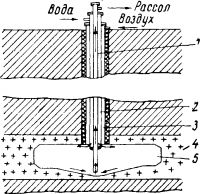
6%) и срок действия скважины не превышает 5—8 лет. В последнее время разработан более совершенный способ подземного выщелачивания, так называемый метод .гидровруба, схематически представленный на рис. 2. При растворении соли создается камера диаметром около 100 м. Способ гидровруба позволяет извлекать до 30% запасов соли и скважина может работать от 40 до 60 лет.
Самосадочная соль образуется за счет естественного испарения воды из насыщенных солью рассолов соляных озер. Эту соль добывают открытыми разработками. Таким путем в СНГ добывается поваренная соль в озерах Эльтон, Баскунчак и др. В самосадочной соли озера Баскунчак в среднем 97,2% NaCl; 0,5% MgCl2; 0,4% CaSO4; до 1,4% Н 2O и 0,1—0,6% нерастворимых веществ.
Рис. 2. Рассольная скважина для подземного растворения соли по методу гидровруба:
1 — труба для вывода рассола; 2 —труба для ввода воды; 3 — труба для ввода воздуха; 4 — пласт каменной соли; 5 — камера выщелачивания.
Во многих районах СНГ имеются подземные рассолы, богатые поваренной солью. Извлеченные из недр земли, они иногда могут непосредственно применяться в качестве промышленных рассолов.
Рассолы из буровых скважин Славянского и Березниковского месторождений имеют концентрацию: 300—303 г/л NaCl; около
2 ,0 г/л Са 2+ ; 0,14—1,4 г/л Mg 2+ ; 3,9—4,4 г/л SO 2- 4.
Добыча соли из морской воды представляет значительный интерес для стран с сухим, жарким климатом, при наличии морских (океанских) границ и удобной, отлогой конфигурации берега. Благоприятные в этом отношении условия имеются в ряде стран Европы, Америки и в КНР. Океанская вода содержит до 35 г/л поваренной соли, а также значительные количества солей магния и других элементов. Поваренная соль, полученная из морской воды, содержит несколько больше примесей, чем каменная соль. Так, например, соль из промыслов возле г. Тяньцзиня содержит, 87%
NaCl; 1,0% Mg 2+ ; 0,5% Са 2+ ; 1,0% SO 2- 4; 8 ,0% Н2O и нерастворимый остаток около 2,5%.
Приготовление электролита для способов с твердым или жидким катодом различно.
В способе с твердым катодом электролизные ванны питаются электролитом, который содержит примерно половину так называемой свежей соли, и половину оборотной соли. Приготовление электролита (рассола) заключается в растворении твердой соли (если сырьем является твердая соль) и очистке рассола, поскольку свежий рассол содержит примесей значительно больше, чем это допустимо. Рассол, поступающий из скважин при извлечении подземных рассолов или при подземном растворении твердой соли, также содержит значительное количество примесей и не может непосредственно направляться на электролиз.
Хлорид натрия хорошо растворяется в воде, причем с изменением температуры его растворимость меняется незначительно.
Небольшое изменение растворимости с температурой для практики очень существенно, так как позволяет работать с растворами, близкими к насыщению (
310 г /л), не опасаясь кристаллизации NaCl в трубопроводах, находящихся при более низких температурах, чем рабочая температура при электролизе.
Перед подачей в электролизеры рассол очищают от Mg 2+ , Са 2+ , а некоторых случаях и от ионов SO 2- 4 , оказывающих вредное влияние на ход электролиза. Допустимое содержание 0,005 г /л Са 2+ , 0,001 г /л Mg 2+ , остаточная щелочность после осаждения примесей не должна превышать 0,3 г /л (в расчете на NaOH).
Выделение Са 2+ из раствора производится в форме малорастворимого СаСO3 путем добавления раствора кальцинированной соды.
Осаждение Mg 2+ ведут раствором NaOH. При этом образуется малорастворимая гидроокись магния Mg(OH)2.
Разработан также способ, по которому осаждение гидроокиси магния ведут известковым молоком. При этом образуется гидроокись магния и в раствор переходят ионы кальция:
После осаждения ионов магния производят осаждение ионов кальция содой.
Образующиеся гидроокись магния и карбонат кальция отфильтровывают и затем раствор подкисляют соляной кислотой для нейтрализации избыточной щелочности.
Очистку от ионов SO 4 раньше вели осаждением в виде сульфата бария, добавляя к рассолу хлорид бария. Однако эта операция является слишком дорогой. От нее в последнее время отказались и ионы SO 2- 4 выводят при выпарке щелоков из оборотной соли.
Нерастворимые загрязнения отделяют отстаиванием и фильтрованием на фильтрпрессах. Очистка и отстаивание растворов производится обычно в деревянных или бетонных баках. Размер баков определяется масштабом производства и находится в пределах 100—400 м 3 .
При электролизе с ртутным катодом из ванны вытекает электролит с содержанием 260—270 г/л NaCl. Такой электролит поступает на донасыщение твердой солью. Однако перед этим раствор подкисляют до 0,1 г/л НСl и при разрежении (400—500 мм рт. ст.) из него удаляют растворенный хлор. После вакуумного дехлорирования содержание растворенного хлора в рассоле не выше 0,15 г/л. Затем рассол насосом подают в башню для отдувки хлора, где через слой рассола продувают сжатый воздух, уносящий растворенный в рассоле хлор. После продувки ртуть и другие металлы, содержащиеся в растворе, осаждают сульфидом натрия и щелочью. Для полного осаждения металлов требуется 3—5 ч. Шлам отфильтровывают, а осветленный раствор направляют на донасыщение в баки, куда подают твердый NaCl.
Если содержание примесей Са 2+ , Mg + и SO 2- 4 в до насыщенном растворе оказывается больше допустимых пределов, то электролит подвергают очистке от этих примесей как указано выше (очистку ot SO 2- 4 ведут хлоридом бария).
Статья на тему Производство хлора и щелочи
Читайте также:

