Гипертермия при меланоме кожи
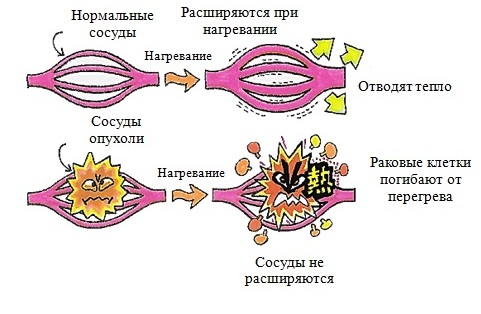
Что касается локальной гипертермии, то ее нельзя рассматривать как самостоятельный метод лечения опухолей кожи. Она используется в комплексе с химиотерапией или лучевой терапией, позволяя не только повысить эффективность, но и уменьшить частоту побочных эффектов этих методов. Метод гипертермии в СВЧ-, УВЧ- и ВЧ-диапазонах основан на том. что микрососудистая система опухолей в большей степени подвержена деструктивному воздействию гипертермии, чем микрососудистая система нормальной ткани.
Гипертермия подавляет синтез ДНК, РНК и белка в клетках, повреждает ферментативные системы, что приводит к нарушению клеточного деления; повышает иммунореактивность организма. Терапевтический эффект гипертермии проявляется при температуре 42-44°С Сеансы терапии целесообразно проводить с интервалом 48-72 ч, так как клетки, подвергнутые нелетальному деструктивному воздействию гипертермии, приобретают термотолерантность, сохраняющуюся в течение 48-72 ч.
Гипертермию с успехом использовали в комплексном лечении метастатической меланомы, болезни Боуэна, метастазов плоскоклеточного рака внутренних органов в кожу. Курс лечения продолжался до 3-4 мес. Клинический эффект (например, прилечении гипертермией болезни Боуэна) наступал через 2-4 нед., очаги, оставшиеся после курса гипертермии, были удалены хирургическим путем в пределах окружающих здоровых тканей; рецидив отмечался в 1 из 6 случаев. При гистологическом исследовании в регрессирующем очаге болезни Боуэна оказались более выраженными инфильтрация Т-лимфоцитами, васкуляри-зация, экспрессия рецепторов к Fas-антигену и фактору некроза опухоли.
В некоторых случаях при новообразованиях кожи возможно применение общей химиотерапии. Для введения химиопрепаратов в организм используют пероральный, внутривенный, внутримышечный, внутриартериальный регионарный, эндолимфатический пути. Цитостатические средства, используемые в дермато-онкологической практике, представлены несколькими группами.
Первая группа химиопрепаратов — апеллирующие вещества. Они обладают цитостатической активностью, так как способны образовывать ковалентные связи с нуклеофильными соединениями, в том числе со структурными элементами ДНК, что приводит к блокаде митоза и нарушению жизнедеятельности клетки. В эту группу включают производные бисфхлорэтиламина, этиленамины и этилендиамины, алкилсульфонаты, производные нитрозомочевины и триазена. Обычно они используются при лечении множественной базалиомы и метатипического рака (проспидин), лимфомы кожи (проспидин, фотрин, хлорамбуцил, циклофосфамид, эмбихин, сарколизин, дакарбазин, дегранол, допан), саркомы Капоши (проспидин, циклофосфамид, фотрин), меланомы (дакарбазин).
Вторая группа химиопрепаратов — антиметаболиты — соединения, нарушающие синтез нуклеиновых кислот и представленные аналогами фолиевой кислоты (метотрексат, используемый, например, при лечении кератоакантомы), пуринов (фопурин, используемый для лечения лимфомы кожи и саркомы Капоши) и пиримидинов (фторофур, применяющийся для лечения лимфомы кожи).
В состав третьей группы химиопрепаратов входят алкалоиды (винбластин и винкристин, применяемые при лимфоме кожи), антибиотики: блеомицин (применяемый при лимфоме кожи, плоскоклеточном раке кожи, болезни Боуэна, бородавках); брунеомицин и доксорубицин (при лимфомах кожи); дактиномицин (при саркоме Капоши и меланоме).
Четвертая группа химиопрепаратов — синтетические вещества разного химического строения: производные мочевины (гидроксикарбамид, применяющийся при меланоме и болезни Ходжкина), а также рад других соединений.
Все перечисленные группы цитостатических средств обладают способностью оказывать действие не только на клеточные популяции, характеризующиеся злокачественным ростом, но и на другие тканевые системы, обладающие быстрой пролиферацией (иммунную систему, клетки слизистой оболочки желудочно-кишечного тракта, кожу и ее придатки). Многие из них высокотоксичны. Среди осложнений химиотерапии наиболее часто описываются: тошнота, рвота, диарея, анорексия, стоматит, алопеция, геморрагический синдром, анемия, тромбоцитопения, лейкопения, гепатит, нефрит, дерматит. Профилактика и лечение осложнений проводятся так же, как при лучевой терапии.
Химиотерапия противопоказана при выраженном истощении больного, диссеминации опухолевого процесса, особенно с метастазами в головной мозг, печень, почки; исходном угнетении гемопоэза (менее 3,0 х 10 9 \л лейкоцитов и 100 х 10 9 \л тромбоцитов), патологии сердечнососудистой системы, активном туберкулезе.
Терапевтическая гипертермия является типом лечения, при котором живые ткани подвергаются воздействию повышенной температуры. И это оказывает губительный эффект на раковые клетки, вызывающий их уничтожение, или снижает устойчивость этих клеток к воздействию радиоактивного лечения или препаратов химиотерапии. Стоит отметить, что температурное воздействие на атипичные ткани не относится к группе радиочастотной абляции, это совершенно иная методика. В сочетании с лучевой терапией метод теплового воздействия носит называние терморадиотерапия.
- Что такое гипертермия
- Локальная, регионарная и общая гипертермия
- Для каких видов рака применяется
- Абляция опухолей
- Осложнения и побочные эффекты
Гипертермия в онкологии: что это такое?
Международная онкология не выработала до сих пор общего мнения относительно того, какие показатели температуры являются самыми безопасными и одновременно самыми эффективными. Во время лечения температура тела, как правило, достигает уровня между 39,5 и 40,5 ° C. Тем не менее, другие исследователи определяют границы гипертермии между 41.8-42 ° C, что присуще для стран Европы и США. Япония и Россия принимают самые высокие показатели — 43-44 ° С.
Температура и время воздействия взаимосвязаны. Более длительная продолжительность и высокие температуры очень эффективны для уничтожения раковых клеток, но они также достаточно серьезно повышают риск токсичности. Опухолевые клетки с дезорганизованной и компактной сосудистой структурой очень тяжело отводят тепло, что способствует стимуляции апоптоза (вид физиологически запрограммированной гибели клеток) в их отношении или обычной гибели. Тогда как здоровые ткани обладают лучшей теплопроводностью, в связи с чем лучше противостоят высоким температурам.
Даже если раковые клетки не гибнут сразу, они могут стать более восприимчивы к ионизирующему излучению в противораковой терапии или химиотерапии. Тепло при локальной гипертермии расширяет кровеносные сосуды опухоли, способствуя повышению оксигенации (насыщению кислородом) новообразования, тем самым делая лучевую противораковую терапию более эффективной. Кислород является мощным радиосенсибилизатором, что значительно повышает эффективность заданной дозы излучения путем формирования ДНК-повреждений. Опухолевые клетки при недостатке кислорода могут быть в 2-3 раза более устойчивы к радиационному повреждению, чем в нормальной кислородной среде.
Гипертермия, как было доказано, весьма эффективна в сочетании с химиотерапией. Опубликованные исследования показали улучшение 10-летней выживаемости без рецидивов и метастазов у пациентов, страдавших раком мочевого пузыря, которые получали комбинированное лечение гипертермией и химиотерапией. 53 % пациентов прожили 10 последующих лет, в то время как химиотерапия в единственном варианте обеспечила выживаемость только у 15 % заболевших.
Интенсивный нагрев вызывает денатурацию и коагуляцию клеточных белков, что быстро уничтожает клетки опухоли. Более длительный умеренный нагрев до температуры всего в несколько градусов выше нормы может вызвать более тонкие структурные изменения в клетках. Мягкая термообработка в сочетании с другими способами может привести к гибели клеток по причине стимуляции биологического разрушения.
Из минусов специалисты отмечают многие биохимические последствия теплового шока в нормальных клетках, в том числе замедление роста и повышенной чувствительности к последующей ионизирующей радиоактивной терапии.
Гипертермия увеличивает приток крови к нагретой области, что может провоцировать удвоение кровотока в опухолях. Такой феномен повышает положительное воздействие химиотерапевтических средств в патологических областях.
Мягкая гипертермия, которая обеспечивает температуру, равную естественно высокой при многих инфекционных заболеваниях, может стимулировать естественные иммунологические атаки на опухоли. Однако это также индуцирует естественный физиологический ответ под названием термотолерантность, который имеет тенденцию защищать атипичные клетки.
Очень высокие температуры, выше 50 ° C, используются для абляции — прямого уничтожения некоторых опухолей. Методика использует вставки в виде металлической трубки непосредственно в опухоль, наконечник которой нагревается, это и вызывает гибель клеток по его периметру.
Стоит подчеркнуть, что методика гипертермической абляции в России пока что в стадии изучения, и в практической медицине применяется редко. Однако эффективность испытаний прогнозирует весьма неплохие перспективы этого метода, в том числе и в нашей стране.
Отличия и особенности методов локальной, регионарной и общей гипертермии
Методы терапевтической гипертермии применяются, как правило, в трех вариантах, в зависимости от показаний и лечебных возможностей.
- Локальная гипертермия
Нагревается очень маленькая площадь, как правило, в рамках самой опухоли. В некоторых случаях цель метода заключается в гибели атипичных клеток путем нагревания, не повреждая окружающие ткани. Тепло может быть стимулировано с помощью:
- ультракоротких волн;
- высоких радиочастот;
- ультразвуковой энергии;
- с использованием магнитной гипертермии.
В зависимости от локализации опухоли, тепло может быть применено к поверхности тела, внутри тканей или глубжележащих областей за счет использования игл или зондов. Одним из относительно распространенных типов является радиочастотная абляция небольших опухолей. Терапевтической цели легче всего достичь, когда опухоль находится на поверхности тела (поверхностная гипертермия), или если существует возможность ввода игл или зондов непосредственно в опухоль (интерстициальная гипертермия).
- Регионарная гипертермия
Нагревается большая площадь тела, например, целый орган или конечность. Как правило, цель метода состоит в ослаблении раковых клеток таким образом, чтобы достичь их гибели последующим радиоактивным излучением или действием химиотерапевтических препаратов. Как и в предыдущем методе, регионарная гипертермия может использовать те же поверхностные или интерстициальные методы или опираться на перфузию крови. Во время процесса перфузии кровь пациента удаляется из организма, нагревается и возвращается в кровеносные сосуды, которые ведут непосредственно в нужную часть тела. Как правило, химиотерапевтические препараты применяются одновременно.
Одним из специализированных типов такого подхода является непрерывная перитонеальная перфузия, которая используется для лечения сложных новообразований внутри брюшной полости, в том числе первичной мезотелиомы брюшной полости и рака желудка. Горячие химиотерапевтические препараты закачивают непосредственно в брюшную полость, чтобы убить раковые клетки.
- Общая гипертермия
Нагревается весь организм до температуры от 39 до 43 °С и выше. Метод, как правило, используется для лечения метастатического рака. Включает в себя использование инфракрасных гипертермических куполов, под которые помещается все тело пациента, за исключением головы. К другим способам можно отнести помещение пациента в очень горячую камеру или укутывание в нагретые влажные одеяла. Из редких методов используют специальные гидрокостюмы с постоянным подогревом или погружение в горячий воск.
Для каких видов рака может применяться гипертермия?
В одиночку гипертермия продемонстрировала уникальную способность терапии злокачественных новообразований. Также известно, что методика значительно увеличивает эффективность других методов лечения.
В сочетании с радиоактивным излучением гипертермия особенно эффективна в присутствии большого количества кислорода при условии одновременного воздействия не менее, чем в течение часа.
В последние десять лет гипертермия в сочетании с облучением была использована с лечебной целью у больных со следующими диагнозами:
- ранняя стадия рака молочной железы;
- при локализации рака на голове и шее;
- рак простаты.
Известные научные издания свидетельствуют об улучшении у 38 % пациентов при раке мочевого пузыря в сочетании с химиотерапией, по сравнению с применением только химиотерапии. У больных раком молочной железы результат показал улучшенную реакцию у 18 % пациентов.
Какие существуют еще типы рака, которые показывают значительное улучшение при лечении гипертермией?
- Меланома и рак кожи.
- Саркома мягких тканей.
- Рак мочевого пузыря.
- Рак шейки матки.
- Рак прямой кишки.
- Злокачественные опухоли подмышечной области и грудной стенки.
- Метастазы в лимфоузлах.
Исследования в России показали интересные результаты с высокой гипертермией в 43,5-44°C, когда метод применяли в отношении:
- рака пищевода;
- рака гортани;
- рака печени;
- при ВИЧ-инфекции и расстройствах иммунной системы.
Абляция опухолей — одна из разновидностей гипертермии
Радиочастотная абляция (РЧА), вероятно, наиболее часто используемая разновидность локальной гипертермии. Для повышения температуры применяются радиоволны высокой частоты.

- Тонкий игольчатый зонд вводится в опухоль на короткое время, как правило, от 10 до 30 минут.
- Размещение зонда регулируется с помощью ультразвука, МРТ или КТ.
- Наконечник зонда выдает высокочастотный ток, который способен создать тепло между 40 и 60°С, что вызывает гибель клеток в пределах определенной области.
- Мертвые клетки не удаляются, становятся рубцовой тканью и рассасываются с течением времени.
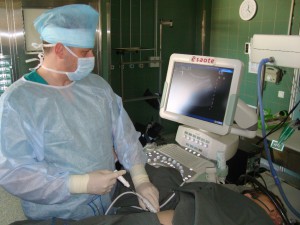
РЧА наиболее часто используется для лечения опухолей, которые не могут быть удалены хирургическим способом, или у пациентов, которые по разным причинам не операбельны. Процедура может быть выполнена амбулаторно. Повторения абляции возможно для опухолей, способных к рецидивам. Также РЧА может быть добавлена к другим лечебным мероприятиям, в том числе оперативному удалению новообразования, лучевой терапии, химиотерапии, инфузионной терапии, алкогольной абляции или химиоэмболизации.
РЧА может быть использована для лечения опухолей, достигших в диаметре вплоть до 5 см. Методика наиболее эффективна для лечения образований в печени, почках и легких. В настоящее время изучается ее применение в других областях тела. Долгосрочная эффективность после лечения гипертермической абляцией пока не известна, но первые результаты обнадеживают.
Возможные осложнения и побочные эффекты гипертермии
Применение высоких температур может привести к ожогам тканей, повреждению органа-мишени, особенно в случаях регионарного лечения. Степень поражений будет варьироваться в зависимости от времени воздействия, температуры и вида тканей. Самыми чувствительными к этому методу являются ткани головного мозга и легких.
- Отек.
- Образование тромбов.
- Внутренние кровотечения.
- Сердечно-сосудистые нарушения.
Сочетаемость с радиоактивным облучением или химиотерапией обладает достаточно сильной токсичностью, что выражается, как правило, через несколько часов после процедуры и может вызывать порой довольно тяжелые расстройства.
За злокачественной меланомой закрепилась репутация полной непредсказуемости, тем не менее, в сравнении с другими раковыми процессами достаточно много известно про закономерности её прогрессирования.
- Как выглядит рецидив меланомы?
- Причины рецидива меланомы
- Места локализации
- Признаки и симптомы меланомы
- Группы рецидива
- Частота возникновения
- Диагностика
- Лечение
- Профилактика
- Чем опасен рецидив
- Прогноз
Как выглядит рецидив меланомы?
Рецидивное новообразование отличается от первичной меланомы не столько внешним видом, сколько общим объемом поражения. Нередко вторичные образования очень похожи на ранее удаленное материнское, только их много больше, они могут быть крупнее или мельче.
В отечественной онкологии различают четыре вида рецидивов меланомы по классификации Вагнера:
- местные — опухоль располагается точно в зоне первичной операции;
- транзитные метастазы или сателлиты — рядом с рубцом, но не ближе 2 сантиметров, могут локализоваться не только в коже, но и в подкожно в клетчатке;
- регионарные метастазы — поражение злокачественным процессом лимфатических узлов вблизи зоны операции;
- отдалённые метастазы — вторичные меланомные опухоли в других органах и тканях.
У пациента могут быть рецидивы любого вида и в любом наборе, и все сразу, что неудивительно для столь агрессивной опухоли.
Причины рецидива меланомы
Предполагается, что источником развития рецидивной или метастатической опухоли становится злокачественная клетка, сохранившаяся в кровеносном или лимфатическом сосуде. На вероятности возврата болезни сказывается агрессивная биология меланомной клетки и её способность к длительному выживанию.
Замечено, что рецидивный процесс характерен для молодых людей от 30 до 50 лет, а сроки прогрессирования ассоциированы с полом. К примеру, поражение регионарных лимфоузлов у женщин случается на первом году после удаления меланомы, у мужчин — на втором-третьем, отдаленные метастазы у мужчины вероятны в первые 3 года после лечения, у женщины — после 3 лет.
Толщина первой опухоли коррелирует с частотой прогрессирования, при толщине более 2 мм у 8–9 пациентов из десятка скорее всего появятся метастазы в лимфоузлах. В клинических исследованиях разработан стандартный подход к расстоянию от опухоли до линии разреза в зависимости от толщины опухолевого узла, так не менее полсантиметра отступают при минимальной высоте, при более чем 2-миллиметровой толщине узелка от него отходят на 2 сантиметра.
Как недавно выяснили, на вероятности рецидивирования мало отражается объём первичной операции, но при недостаточном объеме иссечения, когда в краях удаленных тканей при гистологическом исследовании находят злокачественные клетки, не позже 8 недель выполняется повторная операция или проводится облучение с профилактической лекарственной терапией.
Места локализации
Две трети рецидивов — это метастазы, одна треть — узловые образования в зоне первой операции. Локализация материнской опухоли сказывается на судьбе пациента:
- у каждого третьего, оперированного по поводу меланомы кожи головы и шеи, развиваются опухоли в рубце, причём у женщин беда случается в первый год после лечения;
- транзитные метастазы имеют самую большую процентную долю в группе меланом конечности, такой вариант прогрессии у женщин развивается через пятилетку после иссечения, а в мужской популяции — на втором и третьем году после операции;
- при исходном поражении кожи ноги чаще всего, у семи из десяти обнаруживают вторичные опухоли в лимфоузлах, у женщин в ближайший год, у мужчин чуть позже;
- первичный процесс на туловище у каждого четвёртого осложняется отдаленными метастазами.
Признаки и симптомы меланомы
Симптомы метастазов зависят от места расположения, так при поражении легких может быть кашель с одышкой, при метастазировании в головной мозг — нарушение зрения, головные боли, рвота, судороги.
Регионарное метастазирование проявляется увеличением пакета лимфоузлов, с последующим прорастанием опухоли в мягкие ткани и блокировкой рядом проходящих сосудов, что осложняется отёком конечности.
Клинические исследования доказали, что выявление прогрессирования болезни до появления симптомов существенно улучшает перспективы на жизнь. Течение болезни всегда индивидуально, поэтому наблюдение после лечения должно опираться на биологические характеристики злокачественной опухоли. В Европейской клинике делается всё для раннего обнаружения и предотвращения проблем со здоровьем.
Группы рецидива
В 1985 году отечественный онколог Анисимов предложил для удобства описания клинической картины подразделять рецидивные опухоли на шесть групп:
Классификация в клинической практике используется редко, потому что оценка результатов лечения базируется исключительно на размерах узлов, а не на внешнем виде.
Частота возникновения
При любом виде и размере меланомы самый частый вариант прогрессии после операции — метастазы в другие органы почти у 60% больных.
Самый опасный период — первые три года после хирургического вмешательства, но на первом году у 60% более вероятны метастазы в регионарных лимфоузлах. При 1 и 2 стадии частота поражения лимфоузлов невысока — у каждого пятого, и совсем редко — менее 5% поражается послеоперационный рубец.
Из-за развития рецидивов заболевания только 60% больных живет больше пятилетки, но болезнь способна вернуться и через 15 лет — у 7%, и после 25 лет — у 10%. У каждого пятого с неважным индивидуальным прогнозом, тем не менее, в ближайшие 5 лет рецидива не возникает.
Диагностика
Обследование проходит аналогично диагностике первичного процесса. Особенность диагностики прогрессирования — четкое соблюдение графика регулярных осмотров, что позволяет выявить процесс в самом начале и до появления клинических симптомов.
В европейских странах рекомендуют посещать онколога каждые 2 месяца на протяжении первого года после операции, на втором году — ежеквартально, и далее наблюдаться, не сбавляя интенсивности, поскольку чаще всего рецидивы случаются в первые три года.
Ранняя диагностика рецидива меланомы сегодня объективная реальность. В каждом клиническом случае в Европейской клинике используется индивидуальная программа диагностического поиска, исключающая как избыточность обследования, так и его недостаточность.
Лечение
Лечение местного рецидива в рубце, транзитных метастазов и изменённых лимфатических узлов аналогично тактике при первичной опухоли — оптимальна операция в том числе с пластическим закрытием большого дефекта тканей.
Адъювантное лекарственное лечение после операции — норма, из лекарств используется то, что ранее не применялось для профилактики, правда выбор небольшой: альфа-интерферон и ипилимумаб.
При метастазах в другие органы встает вопрос о лекарственной терапии, и в первой линии прибегают к иммуно-онкологическим препаратам в сочетании с таргетными лекарствами при наличии мутации генов.
Выбор препаратов большой, поэтому при отсутствии результата или прогрессировании на фоне лечения во второй линии прибегают к ранее не использованным лекарствам. Химиотерапия при рецидиве меланомы используется в последнюю очередь совсем не из-за выраженных побочных реакций, проблема в невысоком результате.
При поверхностных образованиях возможна лучевая терапия.
Профилактика
Не существует специфической профилактики, воздействующей на факторы риска прогрессирования, но избегание солнечной инсоляции играет позитивную роль и в предотвращении рецидивирования.
Аналогичную задачу решает и визуальный контроль невусов у переболевшего меланомой пациента с обязательным соблюдением графика медицинских осмотров.
Чем опасен рецидив
Рецидив при меланоме — это не только появление злокачественного образования в рубце, но и метастазы. Чаще всего ими поражаются лимфатические узлы, легкие, кожа, головной мозг и печень. Возможность удаления рецидивного образования открывает перспективы на долгую жизнь, если операция технически невыполнима, то настоящее и будущее будет занято лекарственной терапией.
Выживаемость при множественных органных метастазах не превышает полугода, результаты лекарственной терапии оставляют желать лучшего даже при использовании инновационных иммуноонкологических препаратов, которые редко обещают более двух лет жизни.
Прогноз
Ежегодно меланома диагностируется в среднем у 15 человек из каждых ста тысяч взрослых, умирает примерно 3 больных, причем при достаточно стабильной смертности в последнюю четверть века мужчины стали гибнуть чаще. Пол многое определяет в прогнозе заболевания при прочих равных условиях, но молодые переживают заболевание с меньшими трудностями.
Вероятность смерти при позднем рецидиве многократно ниже, чем при раннем. Раннее выявление прогрессирования обещает лучшие результаты лечения.
Рассказ о применении перфузии конечности при меланоме кожи.
Итак , наша история. Моя мама (1954 г.р.) больна меланомой. В октябре 2014 года при осмотре у онколога был поставлен диагноз Меланома правой голени и дано направление в местный онкодиспансер на удаление родинки методом широкого иссечения. В ноябре 2014 года была проведена операция по удалению родинки и сразу во время нее БСЛУ. В лимфоузлах все чисто.
По гистологическим исследованиям уровень инвазии составил 3 мм. После выписки из стационара обратились за консультацией к химиотерапевту. Химиотерапия, как и любое другое лечение, назначены не были, врачи сказали, что в этом нет необходимости, требуются только контрольные осмотры, УЗИ, рентген и кровь на окномаркер меланомы S 100 каждый три месяца.
В июле 2015 года при контрольном УЗИ был обнаружен мтс в паховые лимфоузлы. Проведена операция по удалению паховых лимфоузлов. Далее, после выписки из хирургического отделения мама сразу была переведена в отделение химиотерапии, где прошла курс высоких доз интерферонов препаратом Лайфферон 18 млн.ед., и далее был назначен этот препарат в течении года в дозе 3млн.ед. (5 дней /2 дня).
Переносился он тяжело, с высокой температурой, ознобом, тахикардией. Как только маме стало не много легче, в ноябре повезла ее в Казань на ПЭТ (сами мы из Ижевска), в результате обследования были выявлены множественные мтс (8 шт) в толще правой конечности (6 в голени и 2 в бедре). Визуально их видно не было, так как на конечности появился умеренный лимфостаз.
В декабре 2015 с результатами ПЭТ обратились в РОНЦ им.Блохина на консультацию по поводу дальнейшего лечения. Терапия интерферонами была признана бесполезной и отменена, рекомендована операция химиоперфузия с гипертермией локально на ногу, т.к. мтс только в конечности, B-Raf мутация отсутствует. Мы согласились на операцию, т.к. нам объяснили, что для нее есть все показания.
28.01.2016 по квоте была проведена химиоперфузия. На момент проведения операции появились видимые метастазы на лобке, но доктора не предложили отказаться от перфузии, не смотря на то, что эта сложнейшая и тяжелая операция по факту уже была не актуальна, т.к. зона воздействия была меньше чем зона поражения. Операцию маме все же провели, обработав ногу до середины бедра мелфаланом и гипертермией до 42 градусов, а все мтс, которые были выше зоны воздействия были просто удалены хирургически. На операцию мы получили квоту от Минздрава РФ, но тем не менее доктора РОНЦ ******** (тут были имена , фамилии и еще кой чего нехорошее, но это я печатать не буду. прим Дядя Вадик). Они могли нас предупредить, что эффекта от нее не будет и порекомендовать другое лечение, направить к другим специалистам, но не сделали этого.
Во-вторых, опять (регулярно) возникает вопрос: стоит ли рассказывать пациенту о препаратах/методах лечения, которых в данный момент нет в нашей стране?
На самой операции хочу остановится еще более подробно.
Операция сложнейшая, когда конечность подключают на аппарат искусственного кровообращения и через сосуды ноги пропускаю химию, превышающую в 20 раз смертельную дозу для человека, потом отмывают физраствором и сосуды подшивают обратно в общий кровоток. Дополняет это все локальная гипертермия. При презентации этого лечения нам рассказали только одну сторону медали, то что это локальное воздействие на очаг поражения, что нет нагрузки на весь организм, что дозы высоки, поэтому опухоли сгорают без следа и можно надеяться на полное излечение. Но не сказали о возможных последствиях, таких как увеличение лимфостаза (сосуды то практически все сожгли), токсическая нейропатия (обострение чувствительности кожи и мышц ноги) и банальные ожоги.
В результате воздействия высоких доз малфалана и гипертермиии наступил ожег мягких тканей ноги, на третий день после операции нога покраснела, через неделю почернела, появились ожеговые пузыри в диаметре до 5 см, что мама пережила за этот послеоперационный месяц одному Богу известно. Мама не могла встать с постели 2 недели. Пузыри вскрывали, бесконечно перевязывали, обрабатывали регенерирующими мазями, но боли не уменьшались. Кожа со стопы и голени от ожегов сходила толстыми пластами. В выписке указали, что операция осложнилась 3 степенью токсичности. По чей это вине произошло? Это организм так отреагировал или это ошибка врачей — мы до сих пор не знаем.
В результате на данной конечности возникла токсическая нейропатия (нарушение чувствительности конечности). Через месяц после операции маму выписали домой. Дополнительное лечение никакое назначено не было, мотивируя тем, что введенный в таких больших дозах мелфолан будет действовать еще 2-3 месяца. Нас пригласили на повторную консультацию в РОНЦ в мае 2016. Восстановительный период после операции продолжался три месяца. Нейропатия не прошла до сих пор. Когда мы приехали на повторную консультацию, то по результатам диагностики было выявлено прогрессирование заболевания. Мтс появились на лобке, в паху, на ноге выше зоны обработки и в подвздошных лимфоузлах. Мтс в толще ноги тоже никуда не пропали. При этом лимфостаз усилился и практически не поддавался лечению.
Мама начала ходить с затруднениями. Хирурги, видя несостоятельность своего лечения быстро перенаправили нас на 18 этаж к химиотерапевту ******., который назначил маме два курса химии. На тот момент я уже самостоятельно узнала о возможности участвовать в КИ (об этом вообще ни кто не рассказывает), мы начали задавать эти вопросы и *******, и ******, и онкологу на приеме в поликлинике ******. Но как оказалось они ничего не знают ни о сроках, ни о наборах, ни об ответственных за набор докторах (взаимодействия между этажами и сотрудниками РОНЦ нет никакого, как будто это разные государства).
Начали самостоятельно разыскивать по РОНЦ ответственных за КИ, вышли на 21 этаж, зав.Демидов Л.В., нашли сотрудников отделения, кто занимается набором в КИ, и на нашу привеликую радость узнали о предстоящем наборе на КИ Пембролизумаб+эпакадостат, планируемое на июль 2016.
Два месяца провели в ожидании, обследовании, сборе анализов и пр. Конечно же ни о какой химии речи быть не могло, т.к. это является исключением для отбора на КИ. Были пройдены все необходимые обследования, подписаны все документы, выдан на руки договор, страховой полис…и в последний момент от спонсоров из Америки (компания Мерк) при последнем согласовании кандидатов пришел отказ. Доктор *****. прокомментировала его следующим образом, что маму исключили из КИ т.к. ранее присутствовало иммунологическое лечение и оно не дало результатов. Поэтому смысла брать ее в КИ спонсор не видит.
Возможности поехать заграницу на лечение у нас нет, да и мама отказывалась и не рассматривала зарубежные поездки. Денег на полный курс Пембролизумаба (2 года) у нас тоже нет, меньше года доктора сказали ставить его бесполезно, да и покупать его в России пока нет возможности, т.к. препарат не зарегистрирован (сейчас уже зарегистрирован, но толку пока что нет прим. Дядя Вадик). И лечить этим препаратом (контролировать ход лечения в России) мало кто берется.
Итог нашей истории очень грустный. Мама в плохом состоянии, на симптоматическом лечении дома. Виню себя, что повезла маму на химиоперфузию и принесла ей много страданий, а не искала медикаментозные пути лечения болезни (мутации не было и таргетная терапия была не актуальной, про пембролизумаб узнала позже). А потом, когда получили отказ в КИ не попыталась любыми путями купить Пембролизумаб и проставить хотя бы столько, сколько бы мы смогли себе позволить по деньгам. Не повторяйте наших ошибок.
P.S. общаемся с двумя коллегами по несчастью, с которыми познакомились в РОНЦ Блохина когда делали химиоперфузию. Они перенесли тоже эту операцию. Положительного эффекта нет ни у одного пациента, а вот последствия в виде нарушения чувствительности ноги и увеличении лимфостаза есть у всех. Считаю данный вид лечения очень слабо эффективным и небезопасным. Жаль, что нельзя повернуть время назад…
Ну вот, собственно, что тут комментировать? 🙁 Могу только выразить огромную благодарность автору за такой подробный рассказ.
Можно с высокой долей вероятности, а посмотрев нижеприсобаченное видео вы со мной согласитесь, скорее всего, что процедура была назначена не с целью лечения, а с целью проведения самой процедуры, ибо пациентов таких мало (цитата из киношки) и врачи цепляются за любую возможность поэкспериметировать, ведь действительно, какой смысл все это проводить, если уже есть отдаленные метастазы
У меня есть фото результатов проведенного лечения (вам я его не покажу). Никаких положительных результатов я не увидел и вообще, как неспециалисту, мне сложно понять смысл таких жутких манипуляций.
НО
В первом видео вы увидите такую карту:
т.е. данный метод достаточно широко представлен в мире (по крайней мере был представлен до появления последних препаратов), только вот в Штатах видимо нет. И Израиль, кстати, имеется, хотя я вот даже не слышал про такие манипуляции в этой стране.
А теперь обратимся к комментариям специалистов. Первое видео очень познавательное и в т.ч. интересна концовка с 12.45 , когда был задан вопрос (звук громче делайте, т.к. без микрофона вопрошающий глаголит).
Читайте также:

