Гипербиотические процессы гипертрофия регенерация опухоль
В клинической работе чрезвычайно важно отличать истинные опухоли от неопухолевых процессов, сопровождающихся изменением объема, массы и структуры тканей и органов.
Учение о новообразованиях представляет собой важнейшую часть более широкой патофизиологической доктрины, описывающей причины и механизмы избыточною или недостаточного роста и размножения клеток — то есть гипербиотических и гипобиотических процессов соответственно.
Гипо- и гипербиотические процессы
Атрофия — уменьшение объема клеток и их числа вследствие превышения скорости гибели клеток над темпами их размножения, приводящее к уменьшению веса и объема органов (тканей) и развитию соответствующей гипофункции. При атрофии происходит усиление интенсивности апоптоза и аутофагоцитоза.
Атрофия — важный адаптационный механизм — лежит в основе рассасывания провизорных органов плода, регрессии гиперплазированных органов, связанных с беременностью, лактацией, натуральными биоритмами и возрастом (инволюционная физиологическая атрофия).
Если гипобиотический процесс, аналогичный атрофии, носит врожденный характер, то он именуется гипоплазией. Гипоплазия чаще касается отдельных органов (например, костной системы — при хондродисплазии), но может относиться и ко всему телу (гипофизарный нанизм). Крайне выраженная гипоплазия, когда имеется лишь органный зачаток, известна под названием аплазии, а если отсутствует и органный зачаток, то это состояние называют агенезией (пример - агенезия почки).
Гипербиотические процессы представляют собой избыточное образование клеток или увеличение их размеров. В организме они представлены гипертрофией, гиперплазией, регенерацией и опухолевым ростом.
Гипертрофия — компенсаторно-приспособительный процесс, индуцированный избытком ростостимулирующих и/или дефицитом ростингибирующих факторов, увеличения размеров клеток и числа функционирующих внутриклеточных структур с соответствующим увеличением размеров и функциональных возможностей органов.
Гиперплазия — адаптационное или патологическое увеличение числа нормальных клеток в органах и тканях и, соответственно, — их размеров. Гиперплазия обратима, дифференцировка клеток и тканевая структура органа при этом остаются нормальными, клетки по-прежнему чувствительны к регуляторным сигналам, или, говоря иначе, остаются под контролем организма.
Гиперплазия может наступать вместе с гипертрофией, под воздействием избытка ростостимулирующих и/или устранения ростингибирующих сигналов. Гиперплазия бывает физиологической и патологической.
Примером гормональной физиологической гиперплазии может служить пролиферация эпителиальных структур в молочной железе во время беременности. Патологическая гиперплазия также обычно является следствием избыточной гормональной стимуляции или воздействия факторов роста на клетки-мишени.
Одним из примеров дисгормональной патологической гиперплазии является железистая гиперплазия эндометрия при высоком уровне эстрогенов. Примером гиперплазии может служить также зоб, когда в условиях гипотиреоза наступает компенсаторная гиперплазия щитовидной железы.
Регенерация
Гипертрофия и гиперплазия составляют основу для такого гипербиотического процесса как регенерация. Регенерацией называется возрождение (восстановление) утраченных тканей, органов и отдельных частей организма Она может быть физиологической (в процессе самообновления тканей) и патологической (при убыли клеток из-за повреждения).
Процессы регенерации присущи всем живым существам, но чем сложнее животные, гем способность к полной (с правильной дифференцировкой и восстановлением исходной ткани) регенерации меньше. У человека регенерируют лишь части органов и тканей, но чаще имеет место неполная регенерация в виде рубцевания.
Рубцевание (или фиброплазия) — это возникновение регенерата, представленного в основном соединительной тканью (например, заживление ран вторичным натяжением). Наиболее хорошо регенерируют эпителиальная и соединительная ткани. Разновидностью неполной регенерации считается метаплазия.
Метаплазия — процесс, при котором одна вполне дифференцированная ткань замещается другой вполне дифференцированной в пределах одного гистиотипа: либо эпителиального, либо мезенхимального (нервным и мышечным тканям метаплазия не свойственна). Метаплазия обычно является реакцией на повреждающие воздействия и носит приспособительный характер. Иногда метаплазию рассматривают как неполную регенерацию с отклонением в дифференцировке клеток органа или ткани.
При метаплазии камбиальные клетки дифференцируются не в характерные, а в иные, не типичные для органа, но вполне зрелые клетки Чаще всего наблюдается замещение однослойного призматического или цилиндрического эпителия на многослойный плоский при хроническом раздражении или воспалении. Например, очаги плоскоклеточной метаплазии часто формируются в бронхах при хроническом бронхите или как реакция на курение.
Считается, что многослойный плоский эпителии более устойчивый и лучше приспособленный к выживанию при воздействии неблагоприятных факторов.
Иногда метаплазия имеет обратную направленность — от плоского эпителия к цилиндрическому. В частности, это наблюдается при так называемом пищеводе Барретта, когда на фоне длительно существующего рефлюкс-эзофагита отмечается метаплазия плоского эпителия нижней трети пищевода в эпителий кишечного типа.
Явление метаплазии само по себе не носит опухолевого характера, однако известно, что рак на фоне пищевода Барретта развивается в 30-40 раз чаще, чем у здоровых лиц
Более того, развивающаяся при наличии метаплазии опухоль обычно имеет строение аденокарциномы, что вообще для рака пищевода не характерно. Примером метаплазии мезенхимальных тканей может служить гетеротопическое костеобразование, когда клетки волокнистой соединительной ткани трансформируются в остеобласты и продуцируют кость там, где в норме ее никогда не бывает.
Принято считать, что метаплазия обратима, а клетки, подвергшиеся этому процессу, не проявляют признаков нарушения нормальных межклеточных взаимоотношений, то есть при метаплазии нет признаков тканевого атипизма.
В большинстве случаев, нет прямой связи между метаплазией и раком. Однако в метапластических участках могут в последующем появляться признаки дисплазии (см ниже). В этом случае определяется повышенный риск возникновения рака. Поэтому метаплазия обычно рассматривается не как предопухолевый, а как фоновый процесс.
Дисплазия — (в переводе с греч. — отклонение в формировании) — характеризуется частичной потерей кош роля за дифференцировкой клеток. Вследствие лого появляются признаки атипии клеток и ткани. Дисплазия частично обратима.
Для нее нехарактерен избыточный рост ткани, но частота возникновения опухолей соответствующей локализации повышена. В некоторых случаях диспластическая стадия в развитии рака очень четко очерчена, присоединяется к гиперплазии или метаплазии и имеет большое значение при скрининге и диспансеризации.
Таковы, например, дисгормональные пролифераты молочных желез, матки и простаты, аденоматозные полипы желудка и толстой кишки, дисплазии эпителия бронхов, папилломы мочевою пузыря. В связи с этими особенностями, дисппазию характеризуют как предопухолевый рост.
Общие сведения об опухолях
Опухоль (новообразование) — продукт неопластического роста — является разновидностью гипербиотического процесса. Единого, общепринятого определения опухопевою роста нет до настоящего времени, что объясняется сложностью и многообразием нонсюбразовании.
В разные исторические периоды опухоль определяли по-разному. М.А. Пальцев, Н.М. Аничков (2001) считают, что целесообразно придерживаться следующего определения: опухоль — это патологический процесс, представленный новообразованной тканью, в которой изменения генетического аппарата клеток приводят к нарушению регуляции их роста и дифференцировки.
При локальном прогрессирующем увеличении объема участка органа или ткани за счет роста числа клеток в нем опухоли называются первично-локализованными (в виде узла).
Однако при лейкозах опухолевые клетки расселены по организму и обнаруживаются в кроветворных органах, крови, а иногда — в других тканях, причем узловые локальные образования могут отсутствовать из-за того, что ткань костного мозга представляет собой суспензию.
Такие опухолевые процессы называются первично-системными, т.е. возникающими в разных участках одной (лимфоидной) системы Как и в нормальных органах, строма любого новообразования (кроме лейкозов), — это в основном опорная и снабжающая фиброваскулярная ткань, не являющаяся носительницей опухолевых свойств, а паренхима — это профильная ткань, сосредоточие ее фенотипа. Кроме того, различают опухоли первично-множественные, мультифокальные, билатеральные.
Мультифокальные (мультицентрические) — это множественные опухоли одинаковой гистологической структуры в одном и том же органе; билатеральные опухоли — опухоли в парных органах (например, в почках) одинаковой гистологической структуры.
По течению и прогнозу для здоровья и жизни ее носителя существует деление опухолей на злокачественные и доброкачественные. Последние имеют гораздо лучший прогноз
Следовательно, подобная классификация является практической, а не строго научной и определяется клиническим течением опухоли и ее морфологической характеристикой. При диагностике задача состоит в том, чтобы максимально объективно оценить морфологическое строение и особенности роста опухоли, с одной стороны, и все детали клиническою плана — с другой.
Доброкачественные опухоли морфологически соответствуют зрелым опухолям, четко отграничены от окружающих тканей, имеют обычно форму узла или полипа (на слизистой оболочке), характерен медленный экспансивный или раздвигающий (а не инфильтрирующий) рост, не дают метастазов и не рецидивируют.
Нередко они вообще могут прекращать свой рост, претерпевая инволюционные изменения При своем росте опухоли раздвигают окружающие ткани, иногда сдавливают их, но, обычно, не повреждают: в некоторых случаях инкапсулируются.
Доброкачественные опухоли, как правило, не оказывают выраженного неблагоприятного воздействия на организм. Однако понятие доброкачественности является относительным.
Например, доброкачественные опухоли тонкой кишки (лейомиомы) больших размеров, сдавливая петли, могут вызывать некроз кишечника; неинвазивно растущая и неметастазирующая опухоль внутри черепа но чисто механическим последствиям может быть фатальной для больного.
Доброкачественные опухоли также могут угрожать жизни больного, если они вызывают эндокринные нарушения (например, гормонально активные аденомы надпочечников).
Злокачественные опухоли соответствуют незрелым опухолям, имеют характерные морфологические признаки, растут быстро, инвазивно (то есть с прорастанием и замещением окружающих тканей), способны к диссеминации и метастазируют.
В финале своего развития неоплазма может разрушать жизненно важные органы и целые системы организма. Но понятие злокачественности также относительное. Некоторые злокачественные опухоли несмотря на способность к метастазированию. имеют относительно доброкачественное течение, обладая низким метастатическим потенциалом и менее выраженными инвазивными свойствами.
Так, папиллярный рак щитовидной железы даже при наличии отдаленных метастазов успешно лечится и обладают лучшим прогнозом по сравнению с другими типами рака этого органа.
Считается, что единственный абсолютный признак злокачественности — метастазирование. Но практически важно уметь оценить степень риска, вызываемого опухолью, до появления метастазов. Поэтому принимают во внимание и другие признаки злокачественности, более или менее тесно связанные с метастатическими потенциями: скорость роста опухоли и ее размер, степень атипизма и т.д.
Считается, например, что карциноид аппендикса должен быть больше 2 см в диаметре, чтобы подпадать под критерий злокачественности, так как известно, что опухоли этого типа при меньших размерах метастазируют редко. Однако, не метастазируют и многие крупные карциноиды. У многиx злокачественных опухолей нет капсулы, но нет ее и у карциноидов, дерматофибром и других доброкачественных опухолей.
Таким образом, точка зрения, жестко разграничивающая доброкачественные и злокачественные новообразования, не получила достаточного обоснования, так как онкогены активированы в обеих типах опухолей. Речь может идти только о разном количестве и степени их активации и о различной степени сохранности активности антионкогенов. Именно в связи с этим имеется много промежуточных вариантов опухолей.
Вместе с тем, есть ряд критериев, которые позволяют с определенной степенью достоверности разделять их на две основные группы. Так, для доброкачественных опухолей характерен только тканевой атипизм (изменения пространственных и количественных взаимоотношений между компонентами ткани: стромой, сосудами и паренхимой).
У злокачественных опухолей присутствует атипизм и тканевой, и клеточный. У злокачественных новообразовании больше выражен биохимический (метаболический) и иммунопотический атипизм, что закономерно сопровождается развитием в организме носитепя паранеоплазий. Некоторые дополнительные, относительные разграничительные признаки двух типов опухолей, представлены в таблице 6.1.
Таблица 6.1. Относительные критерии доброкачественности и злокачественности опухолей [Зайчик А.Ш., Чурилов Л.П., 2002]. 
Вопрос о возможности озлокачествлении доброкачественных опухолей решается неоднозначно. Механизмы нарушения регуляции роста и течения доброкачественных и злокачественных опухолей отличаются друг от друга качественно, что связано с различиями их гено- и фенотипа.
Однако чаще доброкачественные опухоли непосредственно в злокачественные не переходят. Как правило, злокачественная опухоль формируется в доброкачественной заново, на основе появления нового, активированного онкогенами клона. Но есть и исключения — так, нейрофиброма может трансформироваться в злокачественную опухоль, аденоматозный полип толстой кишки и кератопапилпома, при достаточной длительности существования — в рак.
Очевидно, для такой трансформации необходимы дополнительный мутации. Принципиально, возможна спонтанная регрессия опухолей, гораздо чаще при их доброкачественном характере и очень редко — при злокачественном. Лишь как исключение указывают на возможность спонтанного приобретения признаков дифференцировки клетками некоторых злокачественных опухолей и чуть пи не единственным, традиционно приводимым примером служит нейробластома.
Кроме доброкачественных и злокачественных опухолей выделяются новообразования с местнодеструирующим ростом и потенциально злокачественные (или опухоли неопределенной степени злокачественности). Это неясная в плане адекватности лечения и прогнозирования группа опухолей по клинико-морфологическим признакам является неоднородной и до настоящего времени недостаточно изученной.
Местнодеструирующие опухоли часто называют третьим (промежуточным) видом новообразовании. Гистологически они проявляются выраженной пролиферацией клеточных элементов.
Для местнодеструирующих опухопей, как и для злокачественных, характерен инфильтрирующий рост, и даже после их радикального удаления часто возникают рецидивы.
Однако они никогда не озлокачествляются и не обладают способностью к метастазированию. Типичными представителями местнодеструирующих опухолей принято считать базалиому (базальноклеточный рак) кожи, цесмоид, миксому, плеоморфную аденому слюнной железы (смешанную опухоль).
Опухоли неопределенной степени злокачественности или потенциально злокачественные при морфологических признаках доброкачественности иногда могут метастазировать.
Если подходить строго, то правильнее их расценивать как доброкачественные новообразования, имеющие своеобразные черты роста и клинического течения. Среди них можно назвать карциноиды тонкой кишки, гигантоклеточная опухоль кости (остеобластокластома) и др.
В таблице 6.2. представлен перечень наиболее часто встречающихся опухолей неопределенной степени злокачественности и с неустановленным прогнозом.
Таблица 6.2. Перечень опухолей неопределенной степени злокачественности
[Колосов А.Е. и соавт., 1990]. 
Биологическое поведение опухолей, т.е. скорость роста, способность к инфильтрирующему росту, метастазированию, определяется не только морфологическими признаками атипии, но и происхождением гистогенезом опухоли.
При доброкачественных опухолях установление их гистогенеза не представляет трудностей. Однако определить происхождение низкодифференцированных злокачественных опухолей по гистоструктуре удается далеко не всегда. В настоящее время признано, что наиболее точно гистогенез опухоли устанавливается при иммуногистохимических исследованиях.
Накопленный опыт морфологического анализа опухолей в сочетании с клиническими данными говорит в пользу того, что именно с позиций конкретного органа или ткани и с точки зрения нозологических форм, которые типичны для этой локализации, нужно исходить для правильной ориентировки в особенностях течения опухолевою процесса и прогноза ею у конкретного больного.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
Гипербиотические процессы могут рассматриваться как компенсаторно-приспособительные (гипертрофия, гиперплазия) и как сугубо патологические, характеризующиеся неограниченным, беспредельным ростом (опухоли).
Гиперплазия (от греч. hyper — избыток, plasis — образование) — увеличение органа в объеме за счет размножения клеточных элементов. Определяющими факторами в развитии гиперплазии являются повышенная функциональная активность органа, воспалительные и регенераторные процессы, гормональное влияние.
Гипертрофия(от лат. hyper — избыток, trophe — питание) — увеличение органа в объеме за счет нарастания массы отдельных функциональных единиц. Она может быть физиологической, например гипертрофия поперечнополосатых мышц при повышенной физической нагрузке. В таких случаях говорят об истинной гипертрофии. При повышении функциональной активности органа активируется синтез белка с последующим нарастанием энергообразующих, опорных и специфических структур. Усиливаются обменные процессы, возрастает число диктиосом в аппарате Гольджи и митохондрий в клетке. Основным стимулом частичной гипертрофии являются эффекторные нервно-гормональные влияния, индуцируемые рецепторами и нервными центрами при изменениях физиологических констант усиленно работающего органа. Биохимические процессы предшествуют морфологическим проявлениям гипертрофии.
По этиологии и патогенезу различают следующие виды гипертрофии:
ü рабочая, когда предъявляются повышенные требования к функциональной активности органа. Интенсивно работающий орган гипертрофируется. Так, повышенная деятельность сердца приводит к увеличению массы всех его отделов, а при компенсации пороков локализация гипертрофического процесса зависит от условий кровенаполнения камер этого органа. Во время лактации гипертрофируется молочная железа; развитие эмбриона в матке сопровождается гипертрофией ее стенки. В этих ситуациях увеличение массы органов происходит не только за счет отдельных функциональных элементов, но и их размножения (гиперплазии);
ü викарная, характеризующаяся увеличением массы парного органа при удалении или атрофии одного из них. Потеря одной почки ведет к возрастанию объема оставшейся. Викарная гипертрофия никогда не компенсирует на 100 % деятельность выбывшего парного органа. Функция гипертрофированного легкого, надпочечника, почки, других парных органов только на 60—80 % замещает изначальную нагрузку, степень восстановления функции зависит от многих факторов, в том числе от возраста больного животного. Удаление почки у молодой крысы ведет к 65%-ной гипертрофии оставшейся, а у старой — к 25%-ной;
ü регенерационная гипертрофия развивается у оставшейся части органа после частичной резекции. Удаление у подопытного кролика более 50 % ткани печени спустя 1—2 мес приводит к полному восстановлению массы органа;
ü корреляционная гипертрофия характерна для систем, имеющих регуляторно-функциональную взаимосвязь. Например, увеличение выработки адренокортикотропного гормона гипофизом ведет к гипертрофии и гиперплазии коры надпочечника.
В некоторых случаях гипертрофия развивается за счет межуточной ткани, тогда ее называют ложной. Подобную картину можно наблюдать в начальной стадии цирроза печени, когда увеличение ее объема обусловлено разрастанием соединительной ткани, или при увеличении объема мышцы вследствие нарастания жировой ткани между мышечными волокнами.
Среди типичных повреждений клеток выделяют дисбиотические, гипо — и гипербиотические процессы.
Дисбиотические процессы. Это процессы, сопровождающиеся качественными изменениями структуры и функций клетки, ткани и органа в целом. К ним относят дистрофию и дисплазию.
Дистрофия — это типичный патологический процесс в клетках, обусловленный нарушением катаболизма и переваривания (его снижением) и/или образованием избыточного количества нормальных и/или патологических веществ, а также изменением их локализации. Это болезни накопления. Избыточное накопление того или иного вещества трансформирует структуру и функцию клетки, ведет к ее гибели.
В основе клеточной дистрофии лежит ферментопатия, которая возникает вследствие разнообразных причин, ведущих к угнетению или блокаде соответствующих ферментов (приобретенная), либо передается по наследству (наследственная).
По зоне накопления веществ ферментопатии подразделяют на клеточные, внеклеточные и смешанные. Избыточное содержание веществ инфильтрирует клетку и/или межклеточное вещество. Иногда встречается извращенный синтез с образованием аномальных белково-полисахаридных комплексов (амилоид). В других случаях происходит трансформация органических веществ, например белков и углеводов в жиры.
Декомпозиция (фанероз) — накопление веществ в необычном для них участке. Распад соединений, например белково-полисахаридных комплексов на белки и полисахариды, также приводит к дистрофиям.
По видам обмена веществ выделяют белковые (диспротеинозы), жировые (липидозы), углеводные (гликогенозы и мукополисахаридозы), пигментные (пигментные пятна, отсутствие пигментации — альбинизм) и минеральные дистрофии.
Жировую дистрофию часто наблюдают при нарушении обмена веществ в печени, сердце, головном мозге и других органах. Жировая дистрофия в интиме артерий называется атеросклерозом.
Клеточные диспротеинозы по морфологии могут быть зернистые, гиалиновые (гиалиново-капельные), водяночные (вакуольные, гидропические) и роговые. Встречаются также амилоидозы (патологический комплекс белков и полисахаров), липопротиенозы (миелоидоз). Роговая дистрофия занимает особое место и сопровождается избыточным накоплением кератинов (рогового вещества) в ороговевающем эпителии или ороговением эпителия там, где в норме этого не происходит.
Дисплазия — это нарушения процессов развития (детерминации и дифференцировки) клеток, проявляющиеся в стойких изменениях их структуры и функции, что ведет к расстройству жизнедеятельности клеток, образованию клеток-монстров, изменению структуры и функции органов. Дисплазия обусловлена мутациями и/или изменениями реализации генома.
Примером дисплазии является патология строения и функции (морфологический и функциональный атипизм) опухолевых клеток. При этом наблюдается разнообразие их строения (полиморфизм) и величины: изменяются ядра клеток, ядерно-цитоплазматическое отношение, содержание и строение органелл и включений, клетки в целом. Это тесно связано со своеобразием обмена в такой клетке (биохимическая анаплазия).
Гипобиотические процессы. Это процессы, характеризующиеся снижением функциональной активности и уменьшением скорости метаболизма в клетке, ткани и в органе в целом.
К гипобиотическим процессам относят гипотрофию, атрофию, гипоплазию и аплазию, некроз и паранекроз.
Гипотрофия — это уменьшение размеров клетки со снижением ее функции. Гипотрофия на уровне субклеточных структур проявляется в уменьшении тех или иных органелл, элементов ядра и т. д. Это сопровождается снижением функциональной активности поврежденных структур. Гипотрофия может быть нормальным физиологическим процессом и компонентом дифференцировки клеток, но может стать и патологией. Гипотрофия на тканевом и органном уровнях сопровождается уменьшением размеров органов и тканей, образованных этими клетками. Уменьшается количество клеток, образующих паренхиму органа, и идет их замещение соединительной тканью.
Атрофия — это процесс замещения паренхимы органа соединительной тканью (склероз, цирроз) и/или гибель клеток паренхимы с отсутствием функциональной специфической активности органа. На уровне клетки понятие атрофии предполагает инволюцию структурных элементов клетки, например комплекса Гольджи, ядра, ядрышка и др. с резким снижением функциональной активности.
Гипоплазия — это снижение митотической активности клеток с уменьшением размеров органа, который они образуют. Гипоплазия на клеточном уровне указывает на резкое снижение
или прекращение размножения клеток, уменьшение численности клеточной популяции.
Аплазия — это врожденное отсутствие какого-либо типа клеток паренхимы и, следовательно, органа, который они формируют.
Некроз — это саморазрушение клетки с процессами аутолиза (самопереваривания) и гибелью.
Паранекроз морфологически аналогичен некрозу, но носит обратимый характер. Существует тотальный (всей клетки) или парциальный (части клетки) некроз и паранекроз. Тотальный некроз может быть коагуляционным (коагуляция сложных биополимерных комплексов со сморщиванием клетки) и колликвационным (набухание клетки с разрывом клеточных мембран и аутолизом). Очаговый колликвационный некроз иногда называют баллонной дистрофией, а фокальный — ацидофильной дегенерацией клетки.
Гипербиотические процессы. Это процессы, характеризующиеся увеличением размеров и резким усилением функции клетки, ткани и органа до атипичного уровня.
К гипербиотическим процессам относят гипертрофию и гиперплазию.
Гипертрофия — увеличение размеров клетки с избыточным развитием специализированных структур, усилением специфической активности клетки. В патологии гипертрофия может носить компенсаторный (восстанавливающий утерянные функции) или избыточный характер.
Гиперплазия — увеличение количества клеток с усилением их активности.
Избыточные гипертрофия и гиперплазия приводят к тяжелым нарушениям, например избытку гормонов, нарушению проходимости в полых органах, сдавливанию соседних органов и др.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Сайт СТУДОПЕДИЯ проводит ОПРОС! Прими участие :) - нам важно ваше мнение.
ГИПО- И ГИПЕРБИОТИЧЕСКИЕ ПРОЦЕССЫ
Патологическими (вредными для организма) являются различные формы недостатка или избытка роста и размножения отдельных видов клеток, тканей или органов.
Процессы недостатка роста и размножения клеток и тканей называют гипобиотическими.К ним относятся: 1) атрофии (от греч. а - отрицание, trophos - питаю); 2) дистрофии и дегенерации,
различные виды нарушения обмена веществ в клетках органов и тканей.
Процессы избытка роста и размножения клеток, тканей и органов называются гипербиотическими.К ним относятся: 1) гипертрофия и гиперплазия клеток, органов и тканей; 2) возрождение клеток, органов, тканей, или регенерация; 3) опухоли.
Наконец, возможны особые формы патологического роста тканей, при которых имеют место сочетания гипо- и гипербиотических процессов. Они возникают при пересадках органов и тканей.
Атрофия- процесс уменьшения объема органа или ткани вследствие их недостаточного питания или нарушения обмена веществ. По механизму развития различают несколько видов атрофии.
Атрофия от бездействия. Например, если перерезать сухожилие скелетной мышцы и лишить ее одной из точек прикрепления, произойдет уменьшение объема мышцы вследствие невозможности ее полноценных сокращений. Показана возможность развития атрофии скелетной мускулатуры у животных от неподвижности (гипокинезий) при их искусственной иммобилизации.
Атрофия от денервации органа. Известно, что нервы оказывают на органы и ткани троякое влияние: а) регулируют кровоснабжение органов через вазомоторные нервы; б) оказывают трофическое влияние на ткани, активируют обмен веществ и в) вызывают возбуждение деятельности (сокращение, секреция и др.). Перерезка нерва лишает ткань нормального кровоснабжения и трофического влияния нервной системы. Вследствие этого в денервированном органе или ткани угнетается обмен веществ, уменьшается объем органа.
Атрофия вследствие длительного сдавления органа или ткани, которое нарушает их нормальное питание и обмен веществ (рис. 13-5).
Например, опухоль, оказывая давление на кость, может вызвать ее истончение и последующее разрушение. При закупорке мочеточника моча скапливается в нем и в почечной лоханке, вызывает атрофию ткани почки от давления на нее со стороны лоханки (гидронефроз).
Дистрофия клеток.Разнообразные патологические процессы сопровождаются существенными нарушениями обмена веществ в
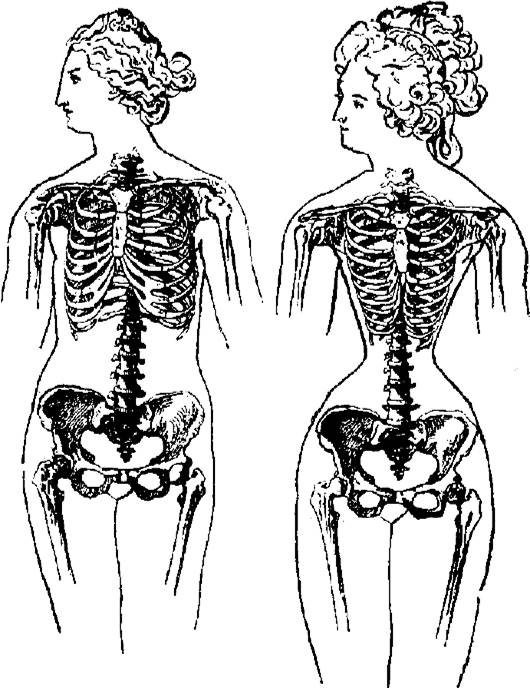
Рис. 13-5. Атрофия вследствие воздействия длительного сдавливания. Женщина, имеющая нормальный остов груди (слева), и со скелетом, изуродованным от ношения корсета (справа) (по Г. Плоссу, 1902)
клетках, которые называются дистрофией (дегенерацией, перерождением). В зависимости от характера изменения обмена веществ в клетках различают белковые, жиролипоидные и углеводные дистрофии.
Глава 25. РЕГЕНЕРАЦИЯ И ГИПЕРТРОФИЯ
Регенерация (лат. re — снова + generare — производить, создавать) — восстановление или возмещение клеток и тканей в организме взамен утраченных.
По этиологии и механизму развития различают физиологическую, репаративную регенерацию, регенерационную гипертрофию и патологическую регенерацию.
Физиологическая регенерация — генетически запрограммированное биохимическое (молекулярное, внутриклеточное) и клеточное восстановление тканей и органов, протекающее в организме при естественной жизнедеятельности, обеспечивающее его постоянное и постепенное самообновление и саморазвитие (например, регенерация крови, эпидермиса кожи и т. д.). Она включает в себя протекающее по законам жизни, генетической и фенотипической наследственности и изменчивости восстановление утрачиваемых в процессе обмена веществ и обновления молекул, органелл, клеток, тканей и органов за счет индуцированного синтеза ДНК- и РНК-специфических белков под влиянием нервных, гормональных, ферментных, иммунологических и функциональных механизмов, размножение клеток митотическим и амитотическим путями, их дифференциацию и специализацию. Ее результатом является полное восстановление утраченных структурнофункциональных элементов, т. е. реституция (restitutio — восстановление).
Репаративная (лат. герагаге — восстанавливать), или восстановительная, регенерация — восстановление структурных элементов, клеток и тканей при их повреждении или патологической гибели. В ее основе лежат физиологические закономерности, но в зависимости от степени повреждения органа исходом репаративной регенерации может быть не только полное восстановление, или реституция (лат. restituere — восстанавливать), поврежденной или утраченной части органа или ткани (как при физиологической регенерации), заживление раны по первичному натяжению, но и неполное восстановление или замещение, например, образование, соединительной ткани взамен утраченной (заживление раны по вторичному натяжению с образованием плотной рубцовой ткани или костной мозоли на месте перелома кости).
Регенерационная гипертрофия (греч. hyper — верх, слишком, trophe — питание) — возмещение исходной массы органа взамен погибшей за счет увеличения сохранившейся его части или других органов без восстановления формы органа.
В морфологическом отношении репаративная регенерация и регенерационная гипертрофия проявляются в трех формах:
1) регенерационная гипертрофия преимущественно в форме клеточной регенерации (размножение клеток, или гиперплазия);
2) регенерационная гипертрофия преимущественно или исключительно в форме внутриклеточной регенерации (гиперплазии) специфических ультраструктур и увеличения размеров, или гипертрофии клеток (кардиомиоциты, ганглиозные клетки нервной системы и т. д.);
3) смешанная форма — сочетание клеточной и внутриклеточной регенераций (печень, почки, легкие, гладкие и скелетные мышцы, органы вегетативной и гормональной систем и др.).
Патологическая регенерация характеризуется изменением темпов (скорости) регенерации или качественным извращением восстановительного процесса. Она выражается в трех формах:
1) задержка темпов регенерации с недостаточным образованием регенерационного продукта. Примерами неполноценной регенерации могут служить долго не заживающие раны в очаге хронического воспаления, длительно текущие язвы, неполноценное восстановление дистрофически измененных паренхиматозных органов и др.;
2) избыточная продукция неполноценного регенерата (грибовидная, или фунгозная, язва с опухолевидным образованием грануляционной ткани, гиперпродукция соединительной ткани с образованием келоида, избыточная костная мозоль при заживлении перелома кости и т. д.);
Гистологические и цитологические изменения при патологической регенерации характеризуются появлением патологических форм митозов и амитозов (неравномерное деление и расхождение хромосом с образованием неправильных форм митозов — асимметричные, многополюсные, абортивные митозы; неполное и разноразмерное деление ядер при амитозе, образование многоядерных, или гигантских, клеток за счет неполного их слияния, клеток-монстров или, наоборот, карликовых клеток и т. д.). На тканевом уровне отмечают нарушение смены фаз пролиферации и дифференцировки, недостаточную зрелость клеточных и тканевых элементов, их морфофункциональную неполноценность.
Регенерация соединительной ткани при заживлении ран. Высокий биологический потенциал физиологической регенерации соединительной ткани лежит в основе ее репаративной регенерации, которая происходит не только при повреждении соединительной ткани, но и при неполной регенерации других тканей и протекает в неразрывном единстве с воспалительными и иммунными процессами при заживлении ран. В процессе репаративной регенерации соединительной ткани возникает динамическое взаимодействие клеток (фибробластов, макрофагов, тучных клеток, лимфоцитов, эндотелия капилляров) между собой, с межклеточным матриксом (коллагеном, протеогликанами, фибронектином и др.), с клетками крови и паренхимными клетками органов. При этом сначала образуется молодая сочная ткань с большим количеством малодифференцированных юных фибробластов, а также лейкоцитов, плазмобластов и лаброцитов, муфтообразно окружающих вновь образованные путем почкования или аутохтомно тонкостенные капилляры. Между фибробластами при световой (методом серебрения) и электронной микроскопии выявляются расположенные в основном веществе тончайшие аргирофильные ретикулярные волоконца. Выступившие над поверхностью раны петли таких капилляров придают ей макроскопически выраженный ярко-красный и зернистый вид, поэтому ткань получила название грануляционной (лат. granula — зернышко) (первая стадия заживления с образованием грануляционной ткани). Микроскопически такая ткань состоит из юных соединительнотканных клеток на разной стадии гистологической дифференцировки (цв. табл. III, А). При этом в поверхностных участках раны преобладают клетки крови, а в глубине — тканевые.
По мере дифференцирования клеточных элементов, увеличения количества фибробластов и синтеза фибробластами коллагеновых и эластических волокон происходят созревание грануляционной ткани, уменьшение в ней сосудов и клеток крови, преобразование грануляционной ткани в зрелую фиброзную, которая при окрашивании по ван Гизону окрашивается фуксинофильно в красный цвет (вторая стадия заживления раны с образованием фиброзной ткани).
В дальнейшем фибробласты долгоживущей популяции уплощаются и переходят в дифференцированные фиброциты, а фибробласты короткоживущей популяции гибнут после выполнения ими своей генетически запрограммированной функции. В конечном итоге фиброзная ткань превращается в плотную грубоволокнистую рубцовую ткань, подвергающуюся гиалинозу (третья стадия заживления раны с образованием рубца).
Регенерация эпителия кожи при заживлении ран. Покровный эпителий обладает высоким потенциалом физиологической регенерации за счет размножения клеток зародышевого (камбиального) мальпигиева слоя. При репаративной регенерации эпидермиса без повреждения базального слоя и подлежащей стромы (ссадины, эрозии) отмечают усиленное размножение клеток производящего, или базального, слоя, дифференциацию его с образованием росткового (базального и шиповатого), зернистого, блестящего и рогового слоев, связанных с синтезом в их цитоплазме специфического белка кератогиалина, превращающегося в элеидин и кератин (полная регенерация) с заживлением раны по первичному натяжению.
При повреждении эпидермиса и стромы кожи клетки росткового слоя по краям раны размножаются, наползают на восстановленную базальную мембрану и строму органа и покрывают раневой дефект (заживление раны под струпом и по вторичному натяжению). Однако вновь образованный эпителий утрачивает способность к полной дифференциации характерных для эпидермиса слоев, покрывает дефект более тонким пластом и не образует производных кожи: сальных и потовых желез, волосяного покрова (неполная регенерация). Образуется микроскопически выраженный плотный, сухой, белый соединительнотканный рубец, покрытый тонким слоем эпидермиса.
Регенерация серозных оболочек полостей тела и органов, слизистых оболочек пищеварительного, дыхательного трактов и мочеполовых путей (мезотелий, многослойный плоский неороговевающий, переходный, однослойный призматический и многорядный мерцательный) протекает путем размножения и дифференцировки сохранившихся мезотелиальных и эпителиальных клеток, распространяющихся на поврежденную поверхность, а при обширных и глубоких повреждениях (язвах и т. д.) происходит неполное восстановление с образованием соединительнотканного рубца.
Регенерация паренхиматозных органов (печень, почки, поджелудочная железа и др.) протекает по типу регенерационной гипертрофии с образованием рубца.
Физиологическая регенерация кости. Происходит в результате размножения остеогенных клеток — остеобластов в периосте и эндоосте. Репаративная регенерация при переломе костей проявляется в форме первичного и вторичного костного сращения.
Первичное костное сращение наблюдается при иммобилизации (неподвижности) и сближении костных обломков. Характеризуется врастанием в область дефекта и кровоподтека остеобластов, фибробластов и капилляров (предварительная соединительнотканная мозоль). Остеобласты синтезируют межклеточное вещество костей — оссеин; образуется остеоидная ткань в виде веретенообразного утолщения беловатого цвета ткани (первичная костная мозоль, или каллюс). Затем с участием фосфатаз образуются микрокристаллы гидрооксиапатита, которые откладываются вдоль мицелл коллагена — оссеина. Кость приобретает твердость (костная мозоль) и окончательно моделируется в связи с функциональной нагрузкой.
Вторичное костное сращение при переломах часто наблюдается при подвижности костных обломков, повреждениях надкостницы, расстройствах обмена веществ и кровообращения. Протекает медленнее, через стадию образования хрящевой ткани (предварительная костно-хрящевая мозоль), которая в дальнейшем подвергается оссификации.
При патологической регенерации кости происходит избыточное и неправильное новообразование костной ткани, что приводит к деформации кости, появлению костных выростов (остеофитов и экзостозов), преимущественному образованию волокнистой и хрящевой тканей в связи с недостаточной дифференциацией костной ткани. В таких случаях при подвижности костных обломков окружающая ткань приобретает вид связок, формируется ложный сустав.
Регенерация мышц. Регенерация скелетных мышц бывает как физиологической, так и репаративной, полной и неполной. Полная репаративная регенерация мышечной ткани происходит после болезней, связанных с развитием атрофических, дистрофических и некротических процессов, при сохранении сарколеммы. Камбиальные клеточные элементы — миобласты, находящиеся под сарколеммой, по мере распада и рассасывания поврежденной саркоплазмы размножаются и формируют многоядерный симпласт, в котором синтезируются миофибриллы и дифференцируются поперечно-полосатые мышечные волокна. При нарушении целостности мышечного волокна вновь образованные многоядерные симпласты в виде мышечных почек растут навстречу друг другу и при благоприятных условиях (небольшой дефект, отсутствие рубцовой ткани) восстанавливают целостность мышечного волокна. Заполнение места дефекта измельченной мышцей способствует полному восстановлению мышечных волокон. Однако в большинстве случаев при больших травмах и нарушении целостности мышечных волокон место травмы заполняется грануляционной тканью, образуется соединительнотканный рубец, соединяющий вновь образованные многоядерные колбообразные выбухания (мышечные почки) разорванных мышечных волокон.
Полная регенерация гладкой мышечной ткани происходит путем деления миобластов и миофибробластов. Большие повреждения гладких мышц восстанавливаются по типу регенерационной гипертрофии с замещением дефекта рубцовой тканью.
Регенерация нервной ткани. Ганглиозные клетки головного и спинного мозгав течение жизни интенсивно обновляются на молекулярном и субклекточном уровнях, но не размножаются. При разрушении их происходит внутриклеточная регенерация (гиперплазия) органелл оставшихся клеток. Погибшие клетки и небольшие дефекты головного и спинного мозга, вегетативных ганглиев замещаются размножающимися клетками нейро-глии и соединительной ткани с образованием глиальных узелков и рубцов.
Периферические нервы полностью регенерируют при условии сохранения связи центрального отрезка нервного волокна с нейроном и незначительного расхождения перерезанных концов нерва. При этом периферический отрезок нервного волокна подвергается распаду, у центрального отрезка гибель осевого цилиндра происходит только до первых перехватов Ранвье. Сохранившиеся клетки швановской оболочки (леммоциты) поврежденного нервного волокна путем почкования образуют трубочку или футляр (бюнгнеровский тяж), в который врастают осевые цилиндры из центрального отрезка волокна, и восстанавливают нервные окончания. При нарушении регенерации нервов образуются нервная культя и соединительнотканный рубец.
Гипертрофия органов. Это увеличение массы органа или ткани за счет преимущественного увеличения объема клеточных и тканевых элементов (например, кардиомиоцитов или нейронов) под влиянием повышенной функциональной деятельности. При гипертрофии, по существу, наблюдается внутриклеточная гиперплазия органелл.
Увеличение органа вследствие избыточного размножения клеток называется гиперплазией.
Различают истинную гипертрофию органа, при которой увеличивается масса (объем) в основном паренхиматозных элементов, и ложную, когда увеличение органа связано с избыточным разрастанием рыхлой соединительной и жировой тканей, а паренхиматозные элементы, наоборот, уменьшены в объеме, с признаками атрофии. Функциональные возможности таких органов значительно снижены.
Гармоничное увеличение паренхиматозных элементов и стромы органа под влиянием повышенной функциональной деятельности называется физиологической гипертрофией, например гипертрофия сердца и скелетной мускулатуры у спортивных животных, гипертрофия матки и молочной железы у беременных и лактирующих животных и т. д.
Гипертрофия органа или какой-либо его части, возникающая под воздействием патологических факторов, определяется как патологическая (например, гипертрофия миокарда при пороках клапанного аппарата). По происхождению патологическая гипертрофия бывает нескольких видов: рабочая, викарная (заместительная), гормональная, вакатная, а также в виде гипертрофических разрастаний. Во всех случаях патологическая гипертрофия характеризуется воздействием на орган необычных или чрезмерных по своей силе факторов. При этом гипертрофический процесс в органе носит неравномерный характер в зависимости от вида и степени патологического воздействия, с которым этот процесс непосредственно связан (например, в зависимости от вида порока развивается гипертрофия миокарда соответствующего отдела сердца).
Гипертрофия миокарда развивается при повышенной нагрузке на сердце (рабочая гипертрофия) в связи с нарушенным оттоком крови, например при пороке клапанов, изменениях аорты и легочной артерии, эмфиземе и других болезнях легких, нефритах и т. д. Чаще наблюдается гипертрофия мышцы левого желудочка (при недостаточности двухстворчатого клапана или полулунных клапанов аорты), реже — правого или обоих вместе. При комбинированных пороках наблюдается общая гипертрофия миокарда.
Гипертрофия миокарда микроскопически характеризуется увеличением толщины мышечных волокон, ярко выраженной поперечной исчерченностью их, гиперплазией органелл, особенно саркосом. Строма органа умеренно развита.
Макроскопически сердце увеличено в объеме в целом или утолщены только стенки его отдельных камер. Поверхность разреза миокарда интенсивного красно-коричневого цвета, пучки мышечных волокон утолщены, с четким волокнистым рисунком, резко выступают увеличенные в объеме капиллярные мышцы и утолщенные трабекул ы.
Гипертрофия матки при беременности и молочной железы. В матке при беременности значительно утолщены слизистая оболочка и мышечные слои (мышечные волокна). Гипертрофированная молочная железа лактирующих животных имеет большую массу (до 75 кг), гиперплазию железистых клеток и долек, умеренно развитую строму.
Контрольные вопросы. 1. Что такое регенерация? 2. Какая существует классификация регенерации и гипертрофии? 3. По каким признакам отличаются физиологическая репаративная и патологическая регенерации? 4. Как построена грануляционная ткань? 5. Как регенерирует соединительная ткань? 6. Как происходит регенерация костной ткани? 7. Как восстанавливается эпителиальная ткань? 8. Как регенерируют мышечная и нервная ткани? 9. Как идет заживление ран по первичному вторичному натяжениям и под стропом? 10. Что такое гипертрофия и гиперплазия? П. Каковы основные признаки гипертрофии и гиперплазии? 12. Каково значение регенерации и гипертрофии для организма?
Читайте также:

