Гипербарическая оксигенация при онкологии

Кислород под давлением помогает после радиотерапии
В Израиле для лечения онкологических больных все чаще используют ГБО.
Там идет речь об устранении побочных явлений, вызванных лучевой терапией. В первом случае лечение методом ГБО получила 53-летняя пациентка, которая страдала от онкологии. До этого ей удалили опухоль на шее, а затем сделали радиотерапию. Однако и здоровые ткани в результате были сильно повреждены.
Похожая история случилась с 72-летним мужчиной – с той лишь разницей, что он прошел лечение по поводу опухоли простаты. Нежелательным эффектом лучевой терапии стали проблемы с мочевым пузырем и кишечником.
После барокамеры состояние обоих существенно улучшилось, тому свидетельства –рентгеновские снимки и слова самих больных. Лечебный курс ГБО состоял из 60 сеансов и длился 3 месяца. По словам авторов публикации, подобная процедура не причиняет боли и при этом дает ощутимую пользу.
В этой связи нужно сказать, что хотя медицинские технологии развиваются, методы терапии рака не являются совершенными. Согласно данным статистики, до 15% больных жалуются на побочное действие радиационного лечения.
Идеи русского ученого развивают в Израиле
– В Израиле данная методика применяется давно, а сейчас она вошла в стандарты комплексного лечения онкологии, то есть оплачивается страховкой. Более того, врачи обязаны информировать пациентов, страдающих осложнениями радиотерапии опухолей, о необходимости использования ГБО.
Он добавил, что подобные работы проводятся в русле открытий, сделанных в нашей стране. У истоков создания метода лечения с помощью кислорода под давлением стоял ученый, генерал-майор медицинской службы И.А. Сапов. В 1970-х годах в СССР начались испытания этого метода – в том числе с помощью ГБО попробовали лечить онкологию. Сегодня его применяют при комплексной терапии рака в России, Израиле, США, Китае и Польше.
Почему гипербарическая оксигенация полезна при онкологии
Положительный эффект применения барокамеры вызван рядом факторов. Во-первых, кислород под повышенным давлением усиливает антиоксидантную защиту в здоровых клетках и снижает ее в опухолевых. В связи с этим больные перед проведением каждого сеанса лучевой терапии могут проходить сеансы ГБО. Это и способствует снижению количества осложнений.
Во-вторых, при проведении сеансов ГБО больше кислорода поступает в пораженные радиацией участки организма, а это уменьшает воспаление и ускоряет регенерацию тканей.
Третий фактор – микроциркуляторный, то есть применение барокамеры положительно воздействует на капилляры, количество которых увеличивается за счет плазматических капилляров, ускоряя восстановление поврежденных клеток.
Кроме того, проведение сеансов ГБО у онкобольных оказывает положительное воздействие на отдельные органы и системы за счет дезинтоксикационного, биоэнергетического, биосинтетического, метаболического, фармакологического, иммунокоррегирующего и других клинико-физиологических эффектов.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Предисловие к русскому переводу
В повседневной клинической практике нередко встречаются пациенты, которым показано лечение ГБО и имеющие в анамнезе или даже текущей истории болезни те или иные аспекты онкологии (в прошлом опухоль удалена или излечена консервативно, есть доброкачественные новообразования и т.д.). Профильные специалисты, и даже многие барологи, в подобных ситуациях однозначно возражают против включения ГБО в комплексную терапию. Но в настоящее время на высоком уровне доказательности установлено, что ГБО может помочь спасти конечность от ампутации, вернуть слух при острой нейросенсорной тугоухости, уменьшить койко-день при ожогах, помочь в заживлении проблемных ран и при многих других состояниях (всего Обществом Гипербарической и Подводной Медицины США одобрено 14 групп показаний). Насколько обоснованно мы лишаем специфической, не имеющей альтернативы терапии больных, в ней нуждающихся? В личном общении с профильными специалистами – высококлассными профессионалами в своих разделах медицины, можно услышать в основном причину, построенную на личном представлении о механизме действия гипербарического кислорода: заживляет раны – значит стимулирует рост клеток. И конечно же раковых. Однако в отечественной литературе последних лет нет данных о серьёзных исследованиях в этом направлении. Между тем за рубежом есть не только ряд таких исследований, но и обзоры, подробно суммирующие их результаты, в основном не совпадающие с устоявшимися в нашей стране представлениями. Перевод одного из этих обзоров представляется вниманию читателя.
Митрохин Андрей Анатольевич, к.м.н., заведующий отделением ГБО ГКБ им. С.П.Боткина, доцент кафедры анестезиологии и неотложной медицины РМАПО. E-mail: aadoctor@mail.ru
Резюме.
Гипоксия является важным свойством солидных опухолей, затрагивающим усиление жизнеспособности клеток, ангиогенез, гликолитический метаболизм и метастазирование. Более века лечение гипербарической оксигенацией (ГБО) применяли для облегчения или излечения заболеваний связанных с гипоксией и ишемией за счет увеличения количества кислорода, растворенного в плазме и, таким образом, повышения доставки О2 к тканям. Исследования ГБО и рака до недавнего времени были сфокусированы на вопросе, действует ли повышенное содержание кислорода как стимулятор рака или нет. Поскольку кислород считается необходимым для всех основных процессов заживления ран, высказывались опасения, что эффект ГБО будет применим так же и к раковой ткани и будет усиливать ее рост. Более того, некоторые авторы опасались, что применение ГБО пациентам, получавшим лечение от рака, может привести к его рецидиву. Однако в двух системных обзорах, посвященных ГБО и раку, авторы пришли к заключению, что применение ГБО пациентам со злокачественными опухолями безопасно. С целью развития предшествовавших обзоров, мы суммировали работы, выполненные по теме ГБО и рак за период с 2004 по 2012. Исходя из результатов как предлагаемого, так и предыдущих обзоров, можно говорить о том, что нет данных, указывающих на стимуляцию роста опухоли или ее рецидивирования под действием ГБО. С другой стороны, есть данные за то, что применение ГБО может оказывать ингибирующее влияние на некоторые подтипы опухолей. Мы настоятельно полагаем, что нам необходимо расширять знания об эффектах и механизмах, сопровождающих оксигенацию опухоли.
1. Al-Waili N.S., Betler G., Beale J., et al. Hyperbaric oxygen and malignancies: a potential role in radiotherapy, chemotherapy, tumor surgery and phototherapy. // MedSciMonit. 2005. V. 11. P. RA279–RA289.
2. Bennett M.H., Feldmeier J., Smee R., Milross C. Hyperbaric oxygenation for tumour sensitisation to radiotherapy. // Cochrane Database Syst. 2012. Rev. 4. P. CD005007.
3. Beppu T, Tanaka K, Kohshi K. Hyperbaric oxygenation for treatment of glioma. // Gan To Kagaku Ryoho. 2011. V. 38. P. 933–936.
4. Beppu T., Kamada K., Yoshida Y., et al. Change of oxygen pressure in glioblastoma tissue under various conditions. // J Neurooncol V. 58. P. 47–52.
5. Boyle P., Levin B. (eds) World cancer report. IARC, Lyon.
6. Brizel D.M., Lin S., Johnson J.L., et al. The mechanisms by which hyperbaric oxygen and carbogen improve tumor oxygenation. // Br J Cancer. 1995. V. 72. P. 1120–1124.
7. Cannito S., Novo E., Compagnone A., et al. Redox mechanisms switch on hypoxia-dependent epithelial-mesenchymal transition in cancer cells. Carcinogenesis. 2008. V. 29. P. 2267–2278.
8. Chen Q., Huang Z., Chen H., et al. Improvement of tumor response by manipulation of tumor oxygenation during photodynamic therapy. Photochem Photobiol 76:197–203.
9. Chen Y.C., Chen S.Y., Ho P.S., et al. Apoptosis of T-leukemia and B-myeloma cancer cells induced by hyperbaric oxygen increased phosphorylation of p38 MAPK. Leuk. 2007. Res 31. P. 805–815.
10. Chong K.T., Hampson N.B., Bostwick D.G., et al. Hyperbaric oxygen does not accelerate latent in vivo prostate cancer: implications for the treatment of radiation-induced haemorrhagic cystitis. // BJU Int. 2004. V. 94. P. 1275–1278.
11. Daruwalla J., Christophi C. Hyperbaric oxygen therapy for malignancy: a review. // World J Surg . 2006а V. 30. P. 2112–2131.
12. Daruwalla J., Christophi C. The effect of hyperbaric oxygentherapy on tumour growth in a mouse model of colorectal cancer liver metastases. // Eur J Cancer. 2006б. V. 42. P. 3304–3311.
13. Daruwalla J., Greish K., Nikfarjam M., et al. Evaluation of the effect of SMApirarubicin micelles on colorectal cancer liver metastases and of hyperbaric oxygen in CBA mice. // J Drug Target. 2007. V. 15. P. 487–495.
14. de Bock K., Mazzone M., Carmeliet P. Antiangiogenic therapy, hypoxia, and metastasis: risky liaisons, or not? // Nat Rev Clin Oncol. 2011. V. 8. P, 393–404.
15. Dische S., Senanayake F. Radiotherapy using hyperbaric oxygen in the palliation of carcinoma of colon and rectum. // Clin Radiol. 1972. V. 23. P. 512–518.
16. Dong G.C., Hu S.X., Zhao G.Y., et al. Experimental study on cytotoxic effects of hyperbaric oxygen and photodynamic therapy onmouse transplanted tumor. // Chin Med J (Engl). 1987. V. 100. P.697–702.
17. Feldmeier J., Carl U., Hartmann K., Sminia P. Hyperbaric oxygen: does it promote growth or recurrence of malignancy? //Undersea Hyperb Med. 2003 V. 30. P. 1–18.
18. Feldmeier J.J., Heimbach R.D., Davolt D.A., et al. Does hyperbaric oxygen have a cancercausing or -promoting effect? A review of the pertinent literature. // Undersea Hyperb Med. 1994 V. 21. P. 467–475.
19. Ferguson S.D. Malignant gliomas: diagnosis and treatment. // Dis Mon. 2011. V. 57. P. 558–569.
20. Gill A.L., Bell C.N.A. Hyperbaric oxygen: its uses, mechanisms of action and outcomes. // QJM. 2004. V 97. P. 385–395.
21. Godman C.A., Joshi R., Giardina C., et al. Hyperbaric oxygen treatment induces antioxidant gene expression. // Ann N Y Acad Sci. 2010. V. 1197. P. 178–183.
22. Gore A., Muralidhar M., Espey M.G., et al. Hyperoxia sensing: from molecular mechanisms to significance in disease. // J Immunotoxicol. 2010. V. 7. P. 239–254.
23. Granowitz E.V., Tonomura N., Benson R.M., et. al. Hyperbaric oxygen inhibits benign and malignant human mammary epithelial cell proliferation. // Anticancer Res. 2005. V. 25. P. 3833–3842.
24. Gray L.H., Conger A.D., Ebert M., Hornsey S., Scott O.C. The concentration of oxygen dissolved in tissues at the time of irradiationas a factor in radiotherapy. // Br J Radiol. 1953. V. 26. P.638–648.
25. Haroon A.T., Patel M., Al-Mehdi A.B. Lung metastatic load limitation with hyperbaric oxygen. // Undersea Hyperb Med. 2007. V. 34. P.83–90.
26. Harris A.L. Hypoxia—a key regulatory factor in tumor growth. // Nat Rev Cancer. 2002. V. 2: P. 38–47.
27. Heys S.D., Smith I.C., Ross J.A., et al. A pilot study with long term follow up of hyperbaric oxygen pretreatment in patients with locally advanced breast cancer undergoing neoadjuvant chemotherapy. // Undersea Hyperb Med. 2006. V. 33. P.33–43.
28. Hjelde A., Gederaas O.A., Krokan H.E., Brubakk A.O. Lack of effect of hyperoxia on photodynamic therapy and lipid peroxidation in three different cancer cell lines. // Med SciMonit. 2005. V. 11. P. BR351–BR356.
29. Holmquist L., Lofstedt T., Pahlman S. Effect of hypoxia on the tumor phenotype: the neuroblastoma and breast cancer models. // Adv Exp Med Biol. 2006. V.587. P. 179–193
30. Hopf H.W., Rollins M.D. Wounds: an overview of the role of oxygen. // Antioxid Redox Signal. // V. 9. P. 1183–1192.
31. Jevne C., Moen I., Salvesen G., et al. A reduction in the interstitial fluid pressure per se, does not enhance the uptake of the small molecule weight compound 5-fluorouracilinto 4T1 mammary tumours. // Drug Ther Stud. 2011. V. 1. P. 10–14.
32. Jirsa M. Jr, Pouckova P., Dolezal J., et al. Hyperbaric oxygen and photodynamic therapy in tumour-bearing nude mice. // Eur J Cancer 27:109.
33. Johnson R., Lauchlan S.C. Epidermoid carcinoma of the cervix treated by 60Co therapy and hyperbaric oxygen. In: Proceedings Int Cong of Hyperb Med. 1966. P. 648–652.
34. Johnson R.J., Wiseman N., Lauchlan S.C. The effect of hyperbaric oxygen on tumour metastases in mice. // Clin Radiol. 1971. V 22. P. 538–540.
35. Johnson RE, Kagan AR, Bryant TL Hyperbaric oxygen effect on experimental tumor growth. Radiology 88:775–777.
36. Kalns J.E, Krock L., Piepmeier E. Jr. The effect of hyperbaric oxygen on growth and chemosensitivity of metastatic prostate cancer. // Anticancer Res. 1998. V 18. P. 363–367.
37. Kalns J.E., Piepmeier E.H. Exposure to hyperbaric oxygen induces cell cycle perturbation in prostate cancer cells. In Vitro Cell Dev Biol Anim 35:98–101.
38. Kawasoe Y., Yokouchi M., Ueno Y., et al. Hyperbaric oxygen as a chemotherapy adjuvant in the treatment of osteosarcoma. // Oncol Rep 22:1045–1050.
39. Kindwall E. Hyperb medicine practice, 2nd edn. Best,Flagstaff.
40. Kinoshita Y., Kohshi K., Kunugita N. et al. Preservation of tumor oxygen after hyperbaric oxygenation monitored by magnetic resonance imaging. // Br J Cancer. 2000. V. 82/ P. 88–92.
41. Kluft O. Hyperbaric oxygen in experimental cancer in mice. Universiteit van Amsterdam, Amsterdam.
42. Kohshi K, Kinoshita Y, Imada H., et al. Effects of radiotherapy after hyperbaric oxygenation on malignant gliomas. // Br J Cancer. 1999. V. 80. P. 236–241.
43. Kohshi K., Yamamoto H., Nakahara A., et al. Fractionated stereotactic radiotherapy using gamma unit after hyperbaric oxygenation on recurrent high-grade gliomas. // J Neurooncol. 2007. V. 82. P. 297–303.
44. Maier A., Anegg U., Fell B., et al. Hyperbaric oxygen and photodynamic therapy in the treatment of advanced carcinoma of the cardia and the esophagus. // Lasers Surg Med. 2000а. V. 26. P. 308–315.
45. Maier A., Tomaselli F., Anegg U., et al. Combined photodynamic therapy and hyperbaric oxygenation in carcinoma of the esophagus and the esophago-gastric junction. // Eur J Cardiothorac Surg 2000б. V. 18. P.649–654, discussion 654–645.
46. Mayer R., Hamilton-Farrell M.R., van der Kleij A.J., et al. Hyperbaric oxygen and radiotherapy. // Strahlenther Onkol. 2005 V. 181. P. 113–123.
47. McCredie J.A., Inch W.R., Kruuv J., Watson T.A. Effects of hyperbaric oxygen on growth and metastases of the C3HBA tumor in the mouse. // Cancer. 1966. V. 19. P. 1537–1542.
48. Michieli P. Hypoxia, angiogenesis and cancer therapy: to breathe or not to breathe? // Cell Cycle. 2009. V.8. P.3291–3296.
49. Moen I., Jevne C., Wang J., et al. Gene expression in tumor cells and stroma in dsRed 4T1 tumors in eGFP-expressing mice with and without enhanced oxygenation. // BMC Cancer 12:21.
50. Moen I., Oyan A.M., Kalland K.H., et al. Hyperoxic treatment inducesmesenchymal-to-epithelial transition in a rat adenocarcinoma model. // PLoS. 2009а. One 4. P. e6381.
51. Moen I., Tronstad K.J., Kolmannskog O., et al. Hyperoxia increases the uptake of 5-fluorouracil in mammary tumors independently of changes in interstitial fluid pressure and tumor stroma. // BMC Cancer. 2009б. V. 9. P. 446.
55. Ogawa K, Yoshii Y, Inoue O., et al. Phase II trial of radiotherapy after hyperbaric oxygenation with chemotherapy for high-grade gliomas. Brit J of Cancer. 2006. V. 95. P. 862–868.
56. Ohgami Y., Elstad C.A., Chung E., et al. Effect of hyperbaric oxygen on the anticancer effect of artemisinin on molt-4 human leukemia cells. / Anticancer Res. 2010. V. 30. P. 4467–4470.
57. Ohguri T., Imada H., Narisada H., et al. Systemic chemotherapy using paclitaxel and carboplatin plus regional hyperthermia and hyperbaric oxygen treatment for non-small cell lung cancer with multiple pulmonary metastases: preliminary results. Int J Hyperthermia. 2009. V. 25 P.160–167.
58. Overgaard J. Hypoxic modification of radiotherapy in squamous cell carcinoma of the head and neck—a systematic review and meta-analysis. // Radiother Oncol. 2011. V.100. P. 22–32.
59. Peng Z.R., Zhong W.H., Liu J., Xiao P.T. Effects of the combination of hyperbaric oxygen and 5-fluorouracil on proliferation and metastasis of human nasopharyngeal carcinoma CNE-2Z cells. // Undersea Hyperb Med. 2010. V. 37. P. 141–150.
60. Perou C.M., Sorlie T., Eisen M.B., et al. Molecular portraits of human breast tumours. // Nature. 2000. V. 406. P. 747–752.
61. Raa A., Stansberg C., Steen V.M., et al. Hyperoxia retards growth and induces apoptosis and loss of glands and blood vessels in DMBA-induced rat mammary tumors. // BMC Cancer 7:23.
62. Schonmeyr B.H., Wong A.K., Reid V.J., et al. The effect of hyperbaric oxygen treatment on squamous cell cancer growth and tumor hypoxia. // Ann Plast Surg. 2008. V. 60. P. 81–88.
63. Selvendiran K., Kuppusamy M.L., Ahmed S., et al. Oxygenation inhibits ovarian tumor growth by downregulating STAT3 and cyclin-D1 expressions. // Cancer Biol Ther. 2010. V.10 P. 386–390.
64. Shannon A.M., Bouchier-Hayes D.J., Condron C.M. Tumour hypoxia, chemotherapeutic resistance and hypoxia-related therapies. Cancer Treat Rev 29:297–307.
65. Shewell J., Thompson S.C. The effect of hyperbaric oxygen treatment on pulmonary metastasis in the C3H mouse. // Eur J Cancer. 1980. V. 16. P. 253–259.
66. Shi Y., Lee C.S., Wu J., et al. Effects of hyperbaric oxygen exposure on experimental head and neck tumor growth, oxygenation, and vasculature. // Head Neck. 2005. V. 27. P. 362–369.
67. Sorlie T., Perou C.M., Tibshirani R.H., et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. // Proc Natl Acad Sci U S A. 2001. V. 98. P. 10869–10874.
68. Stuhr L.E., Iversen V.V., Straume O., et al. Hyperbaric oxygen alone or combined with 5-FU attenuates growth of DMBA-induced rat mammary tumors. // Cancer Lett. 2004. V.210 P. 35–40.
69. Stuhr L.E., Raa A., Oyan A.M., et al. Hyperoxia retards growth and induces apoptosis, changes in vascular density and gene expression in transplanted gliomas in nude rats. // J Neurooncol. V. 85. P. 191–202.
70. Suit H.D., Maeda M. Hyperbaric oxygen and radiobiology of a C3H mouse mammary carcinoma. // J Natl Cancer Inst. 1967. V. 39. P. 639–652.
71. Sun T.B., Chen R.L., Hsu Y.H. The effect of hyperbaric oxygen on human oral cancer cells. // Undersea Hyperb Med. 2004. V. 31. P. 251–260.
72. Suzuki Y., Tanaka K., Neghishi D., et al. Increased distribution of carboplatin, an anti-cancer agent, to rat brains with the aid of hyperbaric oxygenation. // Xenobiotica. 2008. V. 38. P. 1471–1475.
73. Suzuki Y., Tanaka K., Negishi D., et al. Pharmacokinetic investigation of increased efficacy against malignant gliomas of carboplatin combined with hyperbaric oxygenation. // Neurol Med Chir (Tokyo). 2009. V. 49. P. 193–197, discussion 197.
74. Tang H., Sun Y., Xu C., et al. Effects of hyperbaric oxygen therapy on tumor growth in murine model of PC-3 prostate cancer cell line. // Urology. 2009. V. 73. P. 205–208. (
75. Tang H., Zhang Z.Y., Ge J.P., et al. Effects of hyperbaric oxygen on tumor growth in the mouse model of LNCaP prostate cancer cell line. // Zhonghua Nan Ke Xue. 2009. V. 15. P. 713–716.
76. Teicher B.A. Hypoxia and drug resistance. // Cancer Metastasis. 1994. Rev. 13. P. 139–168.
77. Thiery J.P. Epithelial–mesenchymal transitions in tumour progression. // Nat Rev Cancer. V. 2. P. 442–454.
78. Thom S.R. Hyperbaric oxygen: its mechanisms and efficacy. // Plas Recon Surg 2011. V. 127. Suppl 1. P. 131S–141S.
79. Tonomura N., Granowitz E.V. Hyperbaric oxygen: a potential new therapy for leukemia? Leuk Res 31:745–746.
80. van Zijl F., Krupitza G., Mikulits W. Initial steps of metastasis: cell invasion and endothelial transmigration. Mutat Res 728:23–34.
81. Vaupel P., Mayer A. Hypoxia in cancer: significance and impact on clinical outcome. Cancer Metastasis. 2007. Rev 26. P. 225–239.
82. Watson A.J., Collins P.D. Colon cancer: a civilization disorder. // Dig Dis. 2011. V. 29. P. 222–228.
83. Wrensch M., Minn Y., Chew T., et al. Epidemiology of primary brain tumors: current concepts and review of the literature. // Neuro Oncol. 2002. V. 4. P. 278–299.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Гипербарическая оксигенация рекомендуется в качестве составной части комплексного подхода к лечению рака.
Доктору Варбургу принадлежит открытие того, что основной причиной возникновения рака в теле является недостаток кислорода, который создает кислотную среду в организме человека. Он также обнаружил, что раковые клетки не дышат кислородом и не могут выжить в присутствии высоких уровней кислорода, которое существует при щелочном состоянии организма.
Именно поэтому при онкологии и многих других дегенеративных заболеваниях рекомендуется приводить организм в щелочное состояние и насыщать его кислородом.
Оптимальный уровень кислорода в теле контролирует и не дает распространяться бактериям, вирусам и раковым клеткам по организму, а также предотвращает накопление токсичных веществ. Кислород стимулирует иммунную систему, а также очищает вены и артерии.
Когда организм лишен достаточного количества кислорода, тело начинает болеть.
Признаки недостатка кислорода включают усталость, слабость, низкий уровень гемоглобина, оседание эритроцитов, анемию и, конечно же, рост раковых клеток.
Нормальным клеткам необходим кислород для дыхания, тогда как раковые клетки метаболизируются в процессе ферментации — анаэробный процесс или тот, который требует очень небольшого количества кислорода.
Раковые клетки не похожи ни на какие другие клетки в организме человека. Способ метаболизма и создания энергии для жизни и размножения у них уникален и опасен. Нормальные клетки любят кислород. Если уровень кислорода в клетке падает, это приводит к кислотной среде, которая способствует росту раковых клеток и образованию опухолей. Поэтому увеличение уровня кислорода на клеточном уровне является ключом к изменению анаэробного процесса.
Давление воздуха внутри гипербарической кислородной камеры примерно в 2,5 раза выше, чем естественное атмосферное давление, что заставляет вашу кровь переносить больше кислорода в органы и ткани вашего тела.
Подача кислорода под повышенным давлением оказывает благотворное влияние на общую оксигенацию тела. Количество кислорода в кровотоке увеличивается и это стимулирует исцеление всего организма, перезапускает иммунную систему, снижает распространение метастазов, грибковые инфекции.
Вы можете спросить, а почему бы просто не подышать свежим воздухом на природе? Это очень важный вопрос. Дело в том, что воздух в нашей атмосфере только на 21% состоит из кислорода (в основном из азота, на 78%). Даже если вы практикуете дыхательные практики на свежем воздухе (что само по себе полезно), этого недостаточно, чтобы достичь глубокого целебного эффекта, который происходит при прохождении гипербарической оксигенации.
В течение многих лет гипербарическая оксигенация использовалась докторами натуропатами для лечения рассеянного склероза, черепно-мозговых травм, а также других состояний, для которых характерна гипоксия тканей. Однако, не так давно выяснилось, что гипербарическая оксигенация также помогает при злокачественных опухолях.
Среди многих онкологов-натуропатов считается, что гипербарическая оксигенация исцеляет все от зараженных ран до радиационных травм (полученных от прохождения лучевой терапии), а многие люди утверждают, что вылечились от рака с помощью этой процедуры.
В традиционном лечении онкологией (посредством химиотерапии, лучевой терапии и операций) такая процедура не используется. Однако в Европе, Америке и других частях света все большее количество больниц закупает это оборудование и предлагает своим пациентам данную процедуру в составе комплексного лечения онкологии. В частных иностранных клиниках такая терапия практикуется уже более 50 лет.
Новые исследования указывают на то, что гипербарическая оксигенация может помочь людям вылечиться от рака.
Несколько исследований, включая японское исследование 2013 года, также указывают на способность гипербарической оксигенации повышать эффективность лучевой терапии для больных раком, которые выбирают этот вид лечения. Кислород поддерживает митохондрии и создает неприятные условия для раковых клеток.
Во время прохождения процедуры пациент помещается в специальную камеру, в которой контролируемо увеличивается давление кислорода. При естественном атмосферном давлении кислород разносится по телу только эритроцитами. При использовании гипербарической оксигенации кислород растворяется во всех жидкостях организма, включая плазму, жидкости центральной нервной системы, лимфу и может переносится в те области тела, где циркуляция снижена или блокируется. Многие поврежденные ткани или злокачественные образования характеризуются низкой подачей кислорода, а гипербарическая оксигенация прокладывает новые внутренние каналы для его подачи.
Повышенное содержание кислорода в крови усиливает способность белых кровяных телец убивать бактерии, уменьшает отечность и позволяет новым кровеносным сосудам быстрее расти в пострадавших тканях.
Гипербарическая оксигенация – это простая, безболезненная и не инвазивная процедура.
Гипербарическая оксигенация используется для лечения различных состояний. Традиционная аллопатическая медицина считает, что перечень болезней, которые можно вылечить гипербарической оксигенацией, значительно меньше, по сравнению с тем перечнем, который лечат этой же процедурой доктора-натуропаты.
Перечень болезней, которые лечат этой процедурой в традиционной медицине, включает: тяжелую анемию, абсцесс мозга, ожоги, артериальную газовую эмболию, декомпрессионную болезнь, отравление угарным газом, травмы с размозжением тканей, внезапную глухоту, гангрену, инфекции кожи и костей, вызывающие гниение тканей, незаживающие раны, такие как диабетическая язва стопы, травмы после прохождения лучевой терапии, внезапные безболезненные потери зрения, кожные трансплантат или лоскут, подверженный риску смерти ткани.
Дополнительный перечень болезней, которые этой процедурой лечат доктора-натуропаты: рак, аутизм, церебральный паралич, болезнь Лайма (боррелиоз), мигрень, рассеянный склероз, последствия для выживших при утоплении, восстановление после пластической хирургии, спортивные травмы, инсульт, травматические травмы головного мозга, альцгеймер и деменцию (улучшает состояние), травмы печени, симптомы фибромиалгии.
Необходимо пройти несколько курсов (продолжительность которого лучше всего обсудить с онкологом-натуропатом) и в последствии периодически делать поддерживающие процедуры.
Эту процедуру можно проходить в качестве превентивной меры против рака.
Процедура абсолютно безопасна, если проводится под наблюдением врача. Побочные эффекты иногда включают в себя временную обратимую баротравму (уши и синус), вызванную изменением давления. Иногда кратковременно появляется близорукость (вызвана временным изменением глазных линз), но быстро восстанавливается.
В Москве гипербарическую оксигенацию можно пройти в Боткинской больнице и в НИИ скорой помощи им. Н.В. Склифасовского.

Лечение коронавирусной пневмонии в барокамерах может существенно снизить смертность среди пациентов с тяжелой формой заболевания. К такому выводу пришли ученые из США. Они описали состояние пяти больных, которые экспериментально получали гипербарическую кислородную терапию. Всем им грозила интубация легких на ИВЛ. Однако после нескольких процедур в барокамере все пациенты выздоровели, обойдясь без искусственной вентиляции. В России эту методику в порядке эксперимента применяют уже несколько месяцев. Отечественные специалисты утверждают, что данная процедура эффективна и может быть применена даже для пожилых людей. Однако важно продолжать начавшиеся в России и других странах клинические испытания подобной терапии, чтобы сделать окончательные выводы о её безопасности.
Разумная альтернатива
%204.jpg)
Ученые из больницы Общей системы здравоохранения в Опелузах (Opelousas General Health System) оценили эффективность гиперборической кислородной терапии при тяжелых формах коронавирусной инфекции. Они опубликовали статью о применении гипербарической оксигенации (ГБО) — методе насыщения биологических тканей человека кислородом под высоким давлением в специальных барокамерах. Медики изучили состояние COVID-положительных пациентов, госпитализированных в период между 13 и 20 апреля. У пяти человек была диагностирована тяжелая форма заболевания, им была показана интубация легких на ИВЛ.
Пациент Анна Ивакина, переболевшая коронавирусной инфекцией COVID-19, в кабинете Медицинского биофизического центра имени А. И. Бурназяна перед прохождением лечебного сеанса в барокамере
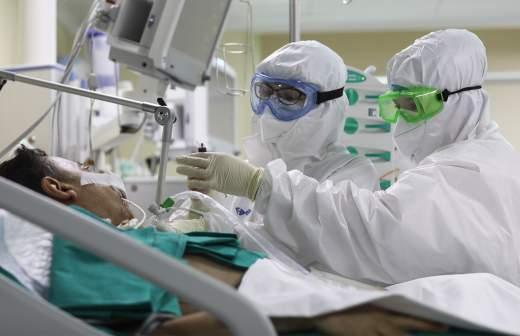
— ГБО является недооцененным методом, хотя он способен давать совершенно изумительные результаты. Следовало бы шире внедрять его в клиническую практику, — отметил эксперт.
Терапия с историей
Пациент Николай Ивакин, переболевший коронавирусной инфекцией COVID-19, проходит лечебный сеанс в барокамере в Медицинском биофизическом центре имени А. И. Бурназяна

В случае с коронавириусной инфекцией ГБО начали применять совсем недавно. Телеканал РЕН ТВ одним из первых сообщал, что лечение больных COVID-19 в барокамерах опробовали врачи Федерального медико-биологического центра имени Бурназяна ФМБА России. И оно показало свою эффективность. Преимущество терапии в барокамерах в том, что она может применяться даже для пациентов пожилого возраста. ГБО поможет данной группе больных избежать интубации и повышения риска смерти, подчеркнула Елена Белова.
Клиническая практика
В России методику гиперборической оксигенации также применяют в экспериментальном режиме. Ранее о деталях лечения в СМИ рассказали представители НИИ имени Склифосовского. По словам медиков, в комплексе с другими терапевтическими методиками пациентам с COVID-19 необходимо 4–5 сеансов, каждый из которых длится 50–60 минут и проводится раз в сутки. Причем улучшения заметны уже после первой процедуры.
— Эта технология, безусловно, является эффективной в лечении ряда заболеваний, — пояснил эксперт. — Однако между кессонной болезнью и коронавирусом существуют весьма ощутимые различия.
По мнению специалиста, медицинское сообщество сейчас по-разному подходит к применению гипербарической оксигенации. Также есть разночтения относительно противопоказаний. К примеру, на странице отделения гипербарической оксигенации ГБУЗ ДГКБ имени Н.Ф. Филатова указано, что помимо эпилепсии и клаустрофобии, противопоказаниями к процедуре являются повышенная температура и заболевания легких, среди которых указана в том числе и пневмония.
Ученые из США в своей статье также подчеркивают, что пока получены только первые результаты использования методики при лечении нового коронавируса. Клинические исследования в этом направлении необходимо продолжать.
Читайте также:


