Генетический анализ на рак предстательной железы
Цена исследования 35 000 руб.
Срок выполнения
35 раб.дн.
Записаться на исследование
+7 (495) 150-66-47
Исследуем: 20 генов
Для кого это исследование
Назначение этой панели исследований показано следующим группам обследуемых:
Здоровым людям с имеющимися случаями онкологических заболеваний в семье (например, при наличии трёх и более случаев рака предстательной железы и/или рака молочной железы, толстой кишки, яичников и поджелудочной железы в семье в одной линии);
Здоровым людям без семейного анамнеза онкологических заболеваний исследование может дать важную информацию о генетической предрасположенности к онкологическим поражениям этого органа. Такая вероятность существует, поскольку человек может быть носителем новых мутаций, которых нет у родителей, и кроме того, наследственный рак может наследоваться от здоровых носителей мутаций. При этом в семье может не быть случаев рака, но у данного конкретного пациента будет присутствовать новая комбинация онкогенных мутаций, унаследованных от обоих родителей-носителей, вызывающая рак.
Пациентам с уже диагностированной опухолью предстательной железы в случае подозрения на наследственную природу заболевания, например, в случае относительно раннего возраста начала развития заболевания, в случае онкологически отягощённого семейного анамнеза, при определённых типах опухолей (по данным исследований, у 8-12% пациентов с метастатическим раком предстательной железы выявляются герминальные мутации в генах, ассоциированных с повышенным риском развития этого рака), при наличии нескольких первичных опухолей разной локализации у одного пациента либо билатерального рака предстательной железы.
У этой группы пациентов выявление мутаций позволяет уточнить диагноз и прогноз, а также выбрать правильную стратегию лечения (имеются, в частности, достаточно успешные клинические испытания и кейс-репорты по эффективности олапариба для лечения пациентов с раком предстательной железы с мутациями в генах BRCA1/2 или TM).
Конечная цель исследования – полная информация о мутациях, связанных с наследственными формами рака предстательной железы, интерпретированная специалистом с точки зрения клинической значимости.
Какие гены мы смотрим
Гены, включенные в панель (на основе рекомендаций Национальной онкологической сети США, NCCN):
ABRAXAS1 (FAM175A), ATM, ATR, BRCA1, BRCA2, BRIP1, CHEK2, EPCAM, GEN1, HOXB13, MLH1, MRE11, MSH2, MSH6, NBN, PALB2, PMS2, RAD51C, RAD51D, TP53
Как сдать тест?
Материал для исследования — венозная кровь, взятая в специальную пробирку.
Кровь можно сдать в лаборатории Genetico либо в других лабораториях по месту жительства. Наша отлаженная логистическая служба доставит биоматериал из любой точки России до места проведения исследования в лаборатории Genetico без дополнительных расходов для пациента.
Метод исследования — высокопроизводительное секвенирование ДНК нового поколения (next generation sequencing, NGS). Секвенирование, то есть определение последовательности нуклеотидов ДНК, относится к современным высокоточным методам молекулярного анализа.
Срок выполнения
Мы проводим полное исследование и формируем заключение в течение 35 рабочих дней.
Сроки могут показаться значительными, но это не так. Это самая высокая скорость на рынке для подобных исследований такого объёма, проводимых с использованием технологии NGS.
Указанное время требуется для выполнения многоступенчатого высокотехнологичного исследования, включающего в себя большое количество лабораторных этапов и промежуточного контроля качества. В результате получается большой массив генетических данных, требующих отдельного анализа и интерпретации с помощью методов биоинформатики, на что тоже необходимо время.
Как выглядит заключение
Формат итогового заключения содержит описание результатов исследования и даёт следующую информацию:
- у пациентов с диагностированным раком — список патогенных, вероятно патогенных мутаций и мутаций с неизвестным клиническим значением, их описание и интерпретация с точки зрения клинической значимости.
- у здорового человека — список патогенных и вероятно патогенных мутаций, их описание и интерпретация с точки зрения клинического потенциала. Мутации с неизвестным клиническим значением в заключение не выносятся в связи с серьёзными сложностями их дальнейшей клинической интерпретации у здорового человека и низкой информативностью для дальнейших диагностических мероприятий.
Заключение отправляется заказчику по электронной почте. Если есть необходимость получить заключение в бумажном варианте, мы отправим его в любой регион почтой России без дополнительных расходов для заказчика.
Что делать, если мутации выявлены?
После выполнения исследования, анализа данных и оформления заключения вы получите информацию о наличии мутаций, ассоциированных с наследственными формами рака предстательной железы и наследственными опухолевыми синдромами, ассоциированными с повышенным риском развития этого типа рака. В случае обнаружения мутаций возможны следующие варианты дальнейших действий:
- обсуждение выявленных мутаций с врачом-генетиком с целью клинической интерпретации полученных результатов;
- обсуждение с врачом-онкологом плана профилактических (например, скрининг на предмет рака предстательной железы начиная с 45 лет) и превентивных мероприятий у здорового человека;
- обследование ближайших кровных родственников на наличие мутаций для выявления носительства методом секвенирования по Сэнгеру;
обсуждение с врачом-генетиком возможностей планирования беременности для рождения здорового потомства (пренатальная диагностика, ПГД) у пациентов детородного возраста;
уточнение диагноза и прогноза у пациентов с диагностированным раком;
выбор стратегии и тактики лечения у пациентов с диагностированным раком, в том числе обсуждение возможности назначения таргетной терапии.
При этом в случае выявления мутаций у здорового человека появится возможность ранней диагностики развития опухолевого процесса, обусловленного наличием единичной мутации или парных мутаций, а у пациента с диагностированным раком в случае выявления мутаций может быть больше возможностей для выработки алгоритма эффективного лечения.
Стоимость исследования
Нам удалось достичь минимальной цены для исследования такого уровня и такого охвата. Стоимость панели составляет 35 000 рублей. При этом все возможные логистические издержки (доставку биоматериала из других городов, отправку заключений) мы берём на себя без дополнительных затрат со стороны обследуемого. Выгрузка сырых данных в указанную стоимость не входит.
Рекомендации
Это максимально полная панель в России, охватывающая наибольшее количество генов (всего – 207), мутации в которых наблюдаются при различных наследуемых злокачественных опухолях.
Во множестве публикаций, посвященных раку предстательной железы, заметное место отводится исследованиям на уровне генного аппарата. Результаты публикаций последних лет проливают свет на многие аспекты регуляции клеточного роста и ее зависимости от генной экспрессии, а также на выяснение молекулярных механизмов превращения нормальной клетки в опухолевую. В резолюции 2-го съезда онкологов стран СНГ (Киев, 2000) подчеркивалась настоятельная необходимость идентификации генов и их продуктов, которые могут служить маркерами опухолевого роста и молекулярными мишенями при разработке высокоспецифических лечебных средств нового поколения.
Предстательная железа, как в возрастном аспекте, так и в условиях развивающихся предопухолевых и злокачественных процессов представляет идеальную модель для изучения молекулярно-генетических профилей. Молекулярная онкология играет все возрастающую роль, и уже сделаны открытия, касающиеся главных механизмов, лежащих в основе развития и прогрессирования рака простаты. Понимание этих механизмов дало возможность выявить факторы, определяющие вероятность метастазирования опухоли. К ним относится и потеря функции E-cadherin, что может помочь клиницистам выбрать наиболее оптимальную, индивидуально обоснованную стратегию лечения.
Процессы локальной инвазии и метастазирования могут возникать в результате нарушения нормальной клеточно-клеточной и клеточно-материнской адгезии, которая обусловлена молекулами клеточной адгезии. Среди них идентифицирован Е-cadherin, выполняющий роль супрессора опухолевой инвазии и метастазирования. E-cadherin является ключевым медиатором клеточно-клеточной адгезии, которая осуществляется путем его взаимодействия с группой субмембранных белков при участии катенинов (а, В и у-катенины), которые служат для закрепления E-cadherin на микроволокнах клеточного скелета.
Уровень содержания E-cadherin соответствует инвазивным и метастатическим свойствам опухолей. Уменьшение уровня E-cadherin может приводить к уменьшению клеточной адгезивности и, соответственно, потенциальной инвазивности раковых клеток. По-видимому, молекулы клеточной адгезии действуют как ключевые ингибиторы клеточной подвижности, тканевой целостности и поддержания дифференциации. Следовательно, потеря экспрессии E-cadherin ассоциируется с плохим клиническим прогнозом и является лимитирующим уровнем в прогрессировании этой болезни.
H.H.Schlechte et al. (2000) подтверждают, что одним из ключевых медиаторов, действующих как опухолевый супрессор в отношении прогрессии рака простаты, является E-cadherin (катениновый комплекс), поскольку те клеточные линии, которые обладают полным набором компонентов этого комплекса, имеют низкий инвазивный потенциал.
В начальной стадии развития рака предстательной железы генетические исследования позволяют определить те вещества, которые направленно действуют на активирование запрограммированной смерти клеток, ингибицию сигнальной трансдукции (передача активирующего сигнала от клетки к клетке), устранение теломеразной активности, а также, как указывалось ранее, использование дифференцированной терапии. Следовательно, одной из наиболее актуальных клинических проблем урологической онкологии является точное определение биологической агрессивности индивидуального злокачественного процесса. Наиболее перспективны исследования по определению различий в экспрессии генов между раковыми клетками и нормальными эпителиальными клетками простаты.

Рис. 20. Мутация опухольсупрессорного гена р53 ведет к утрате контролирующего механизма и поддерживает ненормальный клеточный рост
Нормальная функция белка р53 включает регулирование критических клеточных реакций, вовлекающих G1 и G2-стадии клеточного цикла в реакции поражения ДНК и апоптоза, вызванного некоторыми стимулами типа ДНК-разрушающих средств и гипоксии (L. Н. Hartwell, М. D. Kastan, 1994; Н. Hermeking, С. Lengauer, К. Polvak et al., 1997).

Рис. 21. Справа — выраженная экспрессия гена р53 при раке простаты (иммуногистохимия)
V.Srikantan и S.Srivastava (2003) предлагают гипотетическую модель генеза рака предстательной железы. В основу закладываются молекулярные профили, которые ведут к нарушению дифференциации простатических клеток, прогрессии и началу метастазирования. Модель представляется как интерпретация генетических событий, которые включены в генез комплексного фенотипа новообразований простаты (схема 1).

Схема 1. Гипотетическая модель развития рака простаты
Независимо от точного выбора времени мутаций р53 можно предположить, что мутация связана с прогрессией болезни. Большее количество расстройств р53 замечено в нелеченых метастатических опухолях, чем в нелеченом первичном раке простаты.
Инвазивный, вышедший за пределы органа рак простаты, представлен генетическими событиями, которые наблюдаются при ПИН высокой градации. Весьма вероятно, что они являются предшественниками или дозлокачественными изменениями (клетками) в простате, которые еще не обнаружены, они новые или уникальные, специфические для рака альтерации (рис.22).

Рис. 22. Молекулярные и клеточные изменения в процессе развития рака предстательной железы (по Rinker-Schaeffer et al., 1994, с изменениями)
Альтерации р53, bcl-2-генов обнаруживаются как при локальном раке простаты, и более часто — при прогрессирующих формах. Напрашивается логический вывод: идентификация генов должна проводиться на участке хромосомы, наиболее часто повреждаемой при раке. Опухолевые супрессорные гены создают уязвимые места для критического повреждения ДНК. Центральную роль в контроле клеточной пролиферации, дифференцировании и апоптозе играет протоонкоген с myc, локализованный на хромосоме 8q24.
K.Sato et al. (1999) описывают при локально-прогрессирующем раке простаты (pT3N0M0) определенную корреляцию между myc-амплификацией и частотой рецидивирования, а также послеоперационной выживаемостью после радикальной простатэктомии. Низкий уровень выживаемости обнаруживается при одновременной потере короткого плеча хромосомы 8 в области 8р22.
Молекулярные маркеры
На протяжении более четверти века активно ведутся поиски механизмов осуществления составляющего основу живого организма клеточного цикла, который одинаков для простейших растений, животных и человека. Важнейшей стороной этих фундаментальных исследований может быть открытие естественного, генетически детерминированного процесса нормального клеточного цикла, знания которого пролагают пути к пониманию процессов клеточного деления и раковых образований.
Выяснение нескольких принципиальных вопросов составляет приоритет молекулярно-биологических исследований — возмещается ли отмирающий клеточный материал или же он должен вновь воссоздаваться в процессе роста и клеточного деления, участвуя в механизмах последнего? Что детерминирует внешний сигнал к началу клеточного деления?
P.M.Nurse идентифицировал первую циклинзависимую киназу у человека. Она принадлежит к группе активных молекул, разделяющих S-фазу и за счет восстановленного фосфорилирования оказывает в дальнейшем влияние на протеины.
Фосфатнагруженные протеины удваивают число хромосом и благодаря соответствующим химическим модификациям могут регулировать синтез ДНК. Он установил, что эти эссенциальные функции циклинзависимой киназы возможны в условиях эволюционного процесса.
R.T.Hunt выяснил, что если клетка получает сигнал к репродукции и переходит в фазу G1, то в клеточном ядре обнаруживаются циклиновые белки. Во время роста клетки циклином активизируется циклинзависимая киназа. Начинается удвоение хромосомы. К этому моменту циклин снова перестраивается для того, чтобы избежать увеличения наследственной массы в образцах удвоения. Это является важнейшим механизмом заключительного клеточного цикла. Описываемые закономерности клеточного цикла отражены на рис. 23.

Рис. 23. Клеточный цикл
Среди новых маркеров рака предстательной железы заметное место занимает инсулинподобный фактор роста (ИФР-1), который является митогеном для эпителиальных клеток, стимулирующих прогрессию клеточного цикла от G1 до S-стадии.
Каково же значение последних достижений в генетической и молекулярной биологии для распознавания и терапии злокачественных новообразований, в том числе и рака предстательной железы? Упомянутые ранее исследования лауреатов Нобелевской премии 2001 г. являются определяющими для понимания хромосомальных отклонений (аберраций) во вновь генерированных клетках. При недостаточности адекватно функционирующего контроля в клеточном цикле возникает отчетливый беспорядок прежде всего в делении или потере хромосом.
Гены, кодирующие молекулы циклинзависимой киназы или циклин, могут трансформироваться в онкогены или соединяться с опухольсупрессорными генами. Потеря контроля над клеточным циклом ведет к возможному избыточному росту клеток. В опухолях у человека, включающих рак предстательной железы, обнаруживаются большие количества молекул циклинзависимой киназы и циклина. В этом плане перспективным представляется разработка ингибиторов молекул циклинзависимой киназы. Медикаменты должны вмешаться в сошедший с правильного пути клеточный цикл в опухолевых клетках.
В клеточном цикле активно участвуют теломеры — повторные последовательности ДНК в конце хромосом. После каждого цикла теломеры сокращаются, и по достижении критической длины клетка прекращает разделяться. В процесс включается фермент теломераза, которая может воссоздавать теломеры хромосом после разделения клетки и, таким образом, восстанавливать ущерб, который наносится нормальным взрослым соматическим клеткам в течение последовательных митотических циклов.
Вследствие высокой частоты и одновременно медленного роста рак простаты занимает особое место среди всех злокачественных опухолей. Необычность рака простаты как опухоли состоит еще и в том, что его диагностическое и терапевтическое окна очень узкие. Так, с одной стороны, имеющаяся небольшая ограниченная опухоль в предстательной железе клинически ничем себя не проявляет и, следовательно, не оказывает никакого влияния на содержательность и активность жизненной позиции мужчины.
С другой стороны, рак предстательной железы довольно часто диагностируется поздно, когда выбор адекватного вида лечения оказывается затруднительным либо вовсе невозможным. В этой связи следует отметить, что решающим фактором выживаемости пациентов является биологический потенциал опухоли к началу метастазирования. Именно этим обстоятельством можно объяснить интенсивные разработки раннего распознавания с соблюдением принципов достоверности и объективности.
Раковая прогрессия — это комплексный многоступенчатый процесс, который начинается с трансформации нормальных клеток и продолжается с ростом, инвазией и метастазированием опухоли (рис.24). Хотя точные пути, которые собственно приводят к возникновению рака предстательной железы еще остаются не выясненными, революция последнего десятилетия в молекулярной генетике внесла определенную ясность в клеточные основы данного процесса.
Другой кандидатный ген локализуется на Х-хромосоме. Совсем иной ген, чувствительный к раку простаты, был открыт при широком геномном поиске. Механизмы онкогенеза включают активацию онкогенов таких, как cErb-B, классического онкогена, который при активации кодирует мутированную версию рецептора эпидермального фактора роста (EGF). Этот стволовой рецептор теряет экстрацеллюлярный компонент, который в норме связывает EGF. Таким образом, вместо соответствующего ответа на сигнальную молекулу, мутировавший рецептор стимулирует продолжающееся клеточное деление и не контролирует рост по тирозинкиназному сигнальному пути.

Рис. 24. Комплексный многоступенчатый процесс трансформации нормальных клеток предстательной железы в раковые
Наиболее известным и изученным, влияющим на гормональную зависимость рака простаты, является опухолевый ген-супрессор р53, который локализован на хромосоме 17 (17ql3), продукт его считается основным из регуляторов клеточного цикла. Ген достаточно полно охарактеризован благодаря получению его пространственного изображения (рис. 25).
Основной функцией Р53 как супрессора опухоли является то, что он опосредует клеточную реакцию на повреждение ДНК, чем поддерживается стабильность генома. Нормальная функция этого белка состоит в сохранении клетки в фазе покоя, она либо способна перейти в фазу митоза (деления), либо подвергнуться апоптозу. Наличие дефекта гена р53 фактически характерно для всех опухолей человека, независимо от их типа и локализации.

Рис. 25. Опухолевый супрессорный ген р53
Ген р53, подавляющий опухоль, и протоонкоген bcl-2 стоят в ряду самых важных регуляторов роста клеток и апоптоза. Мутации в аллели р53 приводят к продленному полураспаду существования протеина, который затем выявляется при иммуногистохимическом подсчете. В отличие от других злокачественных опухолей, выделение р53 при локальном раке простаты — довольно редкое явление, но соотносится с прогрессированием опухоли, рецидивом и общим прогнозом. То же верно и для bcl-2, выделение которого происходит в 2,3%—26,9% первичных форм рака простаты (L. Bubendorf et al., 1996).
При детальном рассмотрении оказывается, что р53 — это TSG (tumor suppresse gen — опухолевый супрессорный ген), который участвует в регулировании клеточного цикла на стадии G/S (W.N.Linehan, 1992), а также регуляции апоптоза и действует как ингибитор репликации SV40 ДНК путем отделения антигенов Т-клеток (Т. Boulikas, 1997).
Протеин р53 подавляет связывание полимеразы ДНК на фоне повреждения ДНК на стадии контрольной точки G, клеточного цикла, останавливая таким образом репликацию клеток при наличии нестабильности хромосом. Мутация р53 приводит к непрерывной пролиферации клеток, несмотря на повреждение ДНК. результатом чего является распространение клеток с онкогеииым потенциалом. Ненормальное выделение р53 отмечается в 60% клеточных линий рака простаты с агрессивным течением (L. L.Nielson, D.S. Maneval, 1998). Доказано, что мутации р53 представляют собой независимые предвестники рецидива рака простаты после радикальной простатэктомии.
Еще один ген, р21, играет сходную с р53 роль, подавляя репликацию ДНК при сильном повреждении. Он кодирует протеин, что действует как ингибитор циклинзависимой киназы, индукция которой может также играть роль в репликации и восстановлении ДНК. Таким образом, недостаток функционального гена р21 приводит к сохранению клеточного цикла при наличии поврежденной ДНК.
Несколько иные функции выполняет ген bcl-2.
Несомненно, существуют и другие подобные гены. Кроме онкогенов и опухолевых супрессорных генов, канцерогенез также включает потерю клеточно-клеточной адгезии, которая в норме поддерживает тканевую структуру и препятствует миграции клеток. В частности, делении E-cadherin или b-катенина приводит к повышению клеточной подвижности, предрасполагая к формированию метастазов.

Рис. 26. Иммуноокрашивание гена bcl-2: а - нормальная ткань, б - рак предстательной железы. Ген bcl-2 окрашен в коричневатый цвет
Рядом исследований последних лет идентифицированы гены, имеющие экспрессию в клетках только раковой опухоли предстательной железы и отсутствующие в неизмененных клетках эпителия. К этим генам относится ДДЗ/РСА 3. Дифференцированный фенотипический анализ показал наличие мРНК в злокачественной, а не в доброкачественной ткани простаты. Обнаруживается, что экспрессия ДДЗ является специфической для простаты и значительно выражена при ее раковом поражении. Можно с уверенностью утверждать, что клинические исследования определят, имеют ли эти либо другие молекулы диагностический, прогностический и терапевтический потенциалы.
Несколькими годами ранее предполагалось, что наиболее важной защитой против опухоли является собственная система иммунологического наблюдения. Рак, зародившись в эпителиальных клетках предстательной железы, обычно сначала развивается как узелок и сохраняет в себе последующую способность распространяться в региональные лимфоузлы или отдаленные органы, такие, как кости или легкие. При достижении опухолью размеров более 5 мм она начинает индуцировать развитие собственного кровоснабжения — ангиогенеза. Очевидно, что ангиогенез — это критическое событие в генезе как первичной, так и метастатической опухоли.

Злокачественная опухоль простаты — наиболее часто встречающаяся онкопатология у мужчин. Ее появлению могут предшествовать простатит, гормональные сбои, аденома простаты и прочие доброкачественные изменения. Рак предстательной железы чаще всего возникает у пациентов с предраковыми состояниями, к которым относят атипичный аденоз (атипичная гиперплазия простаты) и гиперплазию с малигнизацией (интраэпителиальная неоплазия простаты). Онкомаркеры позволяют обнаружить образование на ранней стадии.
Факторами риска считаются:
- наследственность (гены BRCA1 и BRCA2);
- застойные явления в простате;
- возраст старше 50 лет;
- неправильное питание;
- вредные привычки;
- воздействие кадмия;
- ИППП;
- заражение вирусами (XMRV, герпес 2 типа, цитомегаловирус).
Симптомы опухоли простаты
Основаниями для проведения анализа на онкомаркеры рака предстательной железы являются наличие подозрительной симптоматики и результаты первичной диагностики. О присутствии новообразований простаты могут говорить следующие признаки:
- учащенное ночное и дневное мочеиспускание;
- недержание мочи;
- боль и жжение при мочеиспускании;
- прерывистая или вялая струя мочи;
- боль в промежности и области лобка;
- трудности в начале мочеиспускания и выделение мочи по капле в конце;
- чувство неполного опорожнения мочевого пузыря;
- кровь в моче или сперме;
- запор и боль во время дефекации и т. д.
Диагностика опухоли простаты
Исследование на онкомаркеры рака предстательной железы — современный и точный способ подтверждения диагноза. Он входит в состав комплексной диагностики, которая включает в себя:
- пальцевое ректальное исследование;
- анализ на ПСА, ПСА3 (онкомаркеры рака предстательной железы);
- ТРУЗИ;
- биопсию простаты.
Что такое онкомаркеры рака предстательной железы?
Онкологическими маркерами называют особые белки, обнаруживаемые в крови или моче пациентов, больных раковыми заболеваниями. Анализ на онкомаркеры не только позволяет диагностировать рак предстательной железы, но и в дальнейшем помогает оценить эффективность терапии или выявить рецидив.
Для обнаружения образований простаты широко используется исследование на простатический специфический антиген (ПСА). Его повышенный уровень является основанием для проведения биопсии простаты. В последние годы на смену этому онкомаркеру рака предстательной железы пришел новый — ПСА3. Он обладает специфичностью и позволяет избежать ненужной биопсии.
Помимо PSA, онкомаркерами рака предстательной железы также считаются:
- раково-эмбриональный антиген (его повышенный уровень также может говорить об образованиях в ЖКТ, легких, яичниках, матке, груди);
- хромогранин А (также может свидетельствовать о присутствии неопластических процессов в желудке, кишечнике, надпочечниках, бронхолегочной системе и др.).
PSA3 — специфичный онкомаркер рака предстательной железы
Развитие молекулярной диагностики расширило возможности для специфичного тестирования на опухоль простаты. Для этого проводится исследование мочи на наличие онкомаркера рака предстательной железы, основанное на поиске гена PSA3. Он представляет собой некодирующую РНК, которую можно картировать в хромосоме 9q21-22.
Сравнение сывороточных показателей онкомаркеров рака предстательной железы ПСА и ПСА3 показало, что последний является более специфичным для выявления новообразований. Уровень PSA изменяется под влиянием таких факторов, как возраст, доброкачественная гиперплазия простаты, воспалительный процесс, травмы, прием ингибиторов 5-альфа-редуктазы.
ПСА3 представляет собой некодирующий участок мРНК, локализованный в девятой хромосоме. В клетках рака предстательной железы он гиперэкспрессирован и является специфичным онкомакером. Тест на этот маркер позволяет делать обоснованные выводы о необходимости биопсии простаты.

- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Когда родственник заболевает раком, нам страшно. В какой-то мере страшно и за свое здоровье – передается ли рак по наследству? Прежде чем делать поспешные выводы и впадать в панику, давайте разберемся с этим вопросом.
По своей сути, рак – генетическое заболевание, которое возникает вследствие поломки генома клетки. Раз за разом в клетке происходит последовательное накопление мутаций, и она постепенно приобретает свойства злокачественной – малигнизируется.

Генов, которые участвуют в поломке, несколько, и перестают работать они не одновременно.
- Гены, кодирующие системы роста и деления, называются прото-онкогенами. При их поломке клетка начинает бесконечно делиться и расти.
- Есть гены-супрессоры опухолей, отвечающие за систему восприятия сигналов от других клеток и тормозящие рост и деление. Они могут сдерживать рост клетки, а при их поломке этот механизм выключается.
- И, наконец, есть гены репарации ДНК, кодирующие белки, которые чинят ДНК. Их поломка способствуют очень быстрому накоплению мутаций в геноме клетки.
Генетическая предрасположенность к онкологии
Существует два сценария возникновения мутаций, вызывающих онкологические заболевания: ненаследственный и наследственный. Ненаследственные мутации появляются в изначально здоровых клетках. Они возникают под воздействием внешних канцерогенных факторов, например, курения или ультрафиолетового излучения. В основном рак развивается у людей в зрелом возрасте: процесс возникновения и накопления мутаций может занимать не один десяток лет.
Однако, в 5-10% случаев предопределяющую роль играет наследственность. Происходит это в том случае, когда одна из онкогенных мутаций появилась в половой клетке, которой посчастливилось стать человеком. При этом каждая из примерно 40*1012 клеток организма этого человека также будет содержать начальную мутацию. Следовательно, каждой клетке нужно будет накопить меньше мутаций, чтобы стать раковой.
Повышенный риск развития рака передается из поколения в поколение и называется наследственным опухолевым синдромом. Встречается данный синдром довольно часто – примерно у 2-4% населения.
Несмотря на то, что основную массу онкологических заболеваний вызывают случайные мутации, наследственному фактору также необходимо уделять серьезное внимание. Зная об имеющихся унаследованных мутациях, можно предотвратить развитие конкретного заболевания.
Предрасположенность к раку наследуется как Менделевский доминантный признак, иными словами, как обычный ген с различной частотой возникновения. При этом вероятность возникновения в раннем возрасте у наследственных форм выше, чем у спорадических.
Распространенные генетические исследования
Коротко расскажем вам об основных видах генетических исследований, которые показаны людям из группы риска. Все эти исследования можно провести в нашей клинике.
Определение мутации в гене BRCA
В 2013 году благодаря Анджелине Джоли весь мир активно обсуждал наследственный рак молочной железы и яичников, о мутациях в генах BRCA1 и BRCA2 теперь знают даже неспециалисты. Из-за мутаций теряются функции белков, кодируемых этими генами. В результате основной механизм репарации (восстановления) двунитевых разрывов молекулы ДНК нарушается, и возникает состояние геномной нестабильности – высокой частоты мутаций в геноме клеточной линии. Нестабильность генома является центральным фактором канцерогенеза.
Учеными описано более тысячи различных мутаций в этих генах, многие из которых (но не все) связаны с повышенным риском возникновения онкологического заболевания.
У женщин с нарушениями в BRCA1/2 риск заболеть раком молочной железы составляет 45-87%, в то время как средняя вероятность этого заболевания – всего 5,6%. Растет вероятность развития злокачественных опухолей и в других органах: яичниках (с 1 до 35%), поджелудочной, а у мужчин – и в предстательной железе.
Генетическая предрасположенность к наследственному неполипозному колоректальному раку (синдром Линча)
Колоректальный рак – одно из самых распространенных онкологических заболеваний в мире. Около 10% населения имеет генетическую предрасположенность к нему.
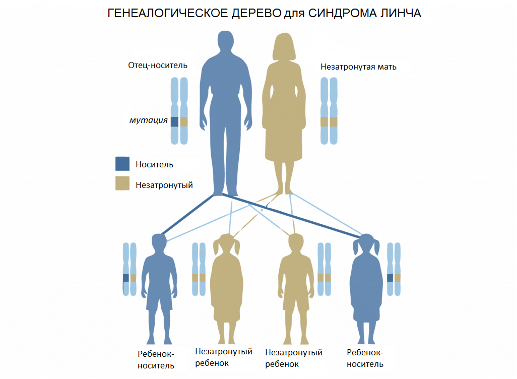
Генетический тест на синдром Линча, также известного как наследственный неполипозный колоректальный рак (НПКР), определяет заболевание с точностью 97%. Синдром Линча – наследственное заболевание, в результате которого злокачественная опухоль поражает стенки толстого кишечника. Считается, что около 5% всех случаев колоректального рака связаны с этим синдромом.
Определение мутации в гене BRaf
При наличии меланомы, опухолей щитовидной или предстательной железы, опухоли яичников или кишечника рекомендуется (а в некоторых случаях обязательно) проведение анализа на BRaf мутацию. Это исследование поможет выбрать необходимую стратегию лечения опухоли.
BRAF – это онкоген, который отвечает за кодировку белка, располагающегося в сигнальном пути Ras-Raf-MEK-MARK. Этот путь, в норме, регулирует деление клеток под контролем фактора роста и различных гормонов. Мутация в онкогене BRaf приводит к избыточному неконтролируемому разрастанию и устойчивости к апоптозу (запрограммированной смерти). Результатом является в несколько раз ускоренное размножение клеток и рост новообразования. По показаниям данного исследования специалист делает заключение о возможности использования ингибиторов BRaf, которые продемонстрировали значительное преимущество по сравнению со стандартной химиотерапией.

Методика проведения анализа
Любой генетический анализ – сложная многоэтапная процедура.
Генетический материал для анализа берут из клеток, как правило, из клеток крови. Но в последнее время лаборатории переходят на неинвазивные методы и иногда выделяют ДНК из слюны. Выделенный материал подвергается секвенции – определению последовательности мономеров при помощи химических анализаторов и реакций. Эта последовательность и является генетическим кодом. Полученный код сравнивают с эталонным и определяют, какие участки относятся к тем или иным генам. На основании их наличия, отсутствия или мутации делают заключение о результатах теста.
Сегодня в лабораториях множество методов генетического анализа, каждый из них хорош в тех или иных ситуациях:
За счет большого количества химических реактивов процедуры генетических исследований достаточно финансово затратные.. Мы стараемся устанавливать оптимальную стоимость всех процедур, поэтому цена на такие исследования у нас начинается от 4 800 рублей.
Группы риска
В группы риска по наследственному раку попадают люди, у которых наблюдается хотя бы один из перечисленных факторов:
- Несколько случаев одного вида рака в семье
(например, рак желудка у деда, отца и сына); - Заболевания в раннем для данного показания возрасте
(например, колоректальный рак у пациента моложе 50 лет); - Единичный случай определенного вида рака
(например, рак яичников, или трижды негативный рак молочной железы); - Рак в каждом из парных органов
(например, рак левой и правой почки); - Больше одного типа рака у родственника
(например, сочетание рака молочной железы и рака яичников); - Рак, нехарактерный для пола пациента
(например, рак молочной железы у мужчины).
Если для человека и его семьи характерен хотя бы один фактор из списка, то следует получить консультацию у врача-генетика. Он определит, есть ли медицинские показания для того, чтобы сдавать генетический тест.
Чтобы обнаружить рак на ранней стадии, носителям наследственного опухолевого синдрома следует проходить тщательный скрининг на онкологические заболевания. В некоторых случаях риск развития рака можно существенно снизить с помощью превентивных операций и лекарственной профилактики.
При проведении теста опухоль анализируется, составляется индивидуальный молекулярный паспорт. В комплексе с анализом крови, в зависимости от требуемого теста, проводится комбинацирование различных анализов на геном и белок. В результате данного теста появляется возможность назначения таргетной терапии, эффективной для каждого типа имеющейся опухоли.
Профилактика
Бытует мнение, что для определения предрасположенности к раку можно сделать простой анализ на наличие онкомаркеров – специфических веществ, которые могут быть продуктами жизнедеятельности опухоли.
Повышение показателя может зависеть от целого ряда причин, совершенно не связанных с онкологическими заболеваниями. В то же время, есть примеры людей с онкологическими заболеваниями, у которых значения онкомаркера оставались в пределах нормы. Специалисты используют онкомаркеры как метод для отслеживания протекания уже обнаруженного заболевания, результаты которого нужно перепроверять.
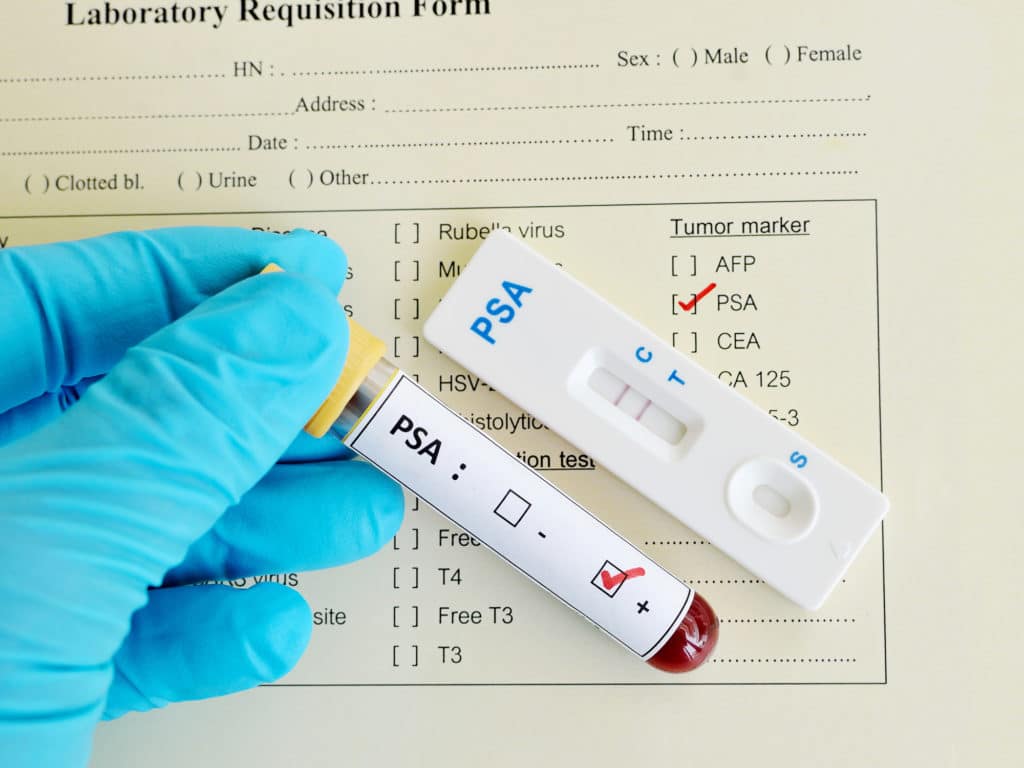
Для выявления вероятности генетической наследственности в первую очередь, если вы входите в группу риска, нужно обратиться за консультацией к врачу-онкологу. Специалист, исходя из вашего анамнеза, сделает вывод о необходимости проведения тех или иных исследований.
Важно понимать, что решение о проведении какого-либо теста должен принять именно врач. Самолечение в онкологии неприемлемо. Неправильно интерпретированные результаты не только могут вызвать преждевременную панику – вы попросту можете упустить наличие развивающегося онкологического заболевания. Выявление рака на ранней стадии при наличии вовремя поставленного правильного лечения дает шанс на выздоровление.
Стоит ли паниковать?
Рак – неизбежный спутник долгоживущего организма: вероятность накопления соматической клеткой критического числа мутаций прямо пропорциональна времени жизни. То, что рак – генетическое заболевание, не значит, что оно наследственное. Он передается в 2-4% случаев. Если у вашего родственника обнаружили онкологическое заболевание – не впадайте в панику, этим вы навредите и себе, и ему. Обратитесь к врачу-онкологу. Пройдите исследования, которые он вам назначит. Лучше, если это будет специалист, который следит за прогрессом в области диагностики и лечения рака и в курсе всего, что вы сами только что узнали. Следуйте его рекомендациям и не болейте.
Читайте также:





