Генетические маркеры рака яичников
Прием биоматериала по данному исследованию может быть отменен за 2-3 дня до официальных государственных праздников, в связи с технологической особенностью производства! Информацию уточняйте в контакт-центре.
Данный анализ является комплексным генетическим исследованием, которое позволяет определить наследственную предрасположенность к раку молочной железы и яичников. В ходе исследования проводится анализ наиболее распространенных маркеров генетического характера, которые указывают на высокие риски развития данных онкологических заболеваний. Анализ относится к ранней диагностике и позволяет своевременно начать лечение или минимизировать риски возникновения этих онкологических заболеваний. Проведение исследования генетических факторов риска развития рака молочной железы и рака яичников необходимо, если эти заболевания есть в семейном анамнезе, наиболее значимым является факт наличия данных заболеваний у близких родственников, а также в раннем возрасте. Проводят анализ, если у пациентки или ее родственников наблюдался двусторонний рак молочной железы, а у мужчин – при наличии в семейном анамнезе рака груди или предстательной железы. Показаниями являются и множественные первичные опухоли как у самой пациентки, так и ее родственников, наличие редких форм рака или опухолей одной локализации у двух и более родственников, а также если опухоли появились в раннем возрасте или имеют место нетипичные пролиферативные заболевания молочной железы. Кроме того, показанием к обследованию является выявление мутаций таких генов, как BRCA1, BRCA2 у близких родственников пациента.
Для определения наследственной предрасположенности к развитию в организме рака яичников и молочной железы необходимо пройти комплексное генетическое исследование. В ходе работы с образцом крови пациента проводится анализ самых распространенных генетических маркеров рака. Именно они являются показателями развития этих видов онкозаболеваний.
Если вам назначили анализ на предрасположенность к раку молочной железы – это не приговор, это один из самых эффективных способов ранней диагностики этого заболевания. Чем быстрее его обнаружат в организме, тем более эффективным будет процесс лечения.
Сдать генный анализ крови на мутацию генов BRCA1 и BRCA2 необходимо при:
- наличии таких видов онкозаболеваний у близких родственников, как рак предстательной железы и рак груди;
- множественных новообразованиях в организме;
- появлении опухолей в раннем возрасте;
- наличии у пациента пролиферативных болезней молочной железы.
ОБЩИЕ ПРАВИЛА ПОДГОТОВКИ К АНАЛИЗАМ КРОВИ
Для большинства исследований кровь рекомендуется сдавать утром натощак, это особенно важно, если проводится динамическое наблюдение за определенным показателем. Прием пищи может непосредственно влиять как на концентрацию исследуемых показателей, так и на физические свойства образца (повышенная мутность – липемия – после приема жирной пищи). В случае необходимости можно сдать кровь в течение дня после 2-4-часового голодания. Рекомендуется незадолго до взятия крови выпить 1-2 стакана негазированной воды, это поможет набрать необходимый для исследования объем крови, уменьшит вязкость крови и снизит вероятность образования сгустков в пробирке. Необходимо исключить физическое и эмоциональное перенапряжение, курение за 30 минут до исследования. Кровь для исследования берется из вены.
Рак яичников (РЯ) — 5-я по частоте причина смертности от онкологических заболеваний среди женщин в США. Заболевание представлено гетерогенной группой новообразований, включающих разнообразные гистотипы: эндометриоидный, серозный, муци-нозный, светлоклеточный и другие редко встречающиеся варианты рака. Каждый морфологический вариант, по всей видимости, характеризуется различными мутациями.
Некоторые опухоли с одинаковым гистологическим строением часто имеют разное клиническое течение, возможно, вследствие разных генетических нарушений, приведших к их развитию. Требуются исследования для установления связи между молекулярными маркерами, гистотипами опухолей и их клиническим течением. На протяжении нескольких десятилетий не было единого мнения о том, характерна ли для рака яичников (РЯ) многоочаговость происхождения. Мок и соавт. опубликовали описание 9 случаев широко распространенного канцероматоза брюшины.
У каждого из больных характер экспрессии гена ТР53 был идентичен в опухолевых клетках, полученных из разных очагов, что свидетельствует о происхождении их от одного предшественника. Tsao и соавт. использовали для аналогичного исследования инактивацию Х-хромосомы и получили аналогичные результаты.
Baker и соавт. выявили амплификацию гена c-myc в 29 % случаев рака яичников (РЯ); в другом исследовании она обнаружена в 50 % случаев. Амплификация c-myc не выявляется в нормальной ткани яичников, доброкачественных аденомах и опухолях с низким злокачественным потенциалом, что свидетельствует о важной роли генетических нарушений в развитии злокачественных новообразований. Также описаны аномалии других онкогенов, в т. ч. делеции, амплификации и точечные мутации гена ras и гиперэкспрессия гена fos.
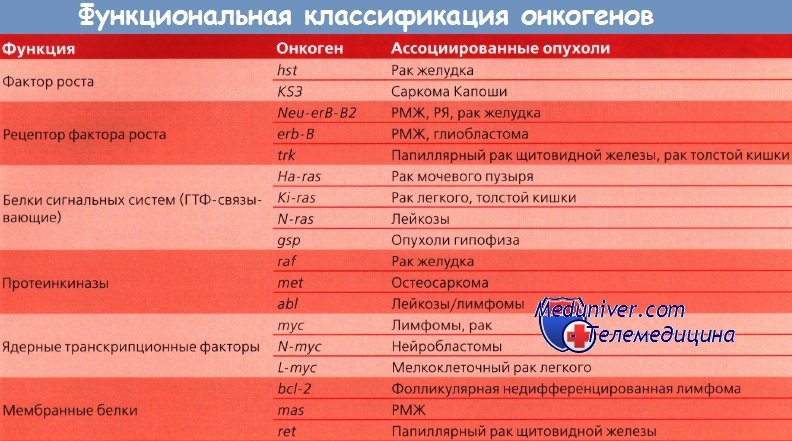
В канцерогенезе рака яичников (РЯ), вероятно, инактивируются гены-супрессоры. Sato и соавт. сообщили результаты исследования 37 опухолей яичников с различными ДНК-пробами и выявили аллельную утрату на хромосомах 6q, 13q и 19q при серозном раке. При опухолях муцинозного типа утраты аллелей отмечались реже. Sasano и соавт. описали гомогенные делеции гена RB в 1 из 24 случаев рака яичников (РЯ). Mazars и соавт. обнаружили мутации гена ТР53 в 36 % из 34 случаев рака яичников (РЯ); большинство мутаций выявлены в экзонах 5 и 7.
Marks и соавт. исследовали экспрессию гена ТР53 более чем в 100 опухолях яичников и более чем в 50 % случаев обнаружили высокий уровень мутантного белка Тр53, хотя в некоторых гистологических образцах опухолевой ткани он не выявлялся. Гиперэкспрессия белка Тр53 четко коррелирует с наличием мутации гена ТР53 в опухоли. Эти исследования свидетельствуют, что мутации и делеции гена ТР53 играют важную роль в развитии и прогрессии некоторых форм рака яичников (РЯ).
Данные, изложенные выше, в первую очередь касаются генетических нарушений в соматических клетках во время развития и прогрессии опухолей. Первичные генетические факторы служат непосредственной причиной рака лишь примерно в 5 % случаев. В настоящее время прилагаются значительные усилия для выделения и клонирования наиболее важных генов. Ген BRCA1 имеется во всех клетках организма, и его мутации связаны с развитием заболевания в некоторых семьях с множественными случаями РЯ. В 1995 г. опубликованы объединенные результаты нескольких исследовательских центров по всему миру.
Мутации гена BRCA1 были выявлены в 9 (6 %) из 145 семей с повышенной частотой множественных случаев рака яичников (РЯ) и рака молочной железы (РМЖ).
Это свидетельствует, но не доказывает, что поврежденные или мутантные формы (на сегодня идентифицировано 50 мутаций) нормального гена BRCA1 могут передаваться в этих семьях из поколения в поколение, а повреждения BRCA1 могут вызывать у женщин предрасположенность к развитию РМЖ и РЯ. Результаты исследований также показывают, что в семьях, в которых заболевание не связано с нарушениями BRCA1, развитие рака яичников (РЯ) может быть обусловлено другими, пока что не идентифицированными генами. Ген BRCA1 был выделен в сентябре 1994 г., что позволило определить специфические изменения, связанные с развитием семейных случаев опухолей.
Также появилась возможность для выявления в таких семьях лиц с изменениями BRCA1, но без заболевания. Риск РЯ или РМЖ у этих женщин очень высок. В то же время о риске этих заболеваний у членов семей, не имеющих унаследованных нарушений гена BRCA1, ничего неизвестно. Таким образом, исследование гена BRCA1 в семьях с предрасположенностью к злокачественным новообразованиям поможет лучше оценить риск у отдельных членов семей. В 1995 г. идентифицирован второй ген, ассоциированный с РМЖ и РЯ, — BRCA2. Наличие мутаций этого гена повышает риск РЯ на протяжении жизни до 10 — 20 %. В настоящее время продолжается изучение этого гена.
Основная задача исследований в будущем — определить влияние, которое оказывают известные мутации генов на риск заболеваний, и их прогноз. Учитывая ограниченный опыт генетического тестирования на рак и неоднозначность результатов, American Society of Human Genetics рекомендует проводить генетические исследования только некоторым членам семей с высокой частотой развития РЯ и РМЖ. Эту работу должны выполнять специалисты, знакомые с генетическими, клиническими и психологическими особенностями тестирования и осознающие его пределы и возможности. Важно, чтобы обследуемые пациенты были подробно проинформированы, а результаты служили пониманию значимости выявленных нарушений.
Молекулярные причины рака молочной железы и яичников
Эпидемиология
Пристальное внимание, уделяемое проблемам лечения больных раком яичников, объясняется не только частотой встречаемости этого заболевания.
Занимая третье место в структуре онкогинекологической патологии, рак яичников удерживает лидирующие позиции среди причины смерти у онкогинекологических больных.
Так, по данным МАИР (Международного агентства по изучению рака), ежегодно в мире регистрируется 166000 новых случаев этой патологии и из них 100000 женщин умирает в течение первого года.
Встретить злокачественное новообразование (ЗНО) яичников у женщин можно практически в любом возрасте (как у новорождённых девочек, так и у женщин после 80 лет). Отсутствие выраженных клинических признаков, поздняя обращаемость к врачу, недостаточная диагностическая база и ошибки в ведении этих больных являются основными причинами того, что у 2/3 больных первично диагностируется местнораспространённый и распространённый рак яичников. Внедрение дорогостоящих диагностических и лечебных мероприятий в III и IV стадиях заболевания не могут значительно изменить показателей лечения и выживаемости этих больных.
Злокачественные опухоли репродуктивной системы (рак молочной железы и гинекологические опухоли - рак тела, шейки матки и яичников) являются наиболее частыми в структуре онкологической заболеваемости женщин, и их суммарная доля превышает 35%. Рак яичников составляет 4-6% среди злокачественных опухолей у женщин и занимает седьмое место по частоте.
Если удельный вес рака яичников в онкологической заболеваемости женщин во всех странах мира примерно одинаков, то частота заболеваемости на 100000 женского населения значительно варьирует. В Европе, особенно в Северных странах и Великобритании, а также в Северной Америке, стандартизованные показатели заболеваемости наиболее высокие (10 и более на 100000). В Центральной и Южной Америке, Африке и Азии, включая индустриальные страны, такие как Япония, но исключая Израиль, эти показатели значительно ниже (7 и менее на 100000) (рис. 31).

Рис. 31. Стандартизованные показатели заболеваемости раком яичников в мире в 1990-е годы (на 100000 женского населения).
За последние 20 лет уровни заболеваемости раком яичников в большинстве стран с высоким риском (Скандинавия, Великобритания, США, Канада) остаются стабильными и даже несколько снижаются. В то же время отмечено повышение заболеваемости в странах с низким риском, таких как Япония, Индия, Сингапур, а также в некоторых странах Южной и Восточной Европы (Португалии, Испании, Югославии, Польше).
В России ежегодно рак яичников выявляется более чем у 11000 женщин (10,17 на 100000). За последние 10 лет в стране произошел прирост заболевания на 8,5%. Интерпретация трендов в заболеваемости раком яичников крайне затруднительна, особенно в экономически развитых странах.
В большинстве индустриальных стран мира рак яичников имеет самые высокие показатели смертности среди всех гинекологических опухолей, что связано с поздней диагностикой заболевания. По сводным данным популяционных раковых регистров стран Европы, 1-летняя выживаемость больных раком яичников составляет 63%, 3-летняя - 41%, 5-летняя - 35%. На рисунке 32 представлены показатели выживаемости больных основными гинекологическими опухолями.

Рис. 32. Относительная выживаемость больных гинекологическим раком по сводным данным популяционных раковых регистров Европы в 1990-е годы (в %).
За последнее десятилетие отмеченное в Европе увеличение 5-летней выживаемости больных злокачественными опухолями яичников на 3% (с 32 до 35%), а в США - на 4% (с 36 до 39%) объясняется не столько улучшением диагностики, сколько эффективным применением химиотерапии в лечении диссеминированных форм рака яичников и герминогенных опухолей.
Рассматривая онкогинекологические показатели заболеваемости и смертности в Омской области за 5 лет (с 2003 по 2007 годы) можно сказать, что в целом основные тенденции соответствуют Российским и мировым.
Успех лечения и прогноз дожития больных всецело зависит от стадии развития злокачественного процесса и своевременности диагностики. К сожалению, статистика свидетельствует, что опухоль выявляется в III-IV стадиях настолько часто (до 40%), что на долю так называемых ранних форм приходится ничтожно малое количество случаев, в основном диагностируемых случайно. Именно количеством диагностируемых у больных ранних опухолей определяются хороший прогноз их полного излечения.
Молекулярная генетика рака яичников
Наследственным факторам еще десять лет назад не придавали особого значения, хотя отдельные указания на существование семейной предрасположенности к данному заболеванию появились довольно давно. Сегодня роль генетической составляющей в патогенезе рака яичников (РЯ) не вызывает сомнений.
Суть молекулярно-генетических изменений в опухолях сводится к трём компонентам:
1) активирующие мутации в онкогенах;
2) инактивирующие мутации в антионкогенах;
3) геномная нестабильность.
Онкогены кодируют белки, играющие важную роль в процессах позитивной регуляции клеточного деления и дифференцировки; если их экспрессия избыточна или протекает в измененном виде, то это индуцирует неконтролируемую пролиферацию клеток. Гены-супрессоры, называвшиеся до недавнего времени антионкогенами, ответственны за синтез белков, осуществляющих негативный контроль клеточного деления или индукцию апоптоза. В противоположность онкогенам функционально значимые мутации в супрессорных генах носят инактивирующий характер.
Одним из наиболее изученных онкогенов, активация которого достаточно часто обнаруживается при раке яичников, является ген K-ras. Продукт гена K-ras относится к классу G-белков и участвует в самых разнообразных аспектах регуляции клеточных процессов. Мутации K-ras встречаются значительно чаще в муцинозных, по сравнению с немуцинозными РЯ, что позволяет обсуждать перспективность данного теста для дифференциальной диагностики.
Другой онкоген, к которому привлечено в последние годы пристальное внимание, - это c-erbB2/HER2, кодирующий мембранный гликопротеид семейства рецепторов эпидермального фактора роста. Гиперэкспрессия данного гена наблюдается в 10-50% случаев. Во многих работах показано, что активация c-erbB2/HER2 указывает на неблагоприятный прогноз течения рака яичника.
Существенное место в патогенезе рака яичников принадлежит супрессорному гену р53. Продукт гена р53 отвечает за самоустранение клеток, получивших критические повреждения ДНК. Инактивация р53 наблюдается примерно в половине опухолей РЯ.
Нарушения в различных генах клеточного цикла, по-видимому, могут иметь весьма сходные функциональные проявления. Известно, что регуляция клеточного цикла находится под контролем белкового комплекса, состоящего из циклинов и циклин-зависимых киназ (Cdk).
Считается, что активирующие события в генах циклинов и Cdk имеют онкогенный эффект, в то время как Cki выступают как гены-супрессоры.
В последние годы внимание широкого круга специалистов, в том числе и онкологов, привлечено к ферменту теломеразе. Основная функция теломераз состоит в препятствовании укорочению концевых участков хромосом в процессе деления клеток. Установлено, что при многих типах опухолей наличие активной теломеразы коррелирует с неблагоприятным прогнозом. Теломеразная активность обнаруживается в 92% карцином яичника. При этом следует заметить, что наиболее высокая активность фермента обнаруживается в низкодифференцированных карциномах.
Предполагается, что некоторые варианты генов, продукты которых участвуют в синтезе андрогенов и эстрогенов, могут несколько увеличивать риск новообразований репродуктивной сферы. В частности, к кандидатам относятся гены группы цитохрома р450 (CYP1A1, CYP17 и CYP19).
Значительный интерес представляют гены, ответственные за метаболизм эндогенных и экзогенных канцерогенов, например группы полициклических ароматических углеводородов (ПАУ). В метаболизме ПАУ ключевая роль принадлежит ферментам группы цитохрома р450. Полиморфизм этих генов может участвовать в формировании целого ряда новообразований.
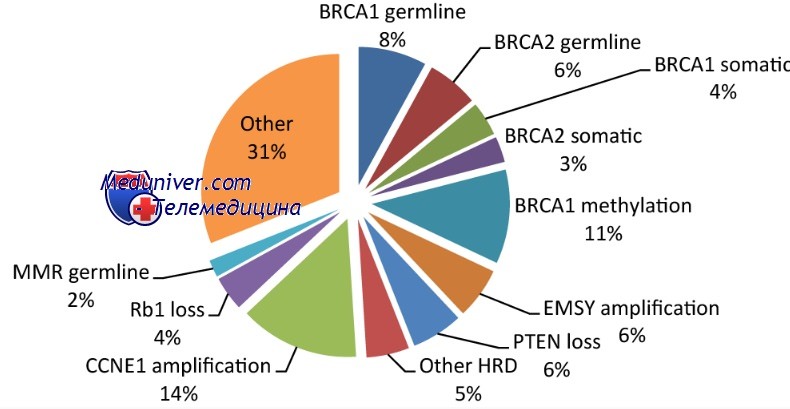
Хотя семейные раки яичника достаточно редки, их молекулярная генетика изучена значительно лучше по сравнению со спонтанными опухолями. Эпидемиологические исследования и анализ семейной истории РЯ позволили выявить, что около 10% случаев эпителиального рака яичников обусловлены передаваемыми в поколениях генетическими изменениями.
В настоящее время описаны две независимые формы наследственного РЯ:
1) синдром рака молочной железы и яичников, на который приходится 90-95% всех случаев наследственного РЯ;
2) синдром, ассоциированный с высокой семейной встречаемостью рака толстой кишки и раком эндометрия (5-10% случаев).
Успехи молекулярной генетики привели к разработке методик прямого обнаружения случаев наследственного рака яичников (табл. 5).
Таблица 5. Молекулярно-генетические детерминанты наследственного рака яичников

Как показывает генетический анализ, большинство случаев наследственного РЯ связано с врождёнными мутациями гена BRCA1 и гена BRCA2.
Синдром неполипозного семейного рака толстой кишки в сочетании с РЯ и раком эндометрия определяется наличием наследственного дефекта в каком-либо из пяти известных генов, MSH2, МПЛП, MSH6, PMS2 или PMS1.
В заключение остановимся коротко на том, какое клиническое значение имеют данные о наследственной природе определенной группы опухолей яичников. Накопленные к настоящему времени результаты исследований не дают еще полного представления об особенностях течения и прогнозе наследственного рака яичников.
Не вызывает сомнений, что BRCA-1 - ассоциированный РЯ морфологически относится к серозному типу и диагностируется обычно у более молодых женщин. Кроме того, создается впечатление, что в случае BRCA мутаций опухоли проявляют несколько большую чувствительность к химиотерапии.
Идентификация мутаций в генах наследственных раковых синдромов имеет решающее значение для превентивной медицины. Предполагается, что лабораторные генетические тесты позволят сфокусировать мероприятия, направленные на раннюю диагностику новообразований, именно на тех лицах, которые в них больше всего нуждаются.
В частности, обнаружение зародышевых мутаций, ассоциированных с семейным РЯ, свидетельствует о необходимости учащённых ультразвуковых обследований органов брюшной полости, пристального внимания за состоянием молочных желёз. В некоторых случаях ставился вопрос о целесообразности профилактической овариэктомии и мастэктомии.
По данным исследований, проведённых на базе Омского областного онкологического диспансера, установлено, что у больных с запущенными формами рака яичников пре- и постменопаузального периода отмечается выраженная иммунная дисфункция, характеризующаяся как количественными, так и функциональными нарушениями Т-клеточного иммунитета.
Кроме того, при этом:
1) снижались показатели субклассов Ig G1, IgG2, IgG3 в 3,2-4,8 раза;
2) С4 комплемента в 2,5 раза;
3) лактоферрина в 5,7-7,0 раз по сравнению с контрольной группой;
4) уровень циркулирующих иммунных комплексов (ЦИК) превышал показатели контрольной группы в 1,6-1,7 раза.
Подводя краткий итог, можно заключить, что в последние годы наши знания о молекулярных механизмах туморогенеза яичников существенно изменились. Хотя многие детали этого сложнейшего процесса остаются не до конца ясными, стало очевидным, что формируются научные основы повышения эффективности диагностики и лечения данной группы злокачественных новообразований.
Пограничные опухоли яичников
Особое место среди новообразований яичников занимают пограничные опухоли. В качестве самостоятельной нозологической единицы они были введены в Международную гистологическую классификацию ВОЗ в 1973 году. Эти новообразования имеют синонимы: опухоли потенциально низкой степени злокачественности, карцинома низкой степени злокачественности.
Выделяют следующие формы пограничных опухолей яичников:
1) серозные опухоли;
2) муцинозные опухоли;
3) эндометриоидные опухоли;
4) светлоклеточные (мезонефроидные) опухоли;
5) опухоли Бреннера;
6) смешанные эпителиальные опухоли.
Пограничные опухоли яичников составляют 10-15% всех новообразований органа. Переходные опухоли встречаются со следующей частотой: серозная опухоль обнаружена у 60,9% больных, муцинозная - у 34,5%, эндометриоидная - у 1,1%, опухоль Бреннера - у 1,1%, смешанная - у 2,3%.
Наиболее часто пограничные опухоли встречаются в I-I стадиях (81%).
Диагностика пограничных опухолей яичника остается прерогативой исключительно патогистологического метода исследования. Важная в диагностическом отношении информация получается при использовании ультразвуковой томографии. Высокая разрешающая способность ультразвуковой аппаратуры позволяет составить представление об особенностях опухоли яичника.
Лапароскопия не позволяет установить диагноз пограничной опухоли яичника даже при исследовании мазков, полученных из брюшной полости. Это объясняется тем, что цитологически трудно дифференцировать элементы мезотелия и элементы имплантантов пограничной опухоли. Распознать пограничную опухоль яичника, основываясь только на визуальной оценке при лапароскопии или лапаротомии, невозможно.
Программы лечения пограничных опухолей в целом мало отличаются от программ терапии злокачественных новообразований и включают комбинацию оперативного и лекарственного методов либо комплексный подход с использованием лучевой терапии. Оперативный этап требует выполнения стандартного объёма операции, описанного выше. Органосохраняющие операции могут быть выполнены только пациенткам молодого возраста, имеющим Ia стадию и низкий риск рецидивирования опухоли.
Группа пограничных опухолей яичника, хотя и является объединенной в самостоятельную нозологическую единицу по своим морфологическим признакам, клинически не однородна. При этом больные с различными морфологическими вариантами опухоли нуждаются в индивидуальном подходе при выборе лечебной тактики и осуществлении наблюдения в последующем.
А.С. Марьенко, A.И. Новиков, В.К. Косенок, В.А. Акулинин
Об этом мы поговорили с онкогинекологом, хирургом Владимиром Носовым, руководителем Клиники гинекологии и онкогинекологии Eвропейского медицинского центра – первой клиники в России, где персонализированная терапия онкогинекологических заболеваний стала стандартной практикой.
В своём нормальном состоянии эти гены участвуют в восстановлении ДНК после различных повреждений, тем самым защищая клетки от опухолевого перерождения. Если возникает мутация в этих генах, здоровые клетки оказываются не защищенными и сами могут становиться злокачественными. Вероятность заболеть раком груди при носительстве мутации гена BRCA 1/2 колоссальная — до 80%(в общей популяции у женщин без мутации — около 10-12%), риск заболеть раком яичников — до 40-45 %( в популяции —около 1,5%) .
В большинстве случаев назначение этих препаратов после первой линии химиотерапии обеспечивает ремиссию около 3 лет – это огромное достижение, еще никогда в онкогинекологии ремиссия при 3-4 стадии заболевания не продлевалась каким-либо лекарством на столь длительный срок.
Дальнейшие исследования позволили выяснить, что мутации могут быть не только герминогенными, то есть присутствующими во всех клетках организма. Дополнительные 15-20% мутаций генов BRCA происходят только в клетках опухоли, но в крови и других клетках организма их нет. Эти мутации называют соматическими. Они не передаются по наследству, не увеличивают риск развития других онкологических заболеваний, но пациенты, у которых обнаружены мутации в клетках опухоли, также являются кандидатами для лечения ингибиторами PARP.
В Институте онкологии EMC мы предлагаем всем пациентам с раком яичников провести полное секвенирование генов BRCA опухоли и крови. Это позволяет подобрать наиболее эффективную персонализированную терапию. Если речь идет о наследственной мутации – мы рекомендуем в обязательном порядке генетическое обследование детям, сестрам, братьям, родителям, а самим пациенткам-носителям мутации – также пройти дополнительный скрининг на рак молочных желез, риски которого колоссально повышены.
Плохое наследство
Наследственная мутация передается детям с вероятностью 50%, причем как по женской, так и по мужской линии. Носителям мы рекомендуем специальную программу наблюдения и профилактические мероприятия для снижения риска онкологических заболеваний, а также обсуждаем с ними вопросы сохранения репродуктивной функции.
Например, на днях я оперировал пациентку 57 лет с раком яичника. На плановой гистологии был подтвержден злокачественный характер опухоли. Мы провели генетическое исследование опухоли, выявили мутацию BRCA1. Затем было выполнено полное генетическое исследование по крови, чтобы понять, является ли мутация соматической (присутствующей только в опухоли) или герминогенной (наследственной). Выяснилось, что мутация наследственная. Мы рекомендовали пройти обследование двум дочерям пациентки, которые, к сожалению, унаследовали эту мутацию. Женщины-близнецы, им сейчас 31 год, обе еще не планировали беременность и роды. Я рекомендовал им обратиться к репродуктологу, провести стимуляцию и заморозить яйцеклетки, а в 35 лет, именно с этого возраста риски рака яичников начинают расти, удалить профилактически яичники и маточные трубы. В этом случае мы сохраняем матку, и в будущем они смогут выносить своих биологических детей.
Более того, во время ЭКО можно провести предимплантационную диагностику и подсадить эмбрионы, не унаследовавшие мутацию. Таким образом, будущее поколение уже будет защищено.
Рак эндометрия (рак тела матки) – самое распространенное онкогинекологическое заболевание у женщин. Сегодня подходы к его лечению также меняются благодаря персонализированной терапии.
До недавних пор считалось, что существует два типа рака эндометрия. Наиболее частый, первого типа, обычно возникает у полных пациентов, часто с сопутствующими диабетом и гипертонией. Второй – серозный, более агрессивный, не связанный с избытком эстрогенов. На основании клинической картины врачи принимали решение о необходимости дополнительного лечения после операции. Сегодня, благодаря лучшему пониманию биологии опухоли, мы знаем, что этих типов не два, а четыре. И для каждого из них предусмотрено определенное лечение. Чтобы определить, с каким типом рака эндометрия мы имеем дело, достаточно для начала провести иммуногистохимическое исследование.
Каждую опухоль эндометрия вне зависимости от стадии, мы тестируем на наличие определенных молекул, указывающих на благоприятный или менее благоприятный прогноз заболевания. Например, наличие мутации гена P53 говорит о менее благоприятном прогнозе. В этом случае мы рекомендуем не только наблюдение, но и дополнительное лечение с помощью химио-или лучевой терапии.
Некоторые раки матки, так же, как и некоторые раки яичников и молочной железы, имеют в своей основе генетический синдром – синдром Линча. Если мы находим проявления синдрома Линча в опухоли, мы направляем пациентов на полноценное генетическое тестирование. Это важно, потому что рак матки – не единственное заболевание, к которому предрасположены носители мутаций, вызывающих синдром Линча. В частности, у них повышен риск рака толстой кишки в молодом возрасте.
Часто первым возникает рак матки, через какое-то время развивается рак толстой кишки.
Поэтому носителям синдрома Линча рекомендуют начинать скрининг на рак кишки не в 45-50, а гораздо раньше — с 30 лет и делать колоноскопию раз в 6 или 12 месяцев, чтобы не пропустить развитие заболевания.
Выявление синдром Линча у пациентки с раком матки может повлиять и на лечение.
При поздних стадиях пациентам с синдромом Линча мы назначаем специфическую иммунотерапию препаратом пемпролизумаб, что позволяет улучшить прогнозы пациентов.
Генетическое профилирование опухоли – это колоссальный прорыв, который позволил нам подойти к полностью персонализированной терапии в онкологии, основанной не только на диагнозе, но и на понимании биологии опухоли. Для пациентов — это возможность получить точное узкоспециализированное лечение, дающее лучшие результаты, а в случае наследственных раков — возможность защитить будущие поколения от опасных заболеваний.
С предрасположенностью к возникновению синдрома РМЖ/РЯ связано присутствие у таких пациентов мутаций в генах BRCA1 или BRCA2. Мутации являются наследственными – то есть, буквально в каждой клетке организма такого человека есть повреждение, которое передалось ему по наследству. Вероятность возникновения злокачественного новообразования у пациентов с мутациями BRCA1 или BRCA2 к 70 годам достигает 80%.
Однако, в каждой клетке присутствует две копии каждого гена — от мамы и от папы, поэтому вторая копия может компенсировать нарушение работы клеточных систем. Но вероятность выхода ее из строя также очень высока. При нарушении процессов восстановления ДНК в клетках начинают накапливаться и другие изменения, которые, в свою очередь, могут привести к злокачественной трансформации и росту опухоли.
Определение генетической предрасположенности к онкологическим заболеваниям:
На базе лаборатории молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова применяется проведение поэтапного анализа для пациентов:
- сначала исследуется присутствие самых частых мутаций (4 мутации)
- при отсутствии таковых и клинической необходимости возможно проведение расширенного анализа (8 мутаций) и/или анализа полной последовательности генов BRCA1 и BRCA2.
 |  |
На данный момент известно более 2 000 вариантов патогенных мутаций в генах BRCA1 и BRCA2. Кроме того, данные гены являются довольно большими – 24 и 27 экзонов соответственно. Поэтому полный анализ последовательностей генов BRCA1 и BRCA2 является трудоемким, дорогостоящим и длительным по времени процессом.
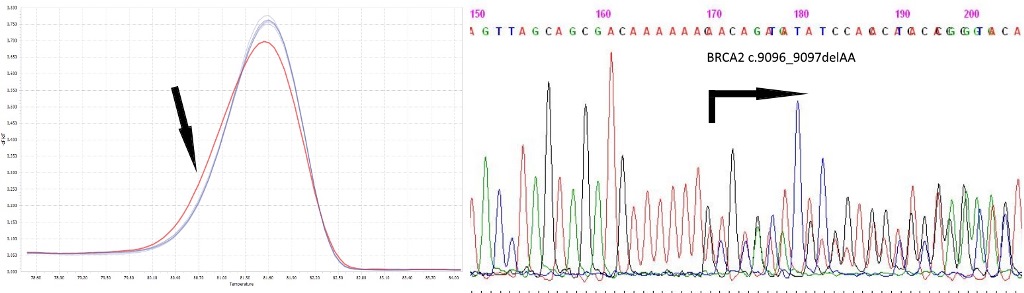
Анализ последовательности гена BRCA2, выявление мутации c.9096_9097delAA
В каких случаях нужно сдать анализ на мутации BRCA1 и BRCA2?
Национальная онкологическая сеть – National Comprehensive Cancer Network (NCCN) рекомендует направлять на генетическое исследование следующих пациентов:
- Пациенты до 45 лет с диагнозом рак молочной железы
- Пациенты в возрасте до 50 лет с РМЖ, если в семье есть хотя бы один близкий кровный родственник с таким диагнозом
- Также в том случае, если у пациента до 50 лет с РМЖ семейная онкологическая история неизвестна
- Если в возрасте до 50 лет диагностировано множественное поражение молочных желез
- Пациенты с РМЖ в возрасте до 60 лет — если по результатам гистологического исследования опухоль является трижды-негативной (отсутствует экспрессия маркеров ER, PR, HER2).
- При наличии диагноза рак молочной железы в любом возрасте — если присутствует хотя бы один из следующих признаков:
- не менее 1 близкой родственницы с РМЖ в возрасте менее 50 лет;
- не менее 2 близких родственниц с РМЖ в любом возрасте;
- не менее 1 близкой родственницы с РЯ;
- наличие не менее 2 близких родственников с раком поджелудочной железы и/или раком предстательной железы;
- наличие родственника-мужчины с раком грудной железы;
- принадлежность к популяции с высокой частотой наследственных мутаций (например, евреи Ашкенази);
- Все пациенты с диагностированным раком яичников.
- Если диагностирован рак молочной железы у мужчины.
- Если диагностирован рак простаты (с индексом по шкале Глисона >7) при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если диагностирован рак поджелудочной железы при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если рак поджелудочной железы диагностирован у уиндивидуума, принадлежащего к этносу евреев Ашкенази.
- Если у родственника обнаружена мутация BRCA1 или BRCA2
Выполнение молекулярно-генетического анализа должно сопровождаться генетическим консультированием, в ходе которого обсуждаются содержание, смысл и последствия тестирования; значение позитивного, негативного и неинформативного результатов; технические ограничения предлагаемого теста; необходимость информировать родственников в случае обнаружения наследственной мутации; особенности скрининга и профилактики опухолей у носителей мутаций и др.
Как сдать анализ на мутации BRCA1 и BRCA2?
Материалом для анализа является кровь. Для генетических исследований используют пробирки с ЭДТА (фиолетовая крышка). Сдать кровь можно в лаборатории НМИЦ или привезти из любой другой лаборатории. Кровь хранится при комнатной температуре до 7 дней.
 |  |
Особая подготовка к исследованию не нужна, на результаты исследования не влияют приемы пищи, прием лекарств, введение контрастных веществ и пр.
Пересдавать анализ через некоторое время или после лечения не потребуется. Наследственная мутация не может исчезнуть или появиться в течение жизни или после полученного лечения.
Что делать, если у женщины обнаружена мутация BRCA1 или BRCA2?
Для носителей патогенных мутаций разработан комплекс мероприятий по ранней диагностике, профилактике и терапии новообразований молочной железы и рака яичников. Если среди здоровых женщин своевременно выявить тех, у кого имеется генный дефект, есть возможность диагностировать развитие заболевания на ранних стадиях.
Исследователями были выявлены особенности лекарственной чувствительности BRCA-ассоциированных опухолей. Они хорошо реагируют на некоторые цитостатические препараты, и лечение может быть весьма успешным.
Для здоровых носителей BRCA-мутаций рекомендовано:
- Ежемесячное самообследование с 18 лет
- Клиническое обследование молочных желез (маммография или магнитно-резонансная томография) с 25 лет.
- Мужчинам-носителям мутации в генах BRCA1/2 рекомендовано проведение ежегодного клинического обследования грудных желез начиная с 35-летнего возраста. С 40 лет целесообразно выполнение скринингового обследования предстательной железы.
- Проведение дерматологического и офтальмологического осмотров c целью ранней диагностики меланомы.
Как предрасположенность к РМЖ и РЯ передается по наследству.
Часто у носителей мутаций BRCA1/BRCA2 возникает вопрос – всем ли детям она передалась и какие генетические причины появления наследственной формы РМЖ? Шансы передать повреждённый ген потомству составляют 50%.
Заболевание одинаково наследуется, как мальчиками, так и девочками. Ген, связанный с развитием рака молочной железы и рака яичников, расположен не на половых хромосомах, поэтому вероятность носительства мутации не зависит от пола ребенка.
Если мутация в нескольких поколениях передавалась через мужчин, очень сложно проводить анализ родословных, так как мужчины довольно редко болеют РМЖ даже при наличии генного дефекта.
Например: носителями были дедушка и отец пациентки, и у них заболевание не проявилось. На вопрос, были ли случаи онкологических заболеваний в семье, такая пациентка ответит отрицательно. При отсутствии других клинических признаков наследственных опухолей (ранний возраст/множественность опухолей), наследственная составляющая заболевания может быть не учтена.
При обнаружении мутации BRCA1 или BRCA2 всем кровным родственникам рекомендуется также пройти тестирование.
Почему при генетическом исследовании важно учитывать этнические корни?
Для многих этнических групп характерен свой набор частых мутаций. Национальные корни обследуемого необходимо учитывать при выборе глубины исследования.



Читайте также:

