Генетическая предрасположенность к лейкозу
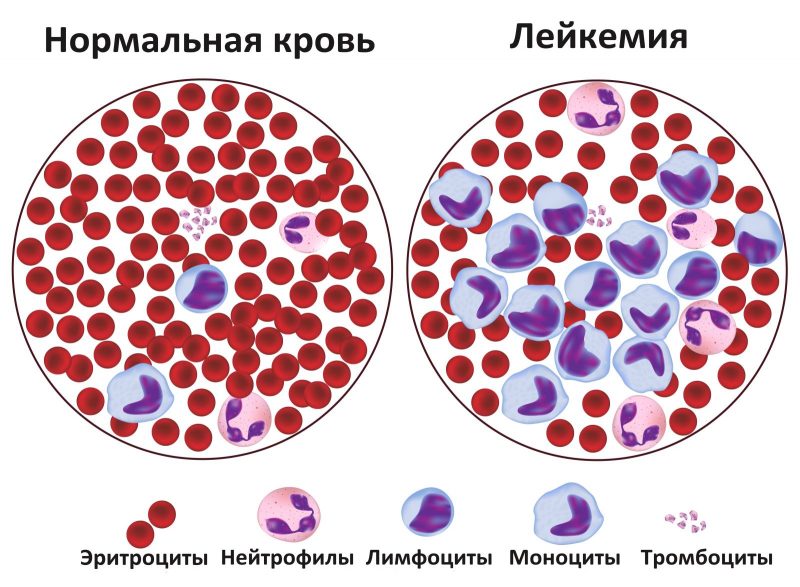
Кровь представляет собой жидкую ткань организма, которая состоит из красных и белых клеток. К первым относятся эритроциты и тромбоциты. Белые представлены гранулоцитами и агранулоцитами. Свое название они получили в результате микроскопического исследования: те клетки, в которых обнаружены гранулы, — гранулоциты. Соответственно, агранулоциты их не имеют. Каждая из фракций крови выполняет определенную функцию. При лейкозе нарушаются функции всех органов и систем человеческого организма.
В составе крови существует четкая пропорция соотношения красных клеток к белым. Ее изменение определяется как лейкоз, то есть разрастание клеток крови одного из ростков — белого или красного. Чаще всего опухолевым изменениям подвергаются белые ростки, поэтому лейкоз иначе называют лейкемией. Опухоль злокачественная, но не называется раком, потому что раковые клетки зарождаются только в эпителиальной ткани.
Причины развития лейкозов
Поражение ростков крови приводит к повреждениям зрелых клеток, которые имеют все признаки опухоли, следовательно, не выполняют полезных функций. Ростки называются мегалобластами, поэтому лейкозы имеют второе название — мегалобластозы. Их изменения происходят на генном уровне в результате необратимых мутаций. Этому способствуют следующие факторы:
- наследственная предрасположенность — чаще всего характерна для хронических лейкозов;
- радиационное поражение — одна из форм лучевой болезни;
- неблагоприятная экологическая обстановка — воздействие канцерогенных факторов;
- синдром иммунодефицита.
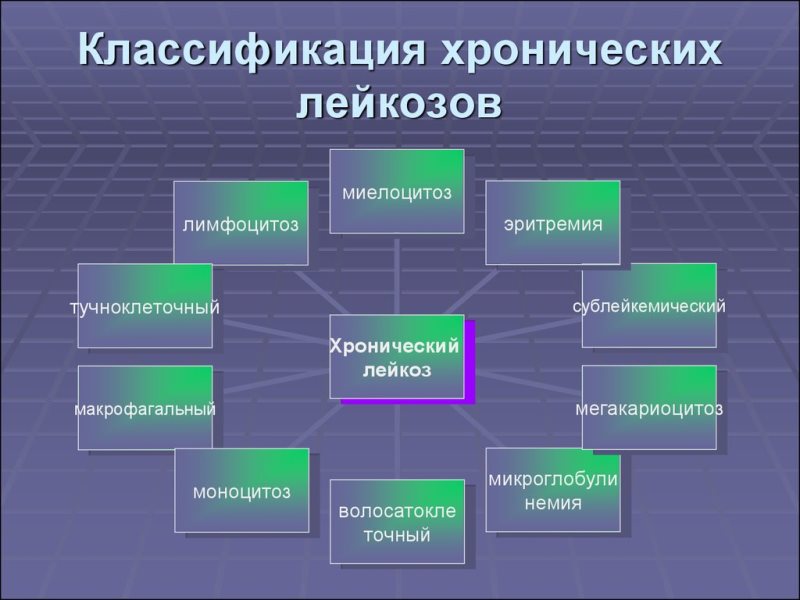
Опухоль зарождается в красном костном мозге. По мере развития лейкоза опухолевые клетки замещают здоровые ростки кроветворения. Попадая в общий кровоток, они метастазируют во все органы и ткани организма. Продолжая размножаться на новых местах локализации, клетки вновь циркулируют по кровеносной системе. В зависимости от того, на каком этапе кроветворения происходит генная мутация, лейкозы подразделяются на острые и хронические.
Классификация лейкозов
Классификация гемобластозов основана на морфологических признаках. Острый лейкоз развивается при поражении унипотентной, стволовой клетки крови. Названия хронических форм зависят от того, какие зрелые клетки крови поражены опухолью. Острая форма лейкоза никогда не станет хронической, которая, в свою очередь, по характеру течения ничем не отличается от острой.
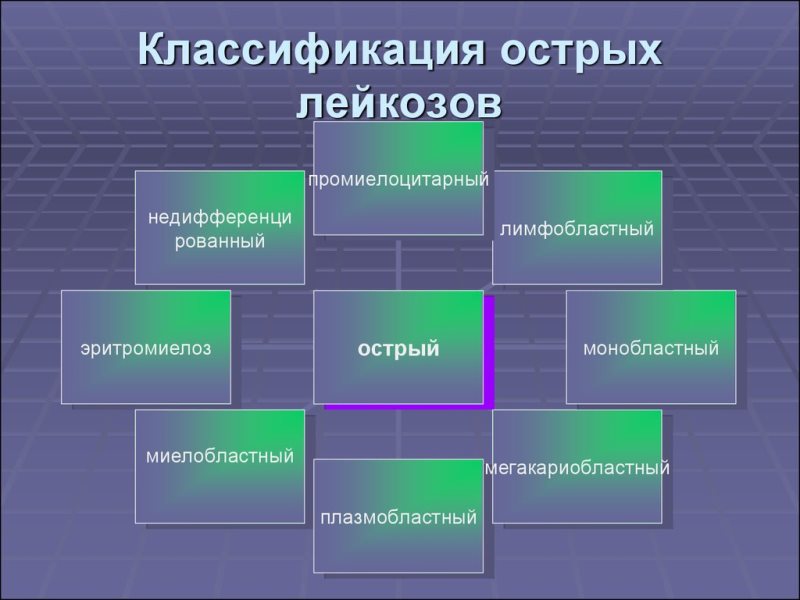
Формы острых лейкозов в зависимости от уровня поражения системы кроветворения:
- миелобластная — стволовые клетки;
- монобластная — моноциты (агранулоциты);
- лимфобластная — лимфоциты (гранулоциты);
- эритромиелобластная — предшественники эритроцитов;
- мегакариобластная — тромбоциты (мегакариоциты);
- недифференцированная — ростки всех клеток крови.
- миелоцитарные, нейтрофильные, эозинофильные, базофильные, миелоидные, тромбоцитемические, эритремические;
- лимфоцитарные — лимфолейкоз, парапротеинемические формы — миеломная и болезнь Сезари, макроглобулинемия Вальденстрема, болезнь Франклина;
- моноцитарные, миеломоноцитарные, гистиоцитоз X.
Симптомы лейкоза:
- боли в костях и суставах;
- кровоточивость;
- увеличение лимфатических узлов, печени, селезенки;
- состояние иммунодефицита — снижение сопротивляемости к инфекциям;
- менингит и энцефалит вследствие метастазов в головной мозг;
- общие явления интоксикации, лихорадка, быстрое похудение, слабость.
Диагностика лейкозов
Диагностические критерии определяются в лаборатории. В зависимости от того, какая именно клетка поражена, выставляется верный диагноз. Генетические исследования позволяют определить стадию и тяжесть опухолевого процесса. Обнаружение экспрессии определенных групп генов и филадельфийской хромосомы имеет значение для выбора препаратов для химиотерапии и своевременного решения о трансплантации красного костного мозга.
Лечение лейкоза
Независимо от формы заболевания, в первую очередь производится уничтожение всех опухолевых клеток — как в месте образования, так и в метастазах. При лейкозах применяется химиотерапия цитостатиками — препаратами, прекращающими рост опухоли. Подбираются средства, к которым чувствительны злокачественные клетки крови. После курса химиотерапии при острых лейкозах производится трансплантация красного костного мозга или проводится повторный курс лечения цитостатиками такой же длительностью и в такой же дозировке. Третий курс химиотерапии — профилактический. При хронических формах лейкоза применяется оперативное лечение и радиотерапия.
Как правило, лейкемия не передаётся между родственниками, то есть она не является наследственным заболеванием. Однако люди могут наследовать генетические отклонения, которые повышают риск развития данной формы рака. Кроме того, вероятность возникновения лейкемии способны повышать факторы, связанные с образом жизни и окружающей средой. К числу таких факторов относятся вредные химические вещества и курение.
В текущей статье мы объясним связь между лейкемией, семейной медицинской историей и генетикой. Мы также обсудим разницу между генетической и наследственной лейкемией, а также рассмотрим факторы риска и дадим советы по профилактике лейкемии.
Передаётся ли лейкемия по наследству?

Лейкемия связана с ДНК, но она не является наследственным заболеванием
Лейкемия — это генетическое заболевание, хотя в большинстве случаев оно не передаётся по наследству.
Данную форму рака принято относить к генетическим состояниям ввиду того, что она связана с ДНК, то есть материалом, который является носителем генетической информации. ДНК определяет развитие, рост и работу клеток.
ДНК ответственна за те характеристики человеческого организма, которые невозможно изменить, например цвет волос и глаз. Однако ДНК также обеспечивает рост и развитие клеток крови, кожи и других структур организма.
Лейкемия развивается на фоне мутации ДНК в клетках костного мозга. Данное состояние вызывает отклонения в развитии клеток крови и костного мозга. Раковые клетки при лейкемии могут предотвращать выработку здоровых клеток.
Такие мутации не всегда передаются между родственниками. Тем не менее изменения ДНК могут быть унаследованы, хотя люди также приобретают их в течение жизни. Связанные с лейкемией мутации ДНК обычно развивается уже после зачатия, а не передаются по наследству от родительских генов.
Иногда родители передают генетические мутации или наследственные заболевания, которые повышают риск развития лейкемии у их детей.
Определённые факторы, например условия окружающей среды, воздействие на организм вредных химических веществ и нездоровый образ жизни, могут приводить к мутациям, которые обуславливают отклонения в ДНК. Однако в большинстве случаев такие мутации возникают по неизвестным причинам.
Острый миелолейкоз — это наследственная форма миелоидной лейкемии. Люди, которые страдают данным состоянием, могут иметь изменённый ген CEBPA.
Факторы риска
Факторы риска — это факторы, которые повышают риск развития у людей определённых медицинских состояний. Они могут быть связаны с генетикой, образом жизни или условиями окружающей среды.
Если человек связан с одним или больше факторами риска развития лейкемии, то это ещё не значит, что однажды у него возникнет данное заболевание.
К числу факторов риска лейкемии относится следующее.
Лейкемия — генетическое заболевание, которое характеризуется изменениями в генах. Люди могут наследовать генетические факторы риска. Кроме того, гены могут изменяться под влиянием условий внешней среды.
Мутации филадельфийской хромосомы трансформируют стволовые клетки в лейкоциты. Такие мутации не передаются по наследству, однако они могут повышать риск развития хронического миелоидного лейкоза.
В 2019 году китайские учёные опубликовали результаты исследования, показавшего, что определённые генные мутации, особенно мутации генов FLT3 и NRAS, часто возникают у людей, страдающих острым миелолейкоз ом 5 варианта. Это вид миело лейкоза, который формируется в незрелых лейкоцитах.
Люди с родственниками первой линии, страдающими лейкемией, имеют повышенный риск развития хронического лимфолейкоза.
По информации экспертов из Центров по контролю и профилактике заболеваний США, острый лимфоцитарный лейкоз чаще затрагивает детей и подростков по сравнению со взрослыми людьми. Острый лимфоцитарный лейкоз — это ещё одна форма лейкемии.
Риск развития хронического лимфолейкоза и острого лимфоцитарного лейкоза повышается по мере взросления. По оценкам Американского онкологического общества, возраст примерно 9 из 10 пациентов с хроническим лимфолейкозом превышает 50 лет.

Мужчины связаны с немного более высоким риском развития лейкемии
Мужчины имеют несколько более высокий риск развития хронического лимфоцитарного лейкоза по сравнению с женщинами. Острый лимфолейкоз также чаще развивается у представителей сильного пола.
Центры по контролю и профилактике заболеваний США отмечают, что чаще всего лейкемия поражает белокожих людей, реже — латиноамериканцев, ещё реже — представителей негроидной расы.
По данным Американского онкологического общества, риск развития острого лимфолейкоза повышают следующие медицинские состояния:
- синдром Дауна;
- синдром Блума;
- синдром Клайнфельтера;
- синдром Ли–Фраумени;
- атаксия-телеангиэктазия (синдром Луи-Бар);
- нейрофиброматоз;
- анемия Фанкони.
Токсические соединения, например промышленные химикаты и радиация, могут повышать риск развития лейкемии. Люди могут попадать под воздействие радиации при прохождении некоторых медицинских процедур, например магнитно-резонансной томографии (МРТ), компьютерной томографии (КТ) или рентгенологического исследования.
Препараты, используемые при химиотерапии, также повышают риск развития лейкемии. Аналогичным эффектом обладают некоторые химические вещества, например бензол, бензин и сигаретный дым.
Бензол — это химическое вещество, которое часто содержится в промышленной продукции — от клея и чистящих средств до стиральных порошков и красок. По данным экспертов из Центров по контролю и профилактике заболеваний США, бензол входит в число тех химических веществ, которые в развитых странах производятся в наибольших объёмах.
Советы по профилактике

Путём отказа от курения можно снизить риск развития лейкемии
Хотя люди не могут контролировать некоторые факторы риска развития лейкемии, например возраст и биологический пол, они могут вносить в свой образ жизни некоторые положительные изменения, например:
- изучать собственные риски и семейную медицинскую историю;
- отказываться от курения;
- стараться не попадать под воздействие бензола, формальдегида и других химических веществ;
- поддерживать здоровый вес путём соблюдения правильной диеты и поддержания достаточного уровня физической активности.
Заключение
Лейкемия вызывает отклонения в развитии клеток крови и костного мозга. Хотя лейкемия не передаётся между родственниками, люди могут наследовать генетические отклонения, которые повышают риск развития данной формы рака.
Факторы внешней среды и образа жизни, например воздействие на организм токсических соединений и курение, могут повышать вероятность возникновения лейкемии.
Люди могут принимать меры по снижению риска развития лейкемии. Для этого необходимо изучать собственные риски и семейную медицинскую историю, а также придерживаться здорового образа жизни.
Лейкемия в большинстве случаев не является наследственной. Однако, человек может унаследовать генетические аномалии, которые повышают риск развития этой формы рака. В других случаях факторы окружающей среды и образ жизни могут увеличить риск развития лейкемии у человека. К таким факторам относятся воздействие токсичных химических веществ и курение.
Лейкемия передается по наследству?
Лейкемия является генетическим заболеванием, поскольку связана с ДНК человека, которая несет генетическую информацию. ДНК определяет развитие, рост и функцию клеток тела, а также отвечает за определение неизменяемых признаков, таких как цвет глаз и волос, а также за рост и развитие крови, кожи и других клеток организма.
Детский лейкоз (лейкемия) развивается за счет мутаций в ДНК клеток костного мозга, приводя к аномальному развитию клеток в крови и костном мозге. Лейкозные клетки могут помешать костному мозгу производить здоровые клетки. Эти мутации не всегда бывают наследственными. Человек может наследовать изменения ДНК от своих родителей или приобретать их в течение всей жизни. Мутации ДНК, связанные с лейкемией, обычно развиваются после зачатия, а не наследуются от генов родителя. Иногда родители передают определенные генетические мутации или наследственные заболевания, которые повышают риск развития лейкемии у ребенка. Некоторые факторы, такие как окружающая среда, воздействие химических веществ и образ жизни, способствуют генетическим мутациям, которые приводят к аномальной ДНК. Однако в большинстве случаев эти мутации происходят по неизвестной причине.
Семейный острый миелоидный лейкоз является наследственной формой острого миелоидного лейкоза (ОМЛ).
Факторы риска развития лейкоза
Фактор риска — это элемент, повышающий риск развития заболевания у человека. Факторы риска могут исходить из генетического состава человека, окружающей среды или образа жизни. Наличие одного или более факторов риска не означает, что у человека будет развиваться болезнь.
Факторы, повышающие риск развития лейкемии, включают:
Лейкемия — это генетическое заболевание, которое вызывает изменения в генах человека. Люди могут наследовать генетические факторы риска, или гены человека могут меняться из-за экологических триггеров. Например, мутации Филадельфийской хромосомы превращают стволовые клетки в лейкоциты. Эта генетическая мутация не наследственная, но она может увеличить риск хронического миелолейкоза. Авторы исследования обнаружили, что некоторые мутации генов, в частности мутации FLT3-ITD и NRAS, часто появляются у людей с типом ОМЛ, который образуется в незрелых белых кровяных клетках.
Наличие родственника первой степени, такого как родитель или брат, с лейкозом может увеличить риск развития хронического лимфолейкоза (ХЛ).
По данным Центров по контролю и профилактике заболеваний (CDC), форма лейкоза, называемая острым лимфолейкозом, поражает детей и подростков чаще, чем взрослых.
Мужчины немного чаще страдают лейкемией, чем женщины.
По данным CDC, лейкемия чаще всего встречается у белых людей, за которыми следуют латиноамериканцы и чернокожие люди.
Следующие наследственные генетические синдромы могут увеличить риск лейкемии:
- Синдром Дауна;
- Синдром Блума;
- Синдром Клайнфельтера;
- Синдром Ли-Фраумени;
- Атаксия-телеангиэктазия;
- Нейрофиброматоз;
- Малокровие Фанкони.
Воздействие окружающей среды
Токсические вещества, такие как промышленные химикаты и радиация, могут увеличить риск лейкемии. Люди могут столкнуться с излучением во время проведения МРТ, рентгенографии и КТ.
Прием химиотерапии также увеличивает риск развития лейкоза.
Такие химикаты как коксобензол, бензин и дым от сигарет, могут повысить риск лейкемии. Бензол — это химическое вещество, присутствующее во многих продуктах, от клея и чистящих средств до моющих средств и красителей.
Рекомендации по профилактике
Хотя люди не могут контролировать определенные факторы риска, такие как возраст и биологический пол, они могут снизить риск лейкемии, изменив образ жизни, например:
- изучить факторы риски и наследственную предрасположенность;
- бросить курить;
- избегать контакта с бензолом, формальдегидом и другими токсичными химическими веществами;
- поддерживать здоровый веса тела, выполнять регулярные физические упражнения и следовать здоровой диете.

Приглашаем подписаться на наш канал в Яндекс Дзен
Виды лейкозов - острые и хронические
Анатомия и физиология костного мозга
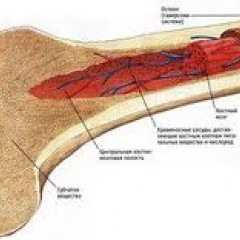
Костный мозг – это ткань находящаяся внутри костей, преимущественно в костях таза. Это самый главный орган, участвующий в процессе кроветворения (рождение новых клеток крови: эритроцитов, лейкоцитов, тромбоцитов). Этот процесс необходим организму, для того чтобы, заменить погибающие клетки крови, новыми. Костный мозг состоит из фиброзной ткани (она образует основу) и кроветворной ткани (клетки крови на разных этапах созревания). Кроветворная ткань включает 3 клеточные линии (эритроцитарный, лейкоцитарный и тромбоцитарный), по которым образуются соответственно 3 группы клеток (эритроциты, лейкоциты и тромбоциты). Общим предком этих клеток, является стволовая клетка, которая запускает процесс кроветворения. Если нарушается процесс образования стволовых клеток или их мутация, то нарушается процесс образования клеток по всем 3 клеточным линиям.
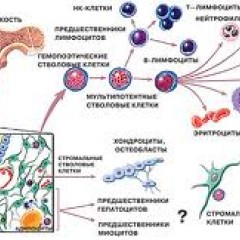
Эритроциты – это красные кровяные клетки, содержат гемоглобин, на нём фиксируется кислород, при помощи которого питаются клетки организма. При недостатке эритроцитов происходит недостаточное насыщение клеток и тканей организма кислородом, в результате чего проявляется различными клиническими симптомами.
Лейкоциты к ним относятся: лимфоциты, моноциты, нейтрофилы, эозинофилы, базофилы. Представляют собой белые клетки крови, они играют роль в защите организма и выработке иммунитета. Их недостаток вызывает снижение иммунитета и развитие различных инфекционных заболеваний.
Тромбоциты – это кровяные пластинки, которые участвуют в образовании тромба. Недостаток тромбоцитов приводит к различным кровотечениям.
Подробнее о видах кровяных клеток читайте в отдельной статье пройдя по ссылке.
Причины лейкоза, факторы риска
Симптомы различных видов лейкозов
- При острых лейкозахотмечаются 4 клинических синдрома:
- Анемический синдром: развивается из-за недостатка выработки эритроцитов, могут присутствовать множество симптомов или некоторые из них. Проявляется в виде усталости, бледности кожи и склер, головокружение, тошнота, быстрое сердцебиение, ломкость ногтей, выпадение волос, патологическое восприятие запаха;
- Геморрагический синдром: развивается в результате недостатка тромбоцитов. Проявляется следующими симптомами: вначале кровотечения из десен, образование синяков, кровоизлияния в слизистые оболочки (язык и другие) или в кожу, в виде мелких точек или пятен. В дальнейшем при прогрессировании лейкоза, развиваются и массивные кровотечения, в результате ДВС синдрома (диссеминированное внутрисосудистое свёртывания крови);
- Синдром инфекционных осложнений с симптомами интоксикации: развивается в результате недостатка лейкоцитов и с последующим снижением иммунитета, повышение температуры тела до 39 0 С, тошнота, рвота, потеря аппетита, резкое снижение веса, головная боль, общая слабость. У больного присоединяются различные инфекции: грипп, пневмония, пиелонефрит, абсцессы, и другие;
- Метастазы - по току крови или лимфы опухолевые клетки попадают в здоровые органы, нарушая их структуру, функции и увеличивая их в размере. В первую очередь метастазы попадают в лимфатические узлы, селезёнку, печень, а потом и в другие органы.
Эритробластный острый лейкоз, поражаются клетки предшественницы, из которых в дальнейшем должны развиться эритроциты. Чаще встречается в пожилом возрасте, характеризуется выраженным анемическим синдромом, не наблюдается увеличение селезёнки, лимфатических узлов. В периферической крови снижено количество эритроцитов, лейкоцитов и тромбоцитов, наличие молодых клеток (эритробластов).
Монобластный острый лейкоз, нарушается выработка лимфоцитов и моноцитов, соответственно они будут снижены в периферической крови. Клинически, проявляется, повышением температуры и присоединением различных инфекций.
Мегакариобластный острый лейкоз, нарушается выработка тромбоцитов. В костном мозге при электронной микроскопии обнаруживают мегакариобласты (молодые клетки, из которых образуются тромбоциты) и увеличенное содержание тромбоцитов. Редкий вариант, но чаще встречается в детском возрасте и обладает неблагоприятным прогнозом.
Хронический миелолейкоз, усиленное образование миелоидных клеток, из которых образуются лейкоциты (нейтрофилы, эозинофилы, базофилы), в результате чего, уровень этих групп клеток будет повышен. Долгое время может протекать бессимптомно. Позже появляются симптомы интоксикации (повышение температуры, общая слабость, головокружение, тошнота), и присоединение симптомов анемии, увеличение селезёнки и печени.
Хронический лимфолейкоз, усиленное образование клеток - предшественниц лимфоцитов, в результате уровень лимфоцитов в крови повышается. Такие лимфоциты не могут выполнять свою функцию (выработка иммунитета), поэтому у больных присоединяются различные виды инфекций, с симптомами интоксикации.
Диагностика лейкоза
- Повышение уровня лактатдегидрогеназы (норма 250 Ед/л);
- Высокий АСАТ (норма до 39 Ед/л);
- Высокая мочевина (норма 7,5 ммоль/л);
- Повышение мочевой кислоты (норма до 400 мкмоль/л);
- Повышение билирубина ˃20мкмоль/л;
- Снижение фибриногена 30%;
- Низкий уровень эритроцитов, лейкоцитов, тромбоцитов.
- Трепанобиопсия (гистологическое исследование биоптата из повздошной кости): не позволяет точно поставить диагноз, а лишь определяет разрастание опухолевых клеток, с вытеснением нормальных клеток.
- Цитохимическое исследование пунктата костного мозга: выявляет специфические ферменты бластов (реакция на пероксидазу, липиды, гликоген, неспецифическую эстеразу), определяет вариант острого лейкоза.
- Иммунологический метод исследования: выявляет специфические поверхностные антигены на клетках, определяет вариант острого лейкоза.
- УЗИ внутренних органов: неспецифический метод, выявляет увеличенные печень, селезёнку и другие внутренние органы с метастазами опухолевых клеток.
- Рентген грудной клетки: является, неспецифическим метом, обнаруживает наличие воспаления в лёгких при присоединении инфекции и увеличенные лимфатические узлы.
Лечение лейкозов
- Полихимиотерапия, применяется с целью противоопухолевого действия:
- Трансфузионная терапия: эритроцитарная масса, тромбоцитарная масса, изотонические растворы, с целью коррекции выраженного анемического синдрома, геморагического синдрома и дезинтоксикации;
- Общеукрепляющая терапия:
- применяется с целью укрепления иммунитета. Дуовит по 1 таблетке 1 раз в день.
- Препараты железа, для коррекции недостатка железа. Сорбифер по 1 таблетке 2 раза в день.
- Иммуномодуляторы повышают реактивность организма. Тималин, внутримышечно по 10-20 мг 1 раз в день, 5 дней, Т-активин, внутримышечно по 100 мкг 1 раз в день, 5 дней;
- Гормонотерапия: Преднизолон в дозе по 50 г в день.
- Антибиотики широкого спектра действия назначаются для лечения присоединяющих инфекций. Имипенем по 1-2 г в сутки.
- Радиотерапия применяется для лечения хронического лейкоза. Облучение увеличенной селезёнки, лимфатических узлов.
Использование солевых повязок с 10% солевым раствором (100 г соли на 1 литр воды). Намочить льняную ткань в горячем растворе, ткань немного сжимать, сложить в четверо, и накладывать на больное место или опухоль, закрепить лейкопластырем.
Настой из измельчённых игл сосны, сухая кожа лука, плоды шиповника, все ингредиенты смешать, залить водой, и довести до кипения. Настоять сутки, процедить и пить вместо воды.
Употреблять соки из красной свеклы, граната, моркови. Кушать тыкву.
Настой из цветков каштана: взять 1 столовую ложку цветков каштана, залить в них 200 г воды, вскипятить и оставить настаиваться на несколько часов. Пить по одному глотку на один приём, необходимо выпить 1 литр в день.
Хорошо помогает в укреплении организма, отвар из листьев и плодов черники. Кипятком примерно 1 литр, залить 5 ложек листьев и плодов черники, настоять несколько часов, выпивать всё за один день, принимать около 3 месяцев.
Рак часто наблюдается у членов одной семьи, объективно подтверждена наследственная природа некоторых злокачественных опухолей. Есть точка зрения, что наследственная предрасположенность — самая вероятная причина всех онкологических заболеваний, и только дело времени, чтобы наука точно установила, мутация какого гена за какой конкретный рак отвечает. Но уже сейчас наследственную передачу рака можно прервать.
Если у человека возникло онкологическое заболевание, очень важно выяснить, есть ли в его роду другие случаи злокачественных новообразований. Семьям, в которых имеется более одного такого случая, нужно пройти консультацию врача-генетика, чтобы понять, есть ли в семейной истории основания для подозрений на наследственный характер патологии. Особенно настораживающим признаком будет онкологическое заболевание в нескольких поколениях семьи. Одним из основных методов работы врача-генетика является составление родословных. Другая важная часть медико-генетической консультации — осмотр и опрос пациента: наследственные заболевания нередко проявляются специфическими признаками.
Принципиальным отличием наследственного рака является возможность его прогнозировать путем выявления патогенных мутаций. На первом этапе семьям, в которых имеется более одного случая развития рака, рекомендуется пройти консультацию врача-генетика, по результатам которого можно будет понять, есть ли в семейной истории основания для подозрения на наследственный характер патологии.
Если в процессе консультации возникают подозрения на наследственную природу заболевания, то следующий этап — целенаправленное генетическое тестирование, поиск мутаций, которые могут вызывать конкретное заболевание. Одни исследования позволяют обнаружить изменения в самом гене, другие — в белке, который кодируется измененным геном. Один ген может претерпеть до 300 мутаций.
В последние годы найдены мутации, ответственные за возникновение и развитие рака молочной железы, яичников, толстой кишки и др. Цель генетического тестирования, или скрининга,— выявить риск возникновения заболевания до появления симптомов. Это дает возможность в одних случаях провести своевременное лечение, в других — рекомендовать меры, позволяющие избежать передачи наследственного заболевания потомству. Мутации генов найдены для нескольких видов рака, тесты на некоторые из них уже используют в клинике — например, тесты на рак груди и кишечника.
От предков или не от предков
Все онкологические заболевания имеют генетическую природу, поскольку при раке гены, отвечающие за правильное деление клетки, повреждены. Но в одних случаях имеют место наследственные мутации, а в других — приобретенные. Результатом повреждения (мутации) гена во всех случаях является бесконтрольное неограниченное деление клеток, что и является сутью ракового процесса.
Несмотря на то что онкологические заболевания имеют генетическую природу, только 10–15% из них передаются по наследству. Почему важно знать, наследственный или ненаследственный рак? Потому что если установлена его наследственная природа, то есть выявлена мутация, вызвавшая его, то известен прогноз и понятна тактика в отношении самого больного и его родственников. Особенно отчетливо наследование мутации прослеживается в случаях так называемого семейного рака молочной железы и яичников, при семейном аденоматозном полипозе и различных опухолевых синдромах (Линча — рак толстой кишки, Ли-Фраумени — разнообразные саркомы и др.). Многие люди, сами будучи здоровыми, являются носителями мутаций, приводящих к наследственным заболеваниям. Если носители одной и той же мутации — оба родителя, заболевание становится неизбежным. Генетическое тестирование позволяет это выявить.
Следует подчеркнуть, что наличие мутации не означает заболевания. Мутация может сидеть в гене много лет до того, как начнет развиваться опухоль. Но, зная про мутацию, врачи могут назначить рациональный режим обследования и профилактического лечения.
Например, у женщин—носительниц гена BRCA1 в 95% случаев в течение жизни разовьется рак груди и в 65% — рак яичников, причем часто рак развивается в молодом возрасте, до 50 лет. Это означает, что носительница должна все время находиться под наблюдением, а в некоторых случаях целесообразно ставить вопрос о профилактическом удалении груди и (или) яичников. У всех на слуху история Анджелины Джоли, которая настояла на удалении обеих молочных желез, поскольку у нее обнаружили мутацию гена BRCA1.
Специалисты знают результаты исследования ткани удаленных молочных желез у 54 шведских женщин—носительниц этого гена в возрасте до 51 года. Ни у одной из них обследование не показывало опухоли груди до операции, но гистологическое изучение удаленной ткани выявило наличие раковых клеток у пяти (10%!) из них.
К профилактической хирургии прибегают и при семейном аденоматозном полипозе, при котором вероятность развития рака толстой кишки после 40 лет достигает 100%, и при других онкологических заболеваниях, если установлена онкогенная мутация.
Понятно, что женщины с отрицательным результатом теста на мутации генов BRCA1 и BRCA2 не застрахованы от спорадического рака груди и яичников. Однако вероятность его возникновения несопоставимо ниже, чем у женщин с положительным тестом.
Женщине следует заподозрить у себя предрасположенность к наследственному раку груди, пройти консультацию врача и генетика и генетическое тестирование, если в семье:
— было более одного случая рака груди или яичников по женской линии (у матери, бабушки, тетки, сестер и т. д.);
— заболевание было диагностировано в молодом возрасте (до наступления климакса);
— были случаи рака груди у мужчины;
— были больные c множественными опухолями (например, у одного человека — рак груди, толстой кишки, матки, рак поджелудочной железы и т. д.);
— были случаи двустороннего рака обеих молочных желез или обоих яичников.
Тестирование и его последствия
Генетическое тестирование имеет несколько преимуществ. Отрицательный результат может принести человеку облегчение, избавить от страха ожидания тяжелой болезни, от которой, возможно, погибли его близкие, а также от регулярных обследований, которые должны быть обязательны в семьях с высоким онкологическим риском. Положительный результат дает человеку возможность принимать обдуманные решения о будущем своем и своего потомства.
Сегодня возможна профилактика наследственного рака, то есть возможность не передать от родителей потомству ген, несущий опасную мутацию. Метод, который позволяет это сделать, называется преимплантационная генетическая диагностика (ПГД). Он заключается в следующем: для пары выполняют ЭКО, проводят генетическую диагностику полученных эмбрионов и переносят в матку женщины только те из них, в которых нет онкогенных мутаций. У родившегося ребенка их не будет, а значит, не будет и наследственного рака.
Открытое письмо Анджелины Джоли, New York Times, 14 мая 2013 года
ПГД проводится не на всем эмбрионе, а на нескольких клетках, которые получают путем его биопсии. Доказано, что биопсия не оказывает влияния на здоровье и состояние ребенка. Другими словами, ПГД не снижает частоту наступления беременности и безопасна для будущего ребенка.
Кроме мутаций, отвечающих за развитие рака груди и яичников, установлены мутации, несущие предрасположенность к меланоме, раку желудка, матки, предстательной, поджелудочной и щитовидной железы, толстой и прямой кишки. Если мутация определена и в семье есть люди, которые хотят иметь ребенка, важно, чтобы они знали о возможности предотвратить передачу следующим поколениям этой мутации и связанного с ней рака с помощью ЭКО и ПГД.
Читайте также:

