Газовые смеси с хлором

Хлор — токсичный, коррозийный, зеленовато-желтый газ с едким, раздражающим запахом. Весит больше воздуха, поэтому при утечке образовывается у пола желто-зеленым скоплением. В спокойном состоянии горению не подлежит, но при повышенных температурах взаимодействует с водородом, что может спровоцировать взрыв, после чего происходит выделение фосгена. Весьма ядовит, даже небольшая плотность его в воздухе (0,001 мг на 1 дм3) может привести к летальному исходу.
Где используется хлор
Большой объем CI2 идет в металлургию для хлорирования при переработке полиметаллических руд и добычи из нее золота, в нефтеперерабатывающей сфере, сельском хозяйстве, медицине, санитарии.
Хлор также используется:
- как средство для отбеливания;
- в препаратах по уничтожению вредных для урожая насекомых, но неопасных для культур;
- в пищевой индустрии действует как добавка E925;
- в химпроизводстве каустической соды;
- при изготовлении искусственного шелка;
- в мыловарении.
Применение хлора в промышленности
Активно используется в промышленных целях, с его помощью получают:
- всевозможные хлорорганические соединения для изготовления пластмассы, синтетических каучуков, химических волокон, растворителей, инсектицидов;
- медикаменты;
- средства дезинфекции.
Больше всего участвует в производстве соляной кислоты, извести, хлоратов. Очищает питьевую воду, не смотря на негативное влияние на организм человека и разрушения трубопроводов. Альтернативные средства применяются реже по причине значительных затрат на ресурсы.
Хранение и транспортировка
Техника безопасности при взаимодействии с хлором
При работе с хлором нужно помнить о его высокой токсичности. В используемых аппаратах может скапливаться взрывоопасные газовые примеси. Вдыхая воздух, содержащий 0,1 мг/л опасного вещества на протяжении 30-60 минут критично для жизни человека, более 0,001 мг/л раздражает дыхательные пути. При скоплении 3-6 мг/м3 начинается ощущение запаха, раздражение глаз и слизистой носа, при 15 мг/м3 – раздражается носоглотка, при 90 мг/м3 – начинаются частые приступы кашля. Более длительный контакт с газом заканчивается летальным исходом.
Присутствие хлора в воздухе определяется газоанализаторами на CL2: ГСА АИГ , Сигма-03 , ЭЛАН плюс , GasBadge Pro , Лидер 021 , GasAlertMicro 5 , GasAlert Extreme , Сенсон-СД-7033 , Сенсон-СД-7032 , Сенсон-СД-7031 , Сенсон-СВ-5023 , Сенсон-СВ-5021 , Сенсон-СД-7033-СМ , Сенсон-СВ-5022 , Сенсон-СД-7032-СМ , Сенсон-СД-7031-СМ , Сенсон-СВ-5021-СМ . Данным оборудованием должны быть оснащены помещения с опасным веществом, для своевременного определения превышенной концентрации и оповещения персонала.
В случае аварии работники цеха должны обезопасить себя специализированными противогазами, а также быть надетыми в защитную спецодежду. Ящики с противогазами должны быть покрашены в желтый цвет.
Для безопасной работы с опасным газом требуется:
- качественное проектирование установок;
- программа пользования и технического обслуживания;
- надлежащие приборы для обеспечения безопасности и знание последовательности действий в случае аварийной ситуации.
Время от времени в обязательном порядке должна проводиться проверка оборудования, для гарантии правильной и надежной работоспособности приборов.
Химзащитная форма персонала должна также осматриваться для определения ее надежности и эффективности, так же как и дыхательные аппараты. Обязательно наличие отдельных закрытых шкафчиков для рабочей и личной одежды.
Необходимость в поверочных газовых смесях возникает у предприятий строительной, химической отраслей, автомобилестроения, авиации, медицины, компаний связанных с контролем над экологией, на вредном производстве, использующих большое количество мощного холодильного оборудования. Производство с использованием лазерных установок и оборонная промышленность так же нуждаются в точной калибровке оборудования. Использование ПГС актуально на стадии первого запуска оборудования, после его ремонта, в плановых проверках, профилактическом тестировании.
Для удобства клиентов компания технические газы в Москве — М-газ производит и осуществляет поставки широкого ряда поверочных газовых смесей. ПГС выпускаются в баллонах под давлением в 10 МПа. Составляющие смеси не реагируют между собой и не вступают в реакцию с внутренней стенкой баллона. При необходимости, мы осуществляем обработку баллонов изнутри специальной краской.
Мы предлагаем:
- однокомпонентные ПГС (аргон, водород, хлор);
- многокомпонентные смеси (аммиак, бутилен, закись азота, сернистый ангидрид, сероводород, сжатый воздух, фосген, фреон, нефтегаз, циклопропан и другие);
- смеси под заказ.
Изготовление газовых смесей под заказ производится из чистых газов, в соответствии с ГОСТом. Доставка осуществляется в баллонах объемом от 5 до 40 литров.

Заказать поверочные смеси у нас можно в новом или б/у баллоне. Второй вариант предусматривает экономию средств, не снижая качество смеси, так как компания М-газ гарантирует соответствие государственным стандартам всех емкостей (металлических и композитных баллонов) и смесей.
М-газ предлагает выгодные условия по поставке поверочных газовых смесей
Преимущества заказа поверочных газовых смесей у нас:
- оперативная доставка (мы транспортируем баллоны с ПГС по всей Москве и области в течение 24 часов с момента формирования заказа);
- качество смесей подтверждено соответствующими сертификатами;
- все баллоны проходят многоуровневую проверку;
- сотрудничество на постоянной основе предусматривает формирование индивидуальных условий.
На складе компании всегда есть в наличии новые и б/у баллоны, в том числе и гост стальные баллоны. Мы регулярно закупаем емкости у предприятий и проводим их переаттестацию и подготовку к повторному использованию. Поэтому все заказы выполняются в наиболее короткие сроки. Доставка может производиться в день формирования заявки.

Сотрудничество на постоянной основе предусматривает заключение договора о поставке баллонов (с газом, ПГС), их регулярном обслуживании (проверке при каждой новой заправке и предоставлении ремонтных работ) для предприятий в указанный срок (с определенной регулярностью или при оформлении заявки). Для оптовых партий или при заказе определенного объема услуг действует специальная цена. Узнать подробности условий сотрудничества можно у менеджера. Для постоянного партнерства укажите в заявке плановый объем закупок баллонов, газа или смесей.
При покупке баллонов у населения мы исключаем возможность сделки для баллонов с коррозией, повреждениями корпуса, наличием трещин и нарушением формы емкости (вмятинами или выпуклостями). Б/у баллоны проходят проверку по внешнему виду, состоянию металла внутри (наличию коррозии и повреждений от высокого давления), исправности всех комплектующих (вентиля, трубки, ручек).
Поставка ПГС возможна оптовыми и розничными партиями. Оба варианта доступны для постоянных клиентов и партнеров, которые обратились впервые. Сопровождающая документация, подтверждающая качество смесей и исправное состояние баллонов, предоставляется при каждой поставке.

Рассмотрены физические свойства хлора: плотность хлора, его теплопроводность, удельная теплоемкость и динамическая вязкость при различных температурах. Физические свойства Cl2 представлены в виде таблиц для жидкого, твердого и газообразного состояния этого галогена.
Основные физические свойства хлора
Хлор входит в VII группу третьего периода периодической системы элементов под номером 17. Он относится к подгруппе галогенов, имеет относительные атомную и молекулярные массы 35,453 и 70,906, соответственно. При температурах выше -30°С хлор представляет собой зеленовато-желтый газ с характерным резким раздражающим запахом. Он легко сжижается под обычным давлением (1,013·10 5 Па), будучи охлажден до -34°С, и образует прозрачную жидкость янтарного цвета, затвердевающую при температуре -101°С.
Из-за своей высокой химической активности свободный хлор не встречается в природе, а существует только в форме соединений. Он содержится главным образом в минерале галите (хлорид натрия NaCl), также входит в состав таких минералов, как: сильвин (KCl), карналлит (KCl·MgCl2·6H2O) и сильвинит (KCl·NaCl). Содержание хлора в земной коре приближается к 0,02% от общего числа атомов земной коры, где он находится в виде двух изотопов 35 Cl и 37 Cl в процентном соотношении 75,77% 35 Cl и 24,23% 37 Cl.
| Свойство | Значение |
|---|---|
| Температура плавления, °С | -100,5 |
| Температура кипения, °С | -30,04 |
| Критическая температура, °С | 144 |
| Критическое давление, Па | 77,1·10 5 |
| Критическая плотность, кг/м 3 | 573 |
| Плотность газа (при 0°С и 1,013·10 5 Па), кг/м 3 | 3,214 |
| Плотность насыщенного пара (при 0°С и 3,664·10 5 Па), кг/м 3 | 12,08 |
| Плотность жидкого хлора (при 0°С и 3,664·10 5 Па), кг/м 3 | 1468 |
| Плотность жидкого хлора (при 15,6°С и 6,08·10 5 Па), кг/м 3 | 1422 |
| Плотность твердого хлора (при -102°С), кг/м 3 | 1900 |
| Относительная плотность по воздуху газа (при 0°С и 1,013·10 5 Па) | 2,482 |
| Относительная плотность по воздуху насыщенного пара (при 0°С и 3,664·10 5 Па) | 9,337 |
| Относительная плотность жидкого хлора при 0°С (по воде при 4°С) | 1,468 |
| Удельный объем газа (при 0°С и 1,013·10 5 Па), м 3 /кг | 0,3116 |
| Удельный объем насыщенного пара (при 0°С и 3,664·10 5 Па), м 3 /кг | 0,0828 |
| Удельный объем жидкого хлора (при 0°С и 3,664·10 5 Па), м 3 /кг | 0,00068 |
| Давление паров хлора при 0°С, Па | 3,664·10 5 |
| Динамическая вязкость газа при 20°С, 10 -3 Па·с | 0,013 |
| Динамическая вязкость жидкого хлора при 20°С, 10 -3 Па·с | 0,345 |
| Теплота плавления твердого хлора (при температуре плавления), кДж/кг | 90,3 |
| Теплота парообразования (при температуре кипения), кДж/кг | 288 |
| Теплота сублимации (при температуре плавления), кДж/моль | 29,16 |
| Молярная теплоемкость Cp газа (при -73…5727°С), Дж/(моль·К) | 31,7…40,6 |
| Молярная теплоемкость Cp жидкого хлора (при -101…-34°С), Дж/(моль·К) | 67,1…65,7 |
| Коэффициент теплопроводности газа при 0°С, Вт/(м·К) | 0,008 |
| Коэффициент теплопроводности жидкого хлора при 30°С, Вт/(м·К) | 0,62 |
| Энтальпия газа, кДж/кг | 1,377 |
| Энтальпия насыщенного пара, кДж/кг | 1,306 |
| Энтальпия жидкого хлора, кДж/кг | 0,879 |
| Показатель преломления при 14°С | 1,367 |
| Удельная электропроводность при -70°С, См/м | 10 -18 |
| Сродство к электрону, кДж/моль | 357 |
| Энергия ионизации, кДж/моль | 1260 |
Плотность хлора
При нормальных условиях хлор представляет собой тяжелый газ, плотность которого приблизительно в 2,5 раза выше плотности воздуха. Плотность газообразного и жидкого хлора при нормальных условиях (при 0°С) равна, соответственно 3,214 и 1468 кг/м 3 . При нагревании жидкого или газообразного хлора его плотность снижается из-за увеличения объема вследствие теплового расширения.
В таблице представлены значения плотности хлора в газообразном состоянии при различных температурах (в интервале от -30 до 140°С) и нормальном атмосферном давлении (1,013·10 5 Па). Плотность хлора меняется с изменением температуры — при нагревании она уменьшается. Например, при 20°С плотность хлора равна 2,985 кг/м 3 , а при повышении температуры этого газа до 100°С, величина плотности снижается до значения 2,328 кг/м 3 .
| t, °С | ρ, кг/м 3 | t, °С | ρ, кг/м 3 |
|---|---|---|---|
| -30 | 3,722 | 60 | 2,616 |
| -20 | 3,502 | 70 | 2,538 |
| -10 | 3,347 | 80 | 2,464 |
| 0 | 3,214 | 90 | 2,394 |
| 10 | 3,095 | 100 | 2,328 |
| 20 | 2,985 | 110 | 2,266 |
| 30 | 2,884 | 120 | 2,207 |
| 40 | 2,789 | 130 | 2,15 |
| 50 | 2,7 | 140 | 2,097 |
При росте давления плотность хлора увеличивается. Ниже в таблицах приведена плотность газообразного хлора в интервале температуры от -40 до 140°С и давлении от 26,6·10 5 до 213·10 5 Па. С повышением давления плотность хлора в газообразном состоянии увеличивается пропорционально. Например, увеличение давления хлора с 53,2·10 5 до 106,4·10 5 Па при температуре 10°С приводит к двукратному увеличению плотности этого газа.
| ↓ t, °С | P, кПа → | 26,6 | 53,2 | 79,8 | 101,3 |
|---|---|---|---|---|
| -40 | 0,9819 | 1,996 | — | — |
| -30 | 0,9402 | 1,896 | 2,885 | 3,722 |
| -20 | 0,9024 | 1,815 | 2,743 | 3,502 |
| -10 | 0,8678 | 1,743 | 2,629 | 3,347 |
| 0 | 0,8358 | 1,678 | 2,528 | 3,214 |
| 10 | 0,8061 | 1,618 | 2,435 | 3,095 |
| 20 | 0,7783 | 1,563 | 2,35 | 2,985 |
| 30 | 0,7524 | 1,509 | 2,271 | 2,884 |
| 40 | 0,7282 | 1,46 | 2,197 | 2,789 |
| 50 | 0,7055 | 1,415 | 2,127 | 2,7 |
| 60 | 0,6842 | 1,371 | 2,062 | 2,616 |
| 70 | 0,6641 | 1,331 | 2 | 2,538 |
| 80 | 0,6451 | 1,292 | 1,942 | 2,464 |
| 90 | 0,6272 | 1,256 | 1,888 | 2,394 |
| 100 | 0,6103 | 1,222 | 1,836 | 2,328 |
| 110 | 0,5943 | 1,19 | 1,787 | 2,266 |
| 120 | 0,579 | 1,159 | 1,741 | 2,207 |
| 130 | 0,5646 | 1,13 | 1,697 | 2,15 |
| 140 | 0,5508 | 1,102 | 1,655 | 2,097 |
| ↓ t, °С | P, кПа → | 133 | 160 | 186 | 213 |
|---|---|---|---|---|
| -20 | 4,695 | 5,768 | — | — |
| -10 | 4,446 | 5,389 | 6,366 | 7,389 |
| 0 | 4,255 | 5,138 | 6,036 | 6,954 |
| 10 | 4,092 | 4,933 | 5,783 | 6,645 |
| 20 | 3,945 | 4,751 | 5,565 | 6,385 |
| 30 | 3,809 | 4,585 | 5,367 | 6,154 |
| 40 | 3,682 | 4,431 | 5,184 | 5,942 |
| 50 | 3,563 | 4,287 | 5,014 | 5,745 |
| 60 | 3,452 | 4,151 | 4,855 | 5,561 |
| 70 | 3,347 | 4,025 | 4,705 | 5,388 |
| 80 | 3,248 | 3,905 | 4,564 | 5,225 |
| 90 | 3,156 | 3,793 | 4,432 | 5,073 |
| 100 | 3,068 | 3,687 | 4,307 | 4,929 |
| 110 | 2,985 | 3,587 | 4,189 | 4,793 |
| 120 | 2,907 | 3,492 | 4,078 | 4,665 |
| 130 | 2,832 | 3,397 | 3,972 | 4,543 |
| 140 | 2,761 | 3,319 | 3,87 | 4,426 |
Жидкий хлор может существовать в относительно узком температурном диапазоне, границы которого лежат от минус 100,5 до плюс 144°С (то есть от температуры плавления до критической температуры). Выше температуры 144°С хлор не перейдет в жидкое состояние ни при каком давлении. Плотность жидкого хлора в этом температурном интервале изменяется от 1717 до 573 кг/м 3 .
| t, °С | ρ, кг/м 3 | t, °С | ρ, кг/м 3 |
|---|---|---|---|
| -100 | 1717 | 30 | 1377 |
| -90 | 1694 | 40 | 1344 |
| -80 | 1673 | 50 | 1310 |
| -70 | 1646 | 60 | 1275 |
| -60 | 1622 | 70 | 1240 |
| -50 | 1598 | 80 | 1199 |
| -40 | 1574 | 90 | 1156 |
| -30 | 1550 | 100 | 1109 |
| -20 | 1524 | 110 | 1059 |
| -10 | 1496 | 120 | 998 |
| 0 | 1468 | 130 | 920 |
| 10 | 1438 | 140 | 750 |
| 20 | 1408 | 144 | 573 |
Удельная теплоемкость хлора
Удельная теплоемкость газообразного хлора Cp в размерности кДж/(кг·К) в интервале температуры от 0 до 1200°С и нормальном атмосферном давлении может быть рассчитана по формуле:
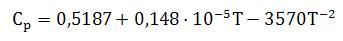
где T — абсолютная температура хлора в градусах Кельвина.
Следует отметить, что при нормальных условиях удельная теплоемкость хлора имеет значение 471 Дж/(кг·К) и при нагревании увеличивается. Рост теплоемкости при температурах выше 500°С становится незначительным, и при высоких температурах удельная теплоемкость хлора практически не изменяется.
В таблице приведены результаты расчета удельной теплоемкости хлора по указанной выше формуле (погрешность расчета составляет около 1%).
| t, °С | Cp, Дж/(кг·К) | t, °С | Cp, Дж/(кг·К) |
|---|---|---|---|
| 0 | 471 | 250 | 506 |
| 10 | 474 | 300 | 508 |
| 20 | 477 | 350 | 510 |
| 30 | 480 | 400 | 511 |
| 40 | 482 | 450 | 512 |
| 50 | 485 | 500 | 513 |
| 60 | 487 | 550 | 514 |
| 70 | 488 | 600 | 514 |
| 80 | 490 | 650 | 515 |
| 90 | 492 | 700 | 515 |
| 100 | 493 | 750 | 515 |
| 110 | 494 | 800 | 516 |
| 120 | 496 | 850 | 516 |
| 130 | 497 | 900 | 516 |
| 140 | 498 | 950 | 516 |
| 150 | 499 | 1000 | 517 |
| 200 | 503 | 1100 | 517 |
При температуре близкой к абсолютному нулю хлор находится в твердом состоянии и имеет низкую величину удельной теплоемкости (19 Дж/(кг·К)). По мере увеличения температуры твердого Cl2 его теплоемкость растет и достигает при минус 143°С величины 720 Дж/(кг·К).
Жидкий хлор имеет удельную теплоемкость 918…949 Дж/(кг·К) в интервале от 0 до -90 градусов Цельсия. По данным таблицы видно, что удельная теплоемкость жидкого хлора выше чем газообразного и при увеличении температуры снижается.
| Твердый хлор | Жидкий хлор | ||
|---|---|---|---|
| t, °С | Cp, Дж/(кг·К) | t, °С | Cp, Дж/(кг·К) |
| -273 | 19 | -90 | 949 |
| -269 | 209 | -80 | 944 |
| -243 | 315 | -70 | 935 |
| -193 | 595 | -30 | 929 |
| -143 | 720 | 0 | 918 |
Теплопроводность хлора
В таблице представлены значения коэффициентов теплопроводности газообразного хлора при нормальном атмосферном давлении в интервале температуры от -70 до 400°С.
Коэффициент теплопроводности хлора при нормальных условиях составляет 0,0079 Вт/(м·град), что в 3 раза меньше чем у воздуха при тех же температуре и давлении. Нагревание хлора приводит к повышению его теплопроводности. Так, при температуре 100°С, значение этого физического свойства хлора увеличивается до 0,0114 Вт/(м·град).
| t, °С | λ, Вт/(м·град) | t, °С | λ, Вт/(м·град) |
|---|---|---|---|
| -70 | 0,0054 | 50 | 0,0096 |
| -60 | 0,0058 | 60 | 0,01 |
| -50 | 0,0062 | 70 | 0,0104 |
| -40 | 0,0065 | 80 | 0,0107 |
| -30 | 0,0068 | 90 | 0,0111 |
| -20 | 0,0072 | 100 | 0,0114 |
| -10 | 0,0076 | 150 | 0,0133 |
| 0 | 0,0079 | 200 | 0,0149 |
| 10 | 0,0082 | 250 | 0,0165 |
| 20 | 0,0086 | 300 | 0,018 |
| 30 | 0,009 | 350 | 0,0195 |
| 40 | 0,0093 | 400 | 0,0207 |
Вязкость хлора
Коэффициент динамической вязкости газообразного хлора в интервале температуры 20…500°С можно приближенно вычислить по формуле:
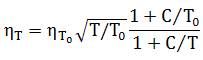
где ηT — коэффициент динамической вязкости хлора при заданной температуре T, К;
ηT0 — коэффициент динамической вязкости хлора при температуре T0=273 К (при н. у.);
С — константа Сюзерленда (для хлора С=351).
При нормальных условиях динамическая вязкость хлора равна 0,0123·10 -3 Па·с. При нагревании такое физическое свойство хлора, как вязкость, принимает более высокие значения.
| t, °С | η, 10 -3 Па·с | t, °С | η, 10 -3 Па·с |
|---|---|---|---|
| 0 | 0,0123 | 200 | 0,0209 |
| 20 | 0,0133 | 250 | 0,0229 |
| 25 | 0,0136 | 300 | 0,0249 |
| 50 | 0,0147 | 400 | 0,0287 |
| 100 | 0,0168 | 500 | 0,0333 |
| 150 | 0,0189 | 600 | 0,0373 |
Жидкий хлор имеет вязкость на порядок выше, чем газообразный. Например, при температуре 20°С динамическая вязкость жидкого хлора имеет величину 0,345·10 -3 Па·с и при росте температуры снижается.
| t, °С | η, 10 -3 Па·с | t, °С | η, 10 -3 Па·с |
|---|---|---|---|
| -53 | 0,569 | 20 | 0,345 |
| -45 | 0,53 | 35 | 0,323 |
| -35 | 0,494 | 50 | 0,3 |
| 0 | 0,385 | 75 | 0,275 |
| 10 | 0,365 | 100 | 0,249 |
- Барков С. А. Галогены и подгруппа марганца. Элементы VII группы периодической системы Д. И. Менделеева. Пособие для учащихся. М.: Просвещение, 1976 — 112 с.
- Варгафтик Н. Б. Справочник по теплофизическим свойствам газов и жидкостей.
- Таблицы физических величин. Справочник. Под ред. акад. И. К. Кикоина. М.: Атомиздат, 1976 — 1008 с.
- Якименко Л. М., Пасманик М. И. Справочник по производству хлора, каустической соды и основных хлорпродуктов. Изд. 2-е, пер. и др. М.: Химия, 1976 — 440 с.
Задача 71.
При прохождении смеси равных объемов SO 2 и О 2 через контактный аппарат 90% молекул SO 2 превращается в SO 3 . Определить состав (в процентах по объему) газовой смеси, выходящей из контактного аппарата.
Решение:
Уравнение реакции горения сернистого газа имеет вид:
Из уравнения реакции вытекает, что из двух молекул SO2 и одной молекулы O2 образуются две молекулы SO3. Известно, что из каждого литра SO2 превратилось в SO3 0,9л, при этом образовалось тоже 0,9л SO3.Кислорода на каждый литр прореагировало соответственно 0,45л О2 (0,9/2 = 0,45).
Таким образом, выходящая смесь газов из контактного аппарата, на каждый литр смеси состояла из 0,1л SO2 (1 – 0,9 = 0,1) и 0,55л О2 (1 – 0,45 = 0,55). Общий объём смеси, выходящей из контактного аппарата, составляет 1,55л (0,1 + 0,55 + 0,9 = 1,55).
Задача 72.
Смесь, состоящая из трех объемов Сl2 и одного объема H2, оставлена в закрытом сосуде на рассеянном свету при постоянной температуре. Через некоторое время содержание Сl2 в смеси уменьшилось на 20%. Изменилось ли давление в сосуде? Каков процентный состав смеси по объему?
Решение:
Уравнение реакции взаимодействия хлора с водородом имеет вид:
При взаимодействии одного моля хлора с одним моль водорода образуется два объёма хлороводорода, т. е. реакция идёт без изменения объёма. При нормальных условиях из трёх литров хлора в реакцию вступило 0,6л (3 . 0,2 = 0,6). Точно такое же количество водорода тоже вступило в реакцию. Таким образом, при взаимодействии 0,6л хлора и 0,6л водорода образовалось 1,2л хлороводорода (2 . 3 = 0,6). Так как реакция идёт без изменения объёма, то давление в системе тоже не изменится.
Находим процентный состав газовой смеси по формуле:

Задача 73.
При взаимодействии NН3 с Сl2 образуются хлороводород и азот. В каких объемных соотношениях взаимодействуют NH3 и С12 и каково отношение объемов получающихся газов?
Решение:
Уравнение реакции взаимодействия аммиака с хлором имеет вид:
При взаимодействии аммиака с хлором из каждых двух объёмов аммиака и трёх объёмов хлора образуются шесть объёмов хлороводорода и один объём азота. Таким образом, аммиак и хлор взаимодействуют в объёмных отношениях 2 : 3 (2VNH3 : 3VCl), а отношение объёмов получающихся газов – 1 : 6 V(N2 : V(HCl).
Ответ: V(NH3) : V(Cl2) = 2 : 3; V(HCl) : V(N2) = 6 : 1.
Задача 74. Какой объем Н2 (при 17°С и давлении 102,4кПа) выделится при растворении 1,5кг цинка в соляной кислоте?
Решение:
Уравнение реакции имеет вид:
Зная мольную массу цинка (65,4г/моль) и мольный объём газа (22,4л), находим объём водорода, который выделится при растворении 1,5кг цинка из пропорции:
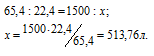
Затем приводим полученный объём к указанным условиям используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
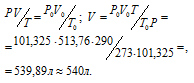
где P и V - давление и объём газа при температуре T = 290К (273 +17 = 290); P0 = 101,325 кПа; T0 = 273 К; P = 102,4 кПа; V0 -объём газа (н.у.) = 513,76 л.
Ответ: 540л.
Задача 75.
После взрыва смеси, состоящей из одного объема исследуемого газа и одного объема Н2, получился один объем водяного пара и один объем азота. Все измерения производились при одинаковых условиях. Найти формулу исследуемого газа.
Решение:
Молекулярная формула воды H2O, а азота – N2. Так как продукты реакции и исходные вещества состоят из одинаковых объёмов, то, учитывая, что образуются по одной молекуле воды и азота из одной молекулы водорода и одной молекулы исследуемого газа, можно предположить, что молекула исследуемого газа состоит из двух атомов азота и одного атома кислорода. Следовательно, формула исследуемого газа имеет вид N2O.
Ответ: N2O.
Задача 76
При одинаковых условиях взяты равные объемы N2 и O2. Каково соотношение масс обоих газов:
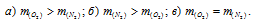
Решение:
Согласно закону Авогадро, в равных объёмах любых газов, взятых при одинаковых условиях (одной и той же температуре и одинаковом давлении) содержится одинаковое число молекул (6,02 . 10 23 ). Поскольку M(O2) равен 32 г/моль, а M(N2) – 28г/моль, то m(O2) > m(N2)
Ответ: а).
Задача 77.
Смешали равные объемы Н2 и С12. Как изменится объем смеси после протекания реакции: а) не изменится;
б) увеличится в два раза; в) уменьшится в два раза?
Решение:
Уравнение реакции взаимодействия хлора с водородом имеет вид:
При взаимодействии одного моля хлора с одним моль водорода образуется два объёма хлороводорода, т.е. реакция идёт без изменения объёма. Поэтому объём смеси после протекания реакции не изменится.
Ответ: а).
Задача 78.
Каково соотношение объемов, занимаемых 1 моль НСI и 1 моль Сl2 (Т и Р одинаковы):
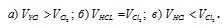
Решение:
Согласно закону Авогадро одно и тоже число молекул любого газа занимает при одинаковых условиях (температура и давление одинаковы) один и тот же объём. Вместе с тем 1 моль любого газа содержит одинаковое число молекул. Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же объём. Этот объём называется мольным объёмом газа и при нормальных условиях (Т = 0 0 С и Р = 101,325 кПа) равен 22,4л. Поэтому соотношение объёмов одного моля HCl и одного моля Cl2 (T и Р одинаковы):
Ответ: б).
Задача 79.
При нагревании НВг полностью разлагается. При этом объём газа не изменяется. Каковы продукты реакции разложения: а) атомы Н и Вг; б) молекулы Н2 и Вг2 в) молекулы Н2 и атомы Br?
Решение:
Уравнение реакции термического разложения бромоводорода имеет вид:
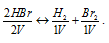
Таким образом, из двух молекул НВг образуются одна молекула Н2 и одна молекула Вг2, т.е. объём системы после реакции не изменяется. Следовательно, продуктами реакции термического разложения HBr являются газообразные Н2 и Вг2.
Читайте также:

