Гамма-терапия при раке шейки матки
ГАММА-ТЕРАПИЯ (гамма[-излучение]+ греч, therapeia лечение) — вид лучевой терапии, основанный на использовании гамма-излучения.
Источниками гамма-излучения служат естественные изотопы — радий и мезоторий и искусственные — кобальт, цезий, иридий и тантал.
Длительный период полураспада этих изотопов ( 226 Ra — 1620 лет, 228 Msth — 6,7 года, 60 Со — 5,25 года, 137 Cs — 30 лет, 192 Ir — 74,4 дня, 182 Та — 111 дней) обусловливает их применение только для наружного облучения; в ткани их вводят в герметически закрытых металлических трубках-фильтрах, изготовленных либо из тяжелого металла (для 226 Ra и 228 Msth), либо из никеля, нержавеющей стали или тонкого слоя золота (для 60 Со, 137 Cs, 192 Ir, 182 Та).
Методика Г.-т. (расположение источника излучения по отношению к облучаемому органу) зависит от локализации, объема и гистол, строения патол, образования.
Содержание
- 1 Дистанционная гамма-тeрапия
- 2 Внутриполостная гамма-терапия
- 3 Внутритканевая гамма-терапия
- 4 Аппликационная гамма-терапия
- 5 Осложнения
- 6 Противопоказания
Дистанционная гамма-тeрапия
Дистанционную гамма-тeрапию (телегамматерапию) применяют в комбинации с хирургическим методом лечения — до и после операции — и самостоятельно для лечения по радикальному плану или с паллиативной целью. Под влиянием предоперационного облучения изменяются биол, свойства опухоли, снижается митотическая активность опухолевых клеток, разрушаются анапластические клетки, наиболее склонные к диссеминации, в результате чего уменьшается частота рецидивов и метастазов. Цель послеоперационного облучения — воздействие на клетки, диссеминированные во время операции, а при нерадикальных операциях и на остаточную опухолевую ткань. Как самостоятельный метод лечения дистанционную Г.-т. применяют с целью достижения полной регрессии опухоли путем разрушения наиболее чувствительных к излучению опухолевых клеток, стойкого нарушения процессов размножения менее чувствительных клеток и усиления реакции окружающей соединительной ткани, к-рая, разрастаясь в самой опухоли и вокруг нее, разделяет опухоль на отдельные комплексы и нарушает ее кровоснабжение.
Источник излучения ( 137 Cs, 60 Со) находится на расстоянии 6—75 см от поверхности тела больного. Для лечения патол, процессов, расположенных на глубине 3—5 см от поверхности тела (рак гортани, миндалин, щитовидной железы, метастазы рака в периферических лимф, узлах), можно производить облучение как на малом, так и на большом расстоянии; при локализации патол, процесса на глубине более 5 см — только на большом расстоянии. Облучение может быть статическим и подвижным. В первом случае источник излучения и больной находятся в фиксированном положении. При подвижном облучении источник излучения перемещается относительно оси тела больного (длинной или короткой) обычно на 90—360°. Угол вращения от 360 до 240° показан при центральном расположении опухоли, длинник к-рой совпадает или параллелен оси тела больного. При эксцентрическом расположении опухоли угол вращения должен быть меньше. Эксцентрическое секторное облучение применяют при поверхностном расположении патол, образований. Подвижное облучение позволяет сконцентрировать максимум дозы в области патол, очага и уменьшить ее на поверхности тела. Вращение источника излучения можно производить вокруг одной, двух или четырех осей. Двух- и четырехосное облучение чаще применяют при лечении распространенных патол, процессов в органах таза. Размеры полей облучения определяют таким образом, чтобы в зону 100% изодозы входила первичная опухоль и регионарные метастазы, а в зону 80% изодозы — область субклиническом распространения опухоли. По мере уменьшения размеров опухоли в процессе Г.-т. поля облучения, учитывая малую толерантность здоровых органов и тканей, включаемых в зону облучения, и большую радиочувствительность периферической части опухоли (см. Радиочувствительность), соответственно уменьшают. Для перемещения максимума дозы в патол, очаг в целях защиты радиочувствительных органов от действия излучения применяют свинцовые блоки и клиновидные фильтры. При Г.-т. больших опухолей для повышения толерантности подкожной клетчатки и близко расположенных органов и тканей необходимо использовать свинцовые решетки или растры. Величина общей очаговой дозы при дистанционной Г.-т. определяется гистол. строением опухоли или характером патол, процесса, его распространением, локализацией, возрастом больного, наличием сопутствующих заболеваний. Облучение производят фракционно. Дозы и интервалы между облучениями зависят от длительности митотического цикла опухолевых и нормальных клеток и от других факторов. При ежедневном фракционированном облучении разовая доза составляет 150—250 рад; при облучении с 2—3-дневными интервалами— 300—500 рад; при крупном фракционированном облучении с интервалом в 7 дней — 700—1000 рад. При увеличении разовой дозы соответственно уменьшают общую дозу.
При лечении рака полостных органов (шейки и тела матки, прямой кишки, мочевого пузыря, носоглотки, пищевода и др.) дистанционную Г.-т. целесообразно сочетать с внутриполостной.
Внутриполостная гамма-терапия
Внутриполостную гамма-терапию применяют при небольших опухолях прямой кишки, мочевого пузыря, полости носа после удаления небольших экзофитных опухолей этих органов или при любых размерах опухоли в сочетании с наружным облучением (при раке влагалища, матки, прямой кишки, мочевого пузыря, пищевода, носоглотки). Применение внутриполостной Г.-т. обусловлено необходимостью увеличения очаговой дозы в наиболее резистентной части опухоли, что вполне возможно вследствие быстрого падения мощности дозы излучения при распределении ее в тканях (уже на глубине 2 см остается до 40% дозы). В качестве источника излучения используют препараты 60Со цилиндрической или шаровидной формы (так наз. бусы), покрытые неактивным золотом.
В пораженную полость вводят и фиксируют в ней специальные аппликаторы, зонды или баллоны. Положение их по отношению к опухоли и соседним органам контролируют по рентгенограммам. Радиоактивные препараты из контейнера ручным способом или автоматически перемещают в аппликаторы. Мощность дозы определяют в зависимости от характера и распространения патол, процесса. Облучение с высокой мощностью дозы проводят в течение 30—60 мин. с интервалом в 1 нед. (при раке шейки, тела матки и прямой кишки), с малой мощностью — в течение 4—8 час. с интервалом в 3—4 дня (при раке пищевода, носоглотки и прямой кишки) или в течение 24— 48 час. с интервалом в 5—6 дней (при раке шейки, тела матки и носоглотки). В зависимости от локализации патол, очага и типа фракционирования аппликации повторяют 2—6 раз.
Внутритканевая гамма-терапия
Внутритканевую гамма-терапию применяют при лечении четко отграниченных опухолей диаметром не более 5 см, со средней и малой радиочувствительностью (рак языка, слизистой оболочки полости рта, нижней губы, кожи, рецидивы опухолей различного гистол, строения, неоперабельные метастазы в лимф, узлах, рак мочевого пузыря в первой стадии, рак в области анального канала). При внутритканевой Г.-т. радиоактивные препараты в виде игл или найлоновых трубочек, содержащих б0Со, 182Та или 192Ir (см. Радиоактивные препараты), вводят непосредственно в опухоль и вокруг нее, располагая их параллельными рядами на расстоянии 1—1,5 см друг от друга или по прямоугольнику. Для фиксации радиоактивных игл используют приспособления из оргстекла или пластмассы. Помимо гамма-излучающих препаратов, можно применять жидкие изотопы со смешанным излучением (гамма и бета). При введении препаратов необходимо соблюдать правила асептики.
Облучение производят с малой мощностью излучения непрерывно в течение 6—8 дней. Общая доза в зависимости от объема облучаемого патол, очага—5000—7000 рад при мощности излучения 30— 40 рад в час. Распределение дозы при внутритканевом облучении характеризуется быстрым падением ее мощности на расстоянии 1 см от препарата, благодаря чему осуществляется локальное воздействие, обеспечивающее его высокую биол, эффективность.
При метастазах рака полости рта и гортани в лимф, узлы подчелюстной области и шеи, при раке молочной железы, саркоме мягких тканей и других операбельных и стоящих на грани неоперабельности злокачественных опухолях, а также с целью предотвращения рецидивов и метастазов опухоли по брюшине и лимф, путям после операции по поводу рака желудка, кишечника и яичников применяют радиохирургический метод внутритканевой Г.-т.: опухоль удаляют, а в ее ложе и в окружающие ткани вводят радиоактивные препараты или ткани инфильтрируют коллоидными радиоактивными растворами. Коллоидный раствор 198Au, разведенный в изотоническом растворе хлорида натрия, вводят в брюшную полость через 10—14 дней после операции. Для анестезии брюшины применяют 0,25% раствор новокаина: 200 мл до введения радиоактивного препарата и столько же после.
Аппликационная гамма-терапия
Аппликационная гамма-терапия показана при доброкачественных (кавернозные ангиомы) и злокачественных опухолях кожи и слизистых оболочек, распространяющихся по поверхности и инфильтрирующих ткани вглубь не более чем на 1 —1,5 см. Источники излучения (60Со, 137Cs) располагают в одной плоскости в виде прямоугольника, квадрата или многоугольника. Препараты укладывают на предварительно приготовленном слепке (муляже) пораженной области, сделанном из пластической, затвердевающей при комнатной температуре массы. По мере прохождения излучения через опухолевую ткань отмечается быстрое падение мощности дозы: на глубине 2 см нормальные ткани не повреждаются. Облучение проводят ежедневно фракционно, разовая доза — 200—600 рад в течение 4—10 час. в день. В связи с трудностями радиационной защиты больного и обслуживающего персонала аппликационный метод применяют редко.
Осложнения
Осложнения при Г.-т., так же как и при других видах лучевой терапии (см. Лучевые повреждения), возникают при понижении толерантности нормальных тканей и органов, вызванном сопутствующими заболеваниями (гипертоническая болезнь, гипотензия, диабет, аллергии различной этиологии, сердечно-сосудистая недостаточность, авитаминоз, белковое голодание, ожирение). Причиной осложнений могут быть также ошибки при составлении плана терапии и отсутствие учета радиочувствительности соседних органов; в редких случаях — высокая индивидуальная радиочувствительность.
Характер осложнений определяется и методом Г.-т. При дистанционной Г.-т. осложнения чаще проявляются развитием склероза и атрофии облученных тканей и органов (фиброз подкожной клетчатки, пневмосклероз и др.); наиболее серьезные осложнения внутриполостной Г.-т.— перфорация органа, лучевые язвы, свищи; при внутритканевой Г.-т. (в случае расположения радиоактивных препаратов близко к хрящевой или костной ткани) — лучевые перихондриты, остеомиелит и лучевые язвы (в мягких тканях).
Противопоказания
Противопоказания к Г.-т.: 1) абсолютные — кахексия, истощение, декомпенсированные формы заболеваний сердца, печени, почек, гипоплазия костного мозга, наличие свищей в соседние полостные органы и выраженные склеротические изменения в тканях, вызванные предшествующей лучевой терапией, прогрессирующие формы туберкулеза; 2) относительные — воспалительные процессы, сопровождающие развитие опухоли, обширные опухолевые процессы, склонность опухоли к распаду и кровоточивости.
Библиография: Козлова А. В. Лучевая терапия злокачественных опухолей, М., 1971, библиогр.; П а в л о в А. С. Внутритканевая гамма- и бетатерапия злокачественных опухолей, М., 1967, библиогр.; Ратнер Т. Г. и Бибер-г а л ь А. В. Формирование дозных полей при дистанционной гамматерапии, М., 1972, библиогр.

- Симптомы рака шейки матки
- Причины возникновения
- Разновидности рака шейки матки
- Распространение рака шейки матки в организме
- Диагностика рака шейки матки
- Лечение рака шейки матки
- Профилактика
- Прогноз при плоскоклеточном раке шейки матки
- Цены на лечение рака шейки матки
Симптомы рака шейки матки

Проявления заболевания неспецифичны и могут встречаться при других патологиях, например, урогенитальных инфекциях :
- Обильные, длительные месячные. Этот симптом имеет значение, если месячные изменились недавно, если прежде они были нормальными.
- Вагинальные кровотечения в промежутках между месячными, после полового акта, после наступления менопаузы.
- Необычные выделения из влагалища: обильные, розового цвета, с неприятным запахом.
- Тазовые боли во время полового акта.
В большинстве случаев эти проявления вызваны не онкологическим заболеванием. Но риск, пусть и небольшой, есть всегда, поэтому при возникновении первых симптомов нужно посетить врача.
На более поздних стадиях к перечисленным симптомам присоединяются такие признаки, как резкая беспричинная потеря веса, боли в пояснице и в ногах, постоянное чувство усталости, патологические переломы костей (признак костных метастазов), подтекание мочи из влагалища.
Причины возникновения
Точные причины рака шейки матки назвать сложно. Но известны факторы риска, которые повышают вероятность возникновения рака шейки матки.
Наиболее значимый фактор риска – папилломавирусная инфекция. По разным данным, до 99% случаев рака шейки матки связаны с вирусами папилломы человека (ВПЧ). До 80% женщин в течение жизни оказываются инфицированы этим возбудителем. Всего существует около 100 типов ВПЧ, из них 30–40 передаются половым путем, лишь 165 повышают риск рака. Но это не значит, что они гарантированно вызовут рак. Типы вируса 16, 18, 31, 33, 35, 39, 45, 51, 52, 56 и 58 относят к высокоонкогенным, 6, 11, 42, 43 и 44 – к низкоонкогенным. Чаще всего виновниками рака шейки матки становятся ВПЧ 16 и 18 типов. Наиболее уязвима к ним зона трансформации (см. ниже). Помимо рака шейки матки, ВПЧ вызывают злокачественные опухоли других органов репродуктивной системы, глотки, ротовой полости, анального канала.
Другие факторы риска:
- Ослабленная иммунная система. Если иммунитет женщины работает нормально, ее организм избавляется от вируса папилломы в течение 12–18 месяцев. Но если защитные силы ослаблены, инфекция сохраняется дольше и повышает риск рака.
- Беспорядочные половые связи. Частая смена партнеров повышает вероятность заражения ВПЧ.
- Акушерский анамнез. Если у женщины было три или более беременностей, либо если первая беременность была до 17 лет, риски повышены в два раза.
- Наследственность. Если у матери или родной сестры женщины диагностирован рак шейки матки, ее риски повышены в 2–3 раза.
- Курение. Вредная привычка также повышает риски вдвое.
- Применение оральных контрацептивов в течение 5 лет и дольше. После прекращения их приема риски снижаются в течение нескольких лет.
Разновидности рака шейки матки
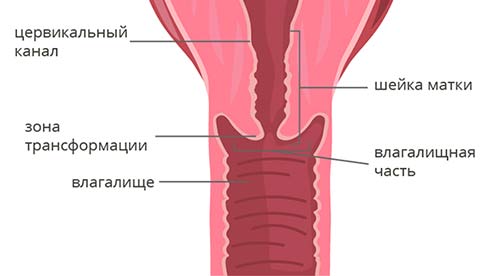
Чтобы понять классификацию рака шейки матки, в первую очередь нужно немного разобраться в ее анатомическом и гистологическом строении. Шейка матки имеет длину 2–3 см и состоит из двух частей:
- Влагалищная часть (экзоцервикс) выступает во влагалище, это то, что гинеколог видит во время осмотра на зеркалах. Слизистая оболочка эндоцервикса состоит из многослойного плоского эпителия .
- Цервикальный канал (эндоцервикс) находится внутри и соединяет влагалище с маткой. Он выстлан цилиндрическим эпителием .
Граница между влагалищной частью и цервикальным каналом называется зоной трансформации.
В 70–90% случаев злокачественные опухоли шейки матки представлены плоскоклеточным раком. Он развивается из многослойного плоского эпителия. Чаще всего злокачественное перерождение происходит в зоне трансформации. В зависимости от того, как выглядит опухолевая ткань под микроскопом, плоскоклеточный рак шейки матки делят на ороговевающий и неороговевающий:
- Ороговевающий плоскоклеточный рак шейки матки называется так потому, что клетки, из которых он состоит, склонны к ороговению. Они крупные, имеют неправильную форму, относительно низкую интенсивность деления. При микроскопическом исследовании обнаруживаются образования, которые называются кератогиалиновыми гранулами и “раковыми жемчужинами”.
- При неороговевающем плоскоклеточном раке шейки матки клетки не склонны к ороговению. Они крупные, имеют форму овала или многоугольника, размножаются более интенсивно.
В зависимости от того, насколько раковые клетки отличаются от нормальных, злокачественные опухоли шейки матки делят на высоко-, умеренно- и низкодифференцированные. Последние ведут себя наиболее агрессивно. Плоскоклеточный ороговевающий рак относят к зрелым формам, он встречается примерно в 20% случаев. Неороговевающий рак - это опухоли средней степени зрелости, они составляют 60-70%. Незрелая форма - это низкодифференцированный рак.
В остальных случаях рак шейки матки представлен аденокарциномой. Она развивается из железистых клеток, продуцирующих слизь. За последние 20–30 лет этот тип злокачественных опухолей стал более распространенным.
Намного реже встречаются аденосквамозные карциномы. Эти опухоли сочетают в себе черты плоскоклеточного рака и аденокарциномы. Чтобы определить тип злокачественной опухоли, нужно провести биопсию.
Распространение рака шейки матки в организме
По мере роста, рак шейки матки распространяется на соседние органы. В первую очередь поражаются регионарные лимфатические узлы, окружающая клетчатка (параметрий).
Часто отмечается поражение верхней трети влагалища, что неудивительно, так как оно находится в непосредственном контакте с шейкой матки. Распространение раковых клеток происходит прямым путем при прорастании опухоли во влагалище, лимфогенно (через лимфатические сосуды), путем контактной имплантации – там, где стенка влагалища соприкасается с опухолью. Также вовлекается тело матки.
Распространение опухолевых клеток в прямую кишку, мочевой пузырь и мочеточники, как правило, происходит контактным путем.
Отдаленные метастазы чаще всего встречаются в забрюшинных лимфатических узлах, легких, костях, печени. Менее чем в 1% случаев метастазирование происходит в селезенку, почки, головной мозг.
Диагностика рака шейки матки
Высокие показатели смертности от рака шейки матки связаны с поздним выявлением заболевания: в 35–40% случаев в России диагноз впервые ставится пациенткам с III–IV стадиями болезни.
Так как рак шейки матки может долго протекать бессимптомно, своевременная диагностика возможно только при регулярном прохождении специальных обследований у гинеколога.
Но даже выявление ВПЧ высокого онкогенного риска не превращает рак шейки матки в нечто фатальное.Во-первых, болезнь может вообще не развиться.Во-вторых, современные технологии позволяют выявлять данную форму рака на самых ранних стадиях и с успехом лечить его, не допуская превращения предраковых изменений в собственно онкологическое заболевание. Следовательно, положительные результаты анализа на ВПЧ должны рассматриваться только как основание для регулярного наблюдения у гинеколога, знакомого с эффективными алгоритмами ведения пациенток из групп риска.
Иногда рак шейки матки выявляется непосредственно во время осмотра на гинекологическом кресле. Однако так определяется, как правило, запущенный онкологический процесс. И напротив, ранние стадии заболевания обычно проходят без каких-либо заметных изменений, поэтому для своевременной диагностики рака шейки матки используются дополнительные исследования. Во время кольпоскопии влагалищную часть шейки матки осматривают с помощью кольпоскопа – прибора, напоминающего бинокль с источником освещения.
Также полученный в ходе этого анализа материал может быть использован для определения активности ВПЧ, которая является важным фактором прогноза и может влиять на тактику лечения. И, наконец, раствор с находящимися в нем клетками пригоден для проведения анализа на определение особого белка (Р16ink4a), появляющегося в клетках еще до начала непосредственно онкологического процесса. Таким образом, метод жидкостной цитологии способен не только выявить рак шейки матки, но и предупредить о повышении риска его развития. После одной-единственной процедуры в распоряжении врача появляются результаты трех точных и информативных анализов, позволяющих определить тактику и стратегию ведения конкретной пациентки.
В профилактических целях (при отсутствии жалоб) данные анализы рекомендуется проводить 1 раз в год.
Прогноз при первичной диагностике рака шейки матки определяется степенью запущенности процесса. К сожалению, в нашей стране на протяжении последних десятилетий сохраняется очень высокая доля женщин, впервые обращающихся за медицинской помощью на поздних стадиях заболевания. При своевременно поставленном диагнозе у пациентов на 1-й стадии рака шейки матки показатель 5-летней выживаемости составляет 75-80%, для 2-й стадии — 50-55%. Напротив, при выявлении на 4-й стадии рака шейки матки большинство пациенток не доживает до пятилетнего рубежа, умирая от распространения опухоли или осложнений.
Лечение рака шейки матки
Исходя из опыта клиники, сохранить матку и возможность деторождения возможно при предраковых изменениях шейки матки. При раке шейки матки одинаково широко используют лучевую терапию и хирургическое лечение — расширенная экстирпация матки с придатками.
Лечение зависит от стадии заболевания. При ранних стадиях рака шейки матки проводится преимущественно хирургическое лечение. Во время операции производится удаление матки. Иногда операцию необходимо дополнять удалением лимфатических узлов малого таза. Вопрос об удалении яичников решается индивидуально, при ранней стадии опухоли у молодых женщин возможно оставление яичников. Не менее значимым является лучевое лечение. Лучевая терапия может как дополнять хирургическое лечение, так и являться самостоятельным методом. При ранних стадиях рака шейки матки результаты хирургического и лучевого лечения практически одинаковы. В лечении рака шейки матки может применяться химиотерапия, но к сожалению, возможности химиотерапии при этом заболевании значительно ограничены.
При 0 стадии раковые клетки не распространяются за пределы поверхностного слоя шейки матки. Иногда эту стадию даже рассматривают как предраковое состояние. Такая опухоль может быть удалена разными способами, но при органосохраняющих вмешательствах в дальнейшем сохраняется риск рецидива, поэтому после операции показаны регулярные сдачи цитологических мазков.
Методы лечения плоскоклеточного рака шейки матки, стадия 0:
- Криохирургия – уничтожение опухоли с помощью низкой температуры.
- Лазерная хирургия.
- Конизация шейки матки – иссечение участка в виде конуса.
- Петлевая электроконизация шейки матки.
- Гистерэктомия. К ней прибегают в том числе при рецидиве злокачественной опухоли после вышеперечисленных вмешательств.
Методы лечения аденокарциномы шейки матки, стадия 0:
- Гистерэктомия.
- В некоторых случаях, если женщина планирует иметь детей, может быть выполнена конизация. При этом важным условием является негативный край резекции по данным биопсии. Впоследствии женщина должна наблюдаться у гинеколога, после родов выполняют гистерэктомию.
Выбор метода лечения всегда осуществляется индивидуально лечащим врачом.
При 1а стадии — микроинвазивный рак шейки матки — выполняют экстирпацию матки с придатками. В случаях, когда опухоль прорастает в кровеносные и лимфатические сосуды, также показано удаление тазовых лимфатических узлов. Если женщина планирует иметь детей, возможны органосохраняющие операции. При стадии Iб — рак ограничен шейкой матки — проводят дистанционное или внутриполостное облучение (брахитерапию) с последующей расширенной экстирпацией матки с придатками. В ряде случаев первоначально проводят операцию, а затем дистанционную гамма-радиотерапию.
При 2-й стадии рака шейки матки — вовлечение верхней части влагалища, возможен переход на тело матки и инфильтрация параметрия без перехода на стенки таза — основным методом лечения является лучевая терапия. Также может быть назначена химиотерапия, обычно препаратом цисплатином или его сочетанием с фторурацилом. В этом случае хирургическое лечение проводится редко.
При 3-й стадии рака шейки матки — переход на нижнюю часть влагалища, инфильтрация параметрия с переходом на кости таза — показана лучевая терапия.

Профилактика
Один из главных факторов риска рака шейки матки — вирус папилломы человека. Поэтому меры профилактики в первую очередь должны быть направлены на предотвращение заражения:
- Беспорядочные половые связи нежелательны, особенно с мужчинами, у которых было много партнерш. Это не защищает от заражения на 100%, но все же помогает сильно снизить риски.
- Презервативы помогут защититься не только от ВПЧ, но и от ВИЧ-инфекции. Стопроцентную защиту они тоже не обеспечивают, потому что не могут полностью исключить контакт с инфицированной кожей.
- Вакцины против ВПЧ — хорошее средство профилактики, но они работают лишь в случае, если женщина пока еще не инфицирована. Если вирус уже проник в организм, вакцина не поможет. Девочек начинают прививать с 9–12 лет.
Второй фактор риска, который связан с образом жизни, и на который можно повлиять — курение. Если вы страдаете этой вредной привычкой, от нее лучше отказаться.
Огромное значение имеет скрининг — он помогает вовремя выявить предраковые изменения и рак шейки матки на ранних стадиях. Нужно регулярно являться на осмотры к гинекологу, проходить PAP-тест и сдавать анализы на ВПЧ.
Основным прогностическим фактором выживаемости пациенток при раке шейки является степень распространенности процесса. Поэтому самым эффективным средством против развития рака являются регулярные профилактические осмотры у специалистов.
Прогноз при плоскоклеточном раке шейки матки
Ориентировочный прогноз определяют на основании статистики. Среди женщин, у которых был диагностирован рак шейки матки, подсчитывают процент выживших в течение определенного времени, как правило, пяти лет. Этот показатель называют пятилетней выживаемостью. Он зависит от того, на какой стадии было выявлено онкологическое заболевание. Чем раньше диагностирован рак и начато лечение — тем лучше прогноз:
- При локализованных опухолях (рак не распространяется за пределы шейки матки, соответствует I стадии) пятилетняя выживаемость составляет 92%.
- При опухолях, которые распространились на близлежащие структуры (стадии II, III и IVA) — 56%.
- При метастатическом раке (стадия IVB) — 17%.
- Средняя пятилетняя выживаемость при всех стадиях рака шейки матки — 66%.
Несмотря на низкие показатели пятилетней выживаемости, рак с метастазами — это не повод опускать руки. Существуют методы лечения, которые помогают затормозить прогрессирование заболевания, продлить жизнь, справиться с мучительными симптомами. Врачи в Европейской клинике знают, как помочь.
Методики внутриполостной гамма-терапии РШМ
Внутриполостная гамма-терапия по общепринятому варианту
Для равномерного распределения лучистой энергии в малом тазу предложены различные модели кольпостатов (Г. Флетчера, В. П. Тобилевича и др.). Назначение их сводится к фиксации радионуклидов в определенном положении. Интервалы между сеансами внутриполостного облучения обычно составляют 5-7 дней. Разовые поглощенные дозы при этом в точках А в зависимости от стадии РШМ составляют 10-15 Гр, в точках В — 3—5 Гр, суммарные в точках А — 60—80 Гр, в точках В — 12-18 Гр.
Расчет поглощенных доз при внутриполостной гамма-терапии проводится на анатомические области: зону парацервикального треугольника (точки А) и латеральные отделы параметральной клетчатки (точки В). Точки А расположены в месте пересечения маточной артерии и мочеточника, в верхнем отделе так называемого парацервикального треугольника, захватывающего клетчатку вблизи шейки матки. Они могут занимать различные положения по отношению к костным структурам малого таза.
Определяются эти точки учета на расстоянии 2 см от источников, введенных в полость матки, и па 2 см выше бокового свода влагалища. Точки В соответствуют локализации запирательных лимфатических узлов, расположены на том же уровне, что и точки А, но отстоят на 5 см от центральной оси малого таза, независимо от локализации матки и введенных в нее источников излучения.
В дальнейшем было предложено также проводить дозиметрию в точках V (задняя стенка пузыря в области треугольника Льето) и R (передняя стенка прямой кишки) в проекции внутреннего зева шейки матки. В последние годы в практику клинической дозиметрии введены новые критические точки. В точке Т измеряется поглощенная доза непосредственно в первичной опухоли: она находится на 1 см выше наружного зева и на 1 см латеральнее линейного источника, находившегося в цервикальном канале. Точка С — область наружных подвздошных лимфатических узлов. Точка D находится на 1 см выше конца линейного источника в полости матки.
При внутриполостной гамма-терапии по общепринятому методу доза излучения на непораженные опухолью органы и ткани может оказаться значительной. Вводимые в матку и влагалище радионуклиды обычно не связаны между собой. Поэтому возможность их смещения за длительный сеанс облучения (24— 45 ч) приводит к деформации дозного поля. Это ухудшает условия облучения опухоли и вызывает увеличение дозовых нагрузок на мочевой пузырь и прямую кишку.
Внутриполостная гамма-терапия по принципу ручного последовательного введения радионуклидных источников
Совершенствование метода впутриполостной гамма-терапии было достигнуто за счет разделения во времени всего лечебного процесса на 2 этапа: первый — подготовительный, осуществляемый вне сферы воздействия ионизирующего излучения, и второй — окончательный, представляющий собой непосредственно процесс облучения больной. Этот принцип проведения внутриполостной гамма-терапии получил название 2-этапного последовательного введения аппликаторов и источников излучения (afterloading). Развитие его ведется по двум направлениям. Первое — совершенствуется методика ручного введения источников низкой активности (simple afterloading), второе — разрабатывается методика дистанционного автоматического введения источников излучения высокой активности (remote afterloading).
При методике ручного способа введения источников излучения (simple afterloading) первый этап — подготовительный — осуществляется вне зоны воздействия ионизирующего излучения и состоит из введения эндостатических устройств и фиксации их относительно опухоли; рентгенологического контроля пространственного размещения лечебных наконечников и тонометрических измерений; дозиметрической подготовки и выбора программы облучения.
Препараты 60Со, предназначенные для введения во влагалищные и маточные аппликаторы, укреплены на металлических стержнях пружинками, позволяющими поворачивать их в полости овоидов. Источники излучения для маточного аппликатора помещены в нейлоновую трубку, их число определяется длиной полости матки и цервикального канала.
Сеансы внутриполостной гамма-терапии проводятся 1 раз в 5—6 дней. Цервикальный канал расширяют до 5—6-го номера расширителя Гегара и вводят неактивные маточный и влагалищный аппликаторы. Систему кольпостата фиксируют стерильным тампоном, что обеспечивает устойчивое положение кольпостата и возможно большее расстояние между источниками излучения, прямой кишкой и мочевым пузырем.
Правильность установки системы контролируется рентгенологическим исследованием, проводимым непосредственно на гинекологическом кресле с помощью рентгеновского аппарата. Снимки выполняются в двух проекциях — фронтальной и сагиттальной. При этом 3 трубки кольпостата заполняются имитаторами радиоактивных препаратов, а прямая кишка и мочевой пузырь контрастируются резиновыми катетерами.
Двухплоскостное изображение кольпостата помогает определить лучевые нагрузки на первичную опухоль и смежные органы. В 5% случаев возникает необходимость в соответствующей коррекции установленной системы. Она состоит в изменении положения овоидов или выборе более подходящего количества имитаторов источников, вводимых в матку.
Транспортировка больных в палату производится после завершения рентгеновского исследования и подтверждения правильности размещения неактивной системы метракольпостата. Радионуклидные источники вводятся в трубку, когда больная находится уже в кровати с прикроватной защитной ширмой. Суммарная активность нуклида в радиоактивном источнике равна 0,91—1,82 МБк. Продолжительность сеанса облучения — 22—26 ч. Расчет поглощенных доз осуществляется по данным рентгенограмм с учетом расстояния между источником излучения и точками учета доз в малом тазу.
При одинаковой активности источников, введенных в матку и влагалище, прямая кишка подвергается наибольшему облучению от влагалищных аппликаторов. Разовые поглощенные дозы в прямой кишке варьируют в пределах 5,5—7 Гр. В ряде наблюдений они превышают 10 Гр. Своевременное обнаружение высоких дозовых значений в мочевом пузыре и прямой кишке позволяет изменить набор и экспозицию радионуклидных препаратов или же изменить соотношение активностей источников, вводимых эндоцервикально и эндовагинально. Это предупреждает тяжелые радиационные повреждения смежных с шейкой матки органов.
Сравнительному анализу подвергли непосредственные, ближайшие и отдаленные результаты лучевого лечения 359 больных РШМ, 153 из которых (1-я группа) лечились сочетанным лучевым методом с применением внутриполостной гамма-терапии в общепринятом варианте, 206 (2-я группа) — подвергались внутриполостной гамма-терапии по принципу ручного последовательного введения радиоактивных источников [Вишневская Е. Е., 1983].
Оценка частоты и тяжести ранних лучевых реакций и осложнений, наблюдавшихся у больных двух анализируемых групп, не выявила существенных различий. Однако частота поздних эрозивно-десквамативных и язвенных ректитов во 2-й группе снизилась более чем в 4 раза, катаральных и язвенных циститов — в 1,2 раза, а такие лучевые повреждения, как ректо- или везиковагинальные свищи, вообще не наблюдались.
Применение шланговых аппаратов со специальным устройством, позволяющим дистанционно управлять процессом облучения, существенно улучшило переносимость лечения, почти полностью исключило лучевую опасность для персонала и сократило продолжительность сеанса облучения.
Сеансу лечения больных РШМ на шланговом аппарате АГАТ-В предшествует выполнение следующих процедур: введение метракольпостата и рентгенологический контроль за пространственным размещением его элементов; тонометрические измерения и дозиметрическое определение длительности сеанса облучения. Тщательная, точная установка и фиксация эндостатов с учетом индивидуальных особенностей больной и опухолевого процесса обеспечивает возможность проведения сеанса облучения в оптимальном варианте и определяет его успех.
Читайте также:

