Фторурацил при колоректальном раке
Вероятность рецидива после радикальных резекций, выполненных по поводу рака в стадии II и III без признаков резидуальной опухоли (R0 резекция), составляет 40-50% случаев.
Углубление знаний о патофизиологии опухоли, доступность различных химиопрепаратов, более совершенные схемы адъювантной и неоадъювантной химиотерапии привели к признанию ее роли, продемонстрировав преимущество комбинированного подхода над хирургическим лечением в отношении ответа опухоли и выживаемости в больших группах больных раком.
Выбор конкретного препарата, схемы, пути введения, времени и продолжительности зависит от нескольких факторов: гистопатологических особенностей, стадии, первичных и вторичных очагов опухоли, общего состояния больного, ответа на лечение, побочных эффектов и выполненной или планируемой операции.
Доказательства преимуществ постоянно изменяются и обновляются по мере получения данных новых исследований.
Показания для химиотерапии:
• Рак толстой кишки, стадия III (TxN1-2).
• Рак толстой кишки, стадия IIВ (T4N0), в частности при перфорации.
• Рак толстой кишки, стадия IIА (ТЗ) с неблагоприятными особенностями: пери-туморальной лимфоваскулярной инвазией, неадекватным количеством исследованных лимфоузлов, низкой дифференцировкой.
• Рак прямой кишки, стадия II (u/T3-4N0) и III (u/pTxN1-2).
• Рак прямой кишки, стадия Т2 после трансанального местного иссечения.
Сумма доказательств эффективности химиотерапии рака толстой кишки
1. Стадия III колоректального рака:
• Послеоперационная химиотерапия в течение 6 месяцев является достаточной (у более длительного курса преимуществ нет).
• Непрерывное введение 5-FU/LV лучше, чем болюсное.
• Необходимость в левамизоле отсутствует.
• Комбинация 5-FU/LV и оксалиплатина лучше, чем 5-FU/LV.
• Капецитабин также эффективен и даже несколько лучше, чем 5-FU/LV.
• Эффективность адъювантной химиотерапии не зависит от возраста больного.
• Роль в адъювантном режиме таких препаратов, как иринотекан, цетуксимаб или бевацизумаб не документирована, но они являются предметом текущих исследований.
2. Стадия II колоректального рака:
• Не документированы преимущества в выживаемости при адъювантной терапии у больных со II стадией заболевания при стандартном риске.
• Химиотерапия при II стадии заболевания высокого риска выглядит логически оправданной, но спорной из-за отсутствия объективной проверки достоверности => необходимость в дальнейших исследованиях.
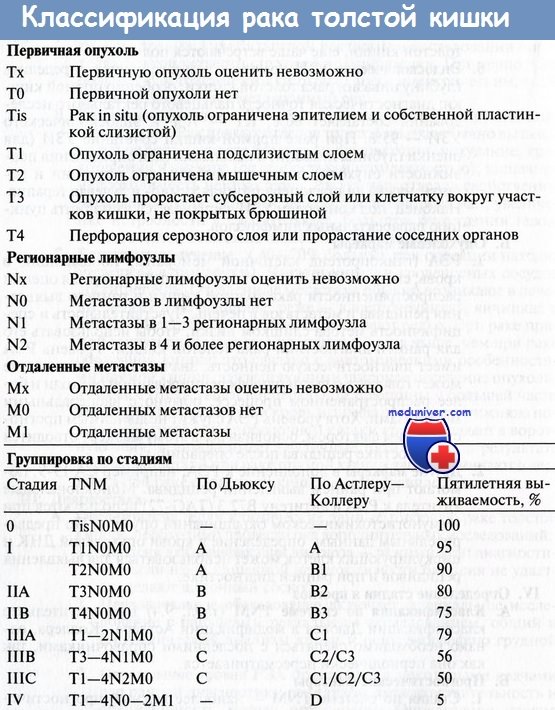
Альтернативы химиотерапии рака толстой кишки:
• Только операция: рак толстой кишки — стадия I (pT1-2N0), стадия IIА (pT3N0); у сохранных больных со II стадией рака толстой кишки при отсутствии неблагоприятных прогностических факторов рутинное применение адъювантной химиотерапии не рекомендуется.
• Радиотерапия или радиотерапия + операция: все реже применяемые методы при опухолях ЖКТ/аноректальной области.
Схемы адъювантной химиотерапии рака толстой кишки (колоректального рака)
1. Еженедельный болюс 5-FU+ лейковорин (Розвел Парк):
Болюсное введение 5-FU + лейковорин еженедельно в течение 6 недель, 2 недели перерыв => 3 цикла каждые 8 недель.
Показания. Стандартная схема, если имеются противопоказания или непереносимость оксали-платина.
Противопоказания. Текущий сепсис, нейтропения, печеночная недостаточность, почечная недостаточность.
Токсичность и побочные эффекты. Степень III и IV: диарея (40%), стоматит (1%), нейтропения (4%).
2. Ежемесячный болюс 5-FU+ лейковорин (Мэйо):
Болюсное введение 5-FU+ лейковорин с 1 по 5 день с последующим 3-х недельным перерывом => 6 циклов каждые 4 недели.
Показания. Стандартная схема при противопоказаниях или непереносимости оксалиплатина.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Более токсичная, по сравнению с другими 5-FU/LV схемами => степень III и IV: диарея (13-21%), стоматит (14-18%), нейтропения (16-55%).
3. Капецитабии (Кселода):
Капецитабин: перорально два раза в день ежедневно в течение 14 дней + перерыв 7 дней => всего 8 циклов каждые 3 недели.
Показания. Альтернативная/новая схема, если имеются противопоказания или непереносимость оксалиплатина.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Переносимость лучше, чем при внутривенном введении 5-FU/LV.
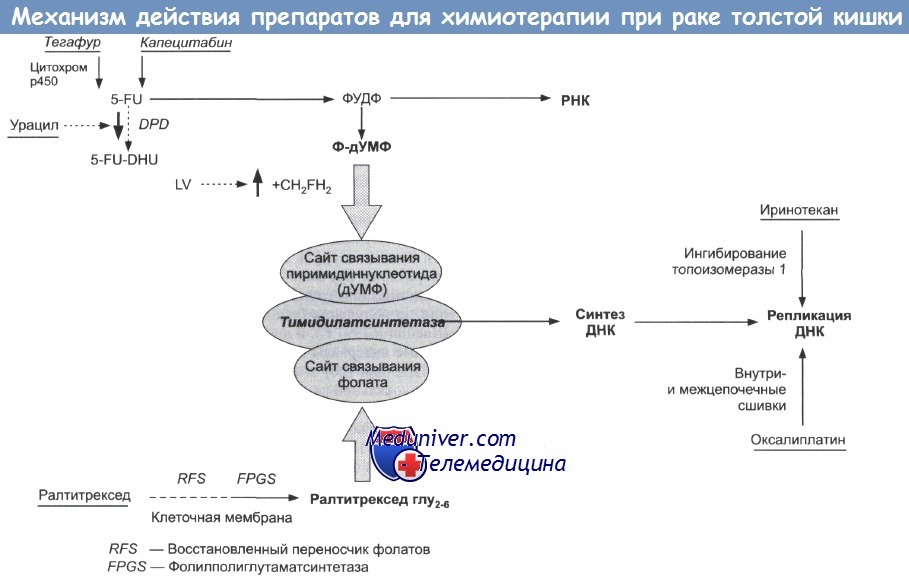
4. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX4):
Оксалиплатин в/в в первый день; лейковорин в/в в первый и второй дни; 5-FU в/в болюсно с последующей непрерывной инфузией в течение первого и второго дня => всего 12 циклов каждые 14 дней.
Показания. При переносимости - стандартная интенсивная схема выбора, в частности при агрессивных опухолях и у молодых больных; риск редукции дозы 18-25% по сравнению с болюсным введением 5-FU/LV (безрецидивная выживаемость - 78% и 73% соответственно).
Противопоказания. Аллергические реакции. Предшествующая нейропатия.
Токсичность и побочные эффекты. Нейтропения (>40%), фебрильная нейтропения, периферическая нейропатия (острая 3 степени - 12%, отдаленная персистирующая - 1%).
5. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX 6):
Оксалиплатин в/в в первый день; лейковорин в/в только в первый день; 5-FU в/в болюсно с последующей непрерывной инфузией (более высокая доза, чем при FOLFOX4) в течение первого и второго дня => всего 12 циклов каждые 14 дней.
Показания. Те же, что и при FOLFOX4, но доза оксалиплатнна выше, а назначение более удобно для больного: необходимость госпитализации только в первый день каждого цикла.
Противопоказания. Аллергические реакции. Предшествующая нейропатия.
Токсичность и побочные эффекты. Нейтропения (>40%), фебрильная нейтропения, периферическая нейропатия (острая III степени - 12%, отдаленная персистирующая - 1%).
6. КАПЕцитабин (КСЕЛода) + ОКСалиплатин (САРЕОХ, XELOX):
Оксалиплатин в/в в первый день; капецитабин нерорально два раза в день ежедневно с 1 по 14 дни + 7 дней перерыв => каждый 21 день 2 раза в день.
Показания. Альтернативная схема FOLFOX с удобным режимом приема.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Сравнимый с FOLFOX или несколько лучший профиль токсичности.
Т.П. Гришина
Впоследние десятилетия во многих странах мира, в том числе и в России, происходит рост заболеваемости раком толстой кишки (РТК). По данным Онкологического научного центра РАМН, в 1960 г.
было зарегистрировано 5007 больных с впервые установленным диагнозом РТК, а к 1992 г. их число увеличилось более чем в 7 раз и составило 37 999.
В настоящее время в структуре онкологической заболеваемости РТК вышел на третье место. Заболеваемость злокачественными новообразованиями слепой и ободочной кишки среди мужчин составляет 11,6, а среди женщин – 9,2 на 100 тыс. взрослого населения. Заболеваемость раком прямой кишки соответственно составила среди мужчин 11,0, а среди женщин –7,1 на 100 000 населения. В некоторых странах Западной Европы и Америки колоректальный рак переместился на второе место по частоте. В США ежегодно выявляется 150 000 новых случаев злокачественных новообразований толстой кишки. Наиболее часто РТК выявляется у лиц старше 50 лет с постепенным снижением уровня заболеваемости в группах населения в возрасте после 75 лет. Но, несмотря на довольно четкое увеличение частоты РТК в старших возрастных группах, все чаще это заболевание диагностируют в молодом возрасте, особенно его семейные и наследственные формы. Таким образом, проблема диагностики и лечения РТК приобрела в настоящее время важное социальное значение.
К лечению заболевших людей необходимо подходить комплексно.
Основным методом является хирургический. В последнее десятилетие резектабильность РТК составляет 70–80%, послеоперационная летальность сократилась до 5%. Пятилетние результаты в большинстве стран в диапазоне 50–60%. При ранних стадиях следует шире использовать метод эндоскопического удаления опухолей, позволяющий уменьшить сроки пребывания пациента в стационаре и избежать некоторых после- операционных осложнений. В хирургии рака прямой кишки использовать сфинктеросохраняющие операции, даже при опухолях нижней трети. При лечении метастазов в печень целесообразно сочетать лекарственное воздействие и операцию.
Лучевая терапиявключена в стандарт лечения рака прямой кишки для уменьшения стадийности предоперационно, для сокращения частоты локальных рецидивов послеоперационно и в качестве основного метода лечения неоперабельного местнораспространенного рака прямой кишки. Было проведено множество исследований, позволивших подобрать оптимальный режим адъювантной терапии для лечения рака толстой кишки.
Окончательное мнение среди онкологов по поводу ценности про- филактического применения фторурацила и левамизола сложилось после публикации итогов межгруппового международного исследования (Moertel). В группе больных со стадией С летальность сократилась на 33%, а частота рецидивов на 41% по сравнению с контролем. Тем не менее эта комбинация уступает в популярности режиму фторурацил + кальция фолинат.
Из новых препаратов, проявивших активность при РТК, следует отметить оксалиплатин. Он относится к 3–й генерации ненефротоксических производных платины и в комбинации с фторурацилом и лейковорином представляет один из наиболее эффективных режимов химиотерапии при метастатическом колоректальном раке (12–15).
Для того чтобы оценить возможность эффективного применения оксалиплатина на более ранних стадиях заболевания, проведено меж- дународное клиническое исследование III фазы у больных раком толстой кишки II и III стадий – Международное многоцентровое, исследование оксалиплатина/5–фторурацила/лейковорина в плане адъювантной терапии при раке толстой кишки (MOSAIC).
Методы исследования
В исследование включали больных, перенесших радикальную резекцию гистологически подтвержденного рака толстой кишки II стадии (Т3 или Т4N0М0) или III стадии (любая степень Т, N1 или N2М0); при этом нижний полюс опухоли должен был находиться выше перитонеального изгиба, т.е.
Лечение должно было начаться через несколько недель после хирур- гического вмешательства. Другими критериями включения были: возраст от 18 до 75 лет, общее состояние по шкале Карнофского не менее 60, уровень раковоэмбрионального антигена менее 10 нг на мл, отсутствие предшествующей химиотерапии, иммунотерапии и радиотерапии, адекватные гематологические показатели, адекватная функция печени и почек. Все пациенты дали письменное информированное согласие, протокол исследования был утвержден этическими комитетами медицинских учреждений, участвовавших в проведении исследования.
Пациентов рандомизировали по двум группам для получения только комбинации фторурацил и лейковорин (ФЛ) или ФЛ с оксалиплатином. В группе ФЛ каждый цикл терапии включал 2–часовую инфузию лейковорина 200 мг/м2 площади поверхности тела, затем болюсную инъекцию фторурацила 400 мг/м2 и затем 22–часовую инфузию фторурацила 600 мг/м2 в течение двух последовательных дней, каждые 14 дней, всего 12 циклов. В группе ФЛ плюс оксалиплатин пациенты получали лечение по той же схеме плюс 2–часовую инфузию оксалиплатина (Элоксатин, Санофи–Синтелабо).
85 мг/м2 в 1–й день одновременно с лейковорином при помощиУ–образной инфузионной системы. Применение одноразовых помп (инфузоры LV5, Бакстер Хелскэр) позволяло проводить длительные инфузии фторурацила в амбулаторных условиях.
Степень неблагоприятных явлений определяли по первой версии общих критериев токсичности Национального института рака. По этим критериям I степень соответствует слабо выраженным, II степень умеренно выраженным, III степень тяжелым, а IV степень – угрожающим жизни неблагоприятным явлениям. Редукцию дозы проводили по наиболее выраженному неблагоприятному явлению на предыдущем цикле.
3 степени выраженности, связанных с лечением. При появлении кожных реакций III/IV степени, связанных с лечением, снижали только дозу фторурацила.
Пациенты проходили обследование перед рандомизацией, каждые две недели в период лечения и затем каждые шесть месяцев в течение пяти лет.
Рецидив заболевания диагностировали на основании данных ин- струментальных исследований и, по необходимости, данных цитоло- гического исследования и биопсии.
Статистический анализ
Рандомизацию проводили в централизованном порядке, для лучшей сбалансированности пациентов в группах по стадии заболевания (Т2 или Т3 против Т4 и N0, N1 или N2), наличию или отсутствию непроходимости кишечника или опухолевой перфорации, а также по медицинским центрам использовали метод минимизации. При принятых условиях трехлетней выживаемости 73% в контрольной группе и 79% в группе, получающей ФЛ с оксалиплатином, соотношения больных с II и III стадиями заболевания 0,4:0,6, длительности периодов набора больных и последующего наблюдения 3 года, снижения риска рецидива через три года, статистической мощности 90%, значения альфа 0,05 и использования критерия log rankдля расчета значений Р объем выборки должен был составлять 2200 больных. В качестве основной переменной эффективности принимали безрецидивную выживаемость, которую определяли как время от рандомизации до рецидива или смерти (первого по времени из указанных событий). Второй колоректальный рак считали рецидивом, опухоли других локализаций при анализе не учитывали.
Основной анализ эффективности проводили через три года наблюдения. Для оценки влияния лечения на безрецидивную выживаемость рассчитывали соотношения рисков и 95% доверительные интервалы в прогностических подгруппах больных, определенных в зависимости от следующих переменных: пол, возраст, стадия заболевания (II против III), исходный уровень раковоэмбрионального антигена, число пораженных лимфоузлов (4), параметр Т (Т4 против Т1, Т2 и Т3), степень клеточной дифференцировки (высоко–/низкодифференцированная карцинома), наличие или отсутствие перфорации, обструкции и венозной инвазии.
Популяция больных
За период с октября 1998 г. по январь 2001 г. в 146 центрах из 20 стран мира в исследование включено 2246 больных, из которых 1123 пациента были рандомизированы в группу для получения ФЛ с оксалиплатином и 1123 в группу ФЛ без оксалиплатина. Из этого числа 1108 пациентов получили хотя бы по одному циклу терапии ФЛ плюс оксалиплатин и 1111 – не менее одного цикла ФЛ. Характеристики больных в двух лечебных группах были хорошо сбалансированы. В обеих группах 60% больных имели III стадию и 40% II стадию заболевания. Медиана времени от хирургического вмешательства до начала химиотерапии составляла 5,7 недель (от 1,1 до 17,0).
Неполное соответствие требованиям участия в исследовании по критерию исходного статуса заболевания отмечено у 41 больного (1,8%).
Химиотерапия
Медиана числа циклов проведенной химиотерапии составила 12 в обеих группах; запланированные 12 циклов терапии получили 74,7% больных в группе ФЛ плюс оксалиплатин и 86,5% больных в группе ФЛ. В группе ФЛ плюс оксалиплатин медиана дозы оксалиплатина составила 34,2 мг/м2/нед по всем циклам и 36,5 мг/м2/нед по всем циклам, включавшим оксалиплатин. В обоих случаях реально введено больным более 80% плановой дозы (соответственно 80,5% и 85,9%). Доза реально введенного фторурацила составила 84,4% от плановой дозы в группе ФЛ плюс оксалиплатин и 97,7% от плановой дозы в группе ФЛ.
Безопасность
Наиболее часто из всех проявлений токсичности III/IV степени в группе ФЛ плюс оксалиплатин отмечались нейтропения, диарея и рвота.
Периферическая нейропатия наблюдалась в период лечения в группе ФЛ плюс оксалиплатин у 92,1% больных, однако половина отмеченных случаев квалифицировалась как явления слабой степени.
Всего через один после окончания лечения симптомы периферической нейропатии все еще присутствовали у 11 из 1018 (1%) пациентов. При обследовании через 18 месяцев эта цифра снизилась до пяти (0,5%).
Двенадцать пациентов (по шесть в каждой группе, 0,5%) умерли в пределах первого месяца после окончания лечения.
Наблюдение и безрецидивная выживаемость
В ходе исследования отмечено хорошее соблюдение графика обследований больными. Среднее время между посещениями составило 5,97 месяца в группе ФЛ плюс оксалиплатин и 5,98 месяца в группе ФЛ. Медиана интервала в обеих группах достигала 6,01 месяца.
На дату проведения анализа (медиана наблюдения 37,9 месяца) рецидив заболевания или смерть зарегистрированы у 237 пациентов в группе ФЛ плюс оксалиплатин (21,1%) и 293 (26,1%) больных в группе ФЛ. Соотношение рисков рецидива заболевания в группе ФЛ плюс оксалиплатин и в группе ФЛ составило 0,77 (p=0,002), т.е. отмечено снижение риска рецидива на 23%. Вероятность остаться в живых без признаков болезни через три года достигала 78,2% (95% доверительный интервал 75,6–80,7%) в группе ФЛ плюс оксалиплатин и 72,9% (95% доверительный интервал 70,2–75,7%) в группе ФЛ (p=0,002 по стратифицированному критерию log rank).
Среди пациентов с III стадией заболевания соотношение рисков рецидива составило 0,76 (95% доверительный интервал 0,62–0,92) в группе ФЛ плюс оксалиплатин по сравнению с группой ФЛ, трехлетняя безрецидивная выживаемость достигала 72,2% и 65,3% соответственно. Среди пациентов с II стадией заболевания соотношение рисков рецидива составило 0,80 (95% доверительный интервал 0,56–1,15) в группе ФЛ плюс оксалиплатин по сравнению с группойФЛ, трехлетняя безрецидивная выживаемость достигала 87,0% и 84,3% соответственно.
Общая выживаемость
На время проведения основного анализа в группе ФЛ плюс оксалиплатин умерли 133 и в группе ФЛ – 146 пациентов (соотношение рисков смерти 0,90; 95% доверительный интервал 0,71–1,13), вероятность остаться в живых через три года составила 87,7% и 86,6% соответственно. Большинство умерших больных имели III стадию заболевания (104 в группе ФЛ плюс оксалиплатин и 119 в группе ФЛ); соотношение рисков смерти в данной подгруппе составило 0,86 (95% доверительный интервал 0,66–1,11).
В исследовании MOSAIC ставилась цель определить эффективность адъювантной терапии в режиме ФЛ плюс оксалиплатин.
Безрецидивная выживаемость в группе ФЛ достигала самых высоких значений, полученных в большинстве исследований адъювантной терапии в режиме ФЛ при раке толстой кишки. Повышение безрецидивной выживаемости среди пациентов, получавших ФЛ плюс оксалиплатин, соответствует снижению относительного риска рецидива на 23%. В связи с тем, что рецидив заболевания развивается главным образом в первые три года после радикального хирургического вмешательства, авторы считают полученные результаты, в этом отношении, показательными.
Общепринято считать эффективной адъювантную терапию при III стадии заболевания, однако целесообразность такого лечения при II стадии остается предметом дискуссий. Последний мета–анализ, проведенный в Клинике Мейо по данным 3300 пациентов, участвовавших в пяти рандомизированных исследованиях, в том числе больных, данные которых также анализировались группой IMPACT В2, показал, что адъювантная терапия при II стадии заболевания может быть эффективной, но в меньшей степени, чем при III стадии. Оценка взаимного влияния прогностических факторов является важным статистическим способом решения вопроса о различиях в клинической эффективности адъювантного лечения для пациентов с II и III стадиями. В настоящем исследовании этот тест не выявил значимого взаимовлияния таких факторов, как стадия болезни и метод лечения, т.е. режим ФЛ плюс оксалиплатин одинаково эффективен как при I I I , так и при I I стадии РТК.
В настоящее время не существует единого мнения относительно наиболее эффективной схемы ФЛ для применения в качестве адъювантной терапии, однако оптимальным является двухмесячный режим, показавший эффективность и низкую токсичность у пациентов с запущенным колоректальным раком как в самостоятельном плане, так и в комбинации с оксалиплатином.
Основной проблемой безопасности при использовании оксалиплатина является периферическая нейропатия. Оксалиплатин является причиной развития частых, преходящих дистальных парестезий в первые минуты инфузии или через короткий промежуток времени после ее начала. В некоторых случаях эти нейросенсорные симптомы проявляются с большей интенсивностью с увеличением кумулятивной дозы, персистируют в течение междозового интервала и приводят к нарушению функции (симптомы 3 степени интенсивности). В настоящем исследовании симптомы периферической нейропатии 3 степени наблюдались у 12,4% пациентов, получавших оксалиплатин. Через год нейропатия 3 степени отмечалась у 11 (1,1%) пациентов. Из них у двух больных выявлены сопутствующие заболевания, которые могли стать причиной этих симптомов (диабет и гемиплегия, соответственно). Несмотря на более высокую частоту нейтропении III и IV степени в группе, получавшей ФЛ плюс оксалиплатин, по сравнению с группой ФЛ, лихорадка и инфекции зарегистрированы только у 1,8% из пациентов первой группы. Аналогичные результаты получены у пациентов с метастатическим колоректальным раком. Анализируя безопасность лечения, следует отметить, что смертность от всех причин в обеих группах была низкой и составила 0,5%, что соответствует самым низким показателям, полученным в исследованиях адъювантной химиотерапии.
Расчеты общей выживаемости на данном этапе могут носить только предварительный характер, и делать выводы относительно различий между группами пока преждевременно. Учитывая, что медиана общей выживаемости с момента постановки диагноза метастатического РТК составляет около 20 месяцев, эффект оксалиплатина на выживаемость можно будет оценить в течение следующих 2 лет.

- Какие химиопрепараты используют при колоректальном раке?
- Способы введения химиопрепаратов. Циклы и курс лечения.
- Что такое протокол химиотерапии, и для чего он нужен?
- Цены на курс химиотерапии в Европейской клинике
Чаще всего курс химиотерапии при раке толстой кишки дополняет хирургическое лечение. В зависимости от сроков проведения, различают два вида терапии:
- Неоадъювантная назначается до операции. Она помогает уменьшить размеры опухоли, благодаря чему рак легче поддается хирургическому лечению.
- Адъювантная проводится после операции. Она уничтожает оставшиеся в организме раковые клетки и помогает предотвратить рецидив.
На поздних стадиях колоректального рака химиотерапия и лучевая терапия становятся основными методами лечения. Вылечить запущенный рак уже невозможно, но активная терапия помогает существенно продлить жизнь.
Какие химиопрепараты используют при колоректальном раке?
До относительно недавнего времени, на протяжении почти полувека, единственной комбинацией препаратов с доказанной эффективностью при раке толстой кишки было сочетание 5-фторурацила с лейковорином. В настоящее время список химиопрепаратов расширился. Помимо указанной комбинации применяют следующие:
- капецитабин (Кселода);
- иринотекан (Камптозар);
- капецитабин + оксалиплатин (Элоксатин);
- лейковорин + фторурацил + оксалиплатин;
- фторурацил + оксалиплатин + иринотекан;
- трифлуридин + типирацил (комбинированный препарат Лонсурф).
Кроме того, при колоректальном раке применяют таргетные препараты. В отличие от химиопрепаратов, которые атакуют любые активно размножающиеся клетки, эти лекарственные средства нацелены на конкретную молекулу-мишень, играющую важную роль в развитии рака:
- Блокаторы VEGF (фактора роста эндотелия сосудов). Раковые клетки выделяют большое количество VEGF, для того чтобы стимулировать рост новых сосудов и обеспечить себя кислородом, питательными веществами. К группе блокаторов VEGF относятся: бевацизумаб, рамуцирумаб, регорафениб.
- Блокаторы EGFR (рецептора эпидермального фактора роста). Это молекула на поверхности клеток, которая под действием эпидермального фактора роста заставляет их размножаться. Если в раковых клетках изменен ген, отвечающий за синтез EGFR, они несут слишком много таких рецепторов и размножаются более агрессивно. К блокаторам EGFR относятся: цетуксимаб, панитумумаб.
Способы введения химиопрепаратов. Циклы и курс лечения.
В большинстве случаев химиопрепараты при колоректальном раке вводят внутривенно. Капецитабин и трифлуридин/типирацил принимают в виде таблеток. Такая химиотерапия называется системной, так как химиопрепарат распространяется по всему организму.
Колоректальный рак нередко метастазирует в печень, и в таких случаях может быть проведена местная химиотерапия. В отделении интервенционной хирургии Европейской клиники проводится химиоэмболизация печени. В сосуд, питающий опухоль, вводят микроскопические частицы — эмболы — и химиопрепарат. Эмболы перекрывают кровоток, а химиопрепарат уничтожает раковые клетки.
При системной терапии химиопрепарат атакует не только опухолевую, но и здоровые ткани. После того как получена очередная доза лекарства, организму нужно время, чтобы восстановиться. Поэтому курс химиотерапии проводят циклами. Один цикл обычно продолжается 2–3 недели. Курс лечения может включать несколько циклов.

Что такое протокол химиотерапии, и для чего он нужен?
Чаще всего для лечения рака применяют сочетания химиопрепаратов с разными механизмами действия. Но какая комбинация будет наиболее эффективна в каждом конкретном случае? Как долго должны продолжаться циклы, и сколько их нужно всего? На эти вопросы уже давно существуют ответы. Они были найдены в ходе многочисленных клинических исследований.
Эти знания отражены в специальных документах — протоколах химиотерапии. Существуют разные протоколы, врачи Европейской клиники ориентируются на рекомендации NCCN — авторитетной ассоциации, в которую входят 27 ведущих онкоцентров США.
Современные технологии позволяют изучить опухоль на молекулярно-генетическом уровне, разобраться, какие молекулярные механизмы играют ключевую роль в опухолевом росте у конкретного пациента. Это дает возможность назначать персонализированное лечение, подбирать для каждого больного оптимальную комбинацию химиопрепаратов. У врачей Европейской клиники есть доступ к данным технологиям, благодаря сотрудничеству с американской лабораторией Caris.
Мы считаем, что помочь можно при любой стадии рака, и используем для этого все современные возможности. Наши врачи применяют оригинальные европейские и американские химиопрепараты с доказанной эффективностью. Мы знаем, как помочь.
Предметы
Аннотация
ФУ дается в виде одного болюса 400 мг / м2, затем 46-часовая инфузия с высокой мощностью дозы. Это избавляет от необходимости посещать палату на 2-й день, сокращает время медсестры и фармацевта и делает расписание более подходящим для амбулаторных условий.
Фармакокинетика FU нелинейна, поэтому более высокие дозы FU, обычно достигаемые с помощью инфузионного лечения, не являются гарантией увеличения воздействия лекарственного средства на опухоль. Поэтому мы провели фармакокинетическое исследование, чтобы оценить воздействие FU (площадь под кривой концентрация-время в плазме, AUC) во время новых схем MdG по сравнению с dG.
Пациенты и методы
Пациенты
В исследованиях приняли участие в общей сложности 108 пациентов (см. Таблицу 1). Соответствующее институциональное и местное одобрение этики было получено, и все пациенты дали письменное информированное согласие.
Таблица в натуральную величину
MdG (46 пациентов)
Чтобы установить оптимальную 46-часовую инфузию FU, было проведено исследование эскалации у 32 пациентов с метастатической аденокарциномой любого желудочно-кишечного тракта первичного происхождения. Критериями приемлемости были статус выполнения ВОЗ 0–2; билирубин -1 ; АЛП и трансаминазы 3 × 10 9 л -1 ; нейтрофилы> 1, 5 × 10 9 л -1 и тромбоциты> 100 × 10 9 л -1 . Женщины с детородным потенциалом должны были использовать контрацепцию. Предыдущая химиотерапия по поводу метастатической болезни была разрешена. После этого в нашем учреждении в качестве стандартного варианта лечения пациентов с метастатическим колоректальным раком, отвечающих тем же критериям приемлемости, была принята MdG при уровне болюса 400 мг / м2 + 2800 мг / м2 в течение 46 часов. Данные о токсичности и реакции были собраны для еще 14 пациентов, что дало в общей сложности 22 пациента с метастатическим колоректальным раком, которых лечили на этом уровне дозы для анализа.
OxMdG (62 пациента)
Первоначально 22 пациента с FU-резистентным колоректальным раком получали лечение OxMdG в рамках программы сострадательного применения для названного пациента. Пациенты должны были иметь неоперабельную, гистологически подтвержденную колоректальную аденокарциному с прогрессированием во время или вскоре после предшествующей химиотерапии. Использовались те же самые общие критерии приспособленности и функции органов, что и для MdG, с добавлением СКФ> 60 мл мин -1 . С мая 1999 года использование OxMdG в нашем учреждении было расширено до официального исследования II фазы, в которое вошли еще пятнадцать пациентов 2-й линии (общее количество достигло 37) и 25 пациентов с нелеченным метастатическим колоректальным раком. Применяются те же критерии приемлемости.
лечение
Венозный доступ с одним просветом был установлен с использованием подкожного порта или линии Хикмана. Профилактический варфарин назначался по 10 мг в день введения линии, затем по 1 мг в день.
MdG включала: фиксированную дозу d, l- LV 350 мг (или l- LV, 175 мг) в виде 2-часовой инфузии внутривенно; затем FU iv болюс в течение 5 мин; затем 46-часовая инфузия ФУ (см. рис. 1). Лечение повторяли каждые 14 дней. MdG давался без рутинных профилактических противорвотных или противодиарейных препаратов, но пациенты получали стандартные дозы метоклопрамида и лоперамида перорально с письменными инструкциями по их применению. 46-часовая инфузия FU доставлялась с помощью одноразового эластомерного насоса (Baxter LV5 ® ). После вливания линия была промыта медсестрой пациента. Линии Хикмана промывали еженедельно между обработками. Пациентам без центрального венозного доступа настой вводился через периферическую канюлю в больнице до тех пор, пока доступ не был установлен.

dG, MdG и OxMdG. Уровни ФУ в плазме показаны для девяти пациентов, получающих dG (данные дня 2, экстраполированные со дня 1) и у 10, получающих MdG, при более низкой дозе 400 мг / м2 болюс + 2400 мг / м2 46-часовая инфузия, используемая в OxMdG график.
Изображение в полном размере
OxMdG предшествовал в / в дексаметазон 8 мг и гранисетрон 1 мг, а затем пероральный дексаметазон (4 мг в день в день 2; в день 3 и день в 4 дня). Оксалиплатин 85 мг / м2 вводили одновременно с ЛЖ через Y-коннектор в течение первых 2 часов. Каждое лекарство разводили в 250 мл 5% -ной декстрозы, и следили за тем, чтобы избежать смешивания оксалиплатина с физиологическим раствором. После этого OxMdG вводили так же, как MdG.
Начальная доза химиотерапии и корректировки
LV не был скорректирован на токсичность. Начальная доза для 5-минутного болюсного FU была 400 мг / м2 для всех пациентов, как для MdG, так и для OxMdG. Доза 46-часовой инфузии ФУ была изучена путем увеличения дозы у первых 32 пациентов, получавших MdG. Было исследовано пять уровней доз, 2000–3600 мг / м2 (таблица 2). Пациентов оценивали на токсичность после каждого цикла (NCI Common Toxicity Criteria v2.0). После цикла 4 дозволенное повышение дозы внутри пациента до следующего уровня было разрешено при условии, что не было острой токсичности, превышающей CTC степени 2 или стойкой степени токсичности 2. Цель состояла в том, чтобы установить дозу, при которой лечение могло бы продолжаться в течение неопределенного времени, поэтому постоянная симптоматическая токсичность степени 2 была принята в качестве показателя для снижения дозы.
Таблица в натуральную величину
После завершения исследования по увеличению дозы, инфузионная доза FU 46 ч была установлена на уровне 2800 мг / м2 для пациентов, получающих только MdG, и 2400 мг / м2 для пациентов, получающих OxMdG. Эти дозы не были увеличены после этого. Как и прежде, исследовательская медсестра оценивала токсичность в начале каждого цикла химиотерапии. Для 1-го дня WBC, ANC или количества тромбоцитов степени ⩾ 2, или для негематологической токсичности степени despite 2, несмотря на симптоматические меры, лечение было отложено на 1 неделю. Если требовалась 2-недельная задержка или две отдельные задержки в 1 неделю, последующие дозы химиотерапии (болюсное введение ФУ; инфузия ФУ; оксалиплатин, но не ЛЖ) были снижены на 20%.
Нейросенсорная токсичность была тщательно оценена у пациентов, получавших OxMdG. Оксалиплатин не был скорректирован для временной вызванной простудой дизетезии, но был исключен из схемы периферической сенсорной нейропатии, вызывающей боль, онемение или потерю функции (NCI CTC 3 степени), если он сохранялся между циклами химиотерапии. Оксалиплатин был повторно введен, если все симптомы невропатии разрешены.
Продолжительность лечения не была фиксированной. Химиотерапия была прекращена при прогрессировании заболевания, но перерывы в лечении обсуждались с пациентами, чье заболевание оставалось контролируемым после 12 циклов, возобновляя тот же режим позже.
Оценка ответа и продолжительности лечения
Анализы крови и клиническую оценку проводили два раза в неделю, анализы опухолевых маркеров - 4 недели, а визуализацию (компьютерная томография ± другие тесты) - 12 недель. Первоначально ответ на химиотерапию оценивали с использованием критериев ВОЗ, но после того, как была обнаружена неожиданно высокая активность в когорте терапии первой линии OxMdG, все записи о случаях заболевания и сканы в этой группе были подвергнуты внешнему анализу и оценены с использованием критериев RECIST (Therasse et al, 2000) независимый онколог и радиолог.
Фармакокинетика
Десять пациентов, получавших OxMdG, также участвовали в исследовании фармакокинетики FU, в котором были взяты пробы во время одного цикла OxMdG и одного парного цикла только MdG (при инфузии 2400 мг / м2 в течение 46 часов FU). Кровь брали с 10 интервалами до 4 часов, а также через 24 и 46 часов. Образцы подвергали холодному прядению, а плазму замораживали сразу после сбора. Плазму 5-FU определяли анализом ВЭЖХ (Seymour et al, 1994). Трапециевидный метод был использован для расчета FU AUC 0–48 часов. Об этом исследовании сообщается в другом месте и показывает, что оксалиплатин не оказывает значительного влияния на фармакокинетику плазмы FU (Joel et al, 2000).
Для текущего исследования данные для этих 10 пациентов во время MdG сравниваются с историческими контрольными данными для девяти пациентов, ранее изученных с использованием тех же методов отбора проб и анализа, в той же лаборатории, во время лечения dG. Пациенты, получавшие dG, проходили фармакокинетический отбор в течение первых 24-часового периода, и эти данные были экстраполированы для оценки FU AUC 0–48 часов . Это предполагает приблизительно одинаковую фармакокинетику FU в дни 1 и 2 стандартной схемы приема dG.
Результаты
Повышение дозы и переносимость МДГ
Данные для всех 46 пациентов, получающих MdG, суммированы в таблице 2. В целом, MdG является хорошо переносимым и практически осуществимым режимом. Ограничивающими дозу побочными эффектами в краткосрочной перспективе являются желудочно-кишечный тракт (диарея, мукозит; тошнота) и, после длительного лечения, дерматологический (дерматит кисти / стопы). Случаев гематологической токсичности 3 степени не было, даже при более высоких дозах ФУ.
При более низких уровнях дозы токсичность ограничивалась тошнотой 2 степени, диареей, стоматитом или летаргией. У одного пациента была достигнута деэскалация с 2400 до 2000 мг / м2 при диарее 4 степени, но за этим исключением 2400 мг / м2 вызвало минимальную токсичность, степень которой сходна со стандартной схемой dG.
При 2800 мг / м2 5 из 22 поддающихся оценке пациентов в конечном итоге нуждались в деэскалации, в одном случае после тошноты 3 степени, но во всех других случаях для стойкой токсичности 2 степени (тошнота; диарея; стоматит; дерматит). Эта степень токсичности выше, чем при стандартной схеме приема dG, но все же меньше, чем при традиционной MTD, и этот уровень дозы был выбран в качестве оптимальной начальной дозы для будущего использования только MdG. Таблица 3 показывает максимальную токсичность на пациента для 33 пациентов, которые получали MdG при этом уровне дозы в исследовании с повышением дозы или в расширенной когорте.
Таблица в натуральную величину
Некоторые пациенты могут переносить более высокие дозы ФУ. При 3200 мг / м2 71% пациентов были в состоянии перенести три или более циклов без снижения дозы. Однако токсичность 2 степени была частой и приводила к снижению дозы у 50% пациентов после шести циклов, поэтому эта доза не была выбрана для дальнейшего исследования. Ни один из пациентов не был введен в дозе 3600 мг / м2, но из пяти пациентов, достигших этого уровня, только два переносили его в течение> трех циклов. Случаев смерти, связанных с лечением, не было.
Переносимость OxMdG
62 пациента OxMdG получили в общей сложности 778 циклов лечения. Данные о серьезных побочных эффектах (SAE) и максимальной общей токсичности представлены для всех циклов у всех пациентов (Таблица 3). Данные о токсичности за цикл приведены только для первых шести циклов у пациентов, проходящих формальное исследование II фазы, во избежание смещения из-за снижения дозы и различных методов сбора данных (Таблица 4).
Таблица в натуральную величину
Профиль токсичности был одинаковым у пациентов первой и второй линии. Основными токсическими эффектами были сенсорная невропатия, летаргия, диарея, тошнота и нейтропения. Однако они редко превышали 2 класс (Таблица 4). У трех пациентов оксалиплатин был исключен из схемы лечения после рецидивирующей миелосупрессии (нейтропения и / или тромбоцитопения), несмотря на соответствующее снижение дозы. Легкая сенсорная невропатия была очень распространенной (55% циклов). Среди 25 пациентов первой линии в формальном исследовании II фазы девять потребовали исключения оксалиплатина для нейротоксичности в какой-то момент до неудачи лечения (медиана, 12 циклов). У пациентов с устойчивостью к ФУ, поскольку прогрессирование заболевания при лечении происходило раньше, меньшее количество (5 из 37) требовало пропуска оксалиплатина для кумулятивной токсичности.
Несмотря на в целом благоприятный профиль токсичности, две смерти были связаны с лечением (3, 2% пациентов). Один пациент после восьми предыдущих бесплодных циклов постепенно прогрессировал в течение 48 часов, не обращаясь за помощью, а затем был срочно доставлен в ближайшую больницу с нейтропенией и дыхательной недостаточностью и умер в течение нескольких часов. У второго пациента не было нейтропении, но он был подвержен подавляющей метициллин-резистентной септицемии Staphylococcus aureus (MRSA), связанной с центральным венозным катетером.
Противоопухолевая эффективность
Исследование по увеличению дозы MdG не было предназначено для измерения эффективности, но у восьми пациентов в группе инфузии 2800 мг / м 2 был необработанный оцениваемый прогрессирующий колоректальный рак. Затем на этом уровне (без эскалации) были введены еще 14 пациентов с колоректальным поражением, чтобы дать предварительный анализ эффективности в общей сложности 22 пациентам (таблица 5). Среди этих 22 пациентов PR ВОЗ наблюдался у восьми (36%), с МР или СД в течение> 12 недель у еще семи (32%). Медиана безотказной выживаемости (FFS) составила 9, 3 месяца. После MdG 15 из 22 пациентов получили химиотерапию второй (± третьей) линии, а одному респондеру была проведена лечебная резекция печени. Медиана общей выживаемости (ОС) от начала приема МДГ составляет 16, 8 месяца.
Таблица в натуральную величину
Ответ опухоли был формальной конечной точкой исследований OxMdG (таблица 5). Тридцать четыре из 37 пациентов второго ряда были оценены для ответа. У четырех пациентов достигнут подтвержденный частичный ответ (12%), у одного пациента - неподтвержденный частичный ответ (3%), а у 12 (35%) - стабильное заболевание в течение по меньшей мере 12 недель. Медиана FFS составила 4, 8 месяца, а медиана ОС - 10, 7 месяца с момента запуска OxMdG.
Для когорты 1-й линии OxMdG все случаи и сканы были проанализированы и оценены для ответа с использованием критериев RECIST независимым онкологом и рентгенологом, назначенным ICRF. Один пациент с болезнью, наблюдаемой только лапароскопически, не был оценен. Один пациент (4%) достиг полного ответа; подтвержденные частичные ответы были замечены у 17 (68%); Неподтвержденные (при втором сканировании) частичные ответы наблюдались еще у двух пациентов (8%). У трех пациентов (12%) заболевание оставалось стабильным не менее 12 недель. Два пациента прогрессировали, в обоих случаях после двух циклов. Общий коэффициент ответа (CR + подтвержденный PR) составил 72%. Медиана выживаемости без сбоев составляет 10, 6 месяцев (диапазон 0, 9–24, 7), а медиана общей выживаемости - 16, 7 месяцев (диапазон 2, 0–26, 7 +).
Три пациента с изначально неоперабельными метастазами перенесли операцию на печени после ответа на OxMdG. Двое с тех пор рецидив, и один ответил на повторный вызов с тем же режимом. Один пациент с заболеванием средостения прошел консолидацию лучевой терапии средостения и остался без заболевания 1 год спустя.
Фармакокинетика
На Рисунке 1 и в Таблице 6 показаны профили плазмы FU во время стандартной схемы лечения dG или MdG (при более низком уровне инфузионной дозы 2400 мг / м2 FU, как в OxMdG). Общая площадь под кривой концентрация-время ФУ во время режима (AUC 0–48 ч ) одинакова для двух режимов (Таблица 6). Это согласуется с клиническими данными, полученными в ходе исследования с повышением дозы, что, несмотря на более высокую интенсивность FU-дозы, MdG в этой дозе обладает такой же минимальной токсичностью, что и стандартный dG.
Таблица в натуральную величину
обсуждение
Новые цитотоксические препараты для лечения колоректального рака привели к долгожданной необходимости разработки безопасных и эффективных схем комбинированного лечения. В Европе dG сочетался с оксалиплатином и иринотеканом, что в каждом случае приводило к успешным испытаниям фазы III при распространенном заболевании. В первом исследовании 210 пациентов получали оксалиплатин + dG, токсичность ⩾ 3 степени была частой, но поддающейся контролю, и была зарегистрирована одна токсическая смерть (
Читайте также:

