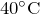Формулы оксидов и гидроксидов с хлором
Определение и формула гидроксида хлора
Существует несколько кислот, в которых хлор проявляет различные степени окисления.
Хлорноватистая кислота
Химическая формула – 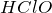
Молярная масса равна 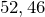
г/моль.
Степень окисления хлора равна +1.
Обладает слабыми кислотными свойствами.
Физические свойства – в свободном виде не выделена, но существует в растворе зеленовато-желтого цвета.
Перегоняется в вакууме, разлагается на свету. Экстрагируется из воды в эфир.
Образует соли — гипохлориты.
- Вступает в реакцию с соляной кислотой с образованием хлора и воды:
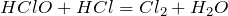
Реагирует разбавленным раствором гидроксида натрия с образованием соли:
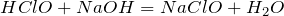
В реакции с иодоводородом проявляет окислительные свойства:
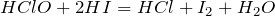
Взаимодействует с сульфидом марганца:
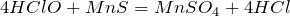
Хлорноватистая кислота образуется из соответствующего оксида:
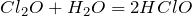
Хлористая кислота
Формула – 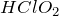
Молярная масса равна 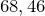
г/моль.
Физические свойства – в свободном виде не выделена.
Существует в разбавленном растворе (бесцветный).
Образует соли — хлориты.
- При температуре
![]()
разлагается на оксид хлора (IV), соляную кислоту и воду:
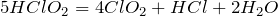
Реагирует с соляной кислотой:
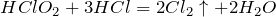
Вступает в реакции обмена с гидроксидом натрия:
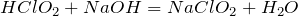
Взаимодействует с хлорноватистой кислотой:
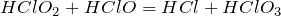
Один из способов получения хлористой кислоты основан на взаимодействии оксида хлора (IV) с пероксидом водорода:
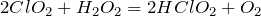
Хлорноватая кислота
Формула – 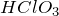
Молярная масса равна 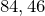
г/моль.
Физические свойства – в свободном виде не выделена.
Существует в бесцветном растворе.
Сильная одноосновная кислота.
Образует соли — хлораты.
- Реагирует с соляной кислотой:
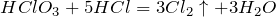
Взаимодействует с 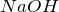
с образованием хлората натрия:
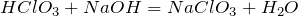
Вступает в реакции окисления-восстановления:
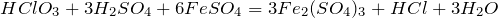
Один из способов получения хлорноватой кислоы основан на взаимодействии хлората бария и серной кислоты:
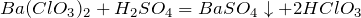
Хлорная кислота
Формула – 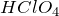
Молярная масса равна 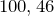
г/моль.
Физические свойства – бесцветная гигроскопичная легкоподвижная жидкость.
Неограниченно смешивается с водой.
Концентрированные растворы маслообразны.
Образует соли — перхлораты.
- Реагирует с щелочами, проявляя кислотные свойства:
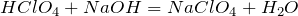
Реагирует с хлоридом калия с образованием перхлората калия:
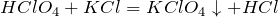
Безводная хлорная кислота реагирует с графитом:
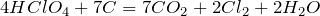
Один из способов получения хлорной кислоты основан на диспропорционировании кипящего раствора хлорноватой кислоты:
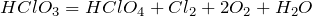
Примеры решения задач
| Задание | Каков pH 0,01 М раствора хлорноватистой кислоты? |
| Решение | Хлорноватистая кислота является слабой и ее константа диссоциации равна: |
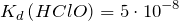
Запишем выражение для электролитической диссоциации кислоты:
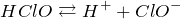
При достижении равновесия 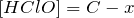
моль/л, 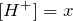
моль/л, 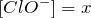
моль/л,
где 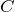
— исходная концентрация кислоты, а 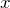
определяет то, сколько прореагировало вещества к моменту равновесия.
Запишем выражение для 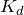
:
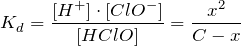
Так как 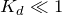
, то 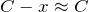
, тогда
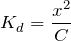
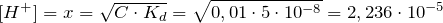
моль/л
Определим 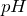
:
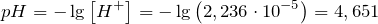
| Задание | К 20 граммам 10%-ного раствора хлорида хлорной кислоты прилили 20 грамм 10%-ного раствора гидроксида калия. Какое из реагирующих веществ находится в недостатке? |
| Решение | Запишем уравнение взаимодействия хлорной кислоты и гидроксида калия: |
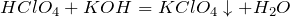
Исходя из уравнения определим количество моль хлорной кислоты:
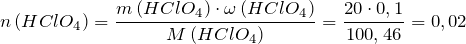
Найдем количество моль гидроксида калия:
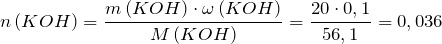
Таким образом, хлорная кислота находится в недостатке.
Задача 165.
Какие из указанных гидроксидов могут образовать основные соли: а) Cu(OH) 2 ; б) Ca(OH) 2 ; в) LiOH; г) Al(OH) 3 ; д) KOH.
Решение:
а) Гидроксид меди (II) Cu(OH) 2 – двухкислотный гидроксид , поэтому может образовать основные соли, например сульфат гидроксомеди (II) или хлорид гидроксомеди (II), например:
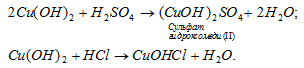
б) Гидроксид кальция Ca(OH)2 - двухкислотный гидроксид, поэтому может образовать основные соли, например сульфат гидроксокальция или хлорид гидроксокальция, например:
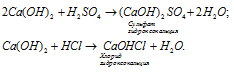
в) Гидроксид лития LiOH - однокислотный гидроксид, поэтому не может образовывать основные соли.
г) Гидроксид алюминия Al(OH)3 – трёхкислотный гидроксид, поэтому может образовывыть одноосновные и двухосновные соли, например:
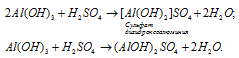
д) Гидроксид калия KOH - однокислотный гидроксид, поэтому основные соли не образует.
Ответ: а), б), г).2
Задача 166.
Ангидридом какой кислоты является Р2О5: а) фосфористой; б) двуфосфорной; в) ортофосфорной?
Решение:
Оксид фосфора Р2О5 является ангидридом ортофосфорной кислоты Н3РО4 и двуфосфорной кислоты Н4Р2О7. При взаимодействии с водой оксид фосфора (V) образует ортофосфорную и полифосфоные кислоты (в кристаллическом состоянии выделена только простейшая двуфосфорная кислота):
Структурная формула ортофосфорной кислоты H3PO4:
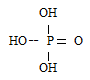
Структурная формула двуфосфорной кислоты Н 4 Р 2 О 7:
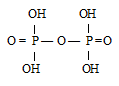
Таким образом, двуфосфорная кислота представляет собой продукт соединения двух тетраэдров РО4-.
Ангидридом Фосфористой кислоты H3PO3 является оксид фосфора (III) Р2О3, который под действием холодной воды медленно взаимодействует с ней, образуя кислоту:
Ответ: а; б.
Задача 167.
Ангидридом какой кислоты можно считать С12О7: а) хлорной; б) хлорноватой; в) хлорноватистой?
Решение:
а) Оксид хлора (VII) С12О7 можно считать ангидридом хлорной кислоты HClO4, потому что если нагреть хлорную кислоту в присутствии Р2О5, отнимающим воду, то образуется оксид хлора (VII):
Оксид хлора (VII) С12О7 c водой не смешивается, их взаимодействие происходит на границе раздела фаз, при этом образуется хлорная кислота:
В соединениях С12О7 и HClO4 атом хлора находится в своей степени окисления +7.
б) Ангидрид хлорноватой кислоты HClO3 не известен. При действии концентрированной серной кислоты на соль хлорноватой кислоты KClO3 вместо него выделяется жёлто-бурый газ с характерным запахом – оксид хлора (IV) ClO2.
в) Ангидридом хлорноватистой кислоты HOCl можно считать оксид хлора (I) Cl2O, потому что в водных растворах кислоты устанавливается два равновесия:
HOCl ⇔ H + + OCl - ;
2HOCl ⇔ Cl2O + H2O
Ответ: а).
Задача 168.
Какие из приведенных соединений относятся к пероксидам а) NO2; б) K2O2; в) BaO2; г) MnO2?
Решение:
Пероксидами или перекисями называются соли перекиси водорода Н2О2. Пероксиды состоят из положительно заряжённых ионов металла и отрицательно заряжённых ионов. Степень окисления кислорода в пероксидах равна -1.
а) NO2 – оксид азота (IV). Степень окисления кислорода в данном соединении равна -1, а азота – равна +4. Значит, NO2 – не пероксид.
б) К2О2 – пероксид калия. Степень окисления калия всегда равна +1, значит, степень окисления кислорода в этом соединении будет равна -1. Таким образом, К2О2 – пероксид.
в) ВаО2 – пероксид бария. Степень окисления бария в соединениях всегда равна +2, значит, степень окисления кислорода в данном соединении равна -1. Таким образом, ВаО2 – пероксид.
г) MnO2 – оксид марганца (IV). Степень окисления атома марганца равна +4, а степень окисления кислорода в данном соединении равна -2, значит, MnO2 – оксид.
Ответ: б), в).
Задача 169.
В реакции нейтрализации гидроксида калия ортомышьяковой кислотой эквивалентная масса последней оказалась равной 142 г/моль. Какая соль при этом образовалась: а) ортоарсенат калия; б) гидроортоарсенат калия; в) дигидроортоарсенат калия?
Решение:
Мольная масса ортомышьяковой кислоты равнв 142г/моль.
Уравнения реакций образования :
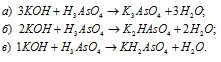
В реакции а) три иона H + замещаются на K + , т.е, N(H + ) = 3. Следовательно, согласно формуле fэкв(кислоты) = 1/N(H + ) фактор эквивалентности ортомышьяковой кислоты в реакции а) будет равен f экв (H 3 AsO 4 ) = 1/N(H + ) = 1/3. В реакции б) два иона H + замещаются на K + , т.е, N(H + ) =2 и fэкв(H3AsO4) = 1/N(H + ) = 1/2. В реакции в) один ион H+ замещаются на ион К + , т.е, N(H + ) = 1 и fэкв(H3AsO4) = 1/N(H + ) = 1/1. Теперь рассчитаем молярную массу эквивалента H3AsO4 (в г/моль) - произведение фактора эквивалентности на молярную массу этого вещества по формуле:
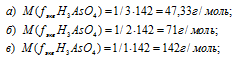
Так как по условию задачи эквивалентная масса кислоты равна 142г/моль, что соответствует реакции в), то образовалась соль – дигидроортоарсенат калия.
Ответ: в).
Задача 170.
Какая формула соответствует марганцовистой кислоте а) НМnО4; б) H4MnO4; в) Н2MnO4?
Решение:
Марганцовистая кислота Н2MnO4 - гидроксид марганца (VI) – гидроксид марганца(VI) – неустойчивое соединение, которое уже в водном растворе диссоциирует до марганцовой кислоты НМnО4 и оксида марганца (IV) MnO2, который при растворении в воде образует гидроксид марганца (IV) H4MnO4 или Mn(OH)4:
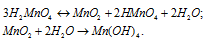
Марганцовистой кислоте соответствует ангидрид MnO3, который в свободном виде не получен. Соли марганцовистой кислоты называются манганатами, например K2MnO4. Манганаты в водных растворах имеют зеленную окраску, которую им придают манганат-ионы MnO4 2- . Степень окисления атома марганца в Н2MnO4 равна +6.
Ответ: в).
Задача 171.
Какая из формул соответствует хлорату бария: а) ВаСI2; б)Ba(OCl)2; в) Ва(ClO3)2; г) Ва(СIО2)2?
Решение:
Хлораты – соли хлорноватой кислоты HCO3. Ион ClO3 - называется хлорат-ион.
а) ВаСI2 – хлорид бария – соль соляной кислоты HCl, её соли называются хлоридами.
б) Ba(OCl)2 – гипохлорит бария - соль хлорноватистой кислоты HlO, её соли называются гиипохлоритами.
в) Ва(ClO3)2 – хлорат бария – соль хлорноватой кислоты HClO3.
г) Ва(СIО2)2 – хлорит бария – соль хлористой кислоты HClO2, её соли называются хлоритами.
Ответ: в).
Задача 172.
Какое название соответствует соли (CuOH)2CO3: а) гидрокарбонат меди; б) карбонат гидроксомеди (II) в) карбонат дигидроксомеди (II)?
Решение:
а) Гидрокарбонат меди Cu(HCO3)2 – кислая соль угольной кислоты H2CO3, в которорй один атом водорода замещён на ион меди Cu 2+ . Ион HCO3 - называется гидрокарбонат-ион, поэтому соли угольной кислоты, в которой один атом водорода замещён на атом металла, называют гидрокарбонаты.
б) Основная соль образуются при неполном замещении гидроксогрупп основания на кислотный остаток. Основная соль может быть образована металлом, валентность которого равна двум или больше в тех случаях, когда для реакции взято в избытке основание, например:
Следовательно, (CuOH)2CO3 - основная соль гидроксида меди (II) Cu(OH)2, в молекуле которого одна гидроксильная группа замещена на кислотный остаток угольной кислоты карбонат-ион CO3 2- .
в) Гидроксид меди (II) Cu(OH)2 - двухкислотное основание, поэтому может образовывать только один вид основных солей, в молекулах которых одна гидроксогруппа замещена на кислотный остаток, например CuOHCl или (CuOH)2CO3. Следовательно, соль карбонат дигидроксомеди (II) не существует.
Ответ: б).
Задача 173.
Какая соль образуется при взаимодействии 1 моля гидроксида цинка и 2 молей ортофосфорной кислоты: а) ортофосфат цинка; б) дигидроортофосфат цинка; в) ортофосфат гидроксоцинка; г) гидроортофосфат цинка?
Решение:
а) Уравнение реакции получения ортофосфата цинка:
б) Уравнение реакции получения дигидроортофосфата цинка:
в) Уравнение реакции получения ортофосфата гидроксоцинка:
г) Уравнение реакции получения гидроортофосфата цинка:
Таким образом, из 1 моля гидроксида цинка и 2 молей орптофосфорной кислоты образуется 1 моль дигидроортофосфата цинка.
Ответ: б).
Задача 174.
Какое взаимодействие приведет к получению нормальной соли из хлорида гидроксомагния: a) MgOHCl + NaOH; б) MgOHClO3 + NaOH; в) MgOHClO3 + HCl; г) MgOHCl + HCl?
Решение:
а) В водных растворах MgOHCl и NaOH как сильные электролиты распадаются на ионы:
MgOHCl ⇔ Mg 2+ + OH - + Cl -
NaOH ⇔ Na + + OH -
Ионы Mg 2+ , OH - , Cl - и Na + не связываются друг с другом и с ионами H + с образованием осадка, газа или слабого электролита, поэтому данная реакция не идёт.
б) В водных растворах MgOHClO3 и NaOH как сильные электролиты распадаются на ионы:
MgOHClO3 ⇔ Mg 2+ + OH - + ClO3 -
NaOH ⇔ ( Na + + OH -
Ионы Mg2+, OH-, ClO3- и Na+ не связываются друг с другом и с ионами H+ с образованием осадка, газа или слабого электролита, поэтому данная реакция не идёт.
в) В водных растворах MgOHCjO3 и HCl как сильные электролиты распадаются на ионы:
MgOHClO3 ⇔ Mg 2+ + OH - + ClO3 -
HCl ⇔ H + + Cl -
Из находящихся в растворе ионов Mg 2+ , OH - , ClO3 - , Cl - , H + ионы OH - и ионы H + связываются друг с другом с образованием слабого электролита воды HOH, поэтому реакция протекает, и при этом образуются две соли: хлорид магния MgCl2 и хлорат магния Mg(ClO3)2:
г) В водных растворах MgOHCl и HCl как сильные электролиты распадаются на ионы:
MgOHCl ⇔ Mg 2+ + OH - + Cl -
HCl ⇔ H + + Cl -
Из находящихся в растворе ионов Mg 2+ , OH - , Cl - , H + ионы H + и ионы OH - связываются друг с другом с образованием слабого электролита воды HOH, поэтому реакции протекает, и при этом образуется соль хлорид магния:
Содержание статьи
- Как получить оксиды хлора
- Как получить хлорид меди
- Как получить хлорид магния
Хлор образует с кислородом целый ряд оксидов, общее число которых составляет целых пять видов. Все их можно описать общей формулой ClxOy. В них валентность хлора меняется от 1 до 7.
Валентность разных оксидов хлора различна: Cl2O - 1, Cl2O3 - 3, ClO2 - 4, Cl2O6 - 6, Cl2O7 - 7.
Оксид хлора(I) применяют для производства гипохлоритов, которые являются сильными отбеливающими и обеззараживающими агентами.
Оксид хлора(II) активно применяют для отбеливания муки, целлюлозы, бумаги и других вещей, а также для стерилизации и дезинфекции.
Оксид хлора(VI) и оксид хлора(VII) применяют для синтеза органических соединений.
Получение Cl2O
Данный оксид на крупнотоннажных производствах получают двумя способами.
1. По методу Пелуза. Проводят реакцию между газообразным хлором и оксидом ртути. В зависимости от условий может образоваться иное соединение ртути, однако целевой продукт остается. После этого газообразный оксид хлора сжижают при температуре -60 градусов Цельсия.
Уравнения реакции, описывающие метод Пелуза:
2HgO + Cl2 = Hg2OCl2 + Cl2O
HgO + 2Cl2 = HgCl2 + Cl2O
2. Взаимодействие хлора с водным раствором карбоната натрия по реакции:
2Cl2 + 2Na2CO3 + H2O = 2NaHCO3 + Cl2O + 2NaCl
Карбонат натрия может быть заменен другими карбонатами щелочных или щелочноземельных металлов.
Получение ClO2
Единственный промышленный метод получения диоксида хлора основан на взаимодействии хлората натрия и диоксида серы в кислой среде. Результатом такого взаимодействия становится реакция:
2NaClO3 + SO2 + H2SO4 = 2NaHSO4 + ClO2
Получение Cl2O6
В промышленности Cl2O6 получают взаимодействием диоксида хлора с озоном:
2ClO2 + 2O3 = 2O2 + Cl2O6
Получение Cl2O7
1. Осторожное нагревание хлорной кислоты с фосфорным ангидридом приводит к отделению маслянистой жидкости, которая является оксидом хлора (VII). Весь процесс описывается реакцией:
2HClO4 + P4O10 = H2P4O11 + Cl2O7
2. Второй способ получения данного оксида связан с электричеством. Если проводить электролиз раствора хлорной кислоты, то в анодном пространстве можно обнаружить Cl2O7.
3. Нагревание в вакууме перхлоратов переходных металлов приводит к образованию оксида хлора (VII). Наиболее часто нагревают перхлорат ниобия либо молибдена.
Физические свойства оксидов
Cl2O: при стандартных условиях буровато-желтый газ с запахом хлора, а при температуре ниже +2 градусов Цельсия золотисто-красная жидкость. Взрывоопасен в больших концентрациях.
ClO2: при стандартных условиях – газ с характерным запахом красно-желтого цвета, при температуре ниже +10 градусов Цельсия – красно-коричневая жидкость. Взрывается на свету, в присутствии восстановителей и при нагревании.
Cl2O6: неустойчивый газ, который начинает разлагаться при температуре от 0 до +10 градусов Цельсия с образованием диоксида хлора, при 20 градусах Цельсия образуется хлор. Ввиду образования диоксида хлора – взрывоопасен.
Cl2O7: бесцветная маслянистая жидкость, которая при нагревании выше 120 градусов Цельсия взрывается. Может детонировать от удара.
15.1. Общая характеристика галогенов и халькогенов
Галогены ("рождающие соли") – элементы VIIA группы. К ним относятся фтор, хлор, бром и йод. В эту же группу входит и неустойчивый, а потому не встречающийся в природе астат. Иногда к этой группе относят и водород.
Халькогены ("рождающие медь") – элементы VIA группы. К ним относятся кислород, сера, селен, теллур и практически не встречающийся в природе полоний.
Из восьми существующих в природе атомов элементов этих двух групп наиболее распространены атомы кислорода (w = 49,5 %), за ним по распространенности следуют атомы хлора (w = 0,19 %), далее – серы (w = 0,048 %), затем – фтора (w = 0,028 %). Атомов остальных элементов в сотни и тысячи раз меньше. Кислород вы уже изучали в восьмом классе (гл. 10), из остальных элементов наиболее важными являются хлор и сера – с ними вы и познакомитесь в этой главе.
Орбитальные радиусы атомов галогенов и халькогенов невелики и лишь у четвертых атомов каждой группы приближаются к одному ангстрему. Это приводит к тому, что все эти элементы, представляют собой элементы, образующие неметаллы и только теллур и йод проявляют некоторые признаки амфотерности.
Общая валентная электронная формула галогенов – ns 2 np 5 , а халькогенов – ns 2 np 4 . Маленькие размеры атомов не позволяют им отдавать электроны, напротив, атомы этих элементов склонны их принимать, образуя однозарядные (у галогенов) и двухзарядные (у халькогенов) анионы. Соединяясь с небольшими атомами, атомы этих элементов образуют ковалентные связи. Семь валентных электронов дают возможность атомам галогенов (кроме фтора) образовывать до семи ковалентных связей, а шесть валентных электронов атомов халькогенов – до шести ковалентных связей.
В соединениях фтора – самого электроотрицательного элемента – возможна только одна степень окисления, а именно –I. У кислорода, как вы знаете, максимальная степень окисления +II. У атомов остальных элементов высшая степень окисления равна номеру группы.
Простые вещества элементов VIIA группы однотипны по строению. Они состоят из двухатомных молекул. При обычных условиях фтор и хлор – газы, бром – жидкость, а йод – твердое вещество. По химическим свойствам эти вещества сильные окислители. Из-за роста размеров атомов с увеличением порядкового номера их окислительная активность снижается.
Из простых веществ элементов VIA группы при обычных условиях газообразны только кислород и озон, состоящие из двухатомных и трехатомных молекул, соответственно; остальные – твердые вещества. Сера состоит из восьмиатомных циклических молекул S8, селен и теллур из полимерных молекул Sen и Ten. По своей окислительной активности халькогены уступают галогенам: сильным окислителем из них является только кислород, остальные же проявляют окислительные свойства в значительно меньшей степени.
Состав водородных соединений галогенов (НЭ) полностью отвечает общему правилу, а халькогены, кроме обычных водородных соединений состава H2Э, могут образовывать и более сложные водородные соединения состава Н2Эn цепочечного строения. В водных растворах и галогеноводороды, и остальные халькогеноводороды проявляют кислотные свойства. Их молекулы – частицы-кислоты. Из них сильными кислотами являются только HCl, HBr и HI.
Для галогенов образование оксидов нехарактерно, большинство из них неустойчиво, однако высшие оксиды состава Э2О7 известны для всех галогенов (кроме фтора, кислородные соединения которого не являются оксидами). Все оксиды галогенов – молекулярные вещества, по химическим свойствам – кислотные оксиды.
В соответствии со своими валентными возможностями халькогены образуют два ряда оксидов: ЭО2 и ЭО3. Все эти оксиды кислотные.
Гидроксиды галогенов и халькогенов представляют собой оксокислоты.
Хлор самый распространенный, а потому и важнейший из галогенов.
В земной коре хлор встречается в составе минералов: галита (каменной соли) NaCl, сильвина KCl, карналлита KCl·MgCl2·6H2O и многих других. Основной промышленный способ получения – электролиз хлоридов натрия или калия.
Простое вещество хлор – газ зеленоватого цвета с едким удушающим запахом. При –101 °С конденсируется в желто-зеленую жидкость. Хлор весьма ядовит, во время первой мировой войны его даже пытались использовать в качестве боевого отравляющего вещества.
Хлор – один из самых сильных окислителей. Он реагирует с большинством простых веществ (исключение: благородные газы, кислород, азот, графит, алмаз и некоторые другие). В результате образуются галогениды:
Cl2 + H2 = 2HCl (при нагревании или на свету);
5Cl2 + 2P = 2PCl5 (при сжигании в избытке хлора);
Cl2 + 2Na = 2NaCl (при комнатной температуре);
3Cl2 + 2Sb = 2SbCl3 (при комнатной температуре);
3Cl2 + 2Fe = 2FeCl3 (при нагревании).
Кроме того хлор может окислять и многие сложные вещества, например:
Cl2 + 2HBr = Br2 + 2HCl (в газовой фазе и в растворе);
Cl2 + 2HI = I2 + 2HCl (в газовой фазе и в растворе);
Cl2 + H2S = 2HCl + S (в растворе);
Cl2 + 2KBr = Br2 + 2KCl (в растворе);
Cl2 + 3H2O2 = 2HCl + 2H2O + O2 (в концентрированном растворе);
Cl2 + CO = CCl2O (в газовой фазе);
Cl2 + C2H4 = C2H4Cl2 (в газовой фазе).
В воде хлор частично растворяется (физически), а частично обратимо реагирует с ней (см. § 11.4 в). С холодным раствором гидроксида калия (и любой другой щелочи) аналогичная реакция протекает необратимо:
Cl2 + 2OH
= Cl
+ ClO
+ H2O.
В результате образуется раствор хлорида и гипохлорита калия. В случае реакции с гидроксидом кальция образуется смесь CaCl2 и Ca(ClO)2, называемая хлорной известью.
С горячими концентрированными растворами щелочей реакция протекает иначе:
3Cl2 + 6OH
= 5Cl
+ ClO3
+ 3H2O.
В случае реакции с KOH так получают хлорат калия, называемый бертолетовой солью.
Хлороводород – единственное водородное соединение хлора. Этот бесцветный газ с удушающим запахом хорошо растворим в воде (нацело реагирует с ней, образуя ионы оксония и хлорид-ионы (см. § 11.4). Его раствор в воде называют соляной или хлороводородной кислотой. Это один из важнейших продуктов химической технологии, так как расходуется соляная кислота во многих отраслях промышленности. Огромное значение она имеет и для человека, в частности потому, что содержится в желудочном соке, способствуя перевариванию пищи.
Хлороводород раньше получали в промышленности, сжигая хлор в водороде. В настоящее время потребность в соляной кислоте почти полностью удовлетворяется за счет использования хлороводорода, образующегося в качестве побочного продукта при хлорировании различных органических веществ, например, метана:
И лаборатории хлороводород получают из хлорида натрия, обрабатывая его концентрированной серной кислотой:
NaCl + H2SO4 = HCl + NaHSO4 (при комнатной температуре);
2NaCl + 2H2SO4 = 2HCl + Na2S2O7 + H2O (при нагревании).
Высший оксид хлора Cl2O7 – бесцветная маслянистая жидкость, молекулярное вещество, кислотный оксид. В результате реакции с водой образует хлорную кислоту HClO4, единственную оксокислоту хлора, существующую как индивидуальное вещество; остальные оксокислоты хлора известны только в водных растворах. Сведения об этих кислотах хлора приведены в таблице 35.
Читайте также: