Формулы бинарных соединений с хлором
Хлор — элемент 3-го периода и VII А-группы Периодической системы, порядковый номер 17. Электронная формула атома [10Ne ]3s 2 Зр 5 , характерные степени окисления 0, -1, + 1, +5 и +7. Наиболее устойчиво состояние Cl -1 . Шкала степеней окисления хлора:
+ 1 – Cl2O , ClO — , HClO , NaClO , Ca(ClO)2
— 1 – Cl — , HCl, KCl , PCl5
Хлор обладает высокой электроотрицательностью (2,83), проявляет неметаллические свойства. Входит в состав многих веществ — оксидов, кислот, солей, бинарных соединений.
В природе — двенадцатый по химической распространенности элемент (пятый среди неметаллов). Встречается только в химически связанном виде. Третий по содержанию элемент в природных водах (после О и Н), особенно много хлора в морской воде (до 2 % по массе). Жизненно важный элемент для всех организмов.
Хлор С12 . Простое вещество. Желто-зеленый газ с резким удушливым запахом. Молекула Сl2 неполярна, содержит σ-связь С1-С1. Термически устойчив, негорюч на воздухе; смесь с водородом взрывается на свету (водород сгорает в хлоре):
Хорошо растворим в воде, подвергается в ней дисмутации на 50 % и полностью — в щелочном растворе:
Хлор очень сильный окислитель по отношению к металлам и неметаллам:
Сl2 + РЬ→PbCl2 (300 °С)
Реакции с соединениями других галогенов:
Качественная реакция — взаимодействие недостатка СL2 с КI (см. выше) и обнаружение йода по синему окрашиванию после добавления раствора крахмала.
Получение хлора в промышленности:
2NаСl (расплав)→ 2Nа + Сl2 (электролиз)
2NaCl+ 2Н2O→Н2↑ + Сl2↑ + 2NаОН (электролиз)
и в лаборатории:
(аналогично с участием других окислителей; подробнее см. реакции для НСl и NaСl).
Хлор относится к продуктам основного химического производства, используется для получения брома и йода, хлоридов и кислородсодержащих производных, для отбеливания бумаги, как дезинфицирующее средство для питьевой воды. Ядовит.
Качественная реакция на ион Сl — — образование белых осадков АgСl и Нg2Сl2, которые не переводятся в раствор действием разбавленной азотной кислоты.
Хлороводород служит сырьем в производстве хлоридов, хлорорганических продуктов, используется (в виде раствора) при травлении металлов, разложении минералов и руд. Уравнения важнейших реакций:
Получение НСl в промышленности — сжигание Н2 в Сl2 (см.), в лаборатории — вытеснение из хлоридов серной кислотой:
Хлорид натрия NaСl. Бескислородная соль. Бытовое название поваренная соль. Белый, слабогигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, растворимость мало зависит от температуры, раствор имеет характерный соленый вкус. Гидролизу не подвергается. Слабый восстановитель. Вступает в реакции ионного обмена. Подвергается электролизу в расплаве и растворе.
Применяется для получения водорода, натрия и хлора, соды, едкого натра и хлороводорода, как компонент охлаждающих смесей, пищевой продукт и консервирующее средство.
В природе — основная часть залежей каменной соли, или галита, и сильвинита (вместе с КСl),рапы соляных озер, минеральных примесей морской воды (содержание NaСl=2,7%). В промышленности получают выпариванием природных рассолов.
Уравнения важнейших реакций:
NaCl(ж)→2Na+Cl2↑ (850°С, электролиз )
2NаСl + 2Н2O→Н2↑ + Сl2↑ + 2NаОН (электролиз )
2NаСl(р,20%)→ Сl2↑+ 2Nа(Нg) “амальгама”(электролиз ,на Hg-катоде)
Хлорид калия КСl. Бескислородная соль. Белый, негигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, раствор имеет горький вкус, гидролиза нет. Вступает в реакции ионного обмена. Применяется как калийное удобрение, для получения К, КОН и Сl2. В природе основная составная часть (наравне с NаСl) залежей сильвинита.
Уравнения важнейших реакций одинаковы с таковыми для NаСl.
Уравнения важнейших реакций:
СаСl2(ж) → Са + Сl2 ↑(электролиз ,800°С)
Качественная реакция на ион Аl 3+ — образование осадка АlРO4, который переводится в раствор концентрированной серной кислотой.
Применяется как сырье в производстве алюминия, катализатор в органическом синтезе и при крекинге нефти, переносчик хлора в органических реакциях. Уравнения важнейших реакций:
АlСl3 . 6Н2O →АlСl(ОН)2 (100-200°С, —HCl,H2O)→Аl2O3(250-450°С, -HCl,H2O)
2АlСl3→2Аl + 3Сl2↑(электролиз,800 °С ,в расплаве NаСl)
Получение АlСl в промышленности — хлорирование каолина, глинозёма или боксита в присутствии кокса:
Хлорид железа(II) FеСl2. Бескислородная соль. Белый (гидрат голубовато-зеленый), гигроскопичный. Плавится и кипит без разложения. При сильном нагревании летуч в потоке НСl. Связи Fе — Сl преимущественно ковалентные, пар состоит из мономеров FеСl2 (линейное строение, sр-гибридизация) и димеров Fе2Сl4. Чувствителен к кислороду воздуха (темнеет). Хорошо растворим в воде (с сильным экзо-эффектом), полностью диссоциирует на ионы, слабо гидролизуется по катиону. При кипячении раствора разлагается. Реагирует с кислотами, щелочами, гидратом аммиака. Типичный восстановитель. Вступает в реакции ионного обмена и комплексообразования.
Применяется для синтеза FеСl и Fе2О3, как катализатор в органическом синтезе, компонент лекарственных средств против анемии.
Уравнения важнейших реакций:
FеСl2 (конц.) + Н2O=FеСl(ОН)↓ + НСl↑ (кипячение)
FеСl2 + 2NаОН (разб.) = Fе(ОН)2↓+ 2NaСl (в атм. N2)
FеСl2 + Н2 = 2НСl + Fе (особо чистое,выше 500 °С)
5Fе 2+ + 8Н + + МnО — 4 = 5Fе 3+ + Мn 2+ + 4Н2O
6Fе 2+ + 14Н + + Сr2O7 2- = 6Fе 3+ + 2Сr 3+ +7Н2O
Fе 2+ + S 2- (разб.) = FеS↓
FеСl2 →Fе↓ + Сl2↑ (90°С, в разб. НСl, электролиз)
Получение: взаимодействие Fе с соляной кислотой:
(в промышленности используют хлороводород и ведут процесс при 500 °С).
Хлорид железа(III) FеСl3. Бескислородная соль. Черно-коричневый (темно-красный в проходящем свете, зеленый в отраженном), гидрат темно-желтый. При плавлении переходит в красную жидкость. Весьма летуч, при сильном нагревании разлагается. Связи Fе — Сl преимущественно ковалентные. Пар состоит из мономеров FеСl3 (треугольное строение, sр 2 -гибридизация, преобладают выше 750 °С) и димеров Fе2Сl6 (точнее, Сl2FеСl2FеСl2, строение — два тетраэдра с общим ребром, sр 3 -гибридизация, преобладают при 316-750 °С). Кристаллогидрат FеСl . 6Н2O имеет строение [Fе(Н2O)4Сl2]Сl • 2Н2O. Хорошо растворим в воде, раствор окрашен в желтый цвет; сильно гидролизован по катиону. Разлагается в горячей воде, реагирует со щелочами. Слабый окислитель и восстановитель.
Применяется как хлорагент, катализатор в органическом синтезе, протрава при крашении тканей, коагулянт при очистке питьевой воды, травитель медных пластин в гальванопластике, компонент кровоостанавливающих препаратов.
Уравнения важнейших реакций:
FеСl3 + 3NaОН (разб.) = FеО(ОН)↓ + Н2O + 3NаСl (50 °С)
Хлорид аммония NН4Сl. Бескислородная соль, техническое название нашатырь. Белый, летучий, термически неустойчивый. Хорошо растворим в воде (с заметным эндо-эффектом, Q = -16 кДж), гидролизуется по катиону. Разлагается щелочами при кипячении раствора, переводит в раствор магний и гидроксид магния. Вступает в реакцию кон мутации с нитратами.
Качественная реакция на ион NН4 + — выделение NН3 при кипячении со щелочами или при нагревании с гашёной известью.
Применяется в неорганическом синтезе, в частности для создания слабокислотной среды, как компонент азотных удобрений, сухих гальванических элементов, при пайке медных и лужении стальных изделий.
Уравнения важнейших реакций:
Получение: взаимодействие NH3 с НСl в газовой фазе или NН3 Н2О с НСl в растворе.
Гипохлорит кальция Са(СlО)2. Соль хлорноватистой кислоты НСlO. Белый, при нагревании разлагается без плавления. Хорошо растворим в холодной воде (образуется бесцветный раствор), гидролизуется по аниону. Реакционноспособный, полностью разлагается горячей водой, кислотами. Сильный окислитель. При стоянии раствор поглощает углекислый газ из воздуха. Является активной составной частью хлорной (белильной) извести — смеси неопределенного состава с СаСl2 и Са(ОН)2. Уравнения важнейших реакций:
Хлорат калия КСlO3. Соль хлорноватой кислоты НСlO3, наиболее известная соль кислородсодержащих кислот хлора. Техническое название — бертоллетова соль (по имени ее первооткрывателя К.-Л. Бертолле, 1786). Белый, плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (образуется бесцветный раствор), гидролиза нет. Разлагается концентрированными кислотами. Сильный окислитель при сплавлении.
Применяется как компонент взрывчатых и пиротехнических смесей, головок спичек, в лаборатории — твердый источник кислорода.
Уравнения важнейших реакций:
4КСlO3 = ЗКСlO4 + КСl (400 °С)
2КСlO3 = 2КСl + 3O2 (150-300 °С, кат. МпO2)
(диоксид хлора на свету взрывается: 2СlO2(Г) = Сl2 + 2O2)
2КСlO3 + Е2(изб.) = 2КЕO3 + Сl2↑ (в разб. НNO3, Е = Вr, I)
Получение КСlO3в промышленности — электролиз горячего раствора КСl (продукт КСlO3 выделяется на аноде):
Бромид калия КВr. Бескислородная соль. Белый, негигроскопичный, плавится без разложения. Хорошо растворим в воде, гидролиза нет. Восстановитель (более слабый, чем
Качественная реакция на ион Вr — вытеснение брома из раствора КВr хлором и экстракция брома в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в бурый цвет).
Применяется как компонент травителей при гравировке по металлам, составная часть фотоэмульсий, лекарственное средство.
Уравнения важнейших реакций:
5Вr — + 6Н + + ВrО3 — = 3Вr 2 + 3Н2O
КВr + 3Н2O→3Н2↑ + КВrО3 (60-80 °С, электролиз)
Иодид калия КI. Бескислородная соль. Белый, негигроскопичный. При хранении на свету желтеет. Хорошо растворим в воде, гидролиза нет. Типичный восстановитель. Водный раствор КI хорошо растворяет I2 за счет комплексообразования.
Качественная реакция на ион I — вытеснение иода из раствора КI недостатком хлора и экстракция иода в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в фиолетовый цвет).
Уравнения важнейших реакций:
10I — + 16Н + + 2МnO4 — = 5I2↓ + 2Мn 2+ + 8Н2O
I — + Аg + = АgI (желт.)↓
Бинарные соединения – соединения, образованные двумя химическими элементами.
Бинарные соединения делят на ионные и ковалентные.
Ионными называют такие бинарные соединения, которые образованы атомами металла и неметалла.
Ковалентными называют бинарные соединения, образованные двумя неметаллами.
Общая информация по гидролизу бинарных соединений
Многие бинарные соединения способны разлагаться под действием воды. Такая реакция бинарных соединений с водой называется необратимым гидролизом.
Необратимый гидролиз практически всегда протекает с сохранением степеней окисления всех элементов. В результате взаимодействия бинарных соединения с водой всегда:
✓ элемент в отрицательной степени окисления переходит в состав водородного соединения;
✓ элемент в положительной степени окисления переходит в состав соответствующего гидроксида.
Напомним, что гидроксид неметалла – это ни что иное, как соответствующая кислородсодержащая кислота. Так, например, гидроксид серы (VI) — это серная кислота H2SO4.
Так, например, попробуем записать уравнение необратимого гидролиза фосфида кальция Ca3P2, опираясь на информацию, представленную выше.
Также сказано, что в результате реакции гидролиза практически всегда сохраняются степени окисления элементов.
Таким образом, без расстановки коэффициентов реакция будет описываться следующей схемой:
Расставив коэффициенты получаем уравнение:
Используя аналогичный алгоритм, запишем уравнение гидролиза пентахлорида фосфора PCl5.
При условии, что вы знаете формулы всех неорганических кислот, несложно догадаться, что данным гидроксидом является фосфорная кислота H3PO4.
Само уравнение при этом после расстановки коэффициентов будет иметь вид:
Как видите, если вам дали формулу бинарного соединения и попросили записать уравнения его гидролиза, то ничего сложного в этом нет.
Для успешной сдачи ЕГЭ нужно запомнить, что из ионных бинарных соединений в реакцию необратимого гидролиза водой вступают:
1) нитриды щелочных металов (ЩМ), щелочноземельных металлов (ЩЗМ) и магния:
2) фосфиды ЩМ, ЩЗМ и магния:
3) силициды ЩМ, ЩЗМ и магния:
4) карбиды ЩМ, ЩЗМ и магния. Знать нужно формулы только двух карбидов — Al4C3 и CaC2 и, соответственно, уметь записывать уравнения их гидролиза:
5) сульфиды алюминия и хрома:
6) гидриды ЩМ, ЩЗМ, Mg, Al:
Гидролиз гидридов металлов – редкий пример окислительно-восстановительного гидролиза. Фактически, в данной реакции объединяются ионы водорода H + и анионы водорода H — , в следствие чего образуются нейтральные молекулы H2 с водородом в степени окисления, равной 0.
Из ковалентных бинарных соединений, способных вступать в реакцию необратимого гидролиза, нужно знать про:
1) галогениды фосфора III и V.
2) галогениды кремния:
Гидролиз бинарных соединений действием растворов кислот и щелочей
Помимо обычного гидролиза водой существует также вариант гидролиза, при котором бинарное соединение обрабатывают водным раствором щелочи или кислоты.
Как в таком случае записать уравнение гидролиза?
Для того, чтобы записать уравнение гидролиза бинарного соединения водным раствором щелочи или кислоты, нужно:
1) в первую очередь, представить, какие продукты образовались бы при обычном гидролизе водой.
Например, мы хотим записать уравнение щелочного гидролиза соединения PCl5 действием водного раствора KOH.
Тогда, согласно этому пункту, мы должны вспомнить какие продукты образуются при обычном гидролизе. В нашем случае это HCl и H3PO4
2) посмотреть на отношение этих продуктов к средообразователю (кислоте или щелочи) – реагируют они или нет. Если продукты обычного гидролиза реагируют со средообразователем, то запомнить продукты этого взаимодействия.
Возвращаясь к нашему случаю с PCl5, мы должны посмотреть на то, как относятся к щелочи продукты обычного гидролиза, т.е. HCl и H3PO4. Оба данных соединения в водном растворе являются кислотами, в связи с чем существовать в щелочной среде не могут. В частности, с гидроксидом калия они прореагируют, образуя соответственно соли KCl и K3PO4
3) в конечном уравнении в качестве продуктов записать то, что получается при взаимодействии со средообразователем. Воду при этом мы пока не пишем, вывод о том, писать ее или нет, делаем после попытки уравнивания реакции без нее.
Таким образом, следуя этому принципу, запишем:
Уже до начала расстановки коэффициентов очевидно, что есть необходимость в записи в качестве одного из продуктов реакции воды, поскольку в левой части присутствует водород, а в правой его нет.
Таким образом, суммарная схема реакции будет иметь вид:
А само уравнение после расстановки коэффициентов будет выглядеть так:
Следует отметить, что щелочной гидролиз ионных соединений чаще всего не отличается от обычного гидролиза действием воды, поскольку чаще всего ни один продукт обычного гидролиза с щелочью не взаимодействует.
Аналогично, можно сказать, что кислотный гидролиз ковалентных бинарных соединений не будет отличаться от водного.
В связи с этим имеет смысл более детально рассмотреть кислотный гидролиз ионных бинарных соединений и щелочной гидролиз ковалентных бинарных соединений.
Со всеми перечисленными ионными бинарными соединениями, участвовавшими в реакциях обычного гидролиза водой, можно записать соответствующие уравнения их кислотного гидролиза. Возьмем в качестве примера водный раствор соляной кислоты:
Обратите внимание, что вместо водородного соединения в случае нитридов металлов образуется продукт его взаимодействия с соляной кислотой (NH3 + HCl = NH4Cl). Следует отметить, что нитриды металлов – единственный случай, когда при кислотном гидролизе ионного бинарного соединения не выделяется газообразное водородное соединение. Связано это с тем, что по сравнению с другими водородными соединениями неметаллов, только у аммиака основные свойства выражены в значительной степени.
Как можно заметить, кислотный гидролиз гидридов металлов также относится к окислительно-восстановительным реакциям. В результате этой реакции образуется простое вещество водород. Связано это с тем, что водород с кислотами не реагирует.
Щелочному гидролизу среди ковалентных соединений подвержены все те же бинарные соединения, что и обычному гидролизу водой, то есть галогениды фосфора и кремния:
Щелочной гидролиз галогенидов фосфора III в ЕГЭ не встретится из-за специфических свойства фосфористой кислоты.
Тем не менее, для тех, кто хочет, ниже предоставляю пример такого рода уравнений с пояснением:
Поскольку фосфористая кислота является двухосновной, то несмотря на наличие трех атомов водорода, при ее реакции с щелочью на атомы металла способны заместиться только два атома водорода.

Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:

Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
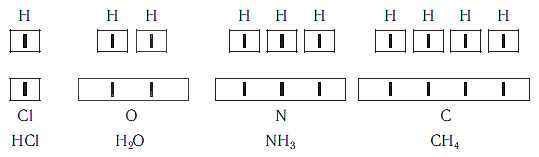
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:

Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
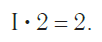
Так же определяют число единиц валентности атома кислорода:
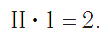
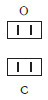
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
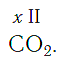
Согласно вышеприведенному правилу х ·1 = II · 2 , откуда х = IV .
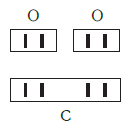
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
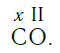
В этом веществе валентность углерода равна II , так как х ·1 = II · 1 , откуда х = II :
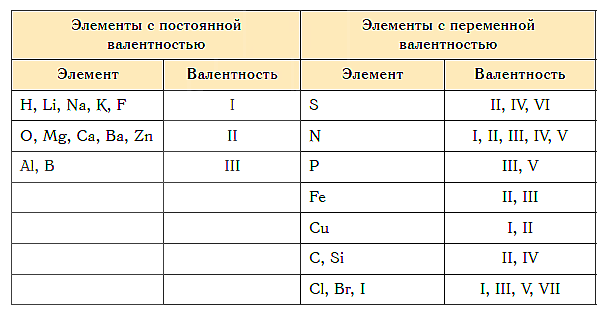
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.

Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV , а азота — III .
Записываем рядом символы элементов в следующем виде:
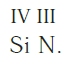
Затем находим НОК валентностей обоих элементов. Оно равно 12 ( IV·III ).
Определяем индексы каждого элемента:
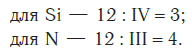
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Определение и формулы бинарных соединений
Их названия образуются от латинского корня названия более электроотрицательного элемента с окончанием –ид и русского названия менее электроотрицательного элемента в родительном падеже, причем в формулах бинарных соединений первым записывается символ менее электроотрицательного элемента. Например, Ag2O – оксид серебра (I), OF2 – фторид кислорода, KBr – бромид калия, Mg3N2 – нитрид магния, CaC2 – карбид кальция (однако названия водородных соединений неметаллов, обладающих свойствами кислот, образуются по правилам, принятым для кислот).
Если менее электроотрицательный элемент может находиться в разных окислительных состояниях, то после его названия в скобках указывают римскими цифрами степень его окисленности. Так, Cu2O – оксид меди (I), CuO – оксид меди (II), CO – оксид углерода (II), CO2 – оксид углерода (IV), SF6 – фторид серы (VI). Можно также вместо степени окисленности указывать с помощью греческих числительных приставок (моно, ди, три, тетра, пента, гекса и т.д.) число атомов более электроотрицательного элемента в формуле соединения: CO–монооксид углерода, CO2 – диоксид углерода, SF6 – гексафторид серы.
Для того, чтобы составить формулу бинарного соединения необходимо соблюдать следующую последовательность действий (рассмотрим подробно на примере оксида железа (III)):
-
Изображаем химические знаки элементов, входящих в состав оксида
Проставляем над знаком каждого элемента валентность римской цифрой:
Примеры решения задач
| Задание | В состав вещества входят 30,7% калия, 25,2% серы, 44% кислорода. Вывести формулу этого соединения. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Найдем соответствующие относительные атомные массы элементов калия, серы и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(K) = 39; Ar(S) = 32; Ar(O) = 16.
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y:z = ω(K)/Ar(K) : ω(S)/Ar(S) : ω(O)/Ar(O);
x:y:z= 30,7/39 : 25,2/32 : 44/16;
x:y:z= 0,787 : 0,787 : 2,75.
Наименьшее число примем за единицу (т.е. все числа разделим на наименьшее число 0,787):
0,787/0,787 : 0,787/0,787 : 2,75/0,787;
1 : 1: 3,5 = 2 : 2: 7.
Следовательно, простейшая формула соединения калия, серы и кислорода имеет вид K2S2O7.
Найдем соответствующие относительные атомные массы элементов натрия, фосфора и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(Na) = 23; Ar(P) = 31; Ar(O) = 16.
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
Na:P:O = 42,07/39 : 18,91/31 : 39,02/16;
Na:P:O = 1,829 : 0,61 : 2,43.
Наименьшее число примем за единицу (т.е. все числа разделим на наименьшее число 0,61):
1,829/0,61 : 0,61/0,61 : 2,43/0,61;
Следовательно, простейшая формула соединения натрия, фосфора и кислорода имеет вид Na3PO4. Это фосфат натрия.
Тема урока. Составление химических формул бинарных соединений по степени окисления химических элементов и валентности. В материале присутствуют все этапы урока от организационной части до заключения и подведения итогов!
Скачать:
| Вложение | Размер |
|---|---|
| urok.docx | 50.32 КБ |
| prezentaciya_uroka_stepen_okisleniya.ppt | 1.45 МБ |
Предварительный просмотр:
Тема урока. Составление химических формул бинарных соединений по степени окисления химических элементов и валентности.
Место данного урока в теме: второй урок в данной теме.
- Образовательные:
- закрепить у учащихся понятие степени окисления, бинарные соединения, химическая формула;
- научить правильно составлять химические формулы бинарных соединений по степени окисления химических элементов и валентности.
- Развивающие:
- научить приемам сравнения и обобщения изучаемых понятий ;
- отработать умения и навыки в определении степени окисления по химическим формулам;
- продолжить развитие навыков самостоятельной работы (через работу с учебником);
- умения работать в парах (при проверке домашнего задания) ;
- способствовать развитию логического мышления (через вопросы заставляющие логически мыслить)
- Воспитательные:
- формировать чувство толерантности (терпимости и уважения к чужому мнению), взаимопомощи
- осуществлять эстетическое воспитание (через оформление доски и тетрадей, при применении презентации)
- развивать уважение к мыслителям прошлого (при помощи высказываний великих людей).
Практическая направленность: умение составлять формулы веществ при решении практических задач.
Технические средства обучения:
- Тест
- Алгоритм для составления формул бинарного соединения.
- Номенклатура бинарных соединений.
Тип урока: комбинированный
Методы и технологии:
- Организационный момент. (Приветствие, готовность, мотивация)
- Проверка домашнего задания.
- Практическая значимость.(Видео фрагмент)
- Постановка темы урока и ее целей. Активизация мыслительных действий (через высказывания великий людей).
- Обобщение. Выведение алгоритма составления формулы бинарного соединения. (Раздаточный материал)
- Закрепление.
- Итоговое обобщение.
- Оценки за урок.
- Домашнее задание.
- Рефлексия.
1. Организационный момент .
(Учебник, тетрадь, дневник, дидактический материал). Приветствие, готовность, мотивация.
Здравствуйте, ребята. Сегодня у нас на уроке присутствуют мои коллеги, поприветствуйте их.
«Три человека тащат тяжёлые камни в город. Пот катится со всех трёх.
– Тащу эту проклятую ношу.
– Зарабатываю на хлеб себе и семье, – бодро ответил он.
Третий на тот же вопрос улыбнулся:
Вывод: Труд имеет значимость для каждого из нас. С помощью трудовой, сознательной деятельности каждый человек создаёт для себя и для людей блага.
Учитель говорит о том, что дети приходят на занятия по химии, чтобы сделать открытия, чтобы узнать что то новое.
2. Проверка домашнего задания.
Тест. (приложение 1)
1.Степень окисления - это величина
в) постоянная и переменная
2. Высшая степень окисления фосфора равна:
а) номеру группы, т.е. 5,
3 . Степень окисления хлора равна -1 в:
4 .В каком соединении степень окисления определена не верно:
5. Степени окисления марганца в соединениях MnO, MnO 2 , Mn 2 O 7 соответственно равны:
3. Практическая значимость.
- Посмотрите на формулы веществ представленных на слайде. Что у них общего? (состоят из двух элементов, т.е. являются бинарными).
Из представленных формул есть важнейшие из них.
Н 2 О-самое удивительное, распространенное и самое необходимое вещество на нашей планете .Без воды никуда.
СО 2 -углекислый газ, основа процесса фотосинтеза, т.е. нашего дыхания, используется для приготовления газированных напитков, сухой лед для хранения мороженного.
Al 2 O 3 - оксид алюминия входит в состав минералов и горных пород, является основой драгоценных камней (рубин, сапфир)
CaO - оксид кальция, применяется в строительстве для получения вяжущих материалов.
Более подробно с ними познакомимся на следующем уроке.
4. Учитель объявляет тему урока – запись темы в тетрадь.
Сегодня на уроке мы научимся составлять химические формулы бинарных соединений по степени окисления химических элементов и валентности.
Составить формулу вещества, значит определить индексы, показывающие число атомов в молекуле.
Алгоритм составления формулы бинарного соединения.(приложение 2)
- На первом месте пишется элемент с меньшей электроотрицательностью (См. в таблицу Д.И. Менделеева).
- Элемент написанный на первом месте имеет положительный заряд, а на втором отрицательный. Указать для каждого элемента степень окисления.
- Найти наименьшее общее кратное для значений степеней окисления. (Число которое делится на исходные числа без остатка).
- Разделить наименьшее общее кратное на значение степени окисления и полученные индексы приписать внизу справа после символа соответствующего элемента.
- Проверка. Суммарное значение степеней окисления равно 0.
- AL S
- AL +3 S -2
- НОК: 3 *2=6
- AL 6:3=2
Задание: попробуем составить формулы содержащие Ca и Сl, AL и O.
- А как назвать эти бинарные вещества?
Правило составления названия бинарных веществ. (приложение3)
1.Названия состоят из двух слов.
2.Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом – ид стоит всегда в именительном падеже.
3.Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название в родительном падеже.
- AL 2 S 3 - сульфид алюминия
- CaCl 2 - хлорид кальция
- AL 2 O 3 – оксид алюминия
Э x H y - гидриды
Э x O y - оксиды
Э x Sy -сульфиды
Э x Cly -хлориды
Э x Br y -бромиды
Э x F y - фториды
Э x P y - фосфиды
Э x N y -нитриды
Э x C y -карбиды
Э x Si y -силициды
- Составьте формулы веществ состоящих из Fe +3 и Cl, Fe +2 и Cl.
А как же назвать эти вещества?
FeCl 3 - хлорид железа (III)
FeCl 2 - хлорид железа (II)
5.Понятие о валентности.
Валентность - это свойства атомов одного химического элемента присоединять определённое число атомов другого.
Это понятие было введено в химию в 1853 г. английским химиком-органиком Франклендом для обоснования количественных отнощений атомов элементов в химических соединениях. Развитие учения о валентности в большой степени связано с открытием Д.И. Менделеевым Периодического закона. Им была установлена связь между валентностью элемента и его положением в периодической системе, введено понятие о переменной валентности. Учение о строении атомов и молекул способствовало разработке электронной теории валентности.
Для расчётов, для составления формул веществ неоходимо знать количественные соотношения атомов различных элементов, в которых они соединяются. Валентность показывает, со сколькими атомами одновалентного элемента соединяется атом данного элемента.
Одновалентными считают все элементы, атомы которых в двухэлементных соединениях всегда связаны с одним атомом другого элемента. Примером одновалентного элемента является водород. Поэтому считается, что валентность элемента указывает на то, со сколькими атомами водорода соединён один атом рассматриваемого элемента. Например: в HCl хлор-одновалентен, в H 2 O кислород-двухвалентен,в NH 3 азот-трёхвалентен.
Водородные соединения известны не для всех элементов, но почти все элементы образуют соединения с кислородом О. Кислород считается всегда двухвалентным.
Таблица постоянных валентностей.
H, Na, Li, K, Rb, Cs
O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
Используя валентности можно составить формулу соединения.
Химическая формула-это условная запись состава вещества посредством химических знаков и индексов.
Например: H 2 O-формула воды, где Н и О-химические знаки элементов, 2-индекс, который показывает число атомов данного элемента, входящих в состав молекулы воды.
При названии веществ с переменной валентностью обязательно указывается его валентность, которая ставится в скобки. Например, Р 2 О 5 - оксид фосфора (V).
Правила определения валентности
элементов в соединениях
Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н 2 О к одному атому кислорода присоединено два атома водорода.
Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО 2 (углекислый газ) имеет валентность IV.
Учитель. Как определить валентность элемента, исходя из таблицы Д.И.Менделеева?
У металлов, находящихся в группах а, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая (схема).
Высшая валентность равна номеру группы.
Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент.
Учитель. Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
Валентность может быть постоянной (у элементов главных подгрупп таблицы Д.И.Менделеева) или переменной (у элементов побочных подгрупп в таблице), но с этим явлением вы познакомитесь чуть позже, а если интересуетесь, то почитайте учебник 9-го класса.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений. Для этого удобно воспользоваться следующей таблицей.
Алгоритм составления формулы соединения В и О
Составление формулы оксида бора
1. Написать символы элементов
2. Определить валентности элементов
3. Найти наименьшее общее кратное численных значений валентностей
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов
6 : 3 = 2, 6 : 2 = 3;
5. Записать индексы при символах элементов
6. Формула соединения (оксида)
Учитель. Запомните еще два правила для составления химических формул соединений неметаллов между собой.
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже. (Демонстрация таблицы Д.И.Менделеева.)
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO 3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
- Используя знания, полученные на этом уроке, составьте формулы следующих веществ: фосфида кальция, оксида свинца (IV)
- Найдите соответствие между формулой вещества и его названием
Читайте также:

