Формула соединения натрия с кислородом и хлором
В группу щелочных металлов входит следующий ряд металлов; литий Li, натрий Na, калий К, рубидий Rb, цезий Cs, франций Fr. Они находятся в главной подгруппе I группы периодической системы.
Все эти металлы сходны в том отношении, что на внешнем электронном слое их имеется один электрон (табл. 18)/.
Щелочные металлы относятся к числу s-элементов. Электрон внешнего электронного слоя атома щелочного металла по сравнению с другими элементами того же периода наиболее удален от ядра, т. е. радиус атома щелочного металла наибольший по сравнению с радиусами атомов других элементов того же периода. В связи
с этим валентный электрон внешнего слоя атомов щелочных металлов легко отрывается, превращая их в положительные однозарядные ионы. Этим обусловлено то, что соединения щелочных металлов с другими элементами построены по типу ионной связи.
В окислительно-восстановительных реакциях щелочные металлы ведут себя как сильные восстановители, и эта способность возрастает от металла к металлу с увеличением заряда ядра атома.
Среди металлов щелочные металлы проявляют наиболее высокую химическую активность. В ряду напряжений все щелочные металлы располагаются в начале ряда. Электрон внешнего электронного слоя является единственным валентным электроном, поэтому щелочные металлы в любых соединениях одновалентны. Степень окисления щелочных металлов обычно +1.
Физические свойства щелочных металлов приведены в табл. 19.
Типичными представителями щелочных металлов являются натрий и калий.
■ 26. Составьте общую характеристику щелочных металлов по следующему плану:
а) сходство и различие в строении атомов щелочных металлов;
б) особенности поведения щелочных металлов в окислительно-восстановительных реакциях;
в) тип кристаллической решетки в соединениях щелочных металлов;
г) особенности изменения физических свойств металлов в зависимости от радиуса атома. (См. Ответ)
Натрий
Электронная конфигурация атома натрия ls 2 2s 2 2p 6 3s 1 . Структура его внешнего слоя:

Натрий встречается в природе только в виде солей. Наиболее распространенной солью натрия является поваренная соль NaCl, а также минерал сильвинит КCl · NaCl и некоторые сернокислые соли, например глауберова соль Na2SO4 · 10H2O, встречающаяся в больших количествах в заливе Каспийского моря Кара-Богаз-Гол.
Из поваренной соли NaCl металлический натрий получают путем электролиза расплава этой соли. Установка для электролиза изображена на рис. 76. В расплавленную соль опускают электроды. Анодное и катодное пространство разделено диафрагмой, которая изолирует образующийся хлор от натрия, чтобы не произошло обратной реакции. Положительный ион натрия принимает с катода электрон и превращается в нейтральный атом натрия. Нейтральные атомы натрия собираются на катоде в виде расплавленного металла. Происходящий на катоде процесс можно изобразить следующей схемой:
Na + + Na 0 .
Поскольку на катоде происходит принятие электронов, а всякое принятие электронов атомом или ионом является восстановлением, то ионы натрия на катоде восстанавливаются. На аноде ионы хлора отдают электроны, т. е. происходит процесс окисления и выделение свободного
газообразного хлора, что можно изобразить следующей схемой:
Полученный металлический натрий имеет серебристо-белый цвет, легко режется ножом. Срез у натрия, если его рассмотреть сразу после разреза, имеет яркий металлический блеск, но быстро тускнеет вследствие крайне быстрого окисления металла.

Рис. 76. Схема установки для электролиза расплава поваренной соли. 1 — кольцевой катод; 2 — колокол для выведения газообразного хлора из анодного пространства
Если натрий окислять в небольшом количестве кислорода при температуре около 180°, то получается окись натрия:
4Na + О2 = 2Na2O.
При горении в кислороде получается перекись натрия:
2Na + O2 = Na2O2.
При этом натрий сгорает ослепительно желтым пламенем.
В связи с легкой и быстрой окисляемостью натрия его хранят под слоем керосина или парафина, причем парафин предпочтительнее, так как в керосине все же растворяется некоторое количество воздуха и окисление натрия хотя и медленно, но все же происходит.
Натрий может давать соединение с водородом — гидрид NaH, в котором водород проявляет степень окисления — 1. Это солеподобное соединение, которое по характеру химической связи и величине степени окисления отличается от летучих гидридов элементов главных подгрупп IV—VII группы.
Металлический натрий может реагировать не только с кислородом и водородом, но и с многими простыми и сложными веществами. Например, при растирании в ступке с серой натрий бурно реагирует с ней, образуя сульфид натрия:
2Na + S = Na2S
Реакция сопровождается вспышками, поэтому ступку нужно держать подальше от глаз и обернуть руку полотенцем. Для реакции следует брать небольшие кусочки натрия.
Натрий энергично сгорает в хлоре с образованием хлорида натрия, что особенно хорошо наблюдать в хлор-кальциевой трубке, в которой через расплавленный и сильно разогретый натрий пропускают ток хлора:
2Na + Сl2 = 2NaCl
Натрий реагирует не только с простыми, но и со сложными веществами, например с водой, вытесняя из нее водород, так как является весьма активным металлом, в ряду напряжений стоит намного левее водорода и легко вытесняет последний из воды:
2Na + 2Н2O = 2NaOH + H2
Загоревшийся щелочной металл нельзя тушить водой. Лучше всего засыпать его порошком кальцинированной соды. В присутствии натрия бесцветное пламя газовой горелки окрашивается в желтый цвет.
Металлический натрий можно использовать как катализатор в органическом синтезе, например при производстве синтетического каучука из бутадиена. Он служит исходным веществом для получения других соединений натрия, например перекиси натрия.
■ 27. Докажите с помощью приведенных в тексте уравнений реакций с участием металлического натрия, что он ведет себя как восстановитель. (См. Ответ)
28. Почему натрий нельзя хранить на воздухе?
29. Ученик опустил в раствор сульфата меди кусочек натрия, надеясь вытеснить из соли металлическую медь. Вместо металла красного цвета получился студенистый голубой осадок. Опишите происшедшие реакции и напишите их уравнения в молекулярной и ионной формах. Как следовало изменить условия реакции, чтобы реакция привела к желаемому результату? Уравнения напишите в молекулярной, полной и сокращенной ионной формах.
30. В сосуд с 45 мл воды поместили 2,3 г металлического натрия. Какова концентрация раствора едкого натра, образовавшегося по окончании реакции.
31. Какие средства можно применять при тушении загоревшегося натрия? Дайте обоснованный ответ. (См. Ответ)
Кислородные соединения натрия. Едкий натр
Кислородными соединениями натрия, как уже было сказано, являются окись натрия Na2O и перекись натрия Na2O2.
Окись натрия Na2O особого значения не имеет. Она энергично реагирует с водой, образуя едкий натр:
Na2O + Н2O = 2NaOH
Перекись натрия Na202 — желтоватый порошок. Ее можно рассматривать как своеобразную соль перекиси водорода, ибо структура ее такая же, как у Н2O2. Как и перекись водорода, перекись натрия является сильнейшим окислителем. При действии воды она образует щелочь и перекись водорода:
Na2O2 + Н2O = Н2O2 + 2NaOH
Перекись водорода образуется и при действии разбавленных кислот на перекись натрия:
Na2O2 + H2SO4 = Н2O2 + Na2SO4
Все указанные выше свойства перекиси натрия позволяют использовать ее для отбелки все возможных материалов.
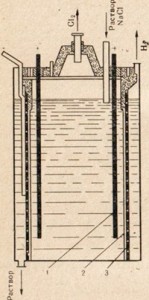
Рис. 77. Схема установки для электролиза раствора поваренной соли. 1 — анод; 2 — диафрагма, разделяющее анодное и катодное пространство; 3 —катод
Очень важным соединением натрия является гидроокись натрия, или едкий натр, NaOH. Его называют также каустической содой, или просто каустиком.
Для получения едкого натра используют поваренную соль — наиболее дешевое природное соединение натрия, подвергая ее электролизу, но в этом случае применяют не расплав, а раствор соли (рис. 77). Описание процесса электролиза раствора поваренной соли см. § 33. На рис. 77 показано, что анодное и катодное пространство разделено диафрагмой. Это сделано с той целью, чтобы образующиеся продукты не вступали между собой во взаимодействие, например Сl2 + 2NaOH = NaClO + NaCl + Н2O.
Едкий натр — твердое кристаллическое вещество белого цвета, прекрасно растворимое в воде. При растворении едкого натра в воде выделяется большое количество тепла и раствор сильно разогревается. Едкий натр необходимо хранить в хорошо закупоренных сосудах, чтобы предохранить его от проникновения водяных паров, под действием которых он может сильно увлажниться, а также двуокиси углерода, под действием которой едкий натр может постепенно превратиться в карбонат натрия:
2NaOH + СO2 = Na2CO3+ Н2O.
Едкий натр—типичная щелочь, поэтому меры предосторожности при работе с ним такие же, как и при работе с любыми другими щелочами.
Едкий натр применяется во многих отраслях промышленности, например для очистки нефтепродуктов, производства мыла из жиров, в бумажной промышленности, в производстве искусственного волокна и красителей, производстве медикаментов и др. (рис. 78).
• Запишите в тетрадь области применения едкого натра.
Из солей натрия следует отметить в первую очередь поваренную соль NaCl, которая служит основным сырьем для получения едкого натра и металлического натрия (подробно об этой соли см. стр. 164), соду Na2CO3 (см. стр. 278), сульфат натрия Na2SO4 (см. стр. 224), нитрат натрия NaNO3 (см. стр. 250) и др.

Рис. 78. Применение едкого натра
Калий
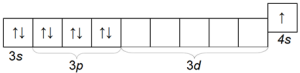
Калий К — также довольно распространенный щелочной металл, отличающийся от натрия величиной атомного радиуса (четвертый период) и потому обладающий большей химической активностью, чем натрий. Электронная конфигурация атома калия 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 .
Структура его внешнего электронного слоя
Калий — мягкий металл, который хорошо режется ножом. Во избежание окисления его, как и натрий, хранят под слоем керосина.
С водой калий реагирует еще более бурно, чем натрий, с образованием щелочи и с выделением водорода, который загорается:
2К + 2Н2O = 2КОН + Н2.
При сжигании в кислороде (при этом для сжигания рекомендуется брать еще более мелкие кусочки металла, чем для сжигания натрия) он, подобно натрию, сгорает очень энергично с образованием перекиси калия.
Следует отметить, что в обращении калий гораздо опаснее натрия. Сильный взрыв может произойти даже при разрезании калия, поэтому обращаться с ним нужно еще осторожнее.
Гидроокись калия, или едкое кали КОН — белое кристаллическое вещество. Едкое кали во всех отношениях сходно с едким натром. Они широко применяются в мыловаренной промышленности, но его получение обходится несколько дороже, поэтому такого применения, как NaOH, оно не находит.
Соли калия следует отметить особо, так как некоторые из них широко используются в качестве удобрения. Таковы хлорид калия КСl, нитрат калия KNO3, который является также азотным удобрением.
■ 37. Чем объяснить то, что едкое кали химически активнее едкого натра? (См. Ответ)
38. В кристаллизатор с водой опустили кусочек калия. После того как реакция закончилась, туда же поместили немного гидроокиси цинка в виде белого студенистого осадка. Осадок исчез, а при испытании раствора фенолфталеином последний окрасился в малиновый цвет. Какие химические процессы здесь произошли?
Какие вещества находятся в растворе? Дайте обоснованный ответ.
39. Почему калий, как и все щелочные металлы, относят к семейству s-элементов? (См. Ответ)
Статья на тему Щелочные металлы
№11 Натрий
История открытия:
Натроном первоначально называли гидроксид натрия. В 1807 г. Дэви путем электролиза слегка увлажненных твердых щелочей получил свободные металлы - калий и натрий, назвав их потассий (Potassium) и содий (Sodium). Берцелиус, и затем Гесс в России предложили названия Natrium / Натрий, которое и закрепилось.
Нахождение в природе, получение:
В природе щелочные металлы в свободном виде не встречаются. Натрий входит в состав различных соединений. Наиболее важным является соединение натрия с хлором NaCl, которое образует залежи каменной соли (Донбасс, Соликамск, Соль-Илецк и др.). Хлорид натрия содержится также в морской воде и соляных источниках. Натрий относится к числу распространенных элементов. Содержание натрия в земной коре составляет 2,64%.
Получают электролизом расплавленного хлорида натрия или гидроксида натрия. Применяется также и восстановление его оксидов, хлоридов, карбонатов алюминием, кремнием, кальцием, магнием при нагревании в вакууме.
Физические свойства:
Натрий - серебристо-белый металл, его плотность - 0,97 г/см 3 , очень мягкий, легко режется ножом. Между атомами металлическая связь. Для вещества с такой связью характерны металлический блеск, пластичность, мягкость, хорошая электрическая проводимость и теплопроводность.
Химические свойства:
Атом натрия при химическом взаимодействии легко отдает валентные электроны, переходя в положительно заряженный ион. На воздухе быстро окисляется, поэтому его хранят под слоем керосина.
При сгорании в избытке кислорода образует пероксид натрия, Na2O2
С водородом при нагревании образует гидрид Na + H2 = 2NaH
Легко взаимодействует со многим неметаллами - галогенами, серой, фосфором и др.
Бурно реагирует с водой: 2Na + 2H2O = 2NaOH + H2
Важнейшие соединения:
Оксид натрия , Na2O (бесцветный), реагирует с парами воды, углекислым газом, потому хранить лучше в безводном бензоле.
При непосредственной реакции натрия с кислородом получается смесь оксида и пероксида натрия. Для получения чистого оксида можно использовать реакцию: Na2O2 + 2Na = 2Na2O
Пероксид натрия , Na2O2 (желтый) кристаллическое вещество с ионной решеткой, взаимодействует с влажным углекислым газом воздуха, выделяя кислород: 2Na2O2 + 2CO2 = 2Na2CO3 + O2
Гидроксид натрия , NaOH - кристаллическое белое вещество, сравнительно легкоплавкое, термически очень устойчиво. При нагревании испаряется без потери воды. Хорошо растворяется в воде, в спиртах.
Галогениды натрия , бесцветные кристаллические вещества, хорошо растворимы в воде, за исключением NaF. Для них характерны восстановительные свойства.
Сульфид натрия , - Na2S. Бесцветное кристаллическое вещество с ионной решеткой. Хорошо растворимо в воде, является сильным восстановителем.
Соли , все соли хорошо растворимы, являются сильными электролитами.
Гидрид натрия , NaH - бесцветное кристаллическое вещество с кристаллической решеткой типа NaCl, анионом является H - . Получают пропусканием водорода над расплавленными металлом. Подвергается термической диссоциации не плавясь, легко разлагаются водой:
2NaH = 2Na + H2
NaH + H2O = NaOH + H2
Применение:
Соединения натрия - важнейшие компоненты химических производств. Используются в мыловарении, производстве стекла, средств бытовой химии.
Натрий важен для большинства форм жизни, включая человека. В живых организмах ионы натрия вместе с ионами калия выполняют функцию передатчиков нервного импульса. Также его ионы играют важную роль в поддержании водного режима организма.
Бондарева Мария Александровна
ХФ ТюмГУ, 561 группа.
Как семейные узы успокоили две буйные натуры
Несмотря на первую часть названия, повествование наше будет не о скучных химических веществах и их взаимодействиях. Наш рассказ — о страстной любви. У истории будет счастливый финал — образование крепкой семьи.
В рамках этого повествования мы побываем на свадьбе, будем наблюдать встречу и развитие отношений между натрием и хлором — двумя влюбленными с очень непростыми характерами. Еще мы увидим пиротехническое действо, побываем на берегу Мертвого моря, выучим стихотворение всего из двух слов, откроем тайну раствора, спасающего жизнь людей, и многое другое.
В химии всё, как в жизни людей: встречи, расставания, воссоединения. Представьте себе: вокруг цветы, музыка. Мы присутствуем на брачной церемонии: соединить свои судьбы решили натрий и хлор. Говоря химическим языком, два вещества вступают в реакцию соединения.
Для начала давайте познакомимся поближе с брачующимися.
Натрий: физические и химические свойства
Итак, познакомимся поближе с женихом — натрием. Обычно родственники невесты интересуются, откуда жених родом. А он имеет вполне определенное место проживание в периодической таблице Менделеева: I группа, порядковый номер 11, группа щелочных металлов.
Натрий — простое вещество. Это серебристо-белый металл. Он легкий, мягкий, на воздухе быстро окисляется, с водой реагирует бурно, со взрывом. Как видим, характер у жениха непростой, взрывной.
Кроме того, натрий взаимодействует:
- с кислородом;
- со многими неметаллами (за исключением азота, йода, благородных газов);
- с кислотами (разбавленными и концентрированными);
- с жидким и газообразным аммиаком;
- со ртутью;
- с некоторыми органическими соединениями.
Хлор: физические и физические и химические свойства
А кто же у нас невеста?
Хлор — элемент 3-го периода, VII А-группы, порядковый номер 17. Это простое вещество, неметалл, входит в группу галогенов. Желто-зеленый ядовитый газ с резким удушливым запахом, термически устойчив, не горит на воздухе, смесь с водородом взрывается на свету.
Кроме водорода, хлор взаимодействует:
- с неметаллами;
- почти со всеми металлами;
- вытесняет бром и йод из их соединений с водородом и металлами;
- при растворении в воде или щелочах образует хлорноватистую, хлорноватую или соляную кислоту либо их соли;
- с гидроксидом кальция, образуя хлорную известь;
- с органическими веществами.
Как видим, у жениха и невесты те еще характеры. Как натрий, так и хлор, вступают в реакцию с различными веществами и соединениями.
Натрий хоть и металл, но мягкий и податливый: его можно резать ножом, как масло. Хлор тоже совсем непрост: ядовитый удушливый газ, он был первым отравляющим веществом, примененным на войне.
Исходя из таких данных, кажется, что альянс этих двоих будет просто чудовищным. Однако давайте не будем спешить с выводами. Рассмотрим, какова же реакция натрия и хлора, как они взаимодействуют.
2Na + Cl₂ = 2NaCl + Q
Визуально реакция натрия и хлора между собой напоминает пиротехническое действо. В колбу, наполненную хлором, опускают небольшие кусочки натрия. Появляются вспышки, огонь, а затем густой белый дым! Очень зрелищно! А ведь этот белый дым и есть мельчайшие кристаллики поваренной соли. Вот какие страсти горят между нашими влюбленными! Куда там мексиканским сериалам!
А теперь охарактеризуем реакцию взаимодействия натрия и хлора с разных позиций.
- С одной стороны, это реакция соединения. Одно простое вещество присоединилось к другому простому веществу — получилось соединение.
- С энергетической точки зрения, реакция экзотермическая, поскольку проходит с выделением энергии — световой и тепловой (в количестве 819 кДж).
- По агрегатному состоянию, это гетерогенная реакция, то есть твердое вещество вступило в реакцию с газом и в результате получилось твердое вещество.
- Реакция необратимая, так как идет до конца с образованием стабильного продукта.
- Кроме того, эта реакция окислительно-восстановительная.
Рассмотрим подробнее последний пункт, поскольку он объясняет побудительные мотивы соединения (почему именно реагирует натрий с хлором.
Дадим определение, что такое окислительно-восстановительная реакция. Реакции, сопровождающиеся передачей электронов от одного атома к другому, называются окислительно-восстановительными. Окислителем называется тот атом, который в ходе реакции принял электроны. А восстановителем — тот, который их отдал. Чтобы запомнить, кто окислитель, а кто — восстановитель, и не путаться в терминологии, есть очень простое стихотворение. Оно состоит всего из двух слов, но выучив его, вы никогда не будете путать, кто отдает, а кто принимает электроны:
Электронное строение атомов натрия и хлора
Порядковый номер элемента в периодической таблице Менделеева определяет заряд ядра, а следовательно, и количество электронов.
Рассмотрим электронное строение натрия и хлора, или образно говоря, имущество жениха и невесты.
Из электронной формулы натрия видно, что на внешнем электронном подуровне у него 1 электрон, который он легко может отдать. С другой стороны, хлору, чтобы достроить р-подуровень, не хватает одного электрона, который он и забирает у натрия. А если следовать нашей сюжетной линии, невеста присваивает часть имущества жениха, который охотно им делится, лишь бы она была рядом.
Надо отметить, что хлор — один из наиболее сильных окислителей. Натрий с хлором легко вступают в реакцию, так как один легко отдает электроны, а другой легко их принимает. Семья при этом получилась крепкая, в виде прекрасного соединения — хлорида натрия. Без поваренной соли ведь никуда: в кулинарии ее применяют сплошь и рядом как вкусовую добавку; в медицине — для лечебных растворов, снимающих отеки; в коммунальной службе — против гололеда; в водоподготовке — для смягчения воды; используется хлорид натрия и в химической промышленности. Кстати, всем известный физраствор, который спас жизнь многим людям, представляет собой 0,9%-ный водный раствор хлорида натрия.
Добывают поваренную соль путем выпаривания соляных растворов. Мировой лидер по производству поваренной соли — Китай. В природе она встречается в виде залежей галита и сильвинита, рапы соляных озер, минеральных примесей морей. Чаще всего это кристаллы белого цвета, но в природе встречаются месторождения соли, окрашенной в голубой, желтый, серый цвет и даже с красным оттенком.
Давайте мысленно перенесемся на Мертвое море.
Не тонуть в нем позволяет высокая концентрация растворенных в нем солей (35 г на 1 литр воды), в том числе и хлорида натрия.
Итак, подытожим: воссоединились такие бурные, непредсказуемые и местами ядовитые натрий и хлор; реакция же дала в результате безобидное и даже полезное соединение — поваренную соль. Как мы говорили вначале, семейные узы обуздали две бурные натуры и сделали их счастливыми и безопасными для окружающих. Такой вот счастливый финал у нашей истории.
Соединения натрия стали известны человечеству с глубокой древности.
Сейчас, также, как и раньше невозможно вообразить свою жизнь без присутствия в ней соединений натрия.
В наши дни абсолютно все люди ежедневно встречают вокруг себя огромное количество соединений натрия, даже, порой, не зная об этом. Это и обычная поваренная соль, пищевая сода, щелочные чистящие средства, мыло и средства для мытья посуды, лекарственные средства (аспирин, тетраборат натрия и другие), стекло, лампы и множество других товаров массового потребления.
Самым распространенным источником натрия на планете считается каменная соль (галит). Галит – это практически чистый NaCl.
Десятки самых разных соединений натрия используются сегодня во всех сферах нашей деятельности.
О наиболее важных соединениях натрия, а также об их использовании в промышленности и пойдет речь ниже.
• Хлорид натрия NaCl – наиболее известное всем применения получил в качестве усилителя вкуса. Ведь хлорид натрия ни что иное, как поваренная соль. Кроме улучшения вкусовых качеств хлорид натрия обладает антибактериальными свойствами, поэтому используется в качестве консерванта.
Под воздействием электрического тока из NaCl, растворенного в воде, получают сразу три важнейших для промышленности элемента. Это газообразный хлор (Cl2), гидрооксид натрия (второе название - каустическая сода) (NaOH) и газообразный водород (H2).
В свою очередь хлор применяется в производстве, красок, растворителей, пластмасс, пестицидов, используется в текстильной и фармацевтической промышленности.
• Гидрооксид натрия и раствор гидрооксида натрия нашли большое применение в металлургической, нефтеперерабатывающей, косметической, текстильной, а также пищевой промышленностях. Кроме того эти соединения успешно применяются для обработки воды.
• Карбонат натрия( Na2CO3) – всем известная сода. Это соединение натрия нашло применение в производстве стекла, бумаги и целлюлозы, мыла, чистящих и моющих средств, в легкой промышленности. Пищевая сода входит в состав продуктов питания. Также используется для очистки сточных вод, кроме того является отправной точкой для производства других соединений натрия.
• Гипохлорит натрия ( NaOCl) – используется в фармацевтической промышленности, в качестве одного из компонентов, входящих в состав бытовой химии, такой, как отбеливатели, обезжириватели , чистящие средства; применятся для обеззараживания и дезинфекции воды.
• Нитрит натрия (NaNO2) – азотосодержащее удобрение, пищевой консервант и улучшитель окраски Е250. Нитрит натрия широко используется в медицине и ветеринарии как сосудорасширяющее средство, бронхолитическое, слабительное, средство против спазмов и противоядие при отравлении цианидами. В фотографии нитрит натрия нашел применение как реагент, противоморозная добавка для бетона, применяется при изготовлении каучука и взрывчатых веществ.
• Нитрат натрия (NaNO3) - это соединение натрия также получило широчайшее применение: консервант Е251 (противомикробная добавка), удобрение. Также используется при изготовлении ракетного топлива, входит в состав взрывчатых веществ, а также в металлообрабатывающей и стекольной промышленности.
• Альгинат натрия (NaC 6 H 7 O 6 ) – производство цемента, краски на водной основе, загуститель в мороженом и других продуктах питания.
• Бифторид натрия (KHF 2 ) – антисептик, не пищевой консервант, также используется при производстве жести и травлении стекла;
• Фторсиликат натрия (Na 2 SiF 6 ) – используется при изготовлении зубных паст со фтором, хозяйственного мыла, также используется при изготовлении средств для борьбы с крысами и насекомыми. Кроме того фторсиликат натрия нашел применение в качестве консерванта для кожи и дерева.
• Метаборат натрия (NaBO 2 ) – гербицид, применяется для уничтожения растительности.
• Стеарат натрия (NaOOCC 17 H 35 ) – используется как добавка в косметические средства и зубные пасты. Применяется в качестве гидроизоляции и как компонент, предотвращающий разрушение пластика.
• Гликолят натрия циркония (NaZrH 3 (H 2 COCOO) 3 ) – это вещество входит в состав дезодорантов, противомикробных препаратов, также применяется при изготовлении огнестойких материалов.
• Парапериодат натрия (Na 3 H 2 IO 6 ) - это соединение помогает бумаге сохранять прочность при намокании.
• Гидрофторид натрия( NaHF2) – антисептик, используется при производстве плавиковой кислоты, также нашел применение для травления стекла.
• Вольфрамит натрия (NaWO4) – изготовление пигментов.
• Гексаметалфосфат натрия (Na6P6O18) – текстильная, кожевенная, нефтяная промышленность, смягчение воды.
• Дитионит натрия (Na2S2O4) – производство красителей
• Салицилат натрия – C7H5NaO3 – фармацевтика.
• Метасиликат натрия (Na2SiO3) – производство бетона, цементных растворов, стекла.
• Гидрид натрия (NaH) – c помощью раствора NaH в гидрооксиде натрия снимают окалину со сталей и тугоплавких металлов.
• Бисульфит натрия (NaHSO3) – фотография, бумажная, текстильная, кожевенная индустрия, очистка воды.
• Фосфат натрия (Na3PO4) – косметические препараты, зубная паста, пищевая добавка.
• Селенит натрия ( Na2SeO3) – минеральная добавка, фармацевтика, ветеринария.
• Тиосульфат натрия – фармацевтическая промышленность
• Станнит натрия (Na2SnO2) – с его помощью открывают ионы кобальта в сталях, добывают металлическое серебро, благодаря станниту натрия возможно полное восстановление органических соединений ртути.
• Метастаннат натрия Na2[Sn(OH)6] – гальваника, лужение алюминия.
• Тиоцианат натрия ( традиционное название -роданит натрия) (NaSCN) – используется в качестве реактива для фотометрического определения железа, также используется в фотографии и текстильной промышленности.
• Натрий-бутадиеновый каучук – самый востребованный из всех каучуков
• Амид натрия (NaNH2) - участвует в синтезе других химических веществ, включая витамин А.
• Ацетат натрия (C2H3O2Na) – легкая, пищевая промышленность, также используется в быту.
• Пиросульфит натрия (Na2(SO2SO3)) – пищевой консервант, также нашел применение в химической и фармацевтической отраслях.
• Кремнефтористый натрий (Na2SiO6) и Гексафторосиликат натрия (Na2[SiF6] ) – необходимы при получении берилла и марганца, используется при изготовлении цементов, стекол, эмалей, замазок.
• Метилат натрия (CH3NaO) – необходим для синтеза в при изготовлении лекарственных препаратов и химикатов.
• Перекись натрия (Na2O2) – великолепный отбеливател.ь
• Фенолят натрия используется для дезинфекции.
• Фторид натрия (NaF)- при изготовлении зубной пасты, кроме того компонент составов флюса для сварки, пайки металлов, эмалей, стекол, керамики, входит в состав средств для очистки металлов и т.д.
Радиоактивные изотопы натрия имеют как медицинское, так и не медицинское применение (например, проверят нефтепроводы на предмет утечек)
Большинство людей никогда не видели металлический натрий (Na). Да и в виде свободного элемента в природе он никогда не встречается. Он настолько активен, что обычно хранится в жидкости, с которой не реагирует, чаще всего используют керосин. Тем не менее, и в виде свободного элемента натрий нашел большое применения в различных областях промышленности. Это и теплообменная среда в атомных электростанциях, и производство других металлов, включая титан, производство аккумуляторов, электрических проводов, натриевых ламп, искусственного каучука и прочее.
Подводя итог всему вышесказанному, необходимо отметить, что переоценить роль такого химического элемента, как натрий, крайне сложно. Однако, важнейшим из всех соединений натрия, по праву может считаться обыкновенная пищевая соль. Ведь именно хлорид натрия имеет огромное влияние на ряд основных функций у растений, животных и людей. Именно хлорид натрия принимает непосредственное участие в водно-солевом обмене, одном из важнейших процессов, протекающих в организмах животных и людей.
Читайте также:

