Формула соединения алюминия с кислородом и хлором

Бинарные соединения алюминия
Алюминий расположены в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 
2s 
2p 
3s 
3p 
Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 
2s 
2p 
3s 
3p 
Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.

Температура плавления 660 о С, температура кипения 1450 о С, плотность алюминия 2,7 г/см 3 .
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Бокситы Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3) — гидрат оксида алюминия

Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.

Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → 4Al + 3KCl
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами . При этом образуется белый аморфный осадок гидроксида алюминия.
Например , хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl

При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Обратите внимание , если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
1. Алюминий – сильный восстановитель . Поэтому он реагирует со многими неметаллами .
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al +N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки . А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , алюминий бурно реагирует с соляной кислотой :
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами . При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑

Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → NaAlO2 + 3H2↑ + Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов . Процесс восстановления металлов из оксидов называется алюмотермия .
Например , алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3
Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
Алюминий – ценный промышленный металл, который подвергается вторичной переработке. Узнать подробнее о приеме алюминия на переработку, а также об актуальных ценах на данный вид металла можно здесь.
Оксид алюминия можно получить различными методами :
1. Горением алюминия на воздухе:
2. Разложением гидроксида алюминия при нагревании :
3. Оксид алюминия можно получить разложением нитрата алюминия :
Оксид алюминия — типичный амфотерный оксид . Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида алюминия с основными оксидами образуются соли-алюминаты.
Например , оксид алюминия взаимодействует с оксидом натрия:
2. Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом оксид алюминия проявляет кислотные свойства.
Например , оксид алюминия взаимодействует с гидроксидом натрия в расплаве с образованием алюмината натрия и воды:
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействует с кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Например , оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
5. Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей.
Например , оксид алюминия реагирует с серной кислотой:
6. Оксид алюминия проявляет слабые окислительные свойства .
Например , оксид алюминия реагирует с гидридом кальция с образованием алюминия, водорода и оксида кальция:
Электрический ток восстанавливает алюминий из оксида (производство алюминия):
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия:
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например , хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например , хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
1. Гидроксид алюминия реагирует с растворимыми кислотами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например , гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом гидроксид алюминия проявляет кислотные свойства.
Например , гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
4. Г идроксид алюминия разлагается при нагревании :
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
Нитрат алюминия при нагревании разлагается на оксид алюминия, оксид азота (IV) и кислород:
Сульфат алюминия при сильном нагревании разлагается аналогично — на оксид алюминия, сернистый газ и кислород:
Для описания свойств комплексных солей алюминия — гидроксоалюминатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоалюминат на две отдельные молекулы — гидроксид алюминия и гидроксид щелочного металла.
Например , тетрагидроксоалюминат натрия разбиваем на гидроксид алюминия и гидроксид натрия:
Na[Al(OH)4] разбиваем на NaOH и Al(OH)3
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы алюминия реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид алюминия не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоалюминат калия реагирует с углекислым газом:
По такому же принципу тетрагидроксоалюминаты реагирует с сернистым газом SO2:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид алюминия реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида алюминия кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид алюминия:
Комплекс разрушается при взаимодействии с хлорной водой (водным раствором хлора) Cl2:
2Na[Al(OH)4] + Cl2 → 2Al(OH)3↓ + NaCl + NaClO
При этом хлор диспропорционирует.
Также комплекс может прореагировать с избытком хлорида алюминия. При этом выпадает осадок гидроксида алюминия:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-алюминат:
Растворимые соли алюминия и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Al 3+ + H2O = AlOH 2+ + H +
II ступень: AlOH 2+ + H2O = Al(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты алюминия и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Более подробно про гидролиз можно прочитать в соответствующей статье.
Соли, в которых алюминий является кислотным остатком (алюминаты) — образуются из оксида алюминия при сплавлении с щелочами и основными оксидами:
Для понимания свойств алюминатов их также очень удобно разбить на два отдельных вещества.
Например, алюминат натрия мы разделим мысленно на два вещества: оксид алюминия и оксид натрия.
NaAlO2 разбиваем на Na2O и Al2O3
Тогда нам станет очевидно, что алюминаты реагируют с кислотами с образованием солей алюминия :
KAlO2 + 4HCl → KCl + AlCl3 + 2H2O
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O
Под действием избытка воды алюминаты переходят в комплексные соли:
Сульфид алюминия под действием азотной кислоты окисляется до сульфата:
либо до серной кислоты (под действием горячей концентрированной кислоты):
Сульфид алюминия разлагается водой:
Карбид алюминия также разлагается водой при нагревании на гидроксид алюминия и метан:
Нитрид алюминия разлагается под действием минеральных кислот на соли алюминия и аммония:
AlN + 4HCl → AlCl3 + NH4Cl
Также нитрид алюминия разлагается под действием воды:
Этот сайт использует Akismet для борьбы со спамом. Узнайте как обрабатываются ваши данные комментариев.
Галогены не соединяются непосредственно с кислородом, поэтому их кислородные соединения получаются только косвенным путем и представляют собой вещества более или менее неустойчивые. Наиболее устойчивы соли кислородных кислот, наименее устойчивы — окислы. Во всех кислородных соединениях галогены проявляют положительную валентность, достигающую семи у высших кислородных соединений хлора и иода.
Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора, которые мы и рассмотрим несколько подробнее.
В табл. 20 для общей ориентировки приведены формулы окислов и кислот, образуемых хлором, а также названия кислот и соответствующих им солей. В скобки заключены предполагаемые, но не полученные пока соединения.
| Кислоты | |||
| Окислы | формула | название | Название солей |
| Сl2O | HClO | Хлорноватистая | Гипохлориты |
| (Cl2O3) | HClO2 | Хлористая | Хлориты |
| СlO2 | — | — | — |
| (Сl2O3) | HClO3 | Хлорноватая | Хлораты |
| Cl2O7 | HClO4 | Хлорная | Перхлораты |
Все кислородные соединения хлора являются сильными окислителями. Производя окисление, положительно валентные атомы хлора обычно восстанавливаются или до нейтрального хлора или до отрицательно заряженных ионов Сl’. Важное практическое применение имеют соли хлорноватистой и хлорноватой кислот — гипохлориты и хлораты.
Гипохлориты. В основе их получения лежит реакция хлора с водой, приводящая к образованию хлорноватистой кислоты:
Эта реакция представляет собой не что иное, как гидролиз хлора. Можно предполагать, что гидролизу предшествует поляризация ковалентной связи между атомами хлора в. молекуле Сl2, т. е. смещение общей пары электронов в сторону одного из атомов под влиянием полярных молекул воды. Затем положительно зарядившийся атом хлора соединяется с гидроксилом воды, вытесняя протон, и одновременно другой атом хлора превращается в ион [:Сl:] — , как это показано на следующей схеме:
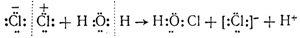
Из схемы видно, что гидролиз хлора является окислительно-восстановительной реакцией, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется:
Сl − e — = Cl (+1)
Cl + e — = C (-1)
Такой процесс, когда одни атомы одного и того же элемента являются окислителями, а другие — восстановителями, называется самоокислением-самовосстановлением.
Получающиеся при гидролизе хлора НСl и НСlO могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается когда прореагирует приблизительно 1 /3растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами Сl2 значительное количество соляной и хлорноватистой кислот.
Расщепление ковалентной связи между атомами хлора при его гидролизе имеет иной характер, чем расщепление связи между ними же, происходящее при действии света на хлор и сопровождающееся образованием свободных атомов хлора

расщепление связи расщепление связи при гидролизе при действии света
Первый вид расщепления ковалентной связи называется неоднород-н ы м, а второй — однородным.
Примерами однородного и неоднородного расщепления связи могут также служить термическая диссоциация йодистого водорода при нагревании:
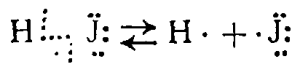
и электролитическая диссоциация иодистого водорода при растворении в воде:
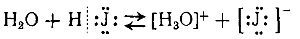
Хлорноватистая кислота НСlO очень неустойчива и в растворе постепенно распадается на хлористый водород и кислород:
По мере разложения хлорноватистой кислоты равновесие приведенной на стр. 324 реакции между хлором и водой смещается вправо и в конце концов весь хлор вступает во взаимодействие с водой, а в растворе остается только НСl. Свет очень ускоряет эту реакцию, поэтому хлорную воду следует всегда хранить в темноте.
Хлорноватистая кислота — очень сильный окислитель; ее образованием при взаимодействии хлора с водой объясняются белящие свойства хлора. Совершенно сухой хлор не белит, но в присутствии влаги происходит быстрое разрушение красящих веществ образующейся при гидролизе хлора хлорноватистой кислотой.
Если к хлорной воде прибавлять понемногу щелочь, то вследствие нейтрализации хлорноватистой и соляной кислот равновесие реакции гидролиза хлора тоже сдвигается вправо; в результате получается раствор, содержащий соли хлорноватистой и соляной кислот:
HCl + НСlO + 2КОН = КСl + КClO + 2Н2O
Тот же результат, очевидно, получится, если непосредственно пропускать хлор в холодный раствор щелочи: 2КОН + Сl2 = КСl + КСlO + Н2O
или в ионной форме:
Полученная таким путем жидкость, содержащая в растворе смесь солей хлорноватистой и соляной кислот, называется ж а-велевой водой (Javelle — местечко около Парижа, где впервые стали изготовлять эту воду) и применяется для беления; ее белящие свойства обусловливаются тем, что гипохлорит калия легко разлагается уже под влиянием углекислого газа воздуха, причем выделяется хлорноватистая кислота:
Последняя и действует обесцвечивающим образом на красящие вещества.
Аналогичный раствор, содержащий гипохлорит натрия, получается при пропускании хлора в раствор едкого натра. Оба раствора могут быть получены также путем электролиза КCl и NaCl, если дать возможность выделяющемуся хлору реагировать с образующимися при электролизе щелочами .
При действии хлора на сухую гашеную известь получается так называемая белильная или хлорная известь. Главной составной частью ее является гипохлорит кальция Са(СlO)2, образующийся по реакции
наряду с ним хлорная известь содержит также и другие соли кальция.
Хлорная известь представляет собою белый порошок с резким запахом, обладающий сильными окислительными свойствами. Во влажном воздухе под действием углекислого газа она постепенно разлагается, выделяя хлорноватистую кислоту, чем и обусловливается ее характерный запах:
При действии на хлорную известь соляной кислоты выделяется хлор:
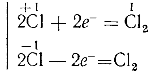
Хлорная известь широко применяется для отбелки растительного волокна (тканей, бумаги), для дезинфекции выгребных ям, отхожих мест, сточных канав и пр. В противохимической обороне хлорная известь играет важную роль как средство дегазации местности, зараженной отравляющими веществами.
В последнее время промышленностью освоено изготовление хлорной извести с очень высоким содержанием активного хлора, состоящей из почти чистого гипохлорита кальция Са(СlO)2. Для ее получения действуют хлором на известковое молоко — смесь гашеной извести с небольшим количеством воды. Образующийся гипохлорит кальция выделяется в виде мелких кристаллов состава Са(СlO )2 • 3Н2О. По окончании реакции осадок отфильтровывают и высушивают. Полученный таким образом технический продукт содержит до 70% активного хлора.
Хлораты представляют собой соли довольно неустойчивой хлорноватой кислоты НСlO3. Общеизвестной и самой важной из этих’солей является хлорат калия КСlO3, или бертолетова соль.
Если нагревать раствор гипохлорита калия, то он утрачивает свои белящие свойства. Это происходит вследствие разложения КСlO с образованием бертолетовой соли по следующему уравнению:
3КСlO = КСlO3 + 2КСl
или в ионной форме
При этой реакции 2 /3 атомов хлора, входящих в состав ионов СlO’ и имеющих валентность +1, превращается в ионы Сl’, т. е. восстанавливается, в то время как 1 /3 тех же атомов из валент ного состояния +1 переходит в валентное состояние +5, т. е. окисляется.
Если пропускать хлор в горячий раствор едкого кали, то вместо КСlO сразу получается КСlO3:
При этом 1 /6 часть атомов хлора окисляется до ионов СlO3‘, а 5 /6 восстанавливаются до ионов Сl’.
Так как бертолетова соль трудно растворима в холодной воде, то при охлаждении раствора она выпадает в виде кристаллов и таким образом отделяется от остающегося в растворе хлористого калия.
При нагревании бертолетова соль легко разлагается с выделением кислорода:
С различными горючими веществами (серой, углем, фосфор ром) бертолетова соль образует смеси, сильно взрывающие при ударе. На этом основано ее применение в артиллерийском деле для устройства запалов. Бертолетова соль употребляется в пиротехнике для приготовления бенгальских огней и других легко воспламеняющихся смесей. Главнейшим же потребителем бертолетовой соли является спичечная промышленность. В головке обычной спички содержится около 50% бертолетовой соли.
Соответствующая бертолетовой соли хлорноватая кислота НСlO3 известна только в виде водного раствора, который может быть сгущен выпариванием до концентрации в 50%. Хлорноватая кислота действует как сильный окислитель. Структурная формула хлорноватой кислоты:
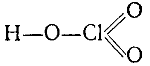
Ангидрид хлорноватой кислоты неизвестен. Вместо него при разложении хлорноватой кислоты, например при действии концентрированной серной .кислоты на бертолетову соль, выделяется желто-бурый газ с характерным запахом — двуокись хлора СlO2. Двуокись хлора очень неустойчива и легко разлагается со взрывом на хлор и кислород от нагревания, соприкосновения с органическими веществами и т. п. Смесь бертолетовой соли с сахаром воспламеняется при смачивании ее каплей серной кислоты, так как выделяющаяся двуокись хлора является сильным окислителем.
При осторожном нагревании в отсутствие катализатора бертолетова соль частично разлагается с выделением кислорода частично же переходит в соль хлорной кислоты — перхлорат калия КСlO4:
Перхлораты — более прочные соединения, чем хлораты. Действуя на перхлорат калия серной кислотой, можно получить свободную хлорную кислоту HClO4, которая в чистом виде представляет собой бесцветную жидкость, замерзающую при —112°.
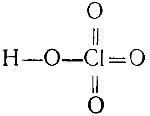
Хлорная кислота HClO4 наиболее устойчивая из кислородных кислот хлора. В то же время она самая сильная из всех известных кислот: ее кажущаяся степень диссоциации в 0,5 н. растворе равна 88%, т. е. больше, чем кажущаяся степень диссоциация соляной кислоты при тех же условиях. Окислительные свойства у хлорной кислоты выражены слабее, чем у хлорноватой.
Строение хлорной кислоты выражается формулой
Если нагревать хлорную кислоту с фосфорным ангидридом, отнимающим от нее воду, то образуется хлорный ангидрид:
Хлорный ангидрид — маслянистая жидкость, кипящая при 83°; сильно взрывает при ударе.
Сопоставление свойств важнейших кислородных соединений хлора позволяет сделать следующий общий вывод:С увеличением валентности хлора растет устойчивость его кислородных кислот, и их окислительная способность уменьшается. Наиболее сильный окислитель — хлорноватистая кислота, наименее сильный — хлорная кислота. Наоборот, сила кислородных кислот хлора увеличивается с увеличением валентности последнего. Наиболее слабой является хлорноватистая кислота (константа ее диссоциации около 10 -8 ), наиболее сильной — хлорная кислота.
Кислородные соединения фтора. Наиболее изученным соединением
фтора с кислородом является окись фтора, или фтористый кислород OF2, впервые полученный только в 1927; г. Это — бесцветный газ, сгущающийся в жидкость при —145°, очень ядовитый, малорастворимый в воде.
Фтористый кислород получается при действии фтора на 2%-ный раствор щелочи:
По всем признакам (низкая температура кипения, плохая растворимость в воде) фтористый кислород представляет собой соединение, в котором связи фтора с кислородом ковалентны. Строение его может быть изображено так:

Так как металлоидные свойства выражены у фтора сильнее, чем у кислорода, то следует считать, что во фтористом кислороде фтор отрицательно одновалентен, а кислород положительно двухвалентен.
Кислородные соединения брома и йода
Из кислородных соединений брома известны бромноватистая НВrО и бромноватая НВrО3 кислоты и их соли, которые получаются аналогично соответствующим соединениям хлора, но отличаются меньшей устойчивостью. Бромная кислота и ее соли неизвестны. Окислы брома очень неустойчивые соединения, существующие только при низких температурах.
Иод образует высший окисел J2O5 — йодноватый ангидрид, которому соответствует йодноватая кислота HJO3. Натриевая соль этой кислоты встречается как примесь к чилийской селитре. Калиевую соль можно получить тем же способом, что и бертолетову соль, действуя иодом на горячий раствор щелочи.
Свободная йодноватая кислота получается окислением иода в присутствии воды. Если в качестве окислителя взять хлор, то реакция идет по следующему уравнению:
Йодноватая кислота представляет собой кристаллическое вещество, вполне устойчивое при обычной температуре. При нагревании до 200° йодноватая кислота теряет элементы воды и переходит в твердый йодноватый ангидрид:
Выше 300° йодноватый ангидрид, в свою очередь, распадается на иод и кислород.
Кроме йодноватой кислоты, известна еще йодная кислота HJO4, которая может быть получена действием иода на НСlO4:
При выпаривании раствора HJO4 получаются бесцветные кристаллы, имеющие состав HJO4 x 2H2O и плавящиеся при 130°. Этот кристаллогидрат следует, однако, рассматривать как новую пятиосновную кислоту H5JO6 (ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например, Ag5JO6).
Йодный ангидрид J2O7 не получен.
Вы читаете, статья на тему Кислородные соединения галогенов
Читайте также:

