Формула льюиса для соединения скандия с хлором
Скандий образует соединения, отвечающие степени окисления элемента +3. Другие степени окисления нехарактерны для скандия.
Оксид и гидроксид скандия. Оксид Sc203 — белое вещество, образующееся при окислении скандия кислородом, термическом разложении гидроксида, карбоната, оксалата, сульфата, нитрата скандия. Тпл = 2480 °С, плотность 3,86 г/см 3 . В воде малорастворим. Хорошо растворяется в концентрированных минеральных кислотах.
Гидроксид скандия Sc(OH)3 - аморфное соединение. Осаждается действием на растворы солей скандия растворами аммиака или щелочей; рН начала выделения 4,9. Растворим в растворах щелочей, карбонатов аммония, щелочных металлов; растворимость резко снижается в присутствии малорастворимых гидроксидов железа, марганца и др.
Карбонат скандия. Для скандия характерно образование основных карбонатов [Sc(OH)m]2(C03)3m·ЗН20, растворимых в растворах (NH4)2C03 и Na2C03 лучше, чем аналогичные соединения РЗЭ.
Нитрат скандия Sc(NO3)3·4Н20 - хорошо растворимая соль; растворимость в воде: 61,27 % (при 15 °С), 67,60 % (при 504 о С).
Сульфат скандия Sc2(S04)3 образует гидраты с 2; 4; 5 и 6 молекулами воды. Растворимость в воде 28,53 % (при 25 о С). С сульфатами щелочных металлов образует соединения Me[Sc(SO4)2] или Me3Sc[SO4]3 в 20 раз менее растворим в растворе K2S04, чем аналогичные соединения элементов иттриевой подгруппы РЗЭ.
Фосфат скандия ScP04·2Н20 - малорастворим, получается действием на водный раствор солей скандия фосфорной кислоты.
Оксалат скандия Sc2(C204)3·nН20 (n = 3; 4; 5; 6; 18) образуется при действии щавелевой кислоты на нейтральные или слабокислые растворы солей скандия.
Иодат скандия Sc(IO3)3·1,5Н20 - хорошо растворим в отличие от аналогичных соединений тория и циркония.
Фторид скандия ScF3 - белое кристаллическое вещество, Т пл = 1552°С, Т кип = 1607 °С. Малорастворим. При обработке концентрированной H2S04 превращается в сульфат, при нагревании в растворе NaOH — в гидроксид. Растворим в HF, растворах фторидов щелочных металлов и аммония; в растворе образуются комплексы [ScF4] - , [ScF6] 3- .
Хлорид скандия ScCl3 - белое кристаллическое вещество, гигроскопичен, Т пл = 968 о С, Т кип = 975 о С. Температурная зависимость давления пара (МПа): lgP = -14200/Т + 10,49 (1066 - 1229 К).
Кристаллогидрат ScCl3·6Н20 при нагревании на воздухе превращается сначала в оксохлорид ScOCl, плохо растворимый в воде, кислотах и щелочах, затем — в Sc20.
Карбид скандия ScC изучен больше, чем другие карбиды скандия. Получается синтезом из элементарных веществ или восстановлением Sc203 углем. Температура плавления 1800 °С, микротвердость 26,7 ГПа.
5.2.4. Области применения скандия
Скандий и его соединения в настоящее время применяют в производстве легких сплавов, электронной технике, светотехнике, производстве специальной керамики. Возможности Применения скандия ограничены высокой ценой. В 1988 г. оксид скандия (1г) стоил 2,8 долл., дистиллированный металл (чистота 99,99 %) — 15 долл. Высокая цена связана с малыми объемами производства (около 100 кг в год в пересчете на металл). Основные производители скандиевой продукции - КНР, Франция.
Легкие сплавы. Скандий представляет интерес как конструкционный материал для ракето- и самолетостроения, астронавтики, поскольку, обладая значительно более высокой температурой плавления, чем алюминий, имеет ту же плотность. Особый интерес представляют сплавы Al — Sc, Mg — Sc, Mg — Sc — Li, Mg — Y — Sc. Так как добавка десятых долей процента скандия к алюминию и его сплавам обусловливает повышение прочностных, в определенных случаях пластических свойств, рост сопротивления против коррозионного растрескивания, улучшение свариваемости деформированных полуфабрикатов. При кристаллизации расплава в процессе образования слитков большая часть скандия входит в пересыщенный раствор, а оставшаяся часть выделяется в виде частиц Al3Sc , которые обусловливают измельчение литого зерна.
Легирование 0,4 % скандия сплавов алюминия и магния увеличивает временное сопротивление на 20 – 35 %, а предел текучести на 60 — 80 %. При этом относительное удлинение остается достаточно высоким (15 — 20 %).
Электронная техника. Важная область применения оксида скандия — производство ферритов для ЭВМ с индукцией 0,08 — 0,1 Тл, что в 3 раза меньше, чем у ферритов из оксидов железа, магния, марганца. Такие ферриты меньше перегреваются при перемагничивании, что увеличивает быстродействие магнитной памяти ЭВМ.
Светотехника. Мателлогалогенидные (иодидные) ртутные лампы с добавками скандия используют для освещения промышленных зданий и спортивных сооружений.
Производство керамики. Разработаны различные виды керамики на основе Zr02 и Hf02 с добавками Sc203, успешно работающие при высоких температурах.
Другие области применения. Гидрид скандия используют в ядерной технике как высокотемпературный замедлитель нейтронов. Борид скандия ScB2 предложено использовать как компонент легких жаропрочных сплавов, а также в материалах катодов электронных приборов. Оксид скандия — компонент германатных оптических стекол, люминофоров.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Поскольку в химической связи участвуют только электроны внешних оболочек, такие электроны называют валентными. Единичная (простая) ковалентная связь возникает, когда атомы делят между собой одну пару валентных электронов.
Структурные формулы наглядно показывают последовательность связывания атомов в молекуле и валентность элементов, однако если такая подробная информация не нужна, молекулы можно записывать в виде сокращенных химических формул. Например, уже знакомые нам молекулы в этом случае выглядят так:
| H2 | Cl2 | O2 | H2O | N2H4 | N2H2 | N2 |
Цифра, стоящяя внизу справа от символа элемента, называется индексом. Индекс показывает, сколько атомов данного элемента содержится в молекуле. Индекс 1 никогда не пишут. Такие формулы называют сокращенными, но чаще - молекулярными формулами, потому что они отражают состав (но не структуру!) молекул. Молекулярные формулы можно составлять по валентностям входящих в них элементов. И наоборот, зная валентности элементов, можно правильно составить из них молекулу.
** Но как определяют валентности элементов? Для этого можно воспользоваться нашими знаниями о строении внешних электронных оболочек атомов, как мы это уже делали при определении валентностей водорода, хлора, натрия, фтора, кислорода и азота в их конкретных химических соединениях.
Некоторые элементы проявляют в любых соединениях одну и ту же валентность. Таковы, например, водород, натрий, калий, серебро, фтор (валентность I); или магний, кальций (валентность II). Другие элементы могут - в зависимости от партнеров по химической реакции - проявлять несколько разных валентностей. Причину этого мы легко объясним чуть позже, исходя из строения их атомов.
В то время, когда химики еще ничего не знали о строении атомов, они успешно определили валентности многих элементов по данным химического анализа.
Анализ позволяет выяснить состав соединения, то есть численное соотношение атомов разных элементов в молекуле - молекулярную формулу. Делается это путем точного определения массы каждого элемента в образце, тщательно очищенном от примесей других веществ. С методикой анализа вы подробно познакомитесь в 10 классе. Сейчас же мы воспользуемся результатами уже проведенного анализа для определения валентности, например, азота.
Допустим, анализ чистого образца газа аммиака дает для его молекулы молекулярную формулу NH3. Можно воспользоваться тем обстоятельством, что валентность водорода всегда I (традиционно валентность обозначают римскими цифрами). Поскольку водород всегда одновалентен, его атомы в этом соединении не могут быть связаны между собой. Значит, они связаны с азотом. Вывод: валентность азота III. Для этого соединения можно придумать единственную структурную формулу:
Еще одно наблюдение: кислород во всех соединениях двухвалентен. Поэтому, например, в соединении SO2 валентность серы может быть только IV (валентность кислорода II умножить на 2 атома кислорода = 4), а в соединении SO3 валентность серы - VI (валентность кислорода II умножить на 3 атома кислорода = 6).
В более сложных случаях можно дать лишь частичный ответ, но и он бывает полезен. Например, о соединении HClO4 мы можем лишь сказать, что остаток ClO4 - одновалентен (так как мы отняли от него одновалентный атом водорода). В соединении H2SO4 остаток SO4 - двухвалентен (отняли два одновалентных атома водорода). Поэтому для определения валентности какого-либо элемента годятся только его простые соединения с водородом и кислородом, содержащие только один атом изучаемого элемента. Требование простоты весьма существенно. Например, по составу соединения СН4 (метан) можно правильно заключить, что элемент углерод четырехвалентен. Но существует и более сложное соединение углерода С6Н4 (бензол), по которому судить о валентности углерода только из результатов анализа затруднительно.
Таблица 3-2. Валентности некоторых элементов (традиционно записываются римскими цифрами). Для элементов с переменной валентностью первая цифра - наиболее распространенная валентность. В скобках даны валентности, встречающиеся реже. Звездочками помечены элементы с постоянной валентностью.
| Элемент | Валентность |
| * Водород (H) | I |
| * Натрий (Na) | I |
| * Калий (K) | I |
| * Серебро (Ag) | I |
| * Фтор (F) | I |
| Хлор (Cl) | I (III, V, VII) |
| Бром (Br) | I (III, V, VII) |
| Иод (I) | I (III, V, VII) |
| Ртуть (Hg) | I, II |
| Медь (Cu) | I, II |
| *Бериллий (Be) | II |
| * Магний (Mg) | II |
| * Кальций (Ca) | II |
| * Барий (Ba) | II |
| * Кислород (O) | II |
| Цинк (Zn) | II |
| Олово (Sn) | II (IV) |
| Свинец (Pb) | II (IV) |
| Железо (Fe) | II, III |
| Сера (S) | II, IV, VI |
| Марганец (Mn) | II, IV, VII |
| Хром (Cr) | III, VI |
| * Алюминий (Al) | III |
| Азот (N) | III (и другие) |
| Фосфор (P) | III, V |
| Углерод (C) | IV |
| Кремний (Si) | IV (II) |
Мы уже знаем вполне достаточно, чтобы правильно определять валентности многих элементов по правилу октета и по электронному строению их атомов. Можно так и поступать в дальнейшем, не утруждая себя заучиванием валентностей важнейших элементов. Но на практике их проще выучить, чтобы не тратить каждый раз время на рисование электронных формул и структур Льюиса.
В таблице 3-2 приводятся сведения о валентностях элементов, с которыми мы не раз столкнемся в нашем курсе.
Теперь разберемся в том, как составляют молекулярные формулы по уже известным валентностям элементов. Нам нужно научиться делать это для сложных веществ, состоящих из двух элементов.
Например, надо записать формулу соединения железа (III) с кислородом (соединения элементов с кислородом называются оксидами). Запишем химические символы железа (Fe) и кислорода (O), а над символами поставим валентности этих элементов.Затем переместим вниз и крест-накрест значения валентностей, записав их справа (и внизу) около символов элементов в виде индексов:
Теперь сделаем проверку. Два атома 3-х валентного железа дадут в сумме (2 х III = 6) свободных валентностей и столько же свободных валентностей (3 х II = 6) обеспечат три атома II-х валентного кислорода. Свободных, неиспользованных валентностей у атомов не осталось. Значит, формула оксида железа (III) составлена правильно: Fe2O3.
Фактически, задача сводится к поиску наименьшего общего кратного для валентностей двух элементов. Поясним это на еще одном примере. Напишем формулу соединения серы (VI) с кислородом:

На первый взгляд кажется, что формула составлена правильно. На самом деле для чисел 2 и 6 имеется наименьшее общее кратное - 6, поэтому оба индекса можно сократить вдвое:

<>
Теперь молекулярная формула оксида серы (VI) написана правильно.
Задачи
3.7. В школьном курсе не изучают химию элемента скандия. Тем не менее, основываясь на электронном строении атома 21Sc, сделайте следующее:
а) напишите электронную формулу скандия и определите его наиболее вероятную валентность (пользуясь правилом октета);
б) напишите формулу Льюиса для соединения скандия с хлором;
в) напишите молекулярную и структурную формулы соединения скандия с хлором;
г) определите: будет ли связь Sc-Cl ковалентной (один вариант), либо (второй вариант) - полярной ковалентной или ионной.
3.8. 1) Используя валентности элементов, напишите молекулярные формулы соединений: а) калия с фтором; б) магния с кислородом; в) кальция с водородом; г) алюминия с фтором; д) алюминия с кислородом.
2) Нарисуйте структурные формулы соединений и определите валентность каждого атома: а) HCl; б) BeCl2; в) AlBr3; г) PH3; д) TiCl4.
** 3.9. Напишите одну молекулярную формулу и нарисуйте по крайней мере две теоретически возможные структурные формулы соединения хрома (III) с кислородом. Подсказка: одна из этих структур содержит кратные связи, другая - циклическая.
3.10. Напишите формулы Льюиса для соединений: H2S, CO2, BeO, I2, ICl. Найдите здесь соединение с ковалентной связью.
** 3.11. Напишите электронную формулу валентной оболочки элемента 34Se. Сколько поделенных и сколько неподеленных электронных пар в соединении H2Se? Нарисуйте его структурную формулу.
** 3.12. Напишите формулу Льюиса и нарисуйте структурную формулу для соединения SF6. Сколько поделенных и сколько неподеленных электронных пар в этом соединении? Примечание: фтор – сильнейший акцептор электронов, поэтому электронные пары химических связей сдвинуты от атома серы к атомам фтора. Какому инертному газу “подражает” сера в этом соединении – аргону или неону?
3.13. Наш старый знакомый Юх нарисовал свой химический автопортрет, повесил его в лаборатории и сказал, что со временем обязательно синтезирует такое соединение. Оно обязательно будет обладать какими-нибудь необычными свойствами. Доктор Пилюлькин сразу нашел ошибку в портрете и сказал Юху, что такое соединение вряд ли можно синтезировать. Какую ошибку смог найти доктор Пилюлькин?

** §3.5 Элементы с переменной валентностью.
№21 Скандий
История открытия:
Элемент, предсказанный в 1870 году Д. И. Менделеевым под названием "экабор", был открыт в 1879 г. шведским химиком Л. Нильсоном, который назвал элемент скандием в честь Скандинавии. Однако Нильсон неправильно оценил свойства скандия, считая его четырехвалентным элементом. Все поставил на свои места его соотечественник П. Клеве, который пришел к выводу, что скандий есть "экабор" Менделеева. 19 августа 1879 г. он написал русскому ученому: "Имею честь сообщить Вам, что Ваш элемент экабор выделен. Это скандий, открытый Л. Нильсоном весной этого года".
Получение:
Содержание скандия в земной коре 6*10 -4 %, основные минераллы: тортвейтит Sc2Si2O7 и стереттит ScPO4*H2O.
Получают скандий восстановлением ScF3 или ScCl3 металлическим кальцием с последующей перегонкой в вакууме.
Физические свойства:
Скандий - легкий металл с характерным желтым отливом, который появляется при контакте металла с воздухом. Металлический скандий имеет удельный вес 2,99 г/см 3 при 20°С (легкий металл), плавится при 1539°С, кипит при 2727°С, хрупок, слабо парамагнитен.
Химические свойства:
Скандий - активный, легко окисляющийся металл, разлагающий воду при нагревании, легко растворяющийся при нормальной температуре в разбавленных кислотах с образованием солей и выделением водорода:
Sc + 3H2O = Sc(OH)3 + 3/2H2 2Sc + 3H2SO4 = Sc2(SO4)3 + 3H2
При нагревании металлический скандий взаимодействует с кислородом, хлором, бромом, йодом, серой и азотом с образованием соответственно Sc2O3, ScCl3, ScBr3, ScI3, Sc2S3, ScN.
В соединениях проявляет степень окисления +3 (редко +2). В растворах скандий находится либо в виде катионов Sc 3+ , либо в составе комплексных анионов: [ScF4] - , [ScF5] 2- и т.д. Свойства многих соединений скандия близки к свойствам аналогичных соединений алюминия.
Важнейшие соединения:
Оксид скандия Sc2O3, получают при нагревании металла в атмосфере кислорода, а также прокаливанием на воздухе гидроксида, нитрата, карбоната или оксалата скандия. Он представляет собой рыхлый белый порошок или бесцветные кубические кристаллы. После сильного прокаливания Sc2O3 плохо растворяется в концентрированной HCl. При сплавлении с оксидами щелочных и щелочноземельных металлов образует скандиаты, напр., LiScO2. Оксид скандия используют в производстве ферритов, люминофоров, стекла и керамики.
Гидроксид скандия Sc(OH)3, получают обработкой растворов солей скандия щелочами:
Sc(NO3)3 + 3NaOH = Sc(OH)3 + 3NaNO3
Гидроксид скандия можно выделить в виде белого аморфного порошка или в виде бесцветных кубических гранецентрированных кристаллов, а также в виде студнеобразного белого осадка, трудно растворимого в воде.
Амфотерный гидроксид с преобладанием основных свойств, в концентрированных растворах щелочей образует гидроксоскандиаты, например: Na3[Sc(OH)6].
Хлорид скандия ScCl3, получают действием сухого хлора на металлический скандий при нагревании, на сульфиды, карбиды скандия или смесь Sc2O3 c углем. Он представляет собой бесцветные ромбоэдрические кристаллы, растворимые в спирте и гидролизующиеся легче, чем хлориды редкоземельных металлов.
Сульфид скандия Sc2S3, получают действием паров серы на металлический скандий, обработкой сероуглеродом оксида скандия или нагреванием безводного сульфата скандия в атмосфере сероводорода. Sc2S3 - желтое твердое вещество; устойчив на воздухе, гидролизуется кипящей водой:
Sc2S3+6HOH=2Sc(OH)3+3H2S.
Гидриды скандия получают взаимодействием скандия с недостатком (ScH2) или избытком (ScH3) водорода при нагревании. Твердые вещества серого цвета, электропроводны.
Карбид скандия Sc4C3, образуется в виде черных гексагональных кристаллов восстановлением оксида скандия углем при нагревании. Компонент металлокерамики.
Применение:
Компонент легких сплавов с высокой прочностью и коррозионной стойкостью, нейтронный фильтр в ядерной технике.
| 21 Sc | 1s 2 2s 2 2p 6 3s 2 3p 6 | 3d 1 4s 2 |
или в виде сокращенной записи: [Ar] 3d 1 4s 2
Электронная формула в виде ячеек:
Скандий – d- элемент. Электронное строение атома заканчивается s- электронами, поэтому элемент будет проявлять металлические свойства.
3. Формулы и химический характер соединений (высшего оксида и гидроксида; водородных соединений).
Гидроксид – Sc(OH)3 обладают слабыми основными свойствами.
Соединений с водородом не образует.
4. Сравнить с соседями (по периоду, по группе).
Порядковый номер 34 имеет селен Se. Элемент находится в IV периоде, значит в атоме имеется 4 энергетических уровня. Он находится в главной подгруппе VI группы; его валентные электроны распределены на 4s и 4p-подуровнях.
Электронная формула селена: 34Se 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4
Внешний уровень в виде ячеек имеет вид:
Атом селена имеет 6 валентных электронов; поэтому высшая валентность равна 6, что соответствует номеру группы.Селен - p- элемент, поэтому будет проявлять свойства неметалла.
Высший оксид SeO3, его гидроксид H2SeO4 и газообразное водородное соединение H2Se имеют кислотный характер.
Билет 3. Валентность и степень окисления элемента в свете теории строения атомов.
Валентность- это способность атомов одного химического элемента присоединять определённое число атомов другого, определяется числом его неспаренных электронов, способных участвовать в образовании химических связей с другими атомами, поэтому валентность всегда выражается небольшими целыми числами
Д.И. Менделеевым была установлена связь между валентностью элемента и его положением в периодической системе, введено понятие о переменной валентности.
Валентность показывает, со сколькими атомами одновалентного элемента соединяется атом данного элемента.
Например:в HCl хлор-одновалентен, в H2O кислород-двухвалентен,в NH3 азот-трёхвалентен.
Постоянная валентность:
I-H, Na, Li, K, Rb, Cs
II-O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
III-B, Al, Ga, In
Степень окисления — это условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер.
Это означает, что более электроотрицательный атом, смещая к себе полностью одну электронную пару, приобретает заряд l-.
Степень окисления указывается сверху над символом элемента. В отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот:

- степень окисления

- заряды
Степень окисления атома в простом веществе равна нулю, например:
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:

При пользовании степенями окисления полезно придерживаться следующих правил:
1) сумма степеней окисления атомов в любой частице равна ее электрическому заряду. Следовательно, степень окисления элемента в его простом веществе равна нулю;
2) в соединениях фтор всегда проявляет степень окисления -1;
3) степень окисления кислорода в соединениях обычно равна -2 (кроме ОF2, Н2О2 и др.);
4) степень окисления водорода равна +1 в соединениях с неметаллами
Валентность. Молекулярные формулы.
Введем еще один важный термин, нужный нам для дальнейшей работы: валентность. Число черточек, отходящих от символа элемента в структурных формулах, равно валентности этого элемента. Валентность элемента - это его способность образовывать определенное число химических связей. По числу черточек в уже знакомых нам формулах нескольких молекул видно, что водород и хлор одновалентны, кислород - двухвалентен, а азот - трехвалентен.
Валентность определяется как число электронных пар, которыми данный атом связан с другими атомами.
Поскольку в химической связи участвуют только электроны внешних оболочек, такие электроны называют валентными. Единичная (простая) ковалентная связь возникает, когда атомы делят между собой одну пару валентных электронов.
Структурные формулы наглядно показывают последовательность связывания атомов в молекуле и валентность элементов, однако если такая подробная информация не нужна, молекулы можно записывать в виде сокращенных химических формул. Например, уже знакомые нам молекулы в этом случае выглядят так:
Цифра, стоящяя внизу справа от символа элемента, называется индексом. Индекс показывает, сколько атомов данного элемента содержится в молекуле. Индекс 1 никогда не пишут. Такие формулы называют сокращенными, но чаще - молекулярными формулами, потому что они отражают состав (но не структуру!) молекул. Молекулярные формулы можно составлять по валентностям входящих в них элементов. И наоборот, зная валентности элементов, можно правильно составить из них молекулу.
** Но как определяют валентности элементов? Для этого можно воспользоваться нашими знаниями о строении внешних электронных оболочек атомов, как мы это уже делали при определении валентностей водорода, хлора, натрия, фтора, кислорода и азота в их конкретных химических соединениях.
Некоторые элементы проявляют в любых соединениях одну и ту же валентность. Таковы, например, водород, натрий, калий, серебро, фтор (валентность I); или магний, кальций (валентность II). Другие элементы могут - в зависимости от партнеров по химической реакции - проявлять несколько разных валентностей. Причину этого мы легко объясним чуть позже, исходя из строения их атомов.
В то время, когда химики еще ничего не знали о строении атомов, они успешно определили валентности многих элементов по данным химического анализа.
Анализ позволяет выяснить состав соединения, то есть численное соотношение атомов разных элементов в молекуле - молекулярную формулу. Делается это путем точного определения массы каждого элемента в образце, тщательно очищенном от примесей других веществ. С методикой анализа вы подробно познакомитесь в 10 классе. Сейчас же мы воспользуемся результатами уже проведенного анализа для определения валентности, например, азота.
Допустим, анализ чистого образца газа аммиака дает для его молекулы молекулярную формулу NH3. Можно воспользоваться тем обстоятельством, что валентность водорода всегда I (традиционно валентность обозначают римскими цифрами). Поскольку водород всегда одновалентен, его атомы в этом соединении не могут быть связаны между собой. Значит, они связаны с азотом. Вывод: валентность азота III. Для этого соединения можно придумать единственную структурную формулу:
Еще одно наблюдение: кислород во всех соединениях двухвалентен. Поэтому, например, в соединении SO2 валентность серы может быть только IV (валентность кислорода II умножить на 2 атома кислорода = 4), а в соединении SO3 валентность серы - VI (валентность кислорода II умножить на 3 атома кислорода = 6).
В более сложных случаях можно дать лишь частичный ответ, но и он бывает полезен. Например, о соединении HClO4 мы можем лишь сказать, что остаток ClO4 - одновалентен (так как мы отняли от него одновалентный атом водорода). В соединении H2SO4 остаток SO4 - двухвалентен (отняли два одновалентных атома водорода). Поэтому для определения валентности какого-либо элемента годятся только его простые соединения с водородом и кислородом, содержащие только один атом изучаемого элемента. Требование простоты весьма существенно. Например, по составу соединения СН4 (метан) можно правильно заключить, что элемент углерод четырехвалентен. Но существует и более сложное соединение углерода С6Н4 (бензол), по которому судить о валентности углерода только из результатов анализа затруднительно.
Валентности некоторых элементов (традиционно записываются римскими цифрами). Для элементов с переменной валентностью первая цифра - наиболее распространенная валентность. В скобках даны валентности, встречающиеся реже. Звездочками помечены элементы с постоянной валентностью.
Скандий в таблице менделеева занимает 21 место, в 4 периоде.
| Символ | Sc |
| Номер | 21 |
| Атомный вес | 44.9559080 |
| Латинское название | Scandium |
| Русское название | Скандий |
Электронная схема скандия
Sc: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
Короткая запись:
Sc: [Ar]4s 2 3d 1
Одинаковую электронную конфигурацию имеют атом скандия и V +2 , Mn +4 , Fe +5
Порядок заполнения оболочек атома скандия (Sc) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ - до 6, на ‘d’ - до 10 и на ‘f’ до 14
Скандий имеет 21 электрон, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
1 электрон на 3d-подуровне
Степень окисления скандия
Атомы скандия в соединениях имеют степени окисления 3, 2, 1.
Степень окисления - это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы скандия
Валентность Sc
Атомы скандия в соединениях проявляют валентность III, II, I.
Валентность скандия характеризует способность атома Sc к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Sc
Квантовые числа определяются последним электроном в конфигурации, для атома Sc эти числа имеют значение N = 3, L = 2, Ml = -2, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат: 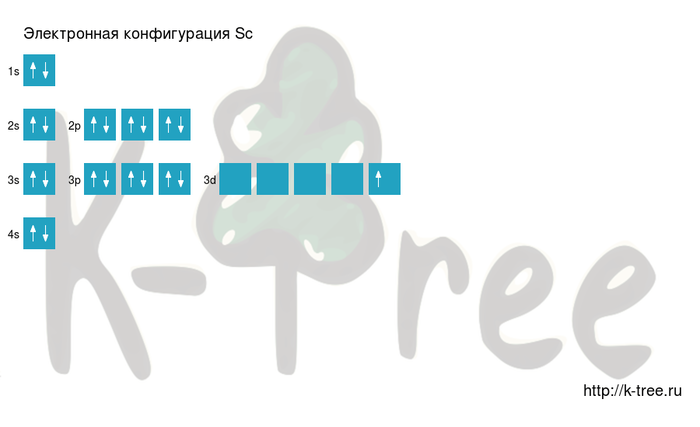
Энергия ионизации
Чем ближе электрон к центру атома - тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации - это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Читайте также:

