Эверолимус при раке молочной железы

В настоящее время препарат используется в качестве иммунодепрессанта для предотвращения отторжения органов после трансплантации и для лечения нескольких типов рака.
Было проведено множество исследований использования эверолимуса и других ингибиторов mТор для лечения различных видов рака.
Фармакотерапевтическая группа: Иммунодепрессивное средство. Новый препарат Эверолимус – это производное сиролимуса. Он действует так же, как сиролимус, в качестве ингибитора мишени рапамицина в клетках млекопитающих (МТор).
Фармакологическое действие
Иммунодепрессивный препарат. Активное вещество препарата — эверолимус — является ингибитором пролиферативного сигнала. Эверолимус оказывает иммуносупрессивный эффект за счет ингибирования антиген-активированной пролиферации Т-клеток и, соответственно, клональной экспансии, вызываемой специфическими интерлейкинами Т-клеток, например интерлейкином-2 и интерлейкином-15.
Блокада этого сигнала эверолимусом приводит к остановке деления клеток на стадии G1 клеточного цикла.
- Профилактика отторжения трансплантата почки и сердца у взрослых реципиентов с низким и средним иммунологическим риском, получающих базовую иммуносупрессивную терапию циклоспорином в форме микроэмульсии и ГКС.
- Распространенный и/или метастатический почечно-клеточный рак (при неэффективности антиангиогенной терапии).
- Для предупреждения отторжения органа после пересадки почки
- Для предупреждения отторжения органа после пересадки печени
- При поздних стадиях рака почки. Препарат Афинитор (Afinitor), непатентованное международное название – эверолимус (everolimus), одобрен в Европе для лечения взрослых пациентов с ангиомиолипомой почки. Это доброкачественная мезенхимальная опухоль, ассоциированная с туберозным склерозом у больных, которые подвергаются риску развития осложнений, не требующих немедленного хирургического вмешательства.
- При субэпендимальной гигантоклеточной астроцитоме (SEGA), связанной с туберозным склерозом (ТС) у пациентов, которым противопоказано хирургическое вмешательство. FDA одобрило Афинитор в детской дозировке для лечения редкой опухоли мозга. Лекарственное средство предназначено для лечения редкой опухоли мозга – субэпендимальной гигантоклеточной астроцитомы (СЭГА). Он может назначаться пациентам в возрасте старше одного года с комплексом туберозного склероза с диагностированной СЭГА, не поддающейся хирургическому вмешательству.
- При прогрессивных или метастатических нейроэндокринных опухолях поджелудочной железы, не поддающихся удалению хирургическим путем. Для лечения взрослых пациентов с нерезектабельными или метастатическими хорошо дифференцируемыми или смешанными нейроэндокринными опухолями поджелудочной железы (PNET) в стадии прогрессирования заболевания, локализованных либо метастазирующих, у неоперабельных пациентов. Применение Afinitor более, чем удвоило время отсутствия роста опухоли и уменьшило риск развития рака на 65%, при сравнении с плацебо у пациентов с PNET.
- Афинитор (эверолимус) показал многообещающие результаты в лечении рака груди. Швейцарская компания Novartis AG получила одобрение FDA на применение лекарственного препарата Афинитор (Afinitor) для лечения распространенного гормон-рецептор-положительного, HER2-отрицательного рака молочной железы у женщин в период постменопаузы. Добавление Афинитор® к гормональной терапии повышает эффективность лечения рака молочной железы у женщин в постменопаузе с распространенным гормон-рецептор положительным, HER2- отрицательным типом рака, в сочетании с экземестаном.
- Применяется для профилактики и лечения кровотечений у больных одной из форм гемофилии.
Противопоказания
Повышенная чувствительность к эверолимусу, сиролимусу или другим компонентам препарата.
Особые указания.
Лечение должны проводить только врачи, имеющие опыт иммуносупрессивной терапии после трансплантации органов, и возможность мониторинга концентрации эверолимуса в цельной крови.
Во время лечения всем пациентам рекомендуется контроль функции почек. При повышении КК следует решить вопрос о коррекции иммуносупрессивной терапии (уменьшение дозы циклоспорина).
Эверолимус (Афинитор) используется в выделяющих лекарственные средства коронарных стентах в качестве иммунодепрессанта для предотвращения рестеноза. Компания Abbott Vascular производит стенты с эверолимусом под названием Xience В. В этих стентах используются кобальтахромовые стенты от Multi-Link Vision и эверолимус от Novartis. Продукт также используется в США и доступен в Японии в качестве экспериментального средства. Аналогичный вариант под названием PROMUS Система Коронарных Стентов с Эверолимусом, производится Boston Scientific и в настоящее время доступен в Соединенных Штатах и в большинстве крупных европейских стран и стран Азиатско-Тихоокеанского региона.
Результаты исследования PLATINUM: стент выделяющий препарат эверолимус хорошо работает.
- КЛЮЧЕВЫЕ СЛОВА: ингибитор, рак молочной железы, лечение рака молочной железы, онкология
Эверолимус является селективным ингибитором mTOR (мишени рапамицина у млекопитающих) – медиатора сигнального пути PI3K/Akt, активация которого усиливает деление клетки, рост кровеносных сосудов и клеточный метаболизм. В терапии онкологических заболеваний эверолимус применяется при распространенном и/или метастатическом почечно-клеточном раке при неэффективности предшествующей терапии ингибиторами тирозиновых киназ и/или цитокинами. В США препарат разрешен к использованию при неоперабельных нейроэндокринных опухолях поджелудочной железы; в Швейцарии – при субэпендимальной гигантоклеточной астроцитоме. В настоящее время препарат активно исследуется в монотерапии или в комбинациях с другими препаратами при целом ряде опухолей: раке молочной железы, гепатоцеллюлярном раке, раке желудка, холангиокарциноме, B-клеточной лимфоме, мелкоклеточном и немелкоклеточном раке легкого, раке предстательной железы, щитовидной железы, эндометрия и др. Данная статья посвящена применению эверолимуса при раке молочной железы (РМЖ).
HER2-позитивный РМЖ
P. Morrow и соавт. в исследовании I–II фазы у больных, получавших комбинации с трастузумабом (1–2-я линии) и лапатинибом (1-я линия), проводили лечение эверолимусом в дозе 5–10 мг/сут и трастузумабом 6 мг/кг каждые 3 недели. В фазе II исследования эверолимус применялся в дозировке 10 мг/сут. В исследование было включено 47 больных, 9 из них ранее получали лапатиниб. ЧР достигнута у 7 больных (15%), стабилизация более 6 месяцев – у 9 (19%). Медиана времени до прогрессирования составила 4,1 мес. Основными побочными эффектами терапии были утомляемость, инфекции, мукозиты [4].
G. Jerusalem и соавт. в исследовании IB фазы больным, резистентным к лечению трастузумабом, назначали эверолимус 5 мг ежедневно или 30 мг еженедельно в комбинации с винорельбином 25 мг/м2 в 1-й, 8-й дни каждые 3 недели и трастузумабом 2 мг/кг еженедельно. Оценена эффективность терапии у 47 больных: частота объективного ответа составила 19,1%, контроль заболевания достигнут у 83% больных; медиана времени до прогрессирования – 30,7 недель [5].
В исследовании IB фазы F. Andre и соавт. 33 больных (31 пациентка ранее получала таксаны, у 32 больных наблюдалась резистентность к трастузумабу) получали эверолимус 5–10 мг ежедневно или 30 мг еженедельно в комбинации с паклитакселом 80 мг/м2 и трастузумабом 2 мг/кг еженедельно.
Рекомендованная доза эверолимуса – 10 мг/сут. Оценена эффективность терапии 27 пациентов. Полная и частичная регрессия составила 44%, контроль болезни более 6 мес. достигнут у 74%, медиана времени до прогрессирования – 34 недели (29,1–40,7). Среди 11 больных, резистентных к таксанам и трастузумабу, общий ответ составил 55%. Уровень токсичности был приемлемым: нейтропения 3–4-й степени отмечена у 17 больных из 33 (52%), фебрильная нейтропения – у 2 больных. В связи с нейтропенией доза паклитаксела была уменьшена у 9 больных. Стоматит 2-й и 3-й степени отмечен у 20 и 7 больных соответственно.
У 6 из этих больных доза эверолимуса была редуцирована, у одной пациентки препарат отменен.
У 1 больной отмечен неинфекционный интерстициальный пульмонит 3-й степени, симптомы которого полностью регрессировали в течение 2 недель после прекращения лечения [6]. В исследовании II фазы F. Dalenc и соавт. у 55 больных, резистентных к трастузумабу и таксанам, применяли паклитаксел 80 мг/м2 внутривенно в 1, 8, 15-й дни каждые 4 недели, трастузумаб еженедельно 2 мг/кг, эверолимус 10 мг ежедневно. Прогрессирование на фоне лечения по поводу метастатического заболевания или вскоре после его окончания (в течение 3 мес. после лечения трастузумабом или в течение 4 мес. после химиотерапии таксанами), а также в течение года после окончания адъювантного лечения расценивалось как резистентность. Медиана предшествующих линий химиотерапии по поводу метастатического заболевания составила 3 (0–8) мес., 68% больных получили антрациклины, 62% – лапатиниб. Эффективность комбинации с эверолимусом оценена у 25 больных: ЧР достигнута у 20%, стабилизация заболевания – у 56% больных. Переносимость была удовлетворительная: 3–4-я степень нейтропении выявлена у 32% больных, включая 1 случай фебрильной нейтропении, стоматит 3-й степени – у 13%, астения/слабость 3-й степени – у 5% [7].
В 2013 г. ожидаются результаты двух крупных международных рандомизированных исследований III фазы. В исследовании BOLERO-1 сравнивается комбинация трастузумаба и паклитаксела с эверолимусом и без него в первой линии лечения HER2-позитивного РМЖ [8]. В исследовании BOLERO-3 изучается эффективность эверолимуса в сравнении с плацебо в комбинации с трастузумабом и винорельбином во 2–3-й линиях лечения после прогрессирования на фоне трастузумаба и таксанов [9]. Результаты этих исследований дадут окончательный ответ, насколько добавление эверолимуса увеличивает время до прогрессирования и ответ на лечение HER2-позитивного РМЖ.
Гормонопозитивный рак молочной железы
В предклинических исследованиях на рецептор-позитивных моделях РМЖ эверолимус показал эффективность, сокращая рост опухолевых клеток, а также усиливал эффективность гормонотерапии в комбинированных режимах. В исследованиях in vitro применение ингибиторов mTOR приводило к восстановлению чувствительности к гормонотерапии в резистентных клетках РМЖ [10].
J. Baselga и соавт. в исследовании эверолимуса при гормоночувствительном РМЖ применяли в неоадъювантном режиме летрозол в комбинации с эверолимусом или плацебо в течение 4 мес. у 270 больных. Эффект лечения оценивался тремя методами. Преимущество в группе больных, получавших эверолимус, отмечено при оценке методом пальпации (частота объективного ответа 68,1% против 59,1% в группе плацебо, р = 0,0616) и при ультразвуковой оценке (58% против 47% соответственно, р = 0,0352). При использовании маммографии достоверной разницы не получено (36,2% в группе эверолимуса против 39,4% в группе плацебо, р = 0,7039). Токсичность 3–4-й степени отмечена у 22,6% больных, получавших эверолимус, и у 3,8%, получавших плацебо. Доза была снижена или лечение прервано в связи с побочными эффектами у 52,9% и у 7,6% соответственно. Больным проводили биопсию опухоли перед лечением и на 15-й день приема препаратов с определением ряда маркеров, в том числе Ki-67. Выявлено, что снижение пролиферативной активности на 15-й день отмечалось значительно чаще в группе больных, получавших эверолимус, чем в группе плацебо, – 57% против 30% соответственно [11].
Новая мишень для таргетной терапии рака
В России зарегистрировано новое показание для применения таргетного противоопухолевого препарата, действующим веществом которого является эверолимус. Он давно и успешно применяется в онкологии, и регистрация его для лечения рака молочной железы не вызвала бы такой резонанс, если бы не надежда на продление жизни, которую связывают с ним десятки тысяч женщин. Опыт первых шести месяцев применения препарата по новому показанию, похоже, не разочаровал ни пациенток, ни врачей.
Несмотря на достижения современной онкологии, рак молочной железы излечивается не более чем у трети заболевших женщин из-за высокой склонности опухолей к метастазированию. Основным методом лечения пациенток с неоперабельными из-за наличия метастазов опухолями является гормональная терапия. Но рано или поздно возникает устойчивость к гормональным препаратам, а иногда опухоль изначально оказывается нечувствительной к ним. И тогда единственным способом продолжить борьбу за жизнь становится химиотерапия. Химиотерапия, как правило, плохо переносится, сопровождается мучительной тошнотой, рвотой, облысением, она наносит значительный вред здоровью. Эверолимус позволяет легче и комфортнее преодолеть устойчивость к гормональной терапии. Он выпускается в виде таблеток, поэтому лечение можно проводить без изменения привычного образа и ритма жизни, а отсутствие характерных для химиотерапии серьезных побочных эффектов позволяет не ухудшать ее качество.
Мишенью эверолимуса является белок mTOR, участвующий в регуляции деления и метаболизма опухолевых клеток, роста кровеносных сосудов. Развитие устойчивости к гормональной терапии связано, в том числе, и с избыточной активацией этого белка. Поэтому подавление эверолимусом активности белка mTOR позволяет преодолеть развившуюся вторичную или имеющуюся первичную устойчивость и продолжить гормонотерапию. Результаты клинических исследований показали, что дополнение этим препаратом гормональной терапии более чем на 50% снижает риск прогрессирования опухоли и более чем в 2 раза увеличивает время, в течение которого опухолевый процесс не активизируется.
Что касается практического опыта применения эверолимуса в лечении рака молочной железы, по словам профессора Рашиды Орловой, руководителя отделения химиотерапии Санкт-Петербургского клинического онкологического диспансера и специализированного Центра онкологии, члена Европейской ассоциации медицинских онкологов (ESMO), полученные на данный момент результаты применения эверолимуса позволяют ожидать определенного прорыва в этой области онкологии.
Несколько омрачает ситуацию опасение, что таргетная терапия будет недоступна из-за дороговизны препарата. Потому что, хоть он и входит в список жизненно необходимых и важнейших лекарственных препаратов, то есть его цена регулируется государством, месячный прием препарата обойдется пациентке в 160 тысяч рублей. Такая сумма будет неподъемной ношей для абсолютного большинства семейных бюджетов. А ведь эверолимус необходимо принимать постоянно, в течение длительного времени, в дополнение к средствам гормональной терапии. Это означает значительное увеличение стоимости лечения. Но дойдет ли препарат до пациенток в рамках государственных гарантий оказания бесплатной медицинской помощи? Не секрет, что эти гарантии в области лекарственного обеспечения часто выполняются не в полном объеме из-за недостаточного финансирования. Опасения эти отчасти разделяет член-корреспондент РАМН, заведующая кафедрой онкологии РМАПО МЗСР РФ на базе Онкологического научного центра им. ак. Н.Н.Блохина РАМН Ирина Поддубная. В то же время она считает, что неадекватное обеспечение онкологических больных необходимыми препаратами нередко является следствием пассивной позиции руководителей региональных департаментов здравоохранения и медицинских учреждений. В качестве положительного примера Ирина Поддубная привела ситуацию в Санкт-Петербурге, где все пациенты обеспечены этим лекарственным средством за счет государства.
Что ж, таргетная терапия эверолимусом получила новую мишень. Насколько успешно будет ее поражение, покажет время.
Читать статьи по темам:
Читать также:
Разные болезни – от одного комплекса генов?
В развитии диабета, атеросклероза, болезней сердца, рака и других заболеваний виноваты нарушения активности одних и тех же генов. Это указывает на возможность применения в терапии рака препаратов, используемых при лечении других болезней.
Рассеянный склероз можно лечить противораковым препаратом
Третья фаза клинических исследований противоракового препарата алемтузумаба подтвердила его бОльшую эффективность по сравнению со стандартно применяемом при лечении рассеянного склероза интерфероном бета-1а.
Помогут ли существующие препараты при болезни Альцгеймера?
Препараты, применяемые для лечения таких распространенных патологий, как диабет, гипертония и заболевания кожи, в течение ближайших 10 лет могут найти применение в терапии болезни Альцгеймера.
Лечите цистит антибиотиками, а не клюквенным соком
Эффективность этого народного средства оставляет желать много-много лучшего: в надежде вылечить цистит придётся выпивать не менее двух стаканов клюквенного сока в течение нескольких месяцев.
Таблетки для здоровой старости
То, что многие пожилые люди предпринимают попытки улучшить свой внешний вид и в целом замедлить или даже обратить вспять процесс старения, стало весьма актуальным для лечащих врачей.
Клинические исследования, спонсируемые фармкомпаниями, вышли из доверия
Врачи склонны не доверять результатам клинических исследований, финансируемых фармацевтическим компаниями, даже при условии их тщательного методологического планирования.
Электронное СМИ зарегистрировано 12.03.2009
Свидетельство о регистрации Эл № ФС 77-35618












Протективное влияние эверолимуса на костную ткань у больных раком молочной железы
— Рак молочной железы — социально значимое заболевание, лидирующее в структуре онкологической заболеваемости и смертности у женщин, — так начала свое выступление Т.Ю. Семиглазова. — Отдельной клинической проблемой является наличие метастатического поражения костей при РМЖ. Другими словами, скелет — излюбленное место для гематогенного метастазирования РМЖ. По данным различных авторов, метастазы в кости диагностируются у 65—80% больных диссеминированным РМЖ, по данным аутопсии — в 90% случаев.
Клиническими проявлениями костных метастазов являются: боль различной степени интенсивности, в ряде случаев требующая назначения наркотических анальгетиков; патологические переломы; компрессия спинного мозга и гиперкальциемия. Все это в значительной степени ухудшает качество жизни больных, а в ряде случаев может быть причиной смерти.
Как рассказала докладчик, еще в 1770 году английский врач Джон Хантер (1728—1793), один из основоположников экспериментальной патологии и анатомо-физиологического направления в хирургии, обнаружил, что при формировании новой кости старая кость резорбируется (остеолизис). Данный процесс получил название костного ремоделирования. Молекулярные исследования последних 20 лет значительно расширили представление о патофизиологии костных метастазов. В костной ткани метастатические клетки нарушают скоординированное взаимодействие между остеокластами — клетками, отвечающими за лизис кости, и остеобластами — костеобразующими клетками, что ведет к повышению скорости патологического ремоделирования. В результате образуется слабая и хрупкая костная ткань, склонная к переломам.
Повышение костной резорбции наблюдается также у здоровых женщин в менопаузе и у больных РМЖ, получающих терапию ингибиторами ароматазы в адъю-вантном (профилактическом) режиме или по поводу диссеминации основного процесса. В 5 крупных рандомизированных исследованиях (ATAC, BIG 1—98, IES, MA-17 и ABCSG8/ARNO 95), в которых 24 243 больные ранним РМЖ получали в адъювантном режиме гормонотерапию тамоксифеном или ингибиторами ароматазы (анастрозолом или летрозолом, или экземестаном), выявлено достоверное увеличение риска патологических переломов на фоне терапии ингибиторами ароматазы. Важно, отметила докладчик, что патологические переломы, развивающиеся на фоне повышенной костной резорбции, увеличивают риск смерти женщин на 32%.
Т.Ю. Семиглазова обратила внимание участников конференции на новые данные, свидетельствующие о значимой роли в нормальном и патологическом костном ремоделировании белка mTOR, контролирующего ряд важнейших функций практически любой клетки в организме человека, включая и остеокласты. В частности, в преклинических исследованиях было доказано, что ингибирование mTOR ведет к уменьшению ферментативной активности и выживания остеокластов и, как следствие, к снижению интенсивности резорбции костной ткани.
Гормонозависимый — эстроген-позитивный рак молочной железы (РЭ+ РМЖ) диагностируется в 70—75% случаев РМЖ, сообщила Т.Ю. Семиглазова. Метастатический РЭ+ РМЖ — волнообразно протекающее заболевание, с высокой частотой метастазирования в кости. Как правило, длительные периоды стабилизации сменяются прогрессированием, редко сопровождающимся висцеральным кризом, то есть клинически значимыми метастазами в легкие или печень. Последовательное применение нескольких линий гормонотерапии — антиэстрогенов (тамоксифена, фулвестранта), нестероидных ингибиторов ароматазы (летрозола или анастрозола), стероидных ингибиторов ароматазы (экземестана), прогестинов (мегестрола ацетата) — позволяет относительно долго сохранять высокое качество жизни данной категории больных. Приоритетность и последовательность назначения той или иной линии гормонотерапии рассматривается индивидуально в каждой конкретной ситуации в зависимости от анамнеза заболевания и сопутствующей патологии.
Несмотря на то, что эндокринотерапия является основным видом лечения больных диссеминированным РЭ+ РМЖ, получить ответ на проводимое лечение удается не во всех случаях. Речь идет о развитии первичной (de novo) или вторичной (приобретенной) резистентности к проводимой ранее гормонотерапии, в ряде случаев являющейся вполне обоснованной причиной отказа от продолжения гормонотерапии и начала химиотерапии. Механизм резистентности к гормонотерапии может быть объяснен тем, что функцию заблокированных рецепторов эстрогенов на поверхности клетки могут взять на себя альтернативные нижележащие сигнальные пути, в частности внутриклеточный сигнальный каскад PI3K/AKT/mTOR. Субстрат комплекса mTORC1 фосфорилирует внутриклеточный домен AF-1 рецептора эстрогена, который отвечает за не зависимую от лиганда активацию рецептора. Таким образом, альтернативная активация рецепторов эстрогенов может способствовать развитию резистентности к эндокринотерапии. Это явилось теоретической предпосылкой для изучения эффективности ингибитора mTOR — эверолимуса у больных диссеминированным РЭ+ РМЖ с прогрессированием после ингибиторов ароматазы.
Эверолимус является избирательным ингибитором серин-треониновой киназы mTOR (мишени рапамицина у млекопитающих), важнейшего регулятора синтеза белка в дистальной части PI3K/AKT-зависимого каскада, деятельность которого нарушена в большинстве опухолевых клеток человека. Эверолимус проявляет свою активность за счет высокоаффинного взаимодействия с внутриклеточным рецепторным белком FKBP12. Комплекс FKBP12-эверолимус связывается с mTORC1 и ингибирует его способность к передаче сигналов. Блокировка трансляции основных протеинов, участвующих в регуляции клеточного цикла, гликолиза и адаптации клеток к гипоксии, ведет к подавлению роста и ангиогенеза опухоли. Итак, таргетный анти-mTOR препарат — эверолимус является активным ингибитором деления опухолевых клеток, роста кровеносных сосудов и метаболизма клеток. Но проявится ли его биологическое направленное действие по отношению к гормонозависимому раку молочной железы, резистентному к нескольким линиям лекарственного лечения, включающим ингибиторы ароматазы?
Ответ на этот вопрос дало рандомизированное многоцентровое исследование III фазы (BOLERO 2). В исследование были включены 724 больные РЭ+ HER2— диссеминированным РМЖ с прогрессированием после нестероидных ингибиторов ароматазы (летрозола или анастрозола) и получавших >3 линий лекарственного лечения в половине случаев. Группы были хорошо сбалансированы по основным клиническим характеристикам, при этом в 75% случаев у больных до начала лечения были зарегистрированы метастазы в кости. Рандомизация проводилась на две группы в соотношении 2:1 в пользу группы, в которой больные получали эверолимус в дозе 10 мг/сутки. Больным назначался либо экземестан в стандартной дозировке + плацебо, либо экземестан + эверолимус. В результате был получен прямой противоопухолевый эффект эверолимуса (таргетного препарата с инновационным механизмом действия, направленным на преодоление резистентности), который заключался в достоверном увеличении частоты объективного ответа, контроля над болезнью и выживаемости без прогрессирования. Медиана выживаемости без прогрессирования, по данным оценки исследователей, в группе экземестан + эверолимус составила 6,9 месяца по сравнению с 2,8 месяца в группе монотерапии экземестаном, тогда как, по данным централизованного пересмотра, — 10,6 месяца против 4,1 месяца соответственно.
Влияние эверолимуса на общую выживаемость пока не определено.
Различия в побочных эффектах III—IV степени этих двух программ в основном были обусловлены умеренной, характерной для эверолимуса токсичностью (стоматитом, анемией, одышкой, гипергликемией, слабостью и пневмонитом 0
В настоящей статье представлены клинические случаи победителей конкурса, который проводился Обществом онкологов-химиотерапевтов. Наградой является поездка на конгресс ESMO в Вену.
Больной ГОВ, 52 года, впервые обратился в НМИЦ онкологии им. Н.Н. Петрова в июле 2005 г. Из анамнеза: 02.09.2005 г. в Санкт-Петербурге по поводу опухоли правой почки (размерами до 12×13 см) выполнена правосторонняя нефрэктомия. Гистологическое заключение – светлоклеточный почечноклеточный рак. По данным дополнительного обследования выявлены множественные метастазы в легких (до 15 мм в диаметре), костях таза, позвонках, правой плечевой кости.
С октября 2005 г. начата первая линия лекарственного лечения интерфероном (по 9 МЕ 3 раза в неделю, внутримышечно) в сочетании с бисфосфонатами, достигнута стабилизация. С сентября 2006 г. выявлено прогрессирование болезни в виде увеличения размеров и количества метастазов в легких. Завершена иммунотерапия интерфероном, начата вторая линия лечения антиэстрогенами в высокой дозе (тамоксифен 120 мг/сут, внутрь). В течение 2 лет (до ноября 2008 г.) сохранялась стабилизация метастатического процесса. По поводу очередного прогрессирования метастазов в легких начата третья линия лекарственного лечения: таргетная терапия сорафенибом (800 мг/сут, внутрь). В марте 2009 г. зарегистрирован частичный регресс в виде уменьшения размеров и количества метастазов в легких, сохранявшийся до августа 2010 г.
По данным КТ органов грудной клетки (от 18.08.2010 г.) – очередное прогрессирование процесса в виде увеличения количества метастазов в легких, появления метастазов в лимфатических узлах средостения. Больному назначена четвертая линия лекарственной терапии эверолимусом (по 10 мг/сут, внутрь). Начал прием препарата с октября 2010 г. В ноябре 2010 г. после незначительной физической нагрузки произошел патологический перелом правой плечевой кости в средней трети, по поводу которого в РНИИТО им. Р.Р. Вредена в феврале 2011 г. выполнена операция остеосинтеза с практически полным восстановлением функции конечности. По поводу метастаза в теле 4-го поясничного позвонка в сентябре 2011 г. произведена пункционная чрезкожная вертебропластика костным цементом.
На момент последнего осмотра в мае 2012 г. больной продолжает прием эверолимуса в прежней дозе, общая продолжительность приема составляет 19 месяцев. Клинически значимых осложнений не отмечено, перерывов в лечении не было. По данным обследования (май 2012 г.) сохраняется стабилизация метастатического процесса в легких. Обращает внимание хорошее качество жизни больного (работоспособен, физически активен, полностью социально адаптирован). Планируется продолжение непрерывного приема эверолимуса (до возникновения серьезных осложнений или исчерпания эффекта лечения).
Пациентка Х., 44 лет, наблюдается в Онкологическом Центре MD Anderson, Хьюстон, США. В сентябре 2010 г. был диагностирован рак левой молочной железы, T1N2MX. Через месяц была выполнена резекция левой молочной железы с подмышечной лимфаденэктомией. При гистологическом исследовании – инфильтративный протоковый рак 3 степени злокачественности с метастазами в 4 л/лимфатических узлах. При иммуногистохимическом исследовании: ER 90%, PR-, Her2neu-, Ki67 48%. При дополнительном исследовании в MD Anderson были выявлены метастазы в кости. Пациентку беспокоили периодические умеренные боли в спине. В декабре 2010 г. начат прием тамоксифена, инъекции золедроновой кислоты, выполнена овариоэктомия. В мае 2011 г. выявлен новый литический очаг в ключице с патологическим переломом, однако продолжена терапия тамоксифеном.
В июне 2011 г. появились боли в грудном отделе позвоночника. При обследовании обнаружены новые литические очаги в ребрах, грудном отделе позвоночника. Был назначен летрозол, продолжены введения золедроновой кислоты. В августе 2011 г. пациентка отметила усиление болей в спине и ребрах. При обследовании выявлен новый очаг в правой вертлужной впадине. Продолжен прием летрозола, назначены обезболивающие препараты. В сентябре 2011 г. отмечено усиление болей, по поводу чего назначены наркотические аналгетики.
В октябре 2011 г. было зафиксировано прогрессирование заболевания (появление новых очагов в подвздошных костях). Боли перестали купироваться наркотическими аналгетиками. Была проведена лучевая терапия на Th12-L5 позвонки, где локализовался наиболее выраженный болевой синдром. 20.10.11 г. больная была переведена на лечение по схеме эверолимус 10 мг/сут. в сочетании с анастрозолом 1 мг/сут. На момент начала данной схемы у пациентки имелись множественные метастазы в позвоночник, кости таза, левую ключицу и отдельные ребра (рис. 1). После 3 недель приема отмечено значительное уменьшение болевого синдрома до 1 степени.
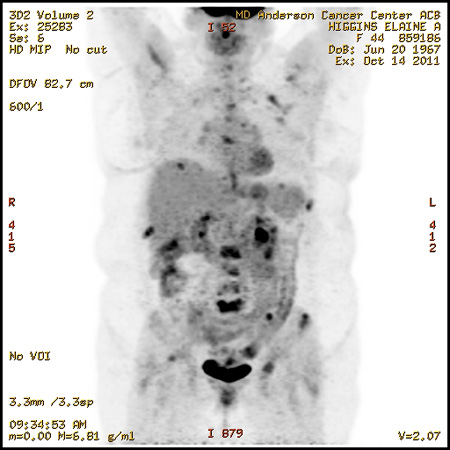
Рисунок 1. Исследование ПЭТ-КТ от 14.10.11 г.
Множественные метастазы во всех отделах позвоночника, костях таза, ребрах, левой ключице.
При контрольном обследовании в январе 2012 г. по данным ПЭТ был отмечен полный метаболический ответ метастатического процесса в костях (рис. 2). К этому времени полностью купировался болевой синдром. Лечение характеризовалось хорошей переносимостью, отмечалось лишь развитие кожной сыпи 1 ст. Пациентка продолжила лечение по схеме анастрозол в сочетании с эверолимусом. При повторных обследованиях в марте и в июне 2012 г. сохранялась полная регрессия метастатического процесса в костях.
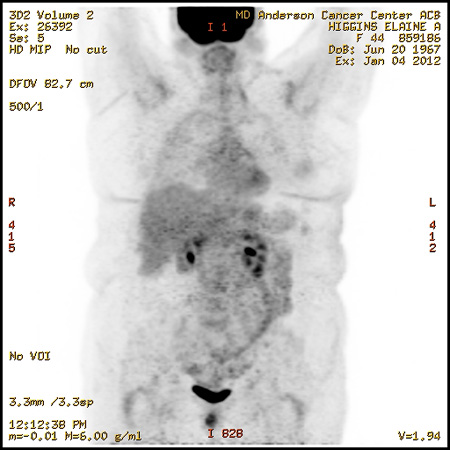
Рисунок 2. Исследование ПЭТ-КТ от 4.01.12 г.
Без признаков метастатического поражения костей.
Данный случай демонстрирует возможность достижения быстрого выраженного ответа при сочетании эверолимуса с ингибиторами ароматазы у пациентки, ранее получившей ингибиторы ароматазы. Введение в клиническую практику эверолимуса позволило существенно расширить возможности гормонотерапии метастатического рака молочной железы за счет появления данной малотоксичной, амбулаторной, пероральной комбинации.
И.С. Шумская, О.В. Исаченкова
Нижегородская государственная медицинская академия, Нижний Новгород
В иностранной литературе содержится информация о возможном восстановлении чувствительности опухоли к ингибиторам тирозинкиназ после терапии ингибиторами mTOR. Представленный клинический случай продемонстрировал справедливость этих данным. Пациент, 49 лет, наблюдается в онкологическом диспансере с сентября 2010 года с диагнозом: рак левой почки T3N×M1, метастазы в легкие, мягкие ткани боковой поверхности брюшной стенки слева.
Из анамнеза: в сентябре 2009 года выполнена нефрэктомия по поводу рака левой почки. Гистологическое исследование: светлоклочный ПКР, с глубоким инфильтративным ростом через стенку лоханки в паранефральную клетчатку. На фоне терапии интерфероном альфа в течение 3 месяцев отмечен рост образований на брюшной стенке. В сентябре 2010 г. по данным КТ органов грудной клетки – метастатическое поражение бронхопульмональных лимфатических узлов, легких, отрицательная динамика.
С сентября 2010 г. начата терапия сунитинибом в дозе 50 мг 4 недели с перерывом в 2 недели. На фоне лечения сунитинибом отмечен частичный регресс метастазов в легких, уменьшение размера мягкотканых образований на брюшной стенке. Лечение сунитинибом проводилось в течение 11 месяцев. В сентябре 2011 по данным УЗИ органов брюшной полости отмечается рост мягкотканых очагов в области послеоперационного рубца, отрицательная динамика по данным КТ грудной клетки в виде увеличения размеров и количества метастатических очагов.
В связи с прогрессированием был назначен эверолимус в дозе 10 мг ежедневно. На фоне лечения зарегистрированы следующие побочные эффекты: через месяц после начала приема препарата впервые был выявлен диабет 2 типа инсулинозависимый, плохо контролируемый сочетанием инсулина и пероральных сахароснижающих препаратов; стоматит 2 степени, появившийся еще на фоне приема сунитиниба; через два месяца после приема препарата появилась нарастающая одышка в покое, кашель. По данным КТ грудной клетки от ноября 2011 размеры и количество метастатических очагов в легких не изменились, однако появились явления лимфангоита. Данное состояние не позволяло исключить медикаментозный пульмонит, в связи с чем была продолжена терапия эверолимусом в дозе 5 мг на фоне глюкокортикостероидов. В результате этого лечения было достигнуто некоторое субъективное улучшение – уменьшилась одышка. Однако после 3 месяцев приема препарата выявлен рост мягкотканых очагов в области послеоперационного рубца, увеличение метастазов в легких по данным КТ грудной клетки. Эверолимус был отменен. После отмены препарата нормализовались показатели глюкозы, в настоящее время никакой сахароснижающей терапии больной не получает.
В связи с прогрессированием заболевания сделана попытка вернуться к терапии сунитинибом в дозе 50 мг. На фоне лечения отмечено значительное уменьшение одышки и уменьшение мягкотканых метастазов. По данным КТ грудной клетки на протяжении последних 8 месяцев наблюдается стабилизация процесса. Статус по шкале ECOG 2.
Читайте также:

