Если взаимодействие серебра с хлором
В таблице Менделеева нет такого элемента, как AgCl, или хлорид серебра. Он образуется при соединении хлора одновалентного (Cl) с серебром (Ag) такой же валентности.
Образующий соединение хлор (Cl) является галогеном и выступает активным окисляющим веществом, встретить его в природе отдельно большая редкость. Ag является благородным металлом, чистое серебро химически инертно и потому практически не участвует в каких-либо реакциях. Может существовать в форме слитков, самородков, серебряных жил и россыпей.
Серебро в несколько раз более активно, нежели хлор, и для того чтобы образовался хлорид серебра, следует провести операцию, где серебросодержащая соль будет взаимодействовать с хлоридами. К примеру, взаимодействующими элементами могут быть нитрат серебра и хлорид натрия.

Взаимодействие этих веществ осуществляется в ходе реакции замещения, итогом которой является образование белого осадка. Полученное соединение не отличается стойкостью. Попадая под солнечные лучи, осадок темнеет, выделяются молекулы серебра, вступающие в реакцию с молекулами серы в атмосфере. Именно по этой причине темнеют все серебряные изделия.
Особенности
Хлорид серебра имеет кристаллическую структуру. Форма кристаллов кубическая. Расположенный в центре атом соединяется с другими атомами и образует октаэдр. AgCl имеет следующие химические особенности:
- его молярная масса составляет всего 143,32 г/моль;
- плотность соединения — 5,56 г/см3;
- кипит при температуре от 455 градусов;
- плавится при температуре от 1547 градусов;
- при кипении и плавлении не разлагается;
- является неорганическим бинарным соединением хлора и серебра; известен как серебряная соль хлороводородной кислоты.

Работа с хлоридом серебра
Физические свойства хлористого серебра таковы:
- цвет соединения белый, элемент и вовсе может не иметь цвета;
- соединение представлено в виде кристаллов;
- природный аналог химического соединения — минерал, известный как хлораргирит;
- плохо растворяется в воде, если температура ее равняется либо не достигает 25 градусов;
- неплохо взаимодействует с растворами аммиака, роданида, пиридина, цианидов, тиосульфатов щелочных металлов, растворяясь в них;
- никак не реагирует на метиловый и этиловый спирты, ацетон.

Полученное серебро из хлорида серебра
Применение
AgCl обладает повышенной чувствительностью к свету. Это его свойство используется при изготовлении фотографических эмульсий. Соединение применяется в процессе производства хлор-серебряно-цинковых батарей, а также как покрытие для радаров.
Хлорид серебра входит в состав веществ, из которых изготавливают электропроводящие стекла и линзы для спектрометров. При производстве электродов химических источников тока также используют AgCl. Пытаясь получить рассматриваемое соединение в домашних условиях, действовать следует осторожно. Попав на кожу, вещество может вызвать раздражение.
Если подружить благородный металл серебро и соляную кислоту, получится хлорид серебра — бесцветные кристаллы или белая соль, способная плавиться при температуре 455° С и кипеть без разложения при 1554° С. Популярность пришла на заре развития фотографии. Способность изменять цвет завораживала. Но помимо светочувствительности, соединение хлора с серебром несет в себе много других замечательных свойств.
И целой страны мало
Серебро по латыни аргентум, поэтому обозначено в химии Ag. В честь него названа целая страна Аргентина, хотя рудники и добыча ведется по всему миру не одно тысячелетие. Есть стойкое убеждение, что запасов его гораздо меньше, чем золота, и придет время, когда их положение в иерархии драгоценностей поменяется. Время покажет, оправданы такие ожидания или нет.
А пока серебро широко используется не только ювелирами. Оно, как в чистом виде, так и в соединениях, широко используется в промышленности и в технике.
Оно более активно, чем золото. Чтобы получить его хлорид, запускают взаимодействие растворимых серебросодержащих солей, обычно — нитрата серебра, с хлоридами, той же поваренной солью. В результате реакции замещения происходит выпадение осадка белого цвета. Соединение нестойкое, через некоторое время под воздействием света темнеет, потому что происходит выделение молекул чистого аргентума, которые соединяются с молекулами серы.
Сероводород всегда присутствует в атмосфере, вот почему серебряные вещи тускнеют и покрываются патиной. Соль, меняющая цвет, подтолкнула к идее фотографического изображения.
Вещество одно, свойств много
У хлорида серебра кристаллическая структура кубического вида, где центральный атом образует с соседями октаэдр, почти такой же, как у поваренной соли NaCl (хлорид натрия). Но в отличие от последней, плохо растворим в воде. При 25° C произведение растворимости составляет всего 1,77•10−10. Показатели растворимости AgCl в минеральных маслах нулевые. Он не растворяется в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Зато растворим в водных растворах аммиака и в жидком аммиаке.

Модель молекулы аммиака
Аммиак — активное соединение водорода и азота, при его окислении образуются кислоты азота, которые легко увлекают металлы, создавая с ними соли, относящиеся к азотнокислым. В частности, нитрат серебра (формула AgNO3) — кристаллическое вещество, используемое для гальванического серебрения, в производстве зеркал, в медицине (ляпис) и для получения других соединений серебра, в том числе хлорида.
Светочувствительность AgCl, когда цвет меняется на глазах, быстро нашла применение в фотографии, но развитие химии показало, что бромид серебра обладает лучшими свойствами менять цвет под воздействием света.
Тем не менее, AgCl нашел себя в других областях человеческой деятельности. В первую очередь, в медицине и косметике, ведь антибактерицидные свойства серебра известны давно. Вода, в которую опустили серебряный крестик, не портится и не зацветает, становится святой.
И для людей, и для науки
Любое полезное свойство быстро находит применение. Препараты, в основе которых хлорид серебра, встречаются:
- среди мазей и гелей для борьбы с угревой сыпью у молодежи;
- в гомеопатии как материал с антибактериальными свойствами;
- в производстве лекарственных препараторов, в частности такого знаменитого, как Silargetten — главного средства борьбы с заражениями и сепсисом в эпоху до пенициллина.
В промышленности используется не менее широко:
- для компонентов фотоэмульсий и различных фотографических материалов;
- при изготовления электродов химических источников тока;
- для компонента электропроводящих стекол;
- в качестве материала для линз в ИК-спектроскопии;
- в виде промежуточного продукта при извлечении его из сульфидной руды;
- в качестве реагента для сереброорганических соединений.
AgCl большей частью производится лабораторным способом, но его можно встретить и в природе в виде минерала хлораргирита.
При работе всегда есть опасность раздражения на коже и на слизистых оболочках с последующими осложнениями.
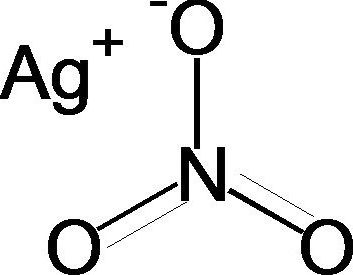
Хлорид серебра, характеристика, свойства и получение, химические реакции.










Хлорид серебра – неорганическое вещество, имеет химическую формулу AgCl.
Краткая характеристика хлорида серебра:
Химическая формула хлорида серебра AgCl.
Хлорид серебра – неорганическое химическое соединение, соль хлороводородной (соляной) кислоты и серебра, бинарное соединение серебра и хлора.
Практически не растворяется в воде, ацетоне, этаноле, метаноле.
Кристаллогидратов не образует.
В расплавленном виде хорошо пристает к стеклу , кварцу и металлам .
Хлорид серебра встречается в природе в виде минерала хлораргирита.
Физические свойства хлорида серебра:
| Наименование параметра: | Значение: |
| Химическая формула | AgCl |
| Синонимы и названия иностранном языке | silver chloride (англ.) |
серебро хлористое (рус.)
Получение хлорида серебра:
Хлорид серебра получают в результате следующих химических реакций:
- 1. взаимодействия нитрата серебра и хлорида калия:
В ходе реакции используется разбавленный раствор хлорида калия.
- 2. взаимодействия нитрата серебра и хлорида натрия:
В ходе реакции используется разбавленный раствор хлорида натрия.
- 3. взаимодействия нитрата серебра и хлорида кальция:
- 4. взаимодействия серебра и хлорида железа (III):
- 5. взаимодействия серебра и хлора:
2Ag + Cl2 → 2AgCl (t = 150-200 °C).
Химические свойства хлорида серебра. Химические реакции хлорида серебра:
Химические свойства хлорида серебра аналогичны свойствам хлоридов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия хлорида серебра и фтора:
В результате реакции образуются фторид серебра (II) и хлор.
2. реакция взаимодействия хлорида серебра и цинка :
2AgCl + Zn = ZnCl2 + 2Ag.
В результате реакции образуются хлорид цинка и серебро.
3. реакция взаимодействия хлорида серебра и оксида бария :
4AgCl + 2BaO → 2BaCl2 + 4Ag + O2 (t > 324°C).
В результате реакции образуются хлорид бария, серебро и кислород.
4. реакция взаимодействия хлорида серебра и гидроксида калия:
4AgCl + 4KOH → 4KCl + 4Ag + O2 + 2H2O (t > 450 °C).
В результате реакции образуются хлорид калия, серебро , кислород и вода .
5. реакция взаимодействия хлорида серебра и сульфида натрия:
В результате реакции образуются сульфид серебра (II) и хлорид натрия.
6. реакция взаимодействия хлорида серебра и йодида натрия:
AgCl + NaI ⇄ AgI + NaCl.
В результате реакции образуются йодид серебра и хлорид натрия. Реакция носит обратимый характер.
7. реакция взаимодействия хлорида серебра и карбоната натрия :
4AgCl + 2Na2CO3 → 4Ag + 4NaCl + 2CO2 + O2 (t = 850-900 °C).
В результате реакции образуются серебро , хлорид натрия, оксид углерода (IV) и кислород.
8. реакция взаимодействия хлорида серебра и нитрата бария:
В результате реакции образуются хлорид бария и нитрат серебра. Реакция протекает в растворе жидкого аммиака .
9. реакция взаимодействия хлорида серебра, пероксида водорода и гидроксида калия :
В результате реакции образуются хлорид калия, серебро , кислород и вода .
10. реакция разложения хлорида серебра:
В результате реакции образуются серебро и хлор . Реакция протекает при комнатной температуре под действием светового излучения.
Применение и использование хлорида серебра:
Хлорид серебра используется во множестве отраслей промышленности и для бытовых нужд:
– как светочувствительный компонент фотографических эмульсий различных фотографических материалов ;
– входит в состав антимикробных композиций на основе ионов серебра;
– в химической промышленности как реагент для получения сереброорганических соединений;
– как компонент электродов химических источников тока, электропроводящих стёкол;
– как материал для линз в ИК-спектроскопии.










хлорид серебра реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие хлорида серебра
реакции
- ← Октан, свойства, химические реакции
- Погода в Екатеринбурге на сегодня, текущая погода, прогноз на 5 дней →
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (105 878)
- Экономика Второй индустриализации России (101 427)
- Программа искусственного интеллекта ЭЛИС (22 572)
- Метан, получение, свойства, химические реакции (15 856)
- Мотор-колесо Дуюнова (15 073)
- Гидротаран – самодействующий энергонезависимый водяной насос (14 425)
- Природный газ, свойства, химический состав, добыча и применение (13 899)
- Крахмал, свойства, получение и применение (13 483)
- Прямоугольный треугольник, свойства, признаки и формулы (13 026)
- Целлюлоза, свойства, получение и применение (11 880)
- Пропилен (пропен), получение, свойства, химические реакции (11 619)
- Этилен (этен), получение, свойства, химические реакции (11 134)
- Бутан, получение, свойства, химические реакции (9 818)
- Оксид алюминия, свойства, получение, химические реакции (9 341)
- Оксид железа (III), свойства, получение, химические реакции (9 121)
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Хлорид серебра, характеристика, свойства и получение, химические реакции.
Хлорид серебра – неорганическое вещество, имеет химическую формулу AgCl.
Краткая характеристика хлорида серебра:
Химическая формула хлорида серебра AgCl.
Хлорид серебра – неорганическое химическое соединение, соль хлороводородной (соляной) кислоты и серебра, бинарное соединение серебра и хлора.
Практически не растворяется в воде, ацетоне, этаноле, метаноле.
Кристаллогидратов не образует.
В расплавленном виде хорошо пристает к стеклу , кварцу и металлам .
Хлорид серебра встречается в природе в виде минерала хлораргирита.
Физические свойства хлорида серебра:
| Наименование параметра: | Значение: |
| Химическая формула | AgCl |
| Синонимы и названия иностранном языке | silver chloride (англ.) |
серебро хлористое (рус.)
Получение хлорида серебра:
Хлорид серебра получают в результате следующих химических реакций:
- 1. взаимодействия нитрата серебра и хлорида калия:
В ходе реакции используется разбавленный раствор хлорида калия.
- 2. взаимодействия нитрата серебра и хлорида натрия:
В ходе реакции используется разбавленный раствор хлорида натрия.
- 3. взаимодействия нитрата серебра и хлорида кальция:
- 4. взаимодействия серебра и хлорида железа (III):
- 5. взаимодействия серебра и хлора:
2Ag + Cl2 → 2AgCl (t = 150-200 °C).
Химические свойства хлорида серебра. Химические реакции хлорида серебра:
Химические свойства хлорида серебра аналогичны свойствам хлоридов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия хлорида серебра и фтора:
В результате реакции образуются фторид серебра (II) и хлор.
2. реакция взаимодействия хлорида серебра и цинка :
2AgCl + Zn = ZnCl2 + 2Ag.
В результате реакции образуются хлорид цинка и серебро.
3. реакция взаимодействия хлорида серебра и оксида бария :
4AgCl + 2BaO → 2BaCl2 + 4Ag + O2 (t > 324°C).
В результате реакции образуются хлорид бария, серебро и кислород.
4. реакция взаимодействия хлорида серебра и гидроксида калия:
4AgCl + 4KOH → 4KCl + 4Ag + O2 + 2H2O (t > 450 °C).
В результате реакции образуются хлорид калия, серебро , кислород и вода .
5. реакция взаимодействия хлорида серебра и сульфида натрия:
В результате реакции образуются сульфид серебра (II) и хлорид натрия.
6. реакция взаимодействия хлорида серебра и йодида натрия:
AgCl + NaI ⇄ AgI + NaCl.
В результате реакции образуются йодид серебра и хлорид натрия. Реакция носит обратимый характер.
7. реакция взаимодействия хлорида серебра и карбоната натрия :
4AgCl + 2Na2CO3 → 4Ag + 4NaCl + 2CO2 + O2 (t = 850-900 °C).
В результате реакции образуются серебро , хлорид натрия, оксид углерода (IV) и кислород.
8. реакция взаимодействия хлорида серебра и нитрата бария:
В результате реакции образуются хлорид бария и нитрат серебра. Реакция протекает в растворе жидкого аммиака .
9. реакция взаимодействия хлорида серебра, пероксида водорода и гидроксида калия :
В результате реакции образуются хлорид калия, серебро , кислород и вода .
10. реакция разложения хлорида серебра:
В результате реакции образуются серебро и хлор . Реакция протекает при комнатной температуре под действием светового излучения.
Применение и использование хлорида серебра:
Хлорид серебра используется во множестве отраслей промышленности и для бытовых нужд:
– как светочувствительный компонент фотографических эмульсий различных фотографических материалов ;
– входит в состав антимикробных композиций на основе ионов серебра;
– в химической промышленности как реагент для получения сереброорганических соединений;
– как компонент электродов химических источников тока, электропроводящих стёкол;
– как материал для линз в ИК-спектроскопии.




хлорид серебра реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие хлорида серебра
реакции
Рассмотрим значение серебра, хлорид которого знаком даже школьникам, изучающим химию. Для начала дадим краткую характеристику самого металла, чтобы понять способы получения его соединений.
Страницы истории
Характеристика свойств
Серебро обладает высокой коррозионной стойкостью, эстетичным внешним видом. На протяжении длительного времени этот металл использовали в качестве торгового эквивалента. Кроме того, из серебра изготавливали посуду, украшения.

Особенности производства
Данный металл считается самым распространенным в земной коре металлом платиновой группы элементов. Несмотря на достаточно высокую его концентрацию в морской воде, этот способ выделения серебра считается нецелесообразным, поэтому практически не используется. Среди основных минералов, которые имеют экономическое значение, выделим кераргирит AgCl (серебра хлорид), аргентит Ag2S (сульфид), бромирит AgBr (бромид), йодирит AgI (иодид).
Данный металл в существенных количествах находится в медных, золотых, цинковых, свинцовых рудах. Среди ранних разработок масштабных месторождений серебра выделим Восточную часть Малой Азии. Есть достоверные сведения об использовании этого драгоценного металла в ювелирном деле в третьем тысячелетии до нашей эры. Обработка серебряной руды проводилась по определенному алгоритму. Сначала ее измельчали, смешивали хлорид натрия, хлорид серебра. Затем добавляли к смеси обожженные железные и медные сульфиды, небольшое количество ртути. Готовая масса утаптывалась на протяжении нескольких дней мулами. В конечном итоге происходил процесс восстановления серебра, а также его амальгирование. Все это собирали, выпаривали, готовые слитки применяли для различных целей.
В начале девятнадцатого века для получения чистого металла серебра хлорид подвергали электролизу. В итоге на катоде выделялось серебро, на аноде получали газообразный хлор. По мере развития металлургической отрасли были найдены новые способы выплавки благородного металла.
Применение в ювелирном деле
Раствор хлорида серебра, подвергнутый электролизу, позволяет получать чистый металл. Учитывая, что серебро является пластичным и мягким веществом, оно без особых проблем поддается обработке, но не имеет достаточной твердости. Для устранения этой проблемы ювелиры используют не чистый металл, а его сплавы с медью. Для получения несложных изделий они используют отливку и плавку в специальные литейные формы. Этот процесс применялся еще в Киевской Руси.

Серебряные изделия часто покрывают эмалью, что придает украшениям изысканный вид.
Применение в технике и науке
Из-за отличных гигиенических свойств, повышенной устойчивости к действию кислот этого вещества медики предположили, что серебро можно вводить в человеческий организм, не опасаясь, что оно будет негативно воздействовать на него. В настоящее время тонкие серебряные пластины применяют при трепанации черепа, с помощью серебряных проволочек предотвращают смещение ломаных костей. Амальгама серебра востребована в зубоврачебной практике в качестве пломбировочного материала.

Химические свойства и биологическая активность
Серебра хлорид, получаемый при взаимодействии солей металла с соляной кислотой, является качественной реакцией на катион Ag+. Многочисленные лабораторные исследования, проводимые в крупных научных центрах, подтвердили уникальные характеристики коллоидного серебра. Оно способно уничтожать многочисленные болезнетворные бактерии, поэтому является оптимальным фильтрующим веществом для питьевой воды.
Элементы металла, содержащиеся в коллоидном растворе, препятствуют слипанию частиц, поэтому помогают излечивать гнойные болезни глаз. Вода, которую настояли на порошкообразном серебре, практически лишена болезнетворных микроорганизмов.
Поиск золота и самородков
- ПОИСК САМОРОДКОВ
- Особенности золота
- Образование месторождений
- Месторождения золота
- Золотоносность кварца
- Основы геологии россыпей
- Выбор места для поиска
- Признаки месторождений
- Методы поиска
- ВСЕ О ЗОЛОТЕ
- История золота
- Свойства золота
- Золото в природе
- Золото в морской воде
- Извлечение золота
- Химия золота
- Коллоидное золото
- Изотопы золота
- Разные статьи про золото
- Новости мира золота
- Благодарности
- Контакты
- Карта сайта
По своей химической активности серебро занимает промежуточное положение между золотом и медью. С кислородом серебро непосредственно не соединяется, но в расплавленном состоянии растворяет около 20 объемов кислорода на один объем металла. В твердом серебре растворимость кислорода мала, поэтому при затвердевании расплавленного серебра происходит выделение растворенного в нем кислорода, сопровождающееся иногда разбрызгиванием металла.
С водородом, азотом и углеродом серебро непосредственно не взаимодействует. Фосфор действует на серебро лишь при температуре красного каления с образованием фосфидов. При нагревании с серой серебро легко образует сульфид Ag2S. Это же соединение получается при действии на серебро газообразной серы, выделяющейся при термической диссоциации некоторых сульфидов (пирита, пирротина, халькопирита), и при нагреве металла в контакте с этими сульфидами.
При воздействии сероводорода поверхность серебра покрывается черной пленкой Ag2S. Процесс медленно идет уже в обычных условиях и является причиной постепенного потемнения серебянных изделий. Серебро взаимодействует также со свободными хлором, бромом и иодом с образованием соответствующих галогенидов. Эти процессы медленно протекают, даже при обычных температурах и ускоряются в присутствии влаги, при нагревании и под действием света.
Электродный потенциал серебра в водных растворах высок
Ag =>Ag + + e, E0 = + 0,799В.
Поэтому, как и золото, серебро не вытесняет водород из водных растворов кислот, устойчиво по отношению к щелочам. Однако в отличие от золота оно растворяется в кислотах, являющихся достаточно сильными окислителями, например, в азотной и концентрированной серной.
Подобно золоту, серебро легко взаимодействует с царской водкой и насыщенной хлором соляной кислотой, но при этом оно остается в нерастворимом остатке вследствие образования малорастворимого хлорида AgCl. Такие различия в поведении золота и серебра часто используют для разделения этих металлов.
Тонкодисперсное серебро в контакте с кислородом воздуха растворяется в разбавленной серной кислоте. Подобно золоту, серебро растворяется также в насыщенных воздухом водных растворах цианидов щелочных и щелочноземельных металлов, в водном растворе тиомочевины в присутствии солей железа (III).
В подавляющем большинстве своих соединений серебро имеет степень окисления (+1). Соединения с более высокой степенью окисления серебра (+2 и +3) сравнительно малочисленны и практического значения не имеют.
Оксид серебра Ag2O черно-коричневого цвета может быть получен введением щелочи в раствор, содержащий ионы Ag + . Вначале, по-видимому, образуется гидроксид, тотчас переходящий в оксид:
Хотя оксид серебра — малорастворимое в воде соединение, его водная суспензия имеет четко выраженную основную реакцию, поэтому соли серебра в водных растворах не гидролизуются и дают нейтральную реакцию. При нагревании до 185 - 190 °С Ag2O разлагается на элементы. Перекись водорода легко восстанавливается Ag2O уже при комнатной температуре:
В водном растворе аммиака Ag2O растворяется с образованием комплексного соединения:
При стоянии из раствора осаждается чрезвычайно взрывчатый даже во влажном состоянии осадок нитрида серебра Ag3N (гремучее серебро).
Галогениды серебра - малорастворимые соединения. Исключение составляет лишь легкорастворимый фторид AgF. Хлорид AgCl, бромид AgBr и иодид Agl выпадают в осадок при введении в раствор, содержащий ионы Ag + (например, раствор AgNO3), ионов Cl, Вr и I. Их произведения растворимости составляют соответственно 1,8-10 -10 (AgCl), 5,3-10 -13 (AgBr) и 8,310 -17 (Agl).
В гидрометаллургии и аффинаже благородных металлов широко используют прием осаждения серебра в виде хлорида, осуществляемый введением в серебросодержащие растворы NaCl или НСl. Хлорид серебра плавится при 455°С. Температура кипения AgCl 1550°С, но заметное улетучивание наблюдается уже при температуре выше 1000°С.
Ионы серебра образуют прочные комплексы с целым рядом ионов и молекул (CN-, S2O3 - , SO3 2- , Сl - , NH3, CS(NH2)2 и т.д.). Благодаря этому практически нерастворимый в воде AgCl легко растворяется в водных растворах цианистого калия, тиосульфата и сульфита натрия, аммиака, например:
AgCl + 2CN - = Ag (CN)2 + Сl -
Вследствие образования комплексов с ионами Сl- хлорид серебра заметно растворим также в концентрированных соляной кислоте и растворах других хлоридов:
Например, в концентрированном растворе NaCl растворимость хлорида серебра составляет 6,7-10 -3 моль/л (0,72 г/л Ag) против 1,3-10 -5 в воде. Концентрированные растворы NaCl использовали ранее для выщелачивания серебра из огарков хлорирующего обжига.
Таким образом при введении хлор-ионов в серебросодержащие растворы концентрация серебра вначале падает (образование AgCl), а затем начинает возрастать (в результате комплексообразования). Поэтому для достижения полноты осаждения серебра следует избегать большого избытка ионов хлора.
Электроотрицательными металлами (цинком, железом) хлорид серебра, взятый в виде суспензии в разбавленной серной кислоте, легко восстанавливается до металла. Этот простой прием получения металлического серебра из его хлорида широко применяют в аффинажном производстве.
Бромид серебра AgBr похож по своим свойствам на AgCl. Он растворим в аммиачных, тиосульфатных, сульфитных и цианистых растворах, легко восстанавливается до металла.
Иодид серебра AgI — наименее растворимый из галогенидов серебра, поэтому в отличие от AgCl и AgBr он не растворим в аммиачных растворах, но растворим в присутствии ионов CN - и S2O3 - , с которыми серебро образует более прочные, нежели с аммиаком, комплексы. Заметной растворимостью AgI обладает также в концентрированных растворах иодидов щелочных металлов, что объясняется образованием комплексных ионов AgI 2- .
Весьма характерной и важной особенностью труднорастворимых галогенидов серебра является их светочувствительность, заключающаяся в том, что под действием света они разлагаются на металлическое серебро и свободный галоид:
Это свойство галоидных солей серебра лежит в основе их применения для производства фотоматериалов - веточувствительных пленок, пластинок и бумаги. Светочувствительность галоидов серебра возрастает в ряду AgI
К галогенидам серебра очень близок по своим свойствам цианид серебра AgCN. Он выпадает в виде белого осадка при добавлении к раствору, содержащему ионы Ag + , раствора цианида щелочного металла (без избытка). Подобно галогенидам серебра, AgCN практически нерастворим в воде (произведение растворимости 2.3-10 -16 ) и разбавленных кислотах, но растворим в аммиачных, тиосульфатных и цианистых растворах, вследствие образования соответствующих комплексных соединений. В отличие от галогенидов цианид серебра под действием света не разлагается.
Из других соединений серебра большое практическое значение имеют нитрат и сульфат серебра.
Нитрат серебра AgNO3 получают действием азотной кислоты на металлическое серебро:
Нитрат серебра представляет собой бесцветные негигроскопические кристаллы, плавящиеся при 208,5 °С ; при температуре выше 350 °С термически разлагается.
AgNO3 очень легко растворяется в воде. При 20 °С его растворимость составляет 222 г на 100 г воды, при 100°С она возрастает до 952 г на 100 г.
В присутствии органических веществ нитрат серебра чернеет вследствие частичного восстановления до металла.
Нитрат серебра - технически наиболее важное соединение этого металла. Эта соль служит исходным продуктом для приготовления остальных соединений серебра. Водный раствор AgNO3 используют в качестве электролита при электролитическом рафинировании серебра.
Сульфат серебра Ag2SO4 может быть получен растворением металлического серебра в горячей концентрированной серной кислоте:
2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2O
Сульфат серебра образует бесцветные кристаллы, плавящиеся при 660 °С. При температуре выше 1000 °С термически разлагается. Растворимость Ag2SO4 в воде невелика, при 25 °С она составляет 0,80 г на 100 г воды. В концентрированной серной кислоте растворимость значительно выше вследствие образования более растворимого бисульфата AgHSO4.
Сульфид серебра Ag2S — наиболее трудно растворимая соль этого металла (произведение растворимости 6.3x10 -50 ). Он выпадает в виде черного осадка при пропускании сероводорода через растворы солей серебра. Образование Ag2S происходит также при действии H2S на металлическое серебро в присутствии влаги и кислорода воздуха:
Как было отмечено, этот процесс является причиной потемнения серебряных изделий при длительном хранении. Сульфид серебра можно получить также непосредственно из элементов, нагревая металлическое серебро с элементарной серой.
В цианистых растворах Ag2S растворяется в результате образования комплексного соединения:
Ag2S + 4CN- = 2Ag (CN) 2- + S 2-
Эта реакция обратима, протеканию ее слева направо способствует повышение концентрации иновов CN - и удаление ионов S2- окислением их кислородом продуваемого воздуха.
С разбавленными минеральными кислотами Ag2S не взаимодействует. Концентрированная серная и азотная кислота окисляют сульфид серебра до сульфата. При нагревании в атмосфере воздуха Ag2S разлагается с образованием металлического серебра и диоксида серы:
Из ранее упоминавшихся комплексных соединений серебра наибольший интерес для гидрометаллургии этого металла представляют хорошо растворимые комплексные цианистые соединения калия, натрия и кальция. Подобно аналогичным соединениям золота, комплексные цианиды серебра образуются при растворении металлического серебра в растворе соответствующего цианида при доступе кислорода воздуха:
4Ag + 8CN - + O2 + 2Н2O = 4Ag(CN)2 + 4OН -
Эта реакция, как и аналогичная реакция с золотом, лежит в основе процесса цианирования.
Как и золото, серебро растворяется в водных растворах тиомочевины в присутствии солей Fe(III), образуя комплексные катионы Ag[CS (NH2)2]2 + .
Читайте также:

