Если опухоль вросла в аорту
Реферат. Лечение забрюшинных опухолей является трудной, многокомпонентной задачей для онкологов. Удаление опухоли с соблюдением онкологических принципов футлярности и зональности части приводит к образованию обширных дефектов на магистральных сосудах. Широкое внедрение новейших методов пластической сосудистой хирургии позволило значительно повысить процент сохранных операций и улучшить качество жизни многих пациентов. Проведен анализ результатов комбинированного лечения у 58 пациентов с местно-распространенными саркомами мягких тканей с инвазией в магистральные сосуды. Использованы реконструктивные хирургические вмешательства на магистральных сосудах при радикальном удалении опухолей, а также первый опыт в протезирования брюшной части аорты. Представленный анализ результатов, показывает что соблюдение онкологических принципов хирургического вмешательства с резекцией магистральных сосудов, пораженных опухолью, использование сосудистой реконструкции позволяет увеличить число органосохранных операций при саркомах и других опухолях опорно-двигательного аппарата и шеи, улучшает качество жизни больных.
Ключевые слова: забрюшинные опухоли, магистральные сосуды, реконструктивная хирургия.
Вовлечение в опухолевый инфильтрат магистральных сосудов, в том числе брюшного отдела аорты, традиционно считается одним из противопоказаний к радикальному хирургическому лечению при злокачественных опухолях брюшной полости и забрюшинного пространства. Такие поражения считаются неоперабельными из-за технических сложностей вмешательства и сомнений в его радикализме. Тем не менее в довольно редких публикациях, посвященных этой проблеме, продолжительность и качество жизни пациентов после комбинированных операций с протезированием аорты при некоторых заболеваниях оказываются вполне удовлетворительными [1].
Удаление забрюшинной опухоли больших размеров, нередко на фоне затрудненного кровотока по нижней полой вене и наличия множественных венозных коллатералей, сопровождается массивной кровопотерей и требует высокой квалификации хирургической, анестезиологической и реанимационной бригады, достаточной технической оснащенности. При выполнении комбинированных вмешательств возможно вскрытие просвета тонкой или толстой кишки и инфицирование брюшной полости в зоне протеза и т.д.
Первые попытки моноблочного удаления опухоли и участка сосудистой магистрали с последующим восстановлением целостности сосуда были предприняты Г.Л. Ратнером (1961) и E.S. Crawford et al. (1956). Однако с тех пор за полувековой период опубликованы лишь немногочисленные работы, касающиеся реконструкции МСЖ при хирургическом лечении опухолей органов живота. Между тем широкое применение сосудистой хирургии в абдоминальной онкологии предполагает увеличение группы резек-табельных наблюдений, повышение радикальности операции, выполнение операций, определяющих качество жизни пациентов. Таким образом, назрела необходимость в реализации давно предложенной ангиоонкологической стратегии, разработке комбинированных ангиоонкологических операций на основе известных приемов и методов сосудистой техники и определение четких показаний к этим операциям.
До сих пор довольно большое число онкологических больных (70—80%) поступает в стационар с распространенным опухолевым процессом. При этом имеет место высокая частота сосудистой инвазии. Несмотря на вышеизложенное, на сей день нет единой точки зрения в хирургическом лечении местно-распространенного опухолевого процесса. Бытует мнение, что разумным решением при данном поражении является отказ от попытки удаления опухоли либо выполнение циторедуктивных и паллиативных вмешательств. В то же время именно местно-распространенный опухолевый процесс с вовлечением магистральных сосудов наглядно отражает острую необходимость в объединении усилий онкологов и ангиохирургов.
Литературные данные последних лет свидетельствуют не только о росте онкологических заболеваний, но и о заметном увеличении числа неоперабельных больных с данной патологией (Илюхин Ю.А., 1998; Тарасов В.А. и др., 2000; Heda К. et al., 2001). Ключевым признаком неоперабельности опухоли считается вовлечение в опухолевой инфильтрат магистрального кровеносного сосуда. Несмотря на достижения современной сосудистой хирургии и позитивного опыта протезирования кровеносных сосудов у онкологических больных, отношение большинства хирургических клиник к возможностям радикального оперативного лечения больных этой категории в настоящее время представляется более чем сдержанным. Все еще высок процент отказа от радикальных операций в связи с опасностью повреждения сосудов или необходимостью вмешательств на них (Васютков В.Я., 1988; Дудицкая Т.К., 1994; Гробель О.В., 1999). При современном развитии ангиохирургии следует признать необоснованным частичное удаление новообразований с неизбежным сохранением опухолевых клеток в непосредственной близости от магистральных сосудов, поскольку это с высокой вероятностью сопровождается рецидивированием процесса и метастазами.
Впервые отдельные сообщения о произведенных реконструктивных вмешательствах на аорте и магистральных артериях при удалении новообразований различной локализации стали появляться с начала 50-х годов (Moore, 1952; Conley, 1953; Lord, Sehetlin, 1954; Lawrence, 1957). В отечественной литературе впервые такая операция была предпринята Г.Л. Ратне-ром в 1961 г., успешно выполнившим реконструкцию сосуда при удалении злокачественной опухоли мягких тканей бедра.
В последние годы сообщения о сосудистых реконструкциях в онкологической практике стали встречаться все чаще (Васютков В.Я., 1995; Зотов С.П., 1996, 1999; Соболевский В.А., 1999; Bianchi С. et al., 1999; Matsushita М. et al., 2001). Вместе с тем следует отметить, что в большинстве публикаций представлены лишь единичные наблюдения об успешно выполненных операциях, что свидетельствует только о принципиальной возможности сосудистой пластики у онкологических больных.
Такие важнейшие аспекты проблемы, как доопера-ционное определение степени вовлеченности сосуда в опухолевый процесс, выбор объема операции на сосудах и пластического материала в зависимости от локализации и морфологии опухоли, а также оценка результатов комбинированного лечения данного контингента пациентов и качества их жизни в разные периоды после операции представляют актуальную задачу не только для онкологии и сосудистой хирургии, но и для широкого круга специалистов разного профиля.
Указанные обстоятельства требуют широкопланового исследования на стыке двух специальностей: онкологии и сосудистой хирургии, и имеют не только медицинское, но и социальное значение.
Удобство использования готового пластического материала с необходимыми качествами и заложенной геометрией различных сосудов привело к широкому использованию синтетических имплантатов. Синтетические протезы изготавливаются из инертных полимеров. Они хорошо зарекомендовали себя при работе в крупных магистральных артериях.
Таким образом, когда возникает необходимость пластики дефектов аорты, это в подавляющем большинстве случаев выполняется с помощью синтетических протезов, поскольку они производятся серийно нескольких типов и размеров, функционировать могут десятилетия, однако общим основным недостатком для них является нестойкость к инфекции.
Таким образом, одной из нерешенных проблем сосудистой хирургии остается недостаточная эффективность современных методов профилактики осложнений протезирования сосудов в условиях инфицированной раны. Существование данной проблемы обусловлено тем, что использовать комбинированные протезы не всегда возможно из-за их отсутствия в экстренных ситуациях, аутовена может быть ранее удалена при флебэктомии или потребоваться в дальнейшем для АКШ или БПШ, или просто ее может быть недостаточно по площади для пластики большого дефекта. Все это побуждает к поиску новых материалов и способов их пластики, которые отвечали бы следующим требованиям: а) стойкость к инфекции; б) достаточные размеры для пластики больших дефектов; в) вызывающие минимальные иммунные реакции в организме (что наиболее легко достигается, если пластический материал является аутотканью).
При соблюдении этих требований трансплантат также должен быть мобильным, обладать достаточной эластичностью и прочностью, не подвергаться склерозированию, деформации и дилатации под действием давления крови в аорте.
Цель работы — улучшение показателей радикальных операций при удалении опухолей различной локализации путем усовершенствования хирургической тактики на магистральных сосудах.
Приводим наш опыт лечения больных с опухолями различных локализаций с инвазией магистральных сосудов. С 1995 по 2012 г. реконструктивные хирургические вмешательства на магистральных сосудах при радикальном удалении опухолей выполнено у 58 больных. Возраст больных — от 22 до 63 лет, мужчин 43, женщин 15. В дооперационном периоде больные обследованы на УЗИ, КТ, МРТ, УЗ-допплерографии, при необходимости проводилась ангиография. По данным этих исследований, у 41 больного до операции была инвазия сосудов. Изолированная пластика дефекта сегмента артерии выполнена у 38 больных, пластика дефекта вен — у 12, сочетанная пластика артерии и вены — у 8 больных. Показанием к выполнению реконструктивных вмешательств явилось прорастание опухоли или метастазов в стенку магистрального сосуда: в бедренную артерию (10), бедренную вену (3), наружную подвздошную артерию (8), наружную подвздошную вену (8), общую сонную артерию (8), бифуркацию сонной артерии (7), внутреннюю сонную артерию (3), плечевую артерию (10), подключичную вену (4), яремную вену (3). В 14 случаях было прорастание сонных артерий метастазами опухолей головы и шеи.

Клинический случай. В 2012 г. в абдоминальное отделение РКОД МЗ РТ поступила пациентка Ш., 56 лет, с диагнозом: опухоль забрюшинного пространства. При обследовании, по данным КТ, МРТ органов брюшной полости, выявлена опухоль забрюшинного пространства ниже почечных сосудов на уровне L3—L4 размерами 82x78 мм, охватывающая брюшную часть аорты.
При планировании хирургического вмешательства у пациентки с забрюшинной опухолью, расположенной вблизи аорты и, возможно, прорастающей в стенку, перед ведущими специалистами РКОД МЗ РТ стоял ряд вопросов: показано ли хирургическое лечение, существует ли техническая возможность удаления опухоли, насколько высок риск вмешательства, насколько соответствует степень риска ожидаемым ближайшим и отдаленным результатам, какова готовность хирургической, анестезиологической и реанимационной бригады к выполнению комбинированного, чреватого массивной кровопотерей вмешательства?
Учитывая современную оснащенность РКОД МЗ РТ и богатый опыт специалистов в лечении забрюшин-ных опухолей, решено было выполнить радикальное оперативное лечение.
Первым этапом во время операции выполнена ревизия органов брюшной полости, где была выявлена забрюшинная опухоль 8x7 см, располагающаяся на передней поверхности аорты и нижней полой вены (рис. 1). Верхний полюс располагался дистальнее впадения почечных вен, нижний полюс — проксимальнее устья нижней брыжеечной артерии.

Опухоль охватывала данные сосуды по передней и боковым поверхностям полуциркулярно, неподвижно. Для верификации диагноза интро-операционно была выполнена срочная гистология, результат — лейомиосаркома. Нижняя брыжеечная артерия перевязана и пересечена у устья. Аорта отделена от позвоночной фасции (рис. 2). Выполнено удаление опухоли с резекцией брюшной части аорты (рис. 3).



Соблюдение онкологических принципов хирургического вмешательства с резекцией магистральных сосудов, пораженных опухолью, использование сосудистой реконструкции позволяет увеличить
число органосохранных операций на магистральных сосудах при саркомах и других опухолях опорно-двигательного аппарата и шеи, улучшает качество жизни больных.
1. Babaian, R.J. Complications of transabdominal retroperito-neal lymphadenectomy / R.J. Babaian, R.B. Bracken, D.E. Johnson // Urology. — 1981. — Vol. 17. — P. 126—131.
2. Beck, S.D.W. Aortic replacement during post-chemotherapy retroperitoneal lymph node dissection / S.D.W. Beck, R.S. Foster, R. Bihle [et al.] // J. Urol. — 2001. — Vol. 165. — P. 1517—1520.
3. Bohner, H. Primary malignant tumors of the aorta: Clinical presentation, treatment, and course of different entities / H. Bohner, B. Luther, S. Braunstein [et al.] // J. Vasc. Surg. — 2003. — Vol. 38. — P. 1430—1433.
Опухоль — это патологическое образование, самостоятельно развивающееся в органах и тканях, отличающееся независимым ростом, разнообразием и необычностью клеток.
Ежегодно в мире регистрируется 8 миллионов новых случаев злокачественных новообразований и более 5,2 миллиона смертей от них.В 2000 году в России от различных причин погибло 2,2 миллиона человек, в том числе 297,9 тысяч - от новообразований (13,4%). Средний возраст умерших составил 59 лет для мужчин и 72 года - для женщин. В России каждые 5 минут регистрируется 4 новых случая злокачественных опухолей. Теории возникновения опухолей:теория раздражения; вирусная теория; мутационная теория (канцерогены); иммуннологическая теория .
Общеизвестно: чем больше теорий придумано, тем меньше ясности в чем-либо. Описанные ниже теории объясняют лишь отдельные этапы формирования опухолей, но не дают целостной схемы их возникновения (онкогенеза).
| Характеристика | Доброкачественная опухоль | Злокачественная опухоль |
| Рост | медленный | быстрый |
| Поверхность | гладкая | бугристая |
| Граница | четкая | нечеткая |
| Консистенция | мягкоэластичная или плотноэластичная | каменистой или деревянистой плотности |
| Подвижность | сохранена | может отсутствовать |
| Связь с кожей | отсутствует | определяется |
| Нарушение целостности кожи | отсутствует | может быть изъязвление |
| Регионарные лимфоузлы | не изменены | могут быть увеличены, безболезненные, плотные |
Benign - доброкачественная: клетки похожи друг на друга и на нормальную ткань.
Malignant - злокачественная. Клетки злокачественной опухоли всегда выглядят уродливо и разнообразно
Доброкачественные опухоли имеют экспансивный рост: опухоль медленно увеличивается и раздвигает окружающие ткани и органы.
Рост злокачественных опухолей называется инфильтрирующим: опухоль растет быстро и при этом пронизывает (инфильтрирует) окружающие ткани, прорастая в кровеносные сосуды и нервы. Действия и вид опухоли на вскрытии похожи на клешни рака, отсюда и название рак.
Ø Лимфатические сосуды забиты конгломератами опухолевых клеток
(показаны красными стрелками).
Ø Некоторые метастазы имеют свои названия по автору, который их первый описал. Например, метастаз Вирхова – в лимфоузлы над левой ключицей при раке желудка.
Пути метастазирования:
Метастазы – это очаги отсева опухоли, метастазирование - сам процесс образования метастазов. В результате роста опухоли ее отдельные клетки могут отрываться, попадать в кровь, лимфу и переноситься в другие ткани. Там они вызывают рост вторичной (дочерней)опухоли. По структуре метастазы обычно не отличаются от родительской опухоли. Метастазируют только злокачественные опухоли. Доброкачественные опухоли
метастазов не дают.
Основные пути метастазирования: лимфогенный; гематогенный; имплантационный.
| Доброкачественные опухоли | Злокачественные опухоли |
| Клетки повторяют клетки ткани, из которой развилась опухоли | Атипия и полиморфизм клеток |
| Рост экспансивный | Рост инфильтрирующий |
| Не дают метастазов | Склонны к метастазированию |
| Практически не дают рецидивов | Склонны к рецидивированию |
| Не оказывают влияния на общее состояние (за исключением редких форм) | Вызывают интоксикацию, кахексию |
Название доброкачественных опухолейсостоит из названия ткани и суффикса -ома.
• Фиброма – доброкачественная опухоль соединительной ткани.
• Липома – доброкачественная опухоль из жировой ткани.
• Аденома – доброкачественная опухоль из железистой ткани.
• Миома – доброкачественная опухоль из мышечной ткани. Если это поперечно-полосатая мышечная ткань (например, мышцы рук и ног), то доброкачественная опухоль называется рабдомиома. Если же гладкая мускулатура (в стенках артерий, кишечника) - опухоль называется лейомиома.
• Если в доброкачественной опухоли имеется сочетание клеток разных тканей, то названия звучат соответствующим образом: фибромиома, фиброаденома, фибролипома
опухоль из эпителиальной ткани
ü рак (карцинома) — злокачественная опухоль из эпителиальной ткани
ü саркома — злокачественная опухоль из соединительной ткани, за исключением крови.
4 основных синдрома рака:
Ø синдром “плюс-ткань”
Ø синдром патологических выделений
Ø синдром нарушения функции органа
Ø синдром малых признаков.
Злокачественные опухоли вызывают раковую интоксикацию(интоксикация – отравление, от слова токсин – яд), вплоть до раковой кахексии (кахексия – истощение.
Международная Классификация TNM
Для злокачественной опухоли дается отдельная характеристика следующих параметров:
• 1. T (tumor, опухоль) — величина опухоли.
2. N (nodes, узлы) — наличие метастазов в регионарных (местных) лимфоузлах.
3. M (metastasis) — наличие отдаленных метастазов.
• Потом классификация была расширена еще двумя характеристиками:
• 4. G (gradus, степень) — степень злокачественности.
5. P (penetration, проникновение) — степень прорастания стенки полого органа (используется только для опухолей желудочно-кишечного тракта).
Выделяют 4 стадии онкозаболевания:
• 1-я стадия: опухоль небольшая, занимает ограниченный участок, не прорастает стенку органа, нет метастазов.
• 2-я стадия: опухоль больших размеров, не распространяется за пределы органа, возможны одиночные метастазы в регионарные лимфатические узлы.
• 3-я стадия: опухоль больших размеров, с распадом, прорастает всю стенку органа или опухоль меньших размеров со множественными метастазами в регионарные лимфатические узлы.
• 4-я стадия: прорастание опухоли в окружающие ткани, в том числе неудалимые (аорта, полая вена и др.) или любая опухоль с отдаленными метастазами.
Понятие о своевременности диагностики.
• ранняя диагностика:
диагноз злокачественного новобразования установлен на стадии рак in situ или в I клинической стадии заболевания . Адекватное лечение должно привести к выздоровлению.
• своевременная диагностика:
диагноз выставлен на II и в некоторых случаях на III стадиипроцесса. Лечение позволяет полностью излечить пациента от онкологического заболевания, но добиться этого удается только у части больных.
• поздняя диагностика:
установление диагноза на поздних стадиях — III и IV, когда излечить пациента принципиально невозможно
Принципы лечения:
§ Основной способ лечения - хирургический.
Принципы хирургического лечения опухолей:
Ø абластика: меры по нераспространению опухолевых клеток во время операции .
• физическая: использование электроножа и лазера, облучение опухоли перед операцией и в раннем послеоперационном периоде.
• химическая: обработка раны после удаления опухоли 70% спиртом, внутривенное введение противоопухолевых препаратов на операционном столе.
Ø антибластика: меры по уничтожению во время операции опухолевых клеток, оторвавшихся от основной массы опухоли
Радикальные операции, излечивающие онкобольного, можно выполнить только в 1-2 стадии злокачественной опухоли. В запущенных стадиях злокачественных опухолей выполняют паллиативные и симптоматические операции. Они не вылечивают больного, а только облегчают его состояние и немного продляют жизнь.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Рак лёгкого с прорастанием в лёгочную артерию
Здравствуйте, уважаемые специалисты!
В марте 2005 г. у моей мамы (58 лет) при флюорографии была обнаружена опухоль правого лёгкого (предыдущая флюорография проводилась 2 года назад). Клинических симптомов на тот момент никаких не было. Очень подвижна, работоспособна. Кашля не было, болей в груди не было. Простудными, инфекционными заболеваниями болела очень редко.
В онкологический диспансер она не пошла. Все назначаемые исследования проводились в обычной городской больнице. На рентгенографии - опухоль в 3 сегменте верхней доли правого лёгкого. На бронхоскопии - никаких изменений нет, в том числе взятый при бронхоскопии кусочек на биопсию. Кровь в норме. Лимфоузлы в норме. Компьютерная рентгенотомография не проводилась. Была назначена операция по удалению опухоли и верхней доли правого лёгкого.
На операции (диагноз из выписки): опухоль правого главного бронха с прорастанием в лёгочную артерию верхней полой вены 2,5-3 см, в 3 сегмент верхней доли правого лёгкого. Гистология: анапластический рак. T4N1M1
Хирург, проводивший операцию, сказал мужу больной, что опухоль неоперабельная из-за прорастания в лёгочную артерию, и никто не возьмется её делать. И направил в онкодиспансер.
В онкодиспансере хирург-онколог усомнился в правильности диагноза и назначил повторную бронхоскопию. Эта бронхоскопия - так же: трахея, бронхи чистые, полностью проходимые, нет никаких изменений. После неё хирург-онколог сказал больной, что снимает часть диагноза, касающуюся главного бронха, и ставит 2 стадию. Но операция невозможна из-за спаек после первой операции. И направил к терапевтам-химикам. В данный момент мама проходит первый курс химиотерапии.
С этими хирургами я сама поговорить не могу, так как проживаю в другом городе. Поэтому, пожалуйста, ответьте:
1. что такое анапластический рак?
2. T4N1M1 - это 4 стадия? И как поставили М1 (отдалённые метастазы), если никаких исследований других органов не проводилось?
3. Возможно ли прооперировать эту опухоль, ведь, наверное, необходимо протезирование лёгочной артерии?
4. И если возможно, то в какие клиники России можно обратиться, желательно поближе к Казахстану (Омск, Новосибирк, Барнаул), где делают подобные операции?
Спасибо за ответ.
Анапластический рак - разновидность, с одной стороны, довольно злокачественная и агрессивная, а с другой - нередко малочувствительная к химиотерапии, поэтому в отношении такой формы рака легкого прежде всего всегда приходится изучать возможности хирургического лечения.
Повидимому, дело обстоит следующим образом: в городской больнице во время операции первичная периферическая опухоль, находящаяся в 3-м сегменте правого легкого, была ошибочно принята за отдаленный метастаз в том же легком, а регионарные метастазы в бронхопульмональных лимфатических узлах были опять-таки ошибочно приняты за первичную опухоль. Отсюда и М1 в стадии - обозначение отдаленных метастазов.
Таким образом, проблем со стороны метастазов пока не предвидится. Другое дело - распространенность первичной опухоли. Если всё обстоит так, как Вы написали, и опухоль прорастает только ПРАВУЮ легочную артерию и верхнюю полую вену, - тогда она в принципе вполне удалима. Легочную артерию при этом протезировать, скорее всего, не придется - целесообразнее, как представляется, удалить всё легкое вместе с его легочной артерией. Протезировать придется верхнюю полую вену: это делается в немногих российских клиниках, но возможно.
Если же опухолью поражен общий ЛЕГОЧНЫЙ СТВОЛ - дело серьезнее, но и здесь возможны варианты.
Сейчас, поскольку уже начата химиотерапия (кстати, какими препаратами, по какой схеме?), я бы рекомендовал провести два цикла, недели через три после второго сделать или магнитно-резонансную томографию грудной клетки, или спиральную компьютерную томографию с болюсным контрастированием сосудов, на этом основании определиться с динамикой - увеличилась ли опухоль и ее метастазы в лимфатических узлах, уменьшились ли они, или остались без изменения - и на этом основании решить вопрос о продолжении химиотерапии или об операции.
Такое препятствие к операции, как спайки после перенесенной диагностической лапаротомии, не представляется мне состоятельным.
Что касается вопроса о том, куда обращаться для операции, с учетом поражения сосудов. Пожалуй, ближе всего к Вам Челябинский областной онкологический центр - там есть такой профессор Фокин, к нему и можно обратиться. Можно было бы, разумеется, и к нам, но наш адрес для Вас - самый далекий в СНГ.
Уважаемый Евгений Серафимович!
Большое спасибо за быстрый ответ. Обязательно сделаем рекомендованную Вами диагностику. Уточним распространение опухоли (поражён ли общий лёгочный ствол). Порадовала принципиальная возможность проведения операции, хотя и такой радикальной.
Химиотерапия проводится препаратами Гемзар и Цисплатин. К сожалению, не могу сказать по какой схеме.
Жизнь сорокалетнего Мустахима из Казахстана перевернулась в сентябре 2018 года. У молодого мужчины обнаружили новообразование в легком. И хотя первая биопсия показала обнадеживающий результат: опухоль доброкачественная, – пациента не оставляли сомнения. Он обратился к российским специалистам, и прямая пункция подтвердила наихудшие ожидания Мустахима: редкая злокачественная опухоль тимуса.
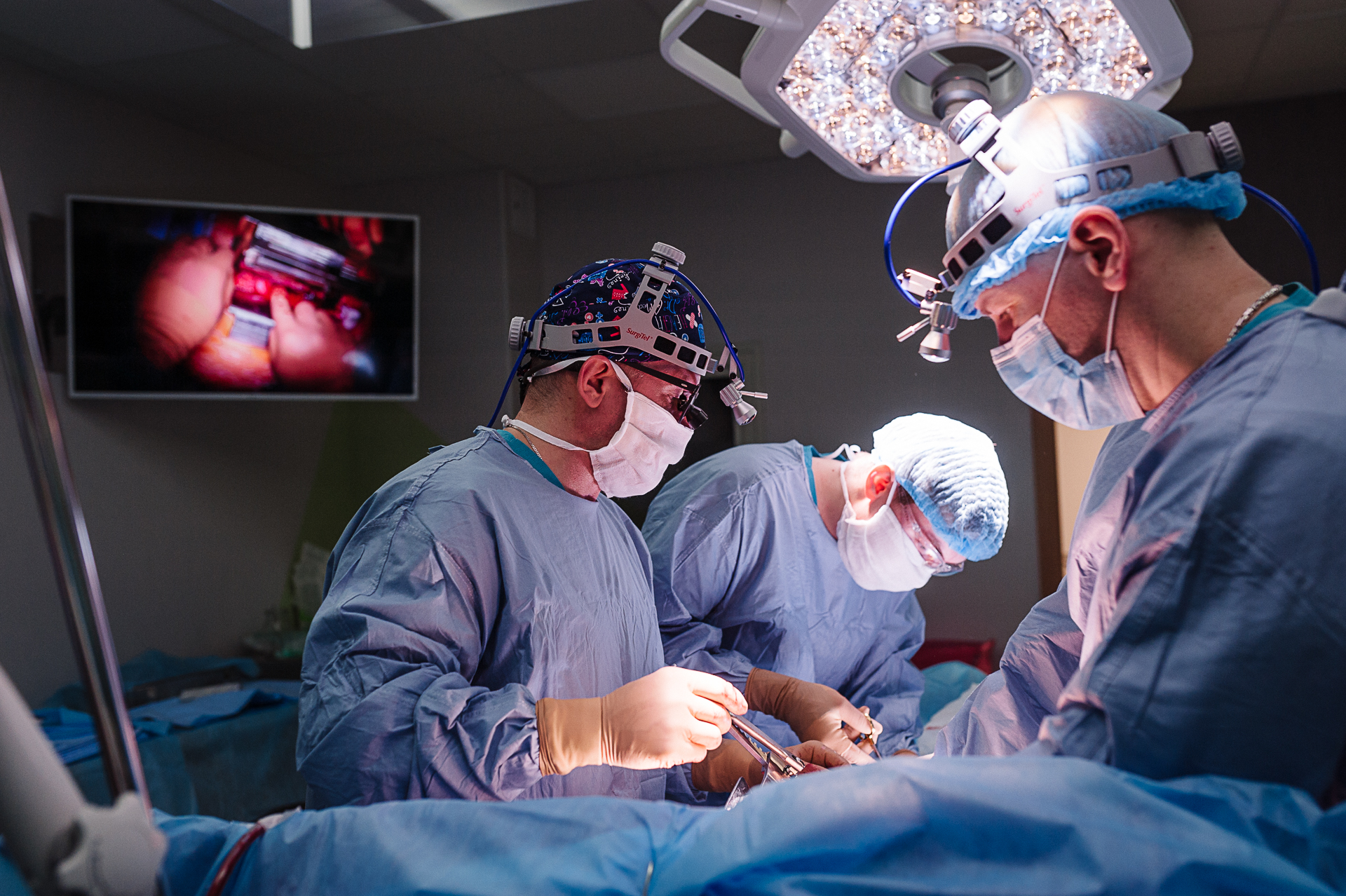
Опухоль, которая поразила легкие, сердце, аорту, проросла в область подключичной и сонной артерий, ствол легочной артерии
В Республиканском центре онкологии Казахстана хирурги смогли удалить лишь 60% новообразования, и были вынуждены остановиться. В процессе операции выяснилось: рак поразил не только легкое, но и перикард, магистральные сосуды и даже одно из предсердий. В мировой практике таких больных чаще всего оперировать не рискуют. Назначают лучевую и химиотерапию. Проводить такую операцию без кардиохирургов, аппаратов искусственного кровообращения и экстракорпоральной поддержки – зачастую невозможно.
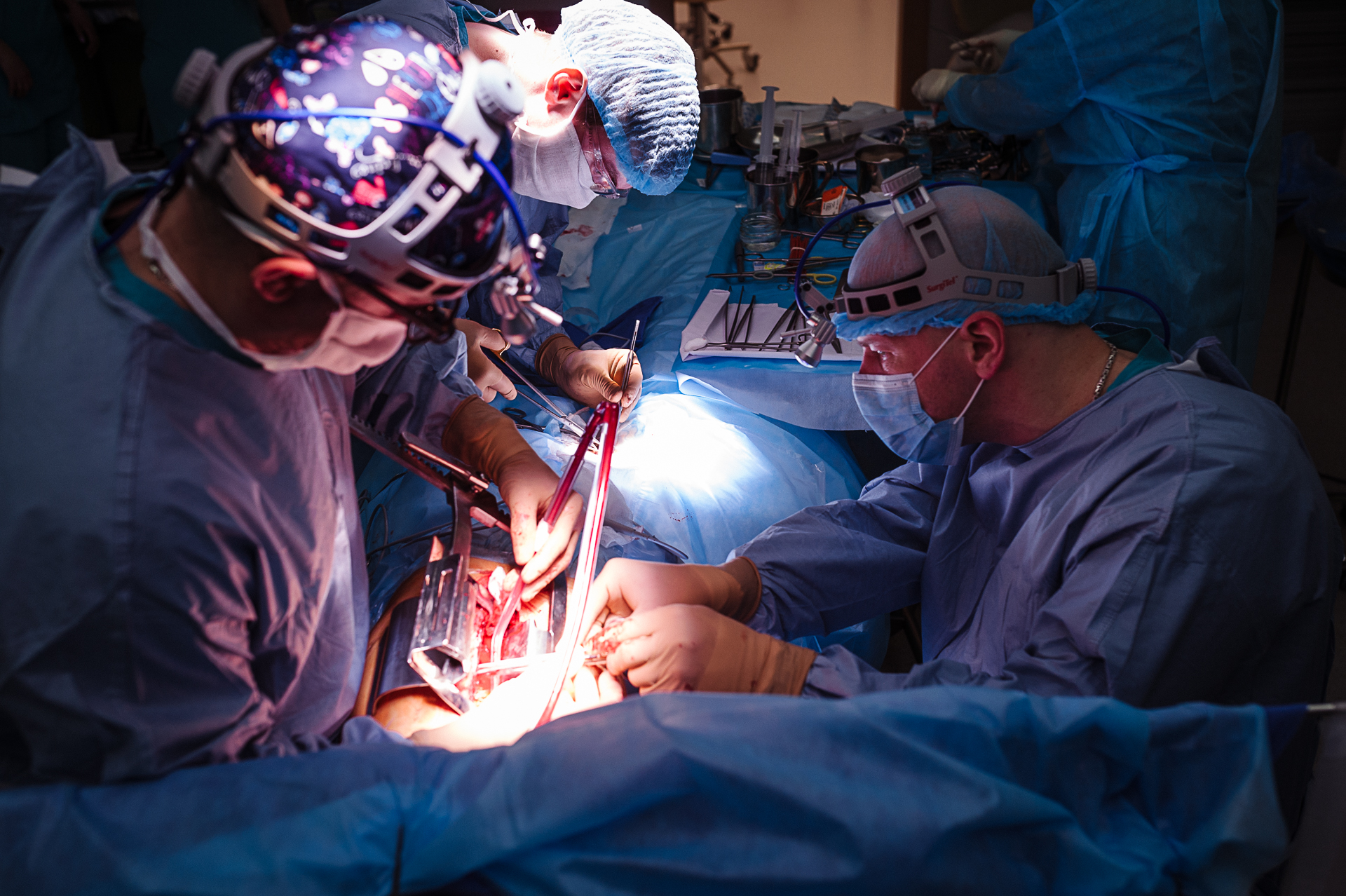
И казахские хирурги сдались. Затем было четыре курса химиотерапии, и хотя после них врачи сказали, что за дальнейшее лечение не берутся, но предложили обратиться к белорусским коллегам-онкологам.
Но Мустахим продолжил бороться за свою жизнь. Он приехал на консультацию в Беларусь, известную высочайшим уровнем специалистов. Однако две ведущие клиники не решились проводить операцию, опасаясь, что пациент ее просто не перенесет.
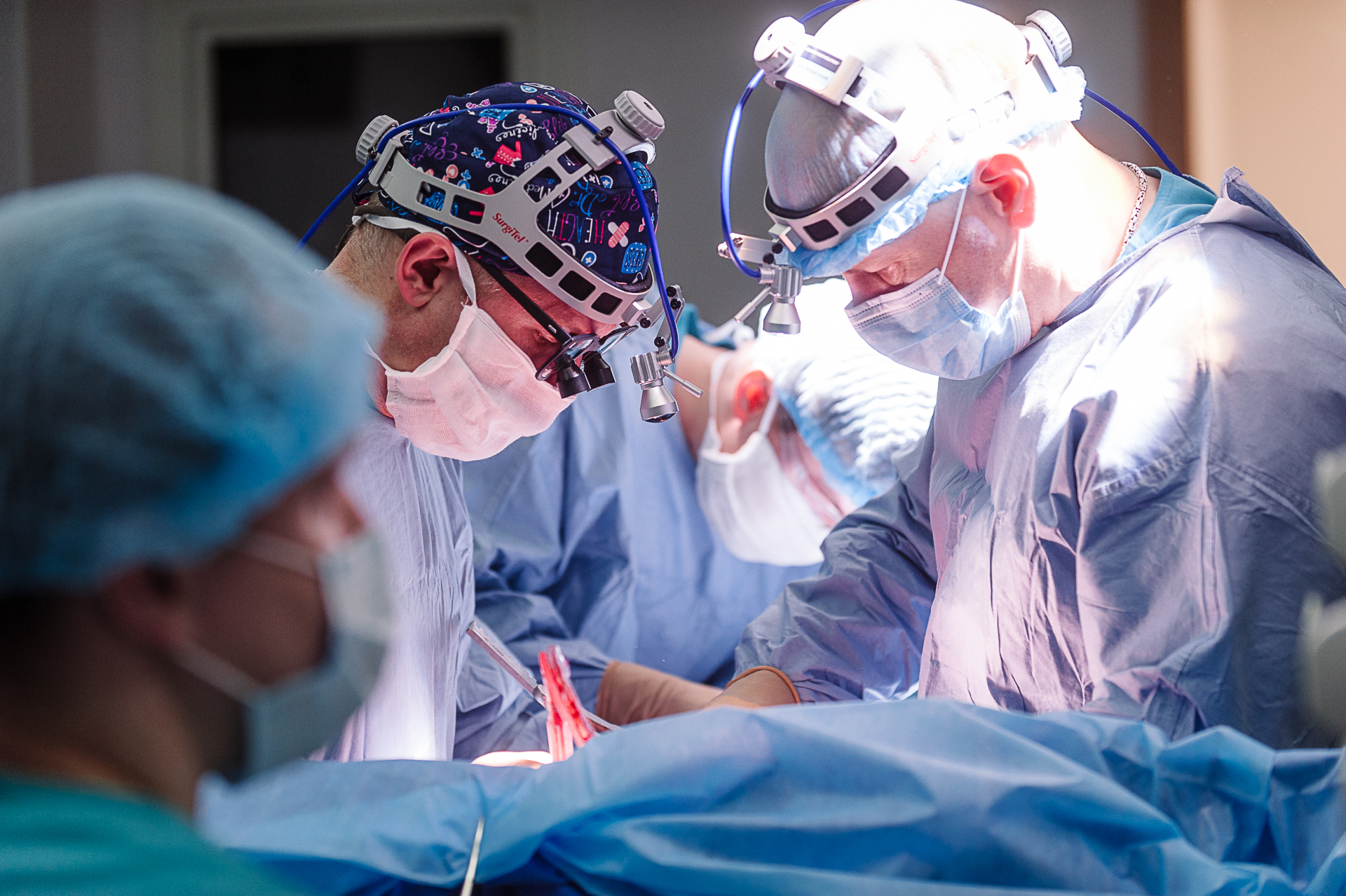
Опухоль проросла в дугу аорты, подключичную, сонную артерии и ствол легочной артерии. Поразила легкое, сердце и главные сосуды. Чтобы ее удалить, нужна была команда торакальных и кардиохирургов, анестезиологов – не только высочайшей квалификации, но большой смелости.
Собрать ее удалось в Одессе, в Медицинском доме Odrex.
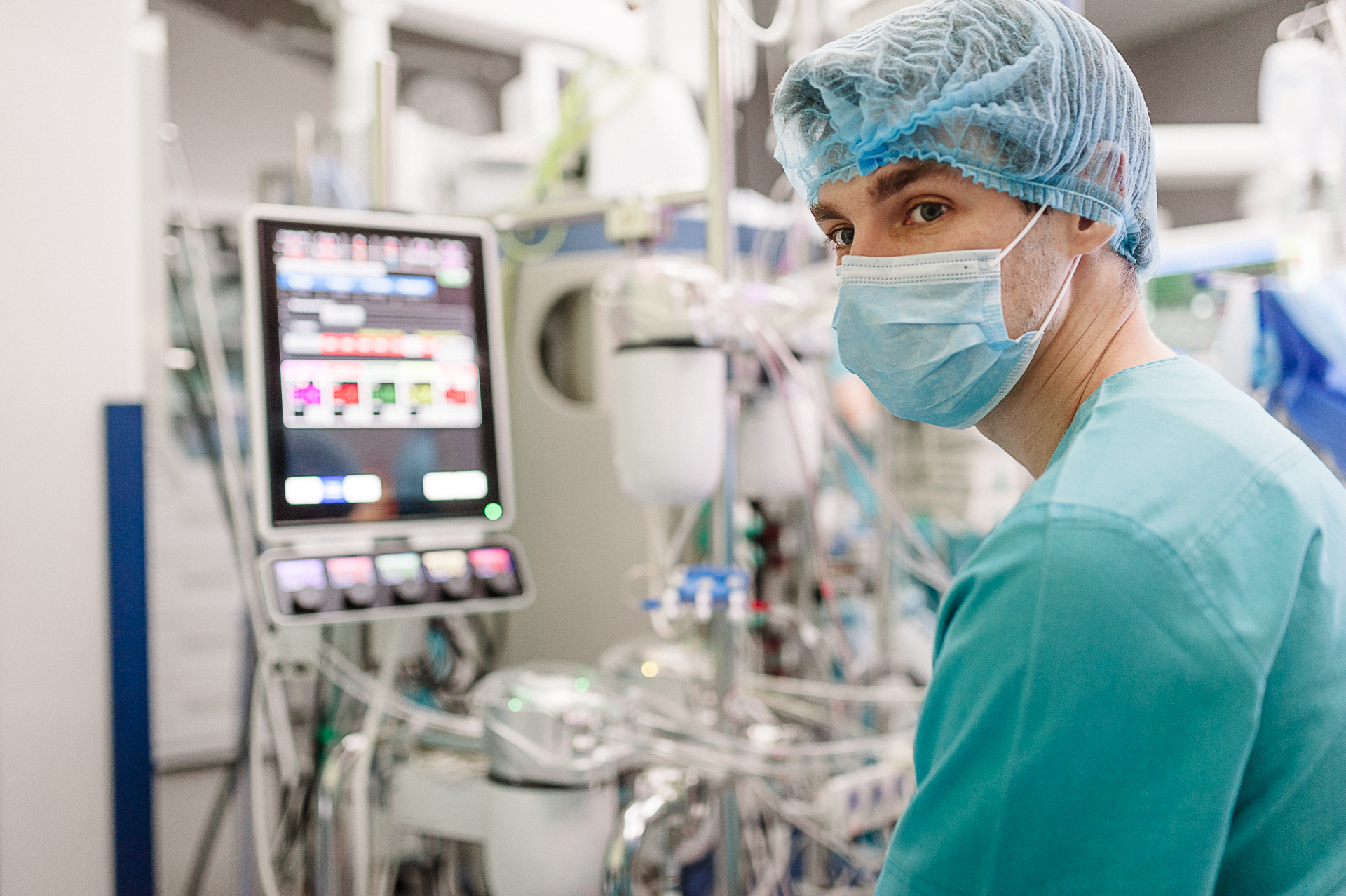
Команде Дмитрия Турлюка предстояло провести большую операцию, которую отказались делать врачи в трех странах
Заведующий кардиохирургическим отделением Odrex Дмитрий Турлюк, руководитель подразделения анестезиологии и интенсивной терапии Клиники Сердца Odrex Максим Павловский, а также приглашенный — один из лучших — торакальный хирург из Беларуси посчитали, что, несмотря на высокий риск, провести операцию реально. К ним присоединился главный онколог Одесской области, торакальный хирург Владислав Севергин.
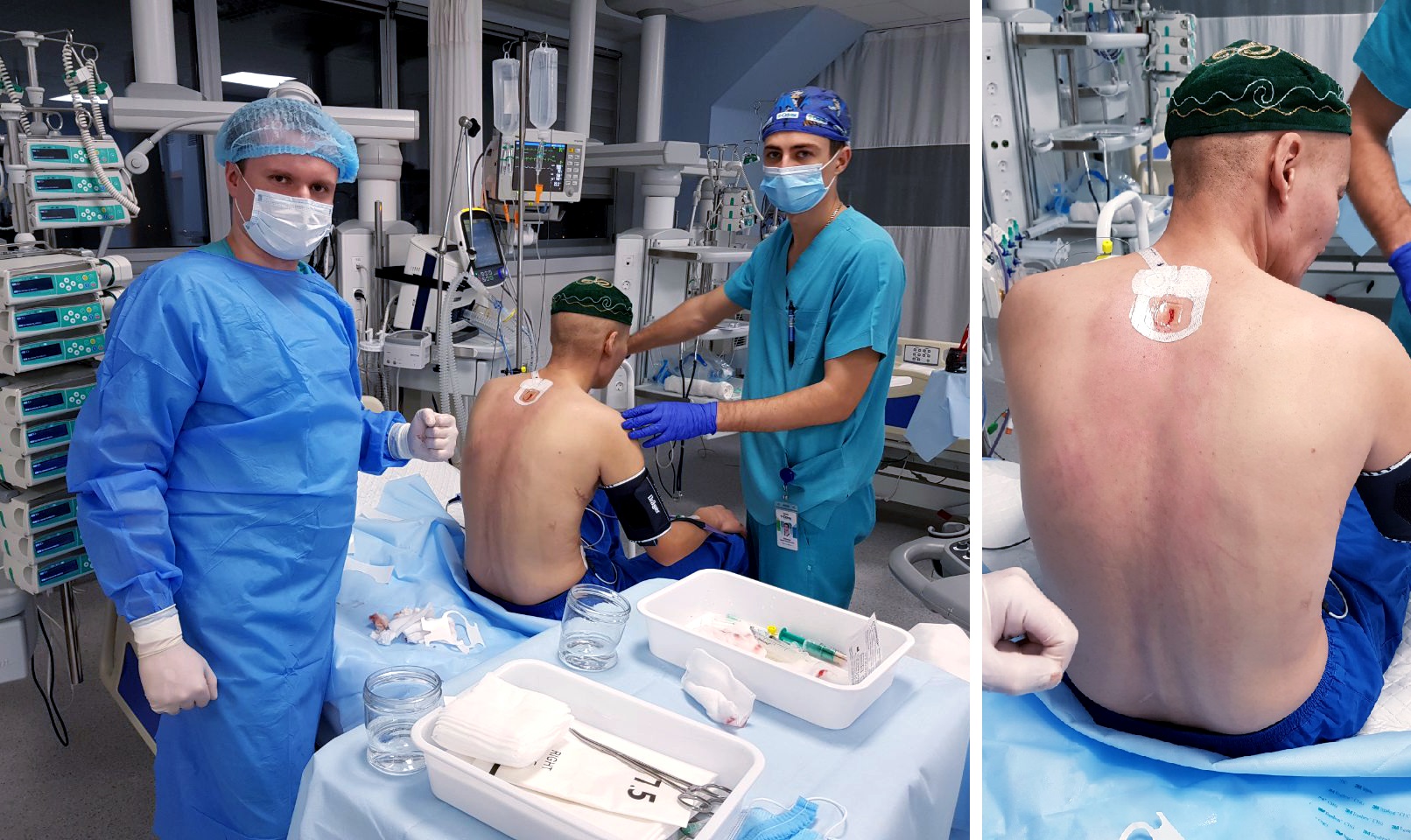
Но для этого, в первую очередь, необходимо было гарантировать стабильное кровообращение пациента во время операции. Оборудование Медицинского дома и навыки специалиста-перфузиолога, Александра Попсуйко, позволили это сделать. Организовали так называемую двухконтурную систему искусственного кровообращения, когда кровь подается в организм больного и снизу, и сверху. Это позволяло обойти зону дуги аорты и обеспечить питание одновременно всех органов.
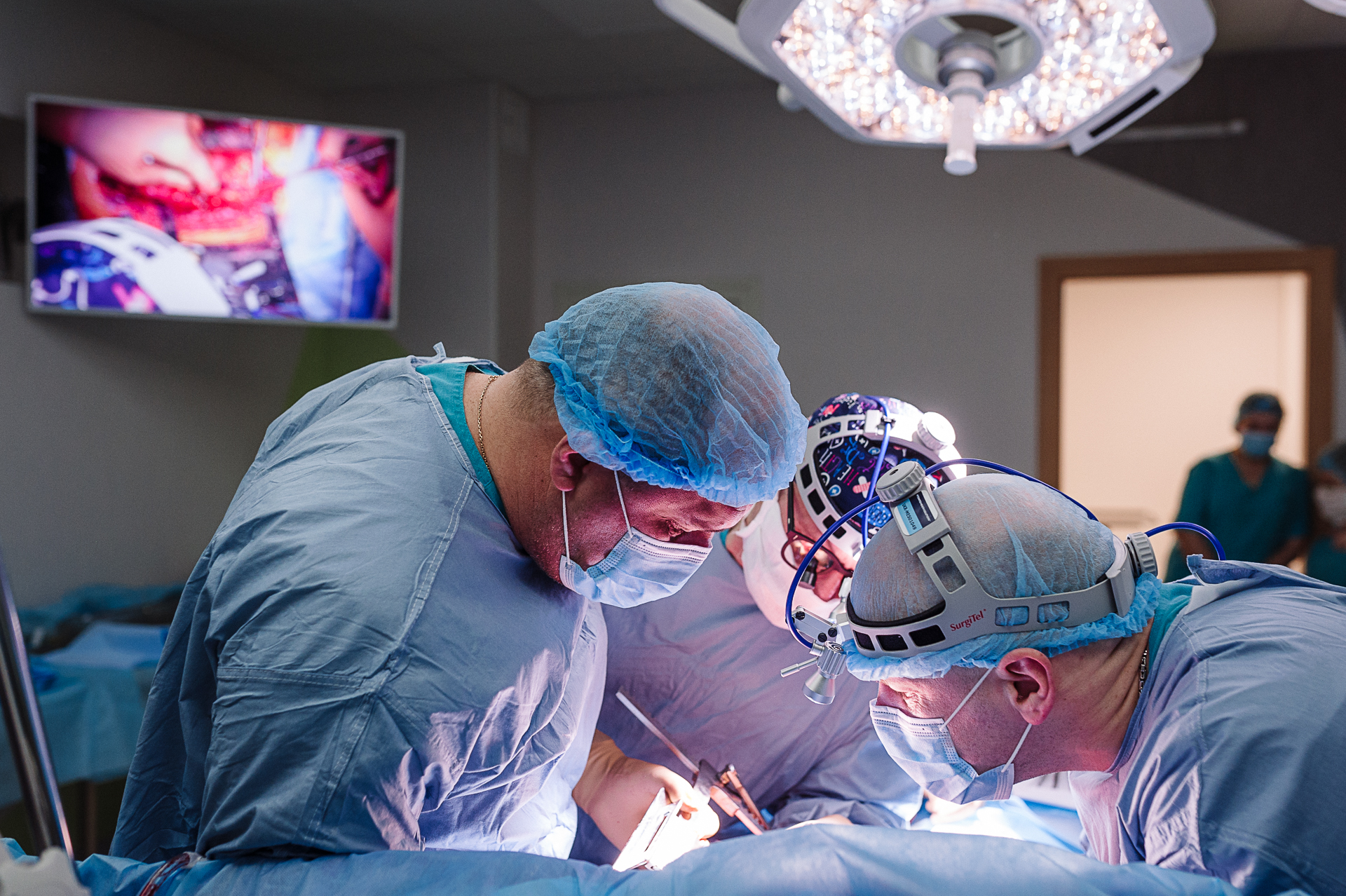
Саму операцию можно назвать фантастической. Хирурги сделали большую резекцию опухоли: вместе с верхней долей легкого и почти со всей передней стенкой легочного ствола, с захватом ушка левого предсердия, которое было ушито. Одним блоком переместили подключичную артерию, восходящую аорту и позвоночную артерию, которая отходила от дуги аорты, сделали резекцию нисходящей части дуги и провели пластику.
Перед тем, как попасть в Одессу, Мустахим перенес две операции. Он потерял голос после одной из них. И обе операции изменили анатомию мужчины: работу хирургов осложняли спаечные процессы. И все же команда справилась. Пациент перенес операцию. Хотя риск не миновал.
Послеоперационный период был сложным и позволил в полной мере оценить возможности отделения анестезиологии и интенсивной терапии Odrex: возможность ежедневного проведения бронхоскопии, наличие оборудования и специалистов для выполнения продленной почечно-заместительной терапии.
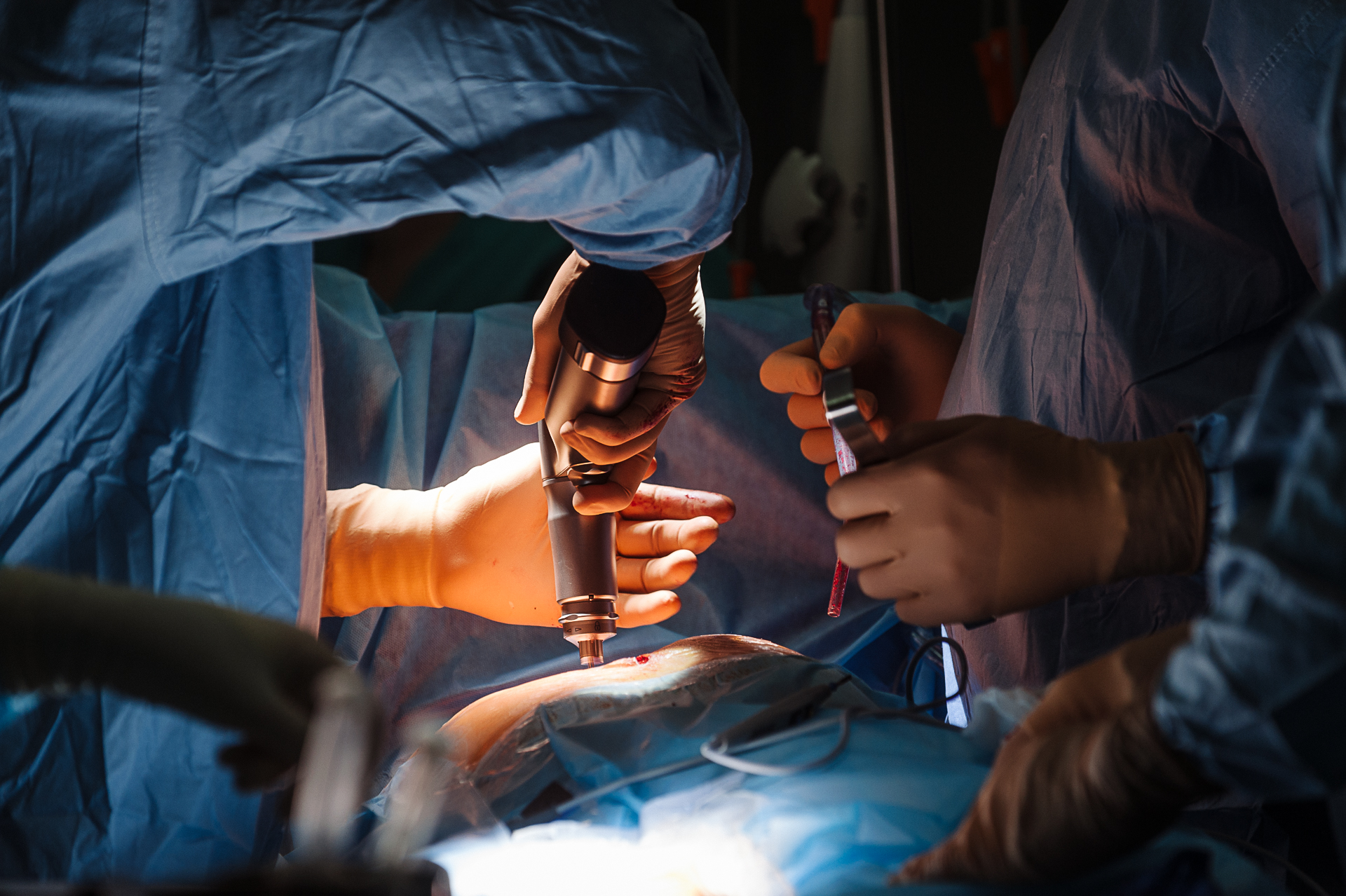
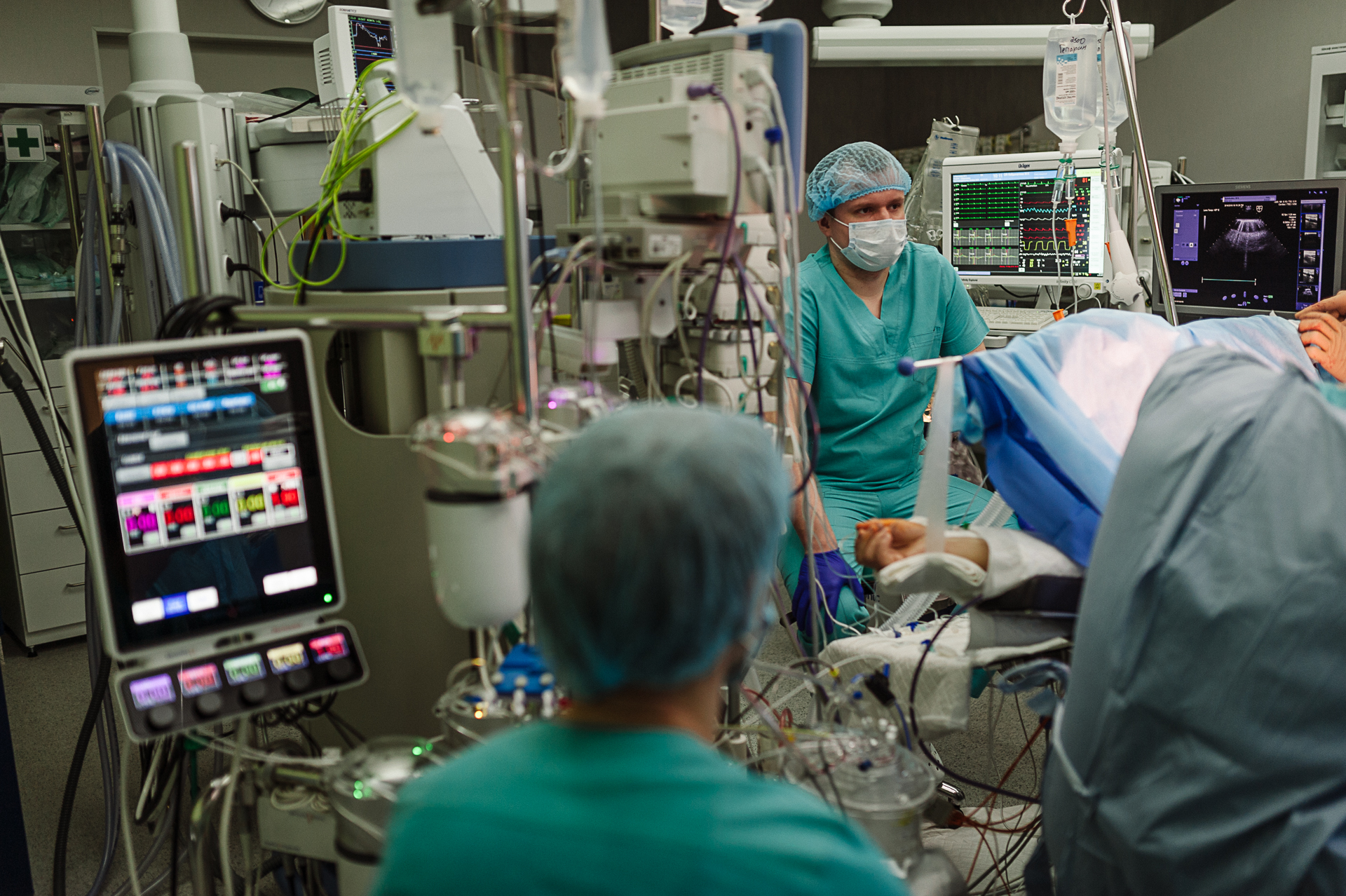
По результатам исследования тканей опухоли в краях отсечения опухоли найдено не было, а значит операция проведена радикально.
Домой, в Казахстан, за рулем собственного автомобиля
Лечение Мустахима прошло в рекордные сроки. Менее чем через две недели он выписался из клиники Odrex, самолетом долетел до Минска, а оттуда, за рулем собственной машины, вернулся в родной Казахстан.

Мустахим Кенжебаевич с кардиохирургом Дмитрием Турлюком и кардиологом Алёной Марченко
Его спасла возможность собрать в клинике Odrex команду для проведения комбинированной операции. Такие совместные операции, на сегодня – актуальное направление хирургии. Ведь тесное соседство сердца, легких и крупных сосудов, создают условия для распространения опухоли. Оперировать сам такое разросшееся образование торакальный хирург не может. И если не получается привлечь кардиохирурга, операция может быть не завершена и останется лишь “пробной”, как в случае с первой попыткой удалить опухоль Мустахима.
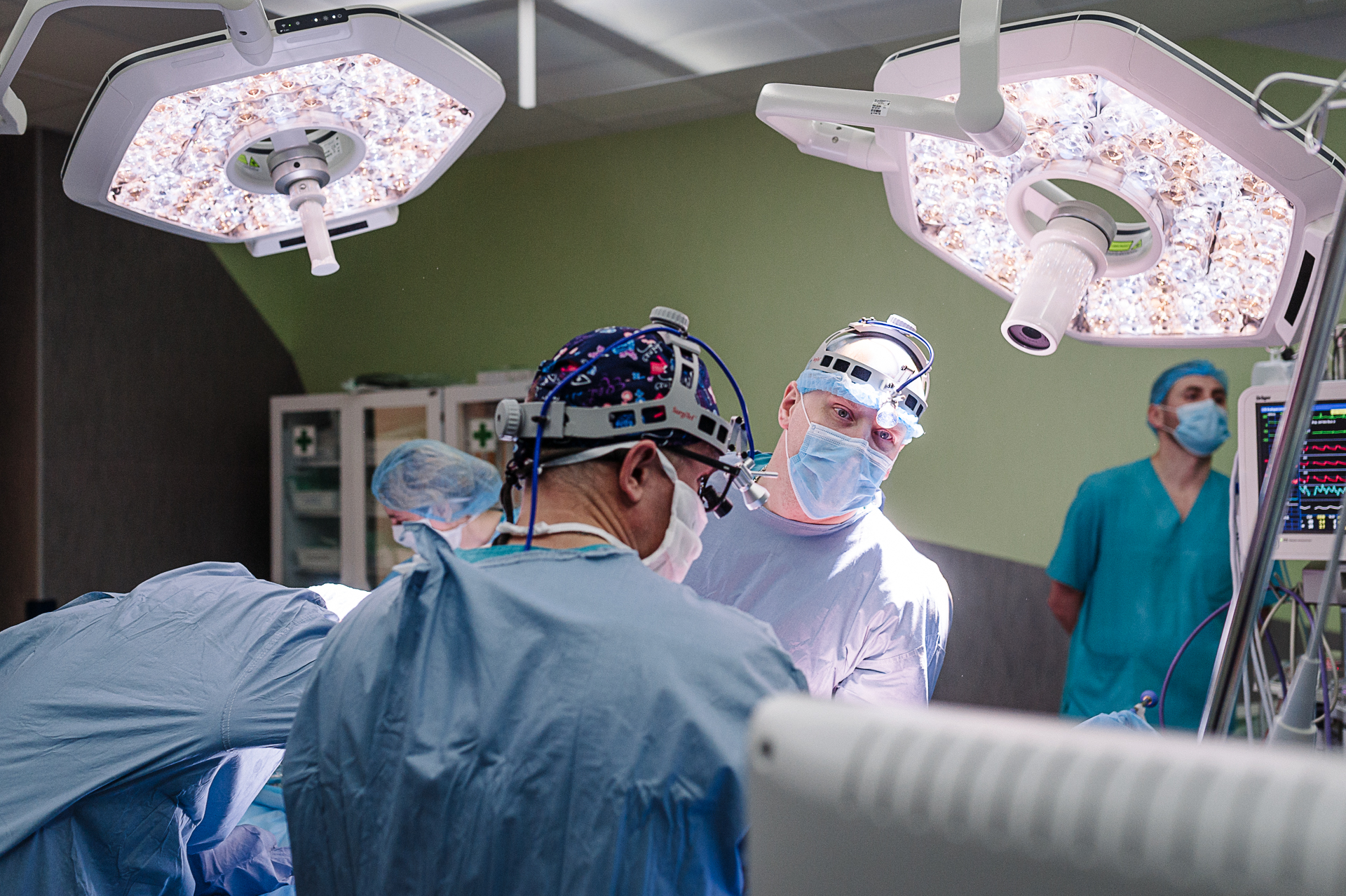
Торакальный хирург и кардиохирург
При этом, для успеха важен не только личный опыт кардио- или торакального хирурга, но и взаимодействие между всеми членами команды, поставленное “на поток”. К сожалению, во многих клиниках, и не только Украины, отсутствие такой командной работы приводит к прерыванию операций или отказу от их проведения. Сорокалетнему Мустахиму повезло найти такую команду в Медицинском доме Odrex.
Читайте также:

