Эпидемиология рака яичников в
Эпидемиология
Пристальное внимание, уделяемое проблемам лечения больных раком яичников, объясняется не только частотой встречаемости этого заболевания.
Занимая третье место в структуре онкогинекологической патологии, рак яичников удерживает лидирующие позиции среди причины смерти у онкогинекологических больных.
Так, по данным МАИР (Международного агентства по изучению рака), ежегодно в мире регистрируется 166000 новых случаев этой патологии и из них 100000 женщин умирает в течение первого года.
Встретить злокачественное новообразование (ЗНО) яичников у женщин можно практически в любом возрасте (как у новорождённых девочек, так и у женщин после 80 лет). Отсутствие выраженных клинических признаков, поздняя обращаемость к врачу, недостаточная диагностическая база и ошибки в ведении этих больных являются основными причинами того, что у 2/3 больных первично диагностируется местнораспространённый и распространённый рак яичников. Внедрение дорогостоящих диагностических и лечебных мероприятий в III и IV стадиях заболевания не могут значительно изменить показателей лечения и выживаемости этих больных.
Злокачественные опухоли репродуктивной системы (рак молочной железы и гинекологические опухоли - рак тела, шейки матки и яичников) являются наиболее частыми в структуре онкологической заболеваемости женщин, и их суммарная доля превышает 35%. Рак яичников составляет 4-6% среди злокачественных опухолей у женщин и занимает седьмое место по частоте.
Если удельный вес рака яичников в онкологической заболеваемости женщин во всех странах мира примерно одинаков, то частота заболеваемости на 100000 женского населения значительно варьирует. В Европе, особенно в Северных странах и Великобритании, а также в Северной Америке, стандартизованные показатели заболеваемости наиболее высокие (10 и более на 100000). В Центральной и Южной Америке, Африке и Азии, включая индустриальные страны, такие как Япония, но исключая Израиль, эти показатели значительно ниже (7 и менее на 100000) (рис. 31).

Рис. 31. Стандартизованные показатели заболеваемости раком яичников в мире в 1990-е годы (на 100000 женского населения).
За последние 20 лет уровни заболеваемости раком яичников в большинстве стран с высоким риском (Скандинавия, Великобритания, США, Канада) остаются стабильными и даже несколько снижаются. В то же время отмечено повышение заболеваемости в странах с низким риском, таких как Япония, Индия, Сингапур, а также в некоторых странах Южной и Восточной Европы (Португалии, Испании, Югославии, Польше).
В России ежегодно рак яичников выявляется более чем у 11000 женщин (10,17 на 100000). За последние 10 лет в стране произошел прирост заболевания на 8,5%. Интерпретация трендов в заболеваемости раком яичников крайне затруднительна, особенно в экономически развитых странах.
В большинстве индустриальных стран мира рак яичников имеет самые высокие показатели смертности среди всех гинекологических опухолей, что связано с поздней диагностикой заболевания. По сводным данным популяционных раковых регистров стран Европы, 1-летняя выживаемость больных раком яичников составляет 63%, 3-летняя - 41%, 5-летняя - 35%. На рисунке 32 представлены показатели выживаемости больных основными гинекологическими опухолями.

Рис. 32. Относительная выживаемость больных гинекологическим раком по сводным данным популяционных раковых регистров Европы в 1990-е годы (в %).
За последнее десятилетие отмеченное в Европе увеличение 5-летней выживаемости больных злокачественными опухолями яичников на 3% (с 32 до 35%), а в США - на 4% (с 36 до 39%) объясняется не столько улучшением диагностики, сколько эффективным применением химиотерапии в лечении диссеминированных форм рака яичников и герминогенных опухолей.
Рассматривая онкогинекологические показатели заболеваемости и смертности в Омской области за 5 лет (с 2003 по 2007 годы) можно сказать, что в целом основные тенденции соответствуют Российским и мировым.
Успех лечения и прогноз дожития больных всецело зависит от стадии развития злокачественного процесса и своевременности диагностики. К сожалению, статистика свидетельствует, что опухоль выявляется в III-IV стадиях настолько часто (до 40%), что на долю так называемых ранних форм приходится ничтожно малое количество случаев, в основном диагностируемых случайно. Именно количеством диагностируемых у больных ранних опухолей определяются хороший прогноз их полного излечения.
Молекулярная генетика рака яичников
Наследственным факторам еще десять лет назад не придавали особого значения, хотя отдельные указания на существование семейной предрасположенности к данному заболеванию появились довольно давно. Сегодня роль генетической составляющей в патогенезе рака яичников (РЯ) не вызывает сомнений.
Суть молекулярно-генетических изменений в опухолях сводится к трём компонентам:
1) активирующие мутации в онкогенах;
2) инактивирующие мутации в антионкогенах;
3) геномная нестабильность.
Онкогены кодируют белки, играющие важную роль в процессах позитивной регуляции клеточного деления и дифференцировки; если их экспрессия избыточна или протекает в измененном виде, то это индуцирует неконтролируемую пролиферацию клеток. Гены-супрессоры, называвшиеся до недавнего времени антионкогенами, ответственны за синтез белков, осуществляющих негативный контроль клеточного деления или индукцию апоптоза. В противоположность онкогенам функционально значимые мутации в супрессорных генах носят инактивирующий характер.
Одним из наиболее изученных онкогенов, активация которого достаточно часто обнаруживается при раке яичников, является ген K-ras. Продукт гена K-ras относится к классу G-белков и участвует в самых разнообразных аспектах регуляции клеточных процессов. Мутации K-ras встречаются значительно чаще в муцинозных, по сравнению с немуцинозными РЯ, что позволяет обсуждать перспективность данного теста для дифференциальной диагностики.
Другой онкоген, к которому привлечено в последние годы пристальное внимание, - это c-erbB2/HER2, кодирующий мембранный гликопротеид семейства рецепторов эпидермального фактора роста. Гиперэкспрессия данного гена наблюдается в 10-50% случаев. Во многих работах показано, что активация c-erbB2/HER2 указывает на неблагоприятный прогноз течения рака яичника.
Существенное место в патогенезе рака яичников принадлежит супрессорному гену р53. Продукт гена р53 отвечает за самоустранение клеток, получивших критические повреждения ДНК. Инактивация р53 наблюдается примерно в половине опухолей РЯ.
Нарушения в различных генах клеточного цикла, по-видимому, могут иметь весьма сходные функциональные проявления. Известно, что регуляция клеточного цикла находится под контролем белкового комплекса, состоящего из циклинов и циклин-зависимых киназ (Cdk).
Считается, что активирующие события в генах циклинов и Cdk имеют онкогенный эффект, в то время как Cki выступают как гены-супрессоры.
В последние годы внимание широкого круга специалистов, в том числе и онкологов, привлечено к ферменту теломеразе. Основная функция теломераз состоит в препятствовании укорочению концевых участков хромосом в процессе деления клеток. Установлено, что при многих типах опухолей наличие активной теломеразы коррелирует с неблагоприятным прогнозом. Теломеразная активность обнаруживается в 92% карцином яичника. При этом следует заметить, что наиболее высокая активность фермента обнаруживается в низкодифференцированных карциномах.
Предполагается, что некоторые варианты генов, продукты которых участвуют в синтезе андрогенов и эстрогенов, могут несколько увеличивать риск новообразований репродуктивной сферы. В частности, к кандидатам относятся гены группы цитохрома р450 (CYP1A1, CYP17 и CYP19).
Значительный интерес представляют гены, ответственные за метаболизм эндогенных и экзогенных канцерогенов, например группы полициклических ароматических углеводородов (ПАУ). В метаболизме ПАУ ключевая роль принадлежит ферментам группы цитохрома р450. Полиморфизм этих генов может участвовать в формировании целого ряда новообразований.
Хотя семейные раки яичника достаточно редки, их молекулярная генетика изучена значительно лучше по сравнению со спонтанными опухолями. Эпидемиологические исследования и анализ семейной истории РЯ позволили выявить, что около 10% случаев эпителиального рака яичников обусловлены передаваемыми в поколениях генетическими изменениями.
В настоящее время описаны две независимые формы наследственного РЯ:
1) синдром рака молочной железы и яичников, на который приходится 90-95% всех случаев наследственного РЯ;
2) синдром, ассоциированный с высокой семейной встречаемостью рака толстой кишки и раком эндометрия (5-10% случаев).
Успехи молекулярной генетики привели к разработке методик прямого обнаружения случаев наследственного рака яичников (табл. 5).
Таблица 5. Молекулярно-генетические детерминанты наследственного рака яичников

Как показывает генетический анализ, большинство случаев наследственного РЯ связано с врождёнными мутациями гена BRCA1 и гена BRCA2.
Синдром неполипозного семейного рака толстой кишки в сочетании с РЯ и раком эндометрия определяется наличием наследственного дефекта в каком-либо из пяти известных генов, MSH2, МПЛП, MSH6, PMS2 или PMS1.
В заключение остановимся коротко на том, какое клиническое значение имеют данные о наследственной природе определенной группы опухолей яичников. Накопленные к настоящему времени результаты исследований не дают еще полного представления об особенностях течения и прогнозе наследственного рака яичников.
Не вызывает сомнений, что BRCA-1 - ассоциированный РЯ морфологически относится к серозному типу и диагностируется обычно у более молодых женщин. Кроме того, создается впечатление, что в случае BRCA мутаций опухоли проявляют несколько большую чувствительность к химиотерапии.
Идентификация мутаций в генах наследственных раковых синдромов имеет решающее значение для превентивной медицины. Предполагается, что лабораторные генетические тесты позволят сфокусировать мероприятия, направленные на раннюю диагностику новообразований, именно на тех лицах, которые в них больше всего нуждаются.
В частности, обнаружение зародышевых мутаций, ассоциированных с семейным РЯ, свидетельствует о необходимости учащённых ультразвуковых обследований органов брюшной полости, пристального внимания за состоянием молочных желёз. В некоторых случаях ставился вопрос о целесообразности профилактической овариэктомии и мастэктомии.
По данным исследований, проведённых на базе Омского областного онкологического диспансера, установлено, что у больных с запущенными формами рака яичников пре- и постменопаузального периода отмечается выраженная иммунная дисфункция, характеризующаяся как количественными, так и функциональными нарушениями Т-клеточного иммунитета.
Кроме того, при этом:
1) снижались показатели субклассов Ig G1, IgG2, IgG3 в 3,2-4,8 раза;
2) С4 комплемента в 2,5 раза;
3) лактоферрина в 5,7-7,0 раз по сравнению с контрольной группой;
4) уровень циркулирующих иммунных комплексов (ЦИК) превышал показатели контрольной группы в 1,6-1,7 раза.
Подводя краткий итог, можно заключить, что в последние годы наши знания о молекулярных механизмах туморогенеза яичников существенно изменились. Хотя многие детали этого сложнейшего процесса остаются не до конца ясными, стало очевидным, что формируются научные основы повышения эффективности диагностики и лечения данной группы злокачественных новообразований.
Пограничные опухоли яичников
Особое место среди новообразований яичников занимают пограничные опухоли. В качестве самостоятельной нозологической единицы они были введены в Международную гистологическую классификацию ВОЗ в 1973 году. Эти новообразования имеют синонимы: опухоли потенциально низкой степени злокачественности, карцинома низкой степени злокачественности.
Выделяют следующие формы пограничных опухолей яичников:
1) серозные опухоли;
2) муцинозные опухоли;
3) эндометриоидные опухоли;
4) светлоклеточные (мезонефроидные) опухоли;
5) опухоли Бреннера;
6) смешанные эпителиальные опухоли.
Пограничные опухоли яичников составляют 10-15% всех новообразований органа. Переходные опухоли встречаются со следующей частотой: серозная опухоль обнаружена у 60,9% больных, муцинозная - у 34,5%, эндометриоидная - у 1,1%, опухоль Бреннера - у 1,1%, смешанная - у 2,3%.
Наиболее часто пограничные опухоли встречаются в I-I стадиях (81%).
Диагностика пограничных опухолей яичника остается прерогативой исключительно патогистологического метода исследования. Важная в диагностическом отношении информация получается при использовании ультразвуковой томографии. Высокая разрешающая способность ультразвуковой аппаратуры позволяет составить представление об особенностях опухоли яичника.
Лапароскопия не позволяет установить диагноз пограничной опухоли яичника даже при исследовании мазков, полученных из брюшной полости. Это объясняется тем, что цитологически трудно дифференцировать элементы мезотелия и элементы имплантантов пограничной опухоли. Распознать пограничную опухоль яичника, основываясь только на визуальной оценке при лапароскопии или лапаротомии, невозможно.
Программы лечения пограничных опухолей в целом мало отличаются от программ терапии злокачественных новообразований и включают комбинацию оперативного и лекарственного методов либо комплексный подход с использованием лучевой терапии. Оперативный этап требует выполнения стандартного объёма операции, описанного выше. Органосохраняющие операции могут быть выполнены только пациенткам молодого возраста, имеющим Ia стадию и низкий риск рецидивирования опухоли.
Группа пограничных опухолей яичника, хотя и является объединенной в самостоятельную нозологическую единицу по своим морфологическим признакам, клинически не однородна. При этом больные с различными морфологическими вариантами опухоли нуждаются в индивидуальном подходе при выборе лечебной тактики и осуществлении наблюдения в последующем.
А.С. Марьенко, A.И. Новиков, В.К. Косенок, В.А. Акулинин
Приблизительно 27 % всех злокачественных опухолей женских половых органов — это рак яичников (РЯ), 53 % летальных исходов от рака женских половых органов приходится именно на эту его локализацию. Это четвертая причина смертности от онкологических заболеваний у женщин в США.
Столь же высокое место в структуре женской смертности злокачественные опухоли яичников занимают в Канаде, Новой Зеландии, Израиле и странах Северной Европы. В США эта патология развивается приблизительно у 14 из 1000 женщин старше 40 лет, но вылечить удается только 4.

Заболеваемость раком различных локализаций у женщин США
У остальных в связи с прогрессированием опухолевого процесса будут наблюдаться повторяющиеся эпизоды кишечной непроходимости, которые приведут к дефициту питания, кахексии и смерти. В обзоре тенденций смертности в США летальность от РЯ в зависимости от возраста за 1975—2002 гг. повысилась, что отражает увеличение и старение популяции. За последние 30 лет смертность женщин моложе 65 лет снизилась, а у более старших — увеличилась, с некоторой стабилизацией показателей за последние 10 лет.
Это можно объяснить применением пероральных контрацептивов молодыми женщинами, а также смещением кривой выживаемости вправо. У пожилых пациенток выживаемость хуже при любой стадии рака яичников (РЯ). Некоторые объясняют это менее активным применением хирургического и химиотерапевтического лечения у данной категории больных. Смертность, стандартизованная по возрасту, у белых женщин выше, чем у чернокожих.
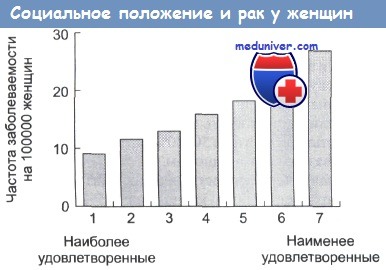
Частота заболеваний раком у женщин различных категорий, отобранных в соответствии с критериями психологической неудовлетворенности по Карстейру.
Эти критерии соответствуют социально-экономическому положению, которое личность занимает в обществе.
У азиаток, уроженок островов Тихого океана, представительниц коренных народностей Америки (индейцы, алеуты, эскимосы) и латиноамериканок показатели смертности ниже, чем у чернокожих.
Злокачественные опухоли яичников возникают в любом возрасте, включая младенческий и детский. Смертность от новообразований яичников у детей и подростков в США незначительно ниже, чем от лейкоза, лимфом, опухолей ЦНС, почек, соединительной ткани и костей. Основные гистологические типы опухолей яичников характерны для определенного возраста.

Злокачественные герминогенные новообразования обычно возникают у женщин моложе 20 лет, а рак яичников (РЯ) — в возрасте старше 50 лет. В возрасте 45—49 лет заболеваемость составляет 16,4 случая на 100 000 женщин, затем резко возрастает: в возрасте старше 60 лет более чем в 2 раза — до 40 на 100 000. Самые высокие цифры отмечают в 65—85 лет, с пиком заболеваемости в 80—84 года (61 случай на 100 000).
Наибольшее количество случаев рака яичников (РЯ) возникает в 60—64 года, более 1/3 случаев — в возрасте старше 65 лет. У пожилых женщин вероятность обнаружения поздних стадий заболевания выше, чем у более молодых; 5-летняя выживаемость в 2 раза ниже (28,4 vs 56,6 %).


Рак яичников.
Распределение злокачественных эпителиальных опухолей яичников по стадиям в зависимости от возраста.
Рак яичников — пятая по частоте причина смерти от рака у женщин, ведущая причина смерти от гинекологических злокачественных опухолей, и вторая по частоте диагностирования опухоль в гинекологии. [1] .
Для многих раковых опухолей причины возникновения малоизучены, данное заболевание не исключение. Однако, есть утверждения, что рак яичников больше распространен среди нерожавших женщин. Также существует мнение, что профилактикой рака яичников является использование оральных контрацептивов [2] .
Безусловно, как и для других раковых заболеваний, ощутимое значение имеет наследственность, иначе говоря, повышенная вероятность заболеть раком яичников может передаваться от матери к дочери. Кроме того, у больных раком молочной железы риск заболевания раком яичников повышен в два раза [2] .
Также бытует мнение, что распространение заболевания связано увеличением количества употребляемых при приеме пищи животных жиров [2] .
Международная федерация акушеров-гинекологов (FIGO) классифицирует стадии заболевания следующим образом [3] :
- I — поражены только яичники;
- IA — поражен один яичник, асцита нет;
- IB — поражены оба яичника, асцита нет;
- IC — появление опухоли на поверхности яичника(-ов), асцит;
- II — заболевание распространяется по малому тазу;
- IIA — поражение матки или маточных труб;
- IIB — поражение других тканей малого таза;
- IIC — опухоль на поверхности яичника(-ов), асцит.
- III — распространяется на брюшину, появляются метастазы в печень и другие органы в пределах брюшной полости, поражение паховых лимфоузлов.
- IIIA — распространение в пределах малого таза, с обсеменением брюшины.
- IIIB — метастазы диаметром до 2 см.
- IIIC — метастазы диаметром более 2 см с вовлечением ретроперитонеальных и паховых узлов.
- IV — отдаленные метастазы.
Симптомы
В основном на ранних стадиях рак яичников протекает без каких-либо симптомов. Кроме того, первые симптомы (увеличенный живот) довольно частно воспринимаются женщиной как проявление аднексита (воспаление яичников). Опухоль постепенно распространяется по брюшной полости, поражая сальник и вызывая накопление жидкости (асцит) [2] .
Также одними из первых симптомов могут быть боли в нижнем отделе живота с тянущим характером, и обычно трудноотличимы от тех болей, которые бывают при воспалении яичников [2] .
Диагностика
Заподозрить рак яичников можно при осмотре живота больной и гинекологическом осмотре. При подозрении на рак производится пункция для получения жидкости из брюшной полости и выявления в ней опухолевых клеток [2] .
Пунктация (биопсия) при раке яичников в развитых европейских странах не рекомендуется, так как это может привести к рассеву опухоли. Поэтому окончательный диагноз может быть поставлен только во время операции при оперативном анализе взятых проб и послеоперационной патологии вырезанных тканей. [4]
Для диагностики рака и оценки распространённости метастатического поражения применяются ультразвуковое исследование брюшной полости и малого таза, компьютерная томография (КТ) органов грудной клетки, а также КТ или МРТ органов брюшной полости [2] .
Наиболее информативным методом диагностики является гистологическое исследование биоптата яичника [3] . Это исследование позволяет определить характер и структуру опухоли. На основе полученных данных онколог составляет тактику лечения и делает прогноз.
Лечение
Основные методы лечения онкологии являются — операция и химиотерапия. При операции на ранней стадии заболевания могут удалить только пораженный яичник, в более сложных случаях, в зависимости от поражения, могут удалить матку и сальник [2] .
Химиотерапия обычно основана на комбинирвоании несколькими препаратами, например, Цисплатин (или Карбоплатин), Циклофосфан, Таксол и др.
Последствия
На самых первых стадиях заболевания вероятность вылечиться в течение 5 лет достигает 80 %, при этом при поражении всего одного яичника и отсутствии распространения на соседние органы эта вероятность может достигать 95 % [2] .
При более поздних стадиях прогноз неутешителен, так как шансы составляют около 25-30 % [2] . При сравнении с другими онкологическими заболеваниями эта цифра достаточно высока.
Причиной смерти обычно становится развитие асцита, метастазы в кости, лёгкие, печень и головной мозг, а также нарушение кишечной проходимости или истощение [2] .
Примечания
Литература
Ссылки (на английском)
папиллома • аденома, фиброаденома, цистаденома, аденоматозный полип • неинвазивная карцинома • базалиома • плоскоклеточный рак • аденокарцинома • коллоидный рак • солидный рак • мелкоклеточный рак • фиброзный рак • медуллярный рак • саркома
фиброма (десмоид) • гистиоцитома • липома • гибернома • лейомиома • рабдомиома • зернисто-клеточная опухоль • гемангиома • гломусная опухоль • лимфангиома • синовиома • мезотелиома • остеобластома • хондрома • хондробластома • гигантоклеточная опухоль • фибросаркома • липосаркома • лейомиосаркома • рабдомиосаркома • ангиосаркома • лимфангиосаркома • остеогенная саркома • хондросаркома
астроцитома • астробластома • олигодендроглиома • олигодендроглиобластома • пинеалома • эпендимома • эпендимобластома • хориодная папиллома • хориодкарцинома • ганглионеврома • ганглионейробластома • нейробластома • медуллобластома • глиобластома • менингиома • менингиальная саркома • симпатобластома • ганглионейробластома • хемодектома • невринома • нейрофиброматоз • нейрогенная саркома
ВВЕДЕНИЕ
Проблема диагностики и лечения новообразований яичников является одной из самых трудных разделов онкогинекологии. У большинства больных злокачественными опухолями яичников заболевание выявляется на поздних стадиях, а результаты их лечения остаются неутешительными. Несмотря на высокую чувствительность многих современных методов диагностики, их специфичность недостаточна для дифференциации доброкачественного и злокачественного процессов в яичниках, что не может обеспечить эффективный скрининг для раннего выявления злокачественных опухолей. Общая пятилетняя выживаемость больных раком яичников не превышает 35-40%.
1.1. ЗАБОЛЕВАЕМОСТЬ, СМЕРТНОСТЬ И ВЫЖИВАЕМОСТЬ
Большинство опухолей яичников являются эпителиальными. Все опухоли могут быть разделены на доброкачественные и злокачественные. Статистические сведения о частоте опухолей яичников в женской популяции касаются только их злокачественных форм. Среди злокачественных опухолей женских половых органов опухоли яичников (карциномы, стромальноклеточные и герминогенные опухоли) занимают третье место после рака шейки и тела матки, их доля достигает 30%. Среди всех злокачественных новообразований у женщин рак яичников занимает седьмое место по частоте, составляя 4-6%. По данным Международного агентства по изучению рака (МАИР) ежегодно в мире регистрируется более 165 000 новых случаев рака яичников, и более 100 тыс. женщин погибают от злокачественных новообразования яичников. Если удельный вес (%) рака яичников в онкологической заболеваемости женщин во всех странах мира примерно одинаков, то частота заболеваемости на 100000 женского населения (%ооо) значительно варьирует. В Европе, особенно в Северных странах и Великобритании, а также в Северной Америке, стандартизованные показатели заболеваемости наиболее высокие (10 и более на 100 000). В Центральной и Южной Америке, Африке и Азии, включая индустриальные страны, такие как Япония, но исключая Израиль, эти показатели значительно ниже (7 и менее на 100 000). За последние 20 лет уровни заболеваемости раком яичников в большинстве стран с высоким риском (Скандинавия, Великобритания, США, Канада) остаются стабильными и даже несколько снижаются. В то же время отмечено повышение заболеваемости в странах с низким риском, таких как Япония, Индия, Сингапур, а также в некоторых странах Южной и Восточной Европы (Португалия, Испания, Югославия, Польша). В России ежегодно рак яичников выявляется более чем у 11 000 женщин (10, 17 на 100 000), занимая седьмое место в структуре общей онкологической заболеваемости (5%) и третье — среди гинекологических опухолей после рака тела и шейки матки [2]. За последние 10 лет в стране произошел прирост заболевания на 8, 5%.
По показателям смертности рак яичника опережает рак тела и шейки матки, занимая 5-е место среди причин смерти от всех опухолей у женщин. В большинстве индустриальных стран мира рак яичников имеет самые высокие показатели смертности среди всех гинекологических опухолей, что связано с поздней диагностикой заболевания. Летальность больных раком яичников на первом году после установления диагноза составляет 35%. По сводным данным популяционных раковых регистров стран Европы, однолетняя выживаемость больных раком яичников составляет 63%, трехлетняя — 41%, пятилетняя — 35%. За последнее десятилетие отмеченное в Европе увеличение пятилетней выживаемости больных злокачественными опухолями яичников на 3% (с 32% до 35%), а в США — на 4% (с 36% до 39%) объясняется не столько улучшением диагностики, сколько эффективным применением платиновой химиотерапии в лечении диссеминированных форм рака яичников и герминогенных опухолей. Риск заболеть раком яичника на протяжении жизни составляет 1,5%, и 1 из 100 женщин может умереть от этого заболевания [92].
1.2. ЭТИОЛОГИЯ
Причины возникновения большинства опухолей яичников остаются неизвестны. Обзоры эпидемиологических исследований указывают на высокую частоту рака яичника в индустриальных странах, за исключением Японии. Возможно, это обусловлено диетическими факторами, а именно, высоким потреблением животных жиров [34, 60], хотя последние исследования [71] не подтверждают связи развития рака яичников ни с высококалорийной пищей, ни с употреблением алкоголя, кофеина и никотина [60]. Нет и убедительных доказательств возможного канцерогенного эффекта радиации, применяемой в диагностических и терапевтических целях, в развитии рака яичников, хотя в эксперименте модели опухолей яичников создавали путем облучения грызунов рентгеновскими лучами или при помощи пересадки ткани яичника в селезенку или другие органы портальной системы. В нескольких исследованиях развитие карцином яичников связывают с использованием талька в гигиенических целях [45].
Наследственный фактор является одним из важных факторов риска в развитии рака яичников, хотя большинство карцином яичника (95%) являются спорадическими по своей природе и их риск развития в популяции не превышает 1,5%, т. е. заболевает 1 из 100 женщин. Тогда как к наследственным формам могут быть отнесены только 5% случаев рака яичника, риск развития заболевания может возрастать до 50%, т. е. заболевает каждая вторая [6]. В настоящее время описаны три синдрома наследственной предрасположенности к возникновению рака яичника: семейный рак яичников, семейный рак молочной железы/яичников, синдром Линча II.
Семейный рак яичников. Риск развития заболевания зависит от числа ближайших родственников, заболевших ранее раком яичников. В семьях, в которых зарегистрирован один случай рака яичников у родственницы 1 степени родства (у матери, дочери или родной сестры), риск заболеть в 2-3 раза выше, чем в популяции, и составляет 4-5%. В семьях, где выявлен рак яичника у одной родственницы 1 степени родства и одной родственницы 2 степени родства (у бабушки, внучки, двоюродной сестры, тети или племянницы), риск возрастает в 4-5 раз по сравнению с популяционным и равняется 7%. В семьях, где две родственницы 1 степени родства заболевают раком яичника, рискует заболеть каждая вторая, т. е. риск равен 50% [23]. Поэтому при медико-генетическом консультировании крайне важен тщательный сбор семейного анамнеза.
Семейный рак молочной железы /яичников. В таких семьях ближайшие родственницы заболевают раком молочной железы в молодом возрасте (до 50 лет) и раком яичников. Степень риска заболеть раком этих локализаций также определяется числом заболевших родственниц различной степени родства. Кроме того, как уже упоминалось, у женщин, ранее заболевших раком молочной железы или яичников, риск развития второй опухоли в 2-4 раза выше, чем в популяции.
Синдром Линча II. При этом синдроме в семьях среди ближайших родственников прослеживается заболеваемость аденокарциномами различных локализаций, преимущественно колоректальным раком, раком молочной железы и эндометрия, раком яичников. Риск возникновения аденокарциномы среди членов семьи также зависит от числа заболевших родственников, и он в любом случае выше в 2 раза, чем в популяции [46].
Недавно были идентифицированы гены BRCA1 в хромосоме 17 ql2-21 и BRCA2 в хромосоме 13 ql2, которые оказались ответственными за возникновение наследственных форм рака молочной железы и рака яичников. Выявление при описанных семейных синдромах мутаций в этих генах свидетельствует о наследственной передаче злокачественной опухоли. Однако рутинное генетическое тестирование ограничено по нескольким причинам. Во-первых, определение возможной точечной мутации на протяжении более 100 000 основании гена у больной и ее родственников при выявленном семейном синдроме остается весьма трудоемким, дорогостоящим и не всегда эффективным даже в современных генетических лабораториях. Во-вторых, генетическое тестирование наследственных форм рака яичников и молочной железы несет в себе этические и социальные проблемы. Отсутствие мутации генов BRCA1 и BRCA2 у обследуемой пациентки не исключает развития спорадических форм этих злокачественных опухолей. Выявление же мутаций генов BRCA1 и BRCA2 у здоровых носительниц ставит вопрос о рекомендациях по ранней диагностике и профилактике заболевания, которые во многом не решены в отношении скрининга рака яичника.
В табл. 1 определены критерии умеренного риска возникновения наследственного рака яичника [6].
1. Две родственницы 1* степени родства с наличием рака яичников в анамнезе
2. Одна родственница 1 степени родства с диагнозом рака яичников и одна родственница 1 степени с диагнозом рака молочной железы в возрасте моложе 50 лет
3. Одна родственница 1 степени родства с диагнозом рака яичников и две родственницы 1 и/или 2** степени с диагнозом рака молочной железы в возрасте моложе 60 лет
4. Наличие мутации гена BRCA1 или BRCA2, ответственных за возникновение рака яичников
5. Три родственницы 1 и/или 2 степени родства с диагнозом рака толстой кишки и один случай рака яичников
* Родственницы 1 степени родства — мать, дочь, родная сестра
** Родственницы 2 степени родства — бабушка, внучка, двоюродная сестра, тетя, племянница
Представленные эпидемиологические данные касаются эпителиальных злокачественных опухолей, т. е. рака яичников. В происхождении неэпителиальных опухолей (стромально клеточных и герминогенных), поражающих женщин преимущественно молодого возраста и детей, основная роль отводится неблагоприятным факторам в период эмбриогенеза. В развитии гранулезоклеточных опухолей также отмечена связь с гиперстимуляцией яичников кломифенцитратом или гонадотропинами при лечении бесплодия. По мнению Wiliemsen [S8], гиперстимуляция, возможно, способствует росту уже существующей опухоли или же возросший уровень фолликулостимулирующего гормона индуцирует канцерогенез в гранулезоклеточной ткани, хотя не исключается и случайное совпадение.
1.3. ПАТОГЕНЕЗ
Эпителиальные опухоли составляют 60% всех новообразований яичников и 80-90% их злокачественных форм. Остальные опухоли возникают из зародышевых и стромальных клеток. Эпителиальные опухоли развиваются из покровного эпителия яичников, т. е. из серозы. В течение эмбриогенеза выстилка целомической полости состоит из мезотелиальных клеток мезодермального происхождения, при этом гонадный валик покрыт серозным эпителием. Мюллеровы протоки, которые дают начало фаллопиевым трубам, матке и влагалищу, являются результатом инвагинации мезотелиальной выстилки. Клетки эпителиальных опухолей могут напоминать различные варианты дифференцировки мюллеровского типа. Серозные опухоли могут иметь сходство с фаллопиевой трубой, муцинозные — с эндоцервиксом, эндометриоидные — с эндометрием. Клетки герминогенных (эмбриональных) опухолей развиваются из зародышевых клеток, мигрирующих в гонады. Мезенхима является источником развития стромы яичника, и стромально клеточные опухоли развиваются из этих клеток.
Согласно овуляторной гипотезе возникновения эпителиальных опухолей, циклическая пролиферация покровного эпителия при непрерывных овуляторных циклах ведет к формированию кист включения. В дальнейшем под влиянием различных гормонов, вырабатываемых в строме яичника, пролиферирующие эпителиальные клетки могут формировать аденомы. Высокий уровень гонадотропинов также может обладать стимулирующим эффектом на пролиферирующий эпителий. Однако остается спорным, что цистаденомы являются предшественниками опухолей с низкой степенью злокачественности (пограничных), которые, в свою очередь, развиваются в инвазивные формы эпителиальных карцином. Последние молекулярно-генетические исследования выявили, что гистологически доброкачественные кисты с очагами малигнизации имели мутации гена р53, ответственного за супрессию опухоли, тогда как в доброкачественных опухолях без очагов малигнизации не было отмечено мутации гена р53 [96]. Тем не менее, пограничные опухоли также не имели мутации р53 [76]. Исследователи полагают, что часть цистаденом генетически предрасположены к развитию инвазивной злокачественной опухоли, а молекулярно-генетическое поведение пограничных опухолей имеет другой характер.
В большинстве случаев злокачественного течения эпителиальных опухолей яичников диссеминация происходит путем эксфолиации опухолевых клеток с поверхности пораженной яичниковой ткани с током внутрибрюшинной жидкости по всей брюшной полости, поражая париетальную и висцеральную брюшину, преимущественно правую половину диафрагмы и капсулу печени. Кроме того, сальник является излюбленным местом метастазирования рака яичников. Лимфогенные метастазы встречаются чаще при уже распространенном раке яичника в брюшной полости. Однако у 10-20% больных с локализованными формами рака яичников могут быть метастазы в забрюшинных лимфатических узлах [58]. Метастазирование в парааортальные лимфатические узлы осуществляется через подвешивающую связку яичника, в тазовые — через широкую связку и параметрии, в паховые — через круглую связку. Лимфогенное метастазирование как первый этап диссеминации более характерен для герминогенных опухолей. Наряду с нарушением нормального оттока лимфы с увеличением проницаемости канцероматозно измененной брюшины появляется асцит, в дальнейшем присоединяется плеврит, чаще правосторонний. У 2-3% больных возможно гематогенное метастазирование с поражением печени, костей, головного мозга. Не исключается прямое прорастание опухоли яичников в ректо-сигмоидный отдел кишки, мочевой пузырь.
Читайте также:

