Эндопротезирование при саркоме юинга
Онкологическое эндопротезирование единственная возможность сохранить хорошее качество жизни после удаления злокачественной опухоли костей. Остеосаркомой, саркомой Юинга, хондросаркомой болеют преимущественно подростки и лица молодого возраста. Имплантация эндопротеза позволяет им вести нормальную жизнь после выздоровления.
Установка импланта никак не влияет на эффективность противоопухолевого лечения.
Органосохраняющие операции как золотой стандарт
Хирургические вмешательства в онкоортопедии начали применять еще в 80-90х годах. Тогда врачи сохраняли нижнюю конечность по строгим показаниям. Эффективность противоопухолевого лечения довольно высока (пятилетняя выживаемость составляет 75-85%).
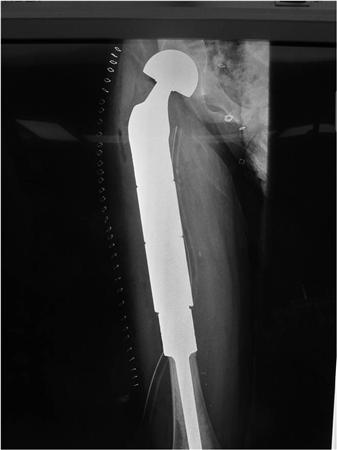
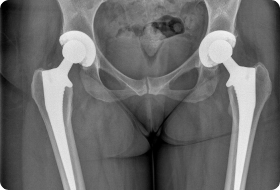
Онкологический имплант бедренной кости.
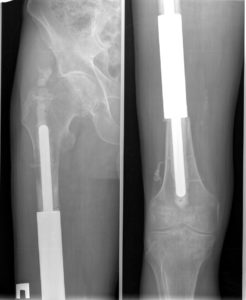
Эндопротезы устанавливают после удаления опухоли любого крупного сустава (коленного, тазобедренного, голеностопного, плечевого, локтевого). Пациентам со злокачественными новообразованиями плечевых, бедренных, большеберцовых костей выполняют их тотальное или диафизарное эндопротезирование — заменяя не сустав, а часть трубчатой кости.
Суть онкологического эндопротезирования заключается в замене удаленных частей сустава искусственными имплантами. Это восстанавливает функции нижней конечности. Операция спасает в 85-90% случаев.
Противопоказания к хирургии
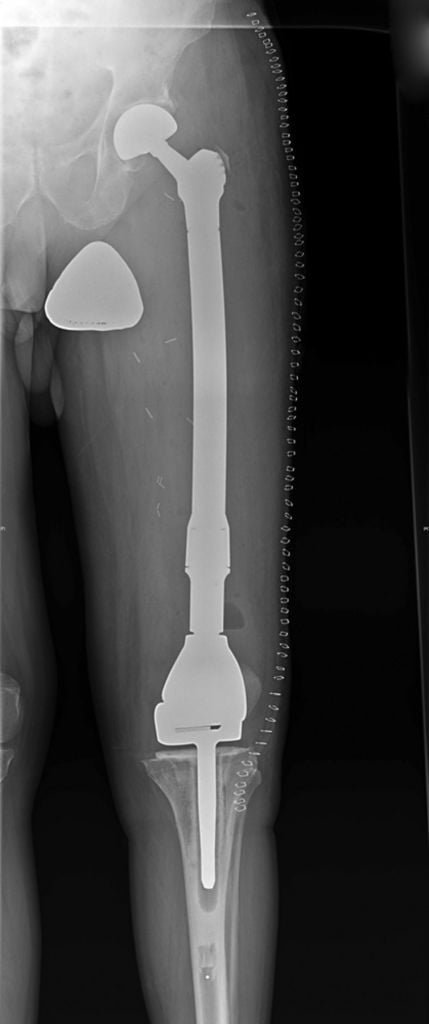
Операция по полной замене бедренной кости с имплантом коленного сустава.
Существует ряд ситуаций, когда ампутация ноги необходима. Иногда отказ от органосохраняющей операции спасает жизнь человека, а попытка сохранить нижнюю конечность приводит к его скорой гибели.
Абсолютные показания к ампутации:
- распад злокачественного новообразования;
- диссеминация (распространение) опухолевых клеток вследствие некачественно выполненной биопсии;
- поражения магистральных сосудов или нервов конечности.
Зачастую врачи рекомендуют ампутацию больным с патологическими переломами, осложнениями химиотерапии и тяжелыми поражениями жизненно важных органов, сопровождающимися декомпенсацией их функций. В этих случаях удаление нижней конечности дает человеку намного больше шансов.
Противопоказанием является невозможность сформировать мышечный футляр для импланта. Это ставит под угрозу приживление протеза и дает риск развития инфекционных осложнений.
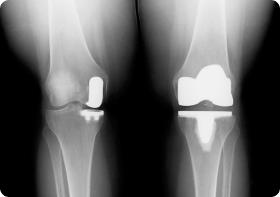
Особенности онкологического эндопротезирования
Если при обычной замене сустава врачи выполняют стандартную резекцию, то при злокачественных опухолях объем удаления костной ткани увеличивается. Врачам нужно подбирать особый имплант каждому больному. Онкологические эндопротезы имеют гораздо больший размер, чем ортопедические.
Таблица 1. Основные различия между онкологическим и обычным эндопротезированием.
| Традиционное | Онкологическое | |
| Предоперационная подготовка | Общеклинические и визуализирующие методы исследования. | Объемное обследование, включающее биопсию, ангиографию, сцинтиграфию, КТ, МРТ и другие нужные методы. |
| Особенности устанавливаемых эндопротезов | Стандартные моноблочные или модульные протезы с цементной или бесцементной фиксацией. | Модульные эндопротезы, форму и размер которых можно отрегулировать в ходе операции. Подобные мегапротезы могут полностью заместить удаленную фрагменты костей. |
| Ход операции | Больному удаляют деструктивно измененные части сустава, а на их место устанавливают эндопротез. | После полноценного обследования пациенту удаляют опухоль вместе с прилегающими тканями. Кости и сустав замещают протезом. Выполняют пластику мягких тканей нижней конечности. |
| Ожидаемые результаты | Полное восстановление функции сустава. Возможны осложнения, устранить которые можно консервативным или хирургическим путем. | Пятилетняя выживаемость после органосохраняющей операции составляет 80%. Онкологическое эндопротезирование позволяет восстановить функции сустава. Риск осложнений в этом случае выше, чем при выполнении обычной ортопедической операции. |
Обследование перед операцией
Перед началом лечения пациента тщательно обследуют. Это помогает выявить злокачественное новообразование, установить его локализацию и размеры.
- Рентгенография. Позволяет подтвердить наличие опухоли и ориентировочно оценить ее размеры. Не дает представления о состоянии магистральных сосудов, нервов, мягких тканей конечности.
- Сцинтиграфия костей скелета. Необходима для выявления метастазов злокачественного новообразования. Обнаруживает опухоли костей любой локализации.
- Биопсия. Наиболее точные результаты дает трепанационная и открытая биопсия. Пункционная и аспирационная менее информативны, поскольку в полученном в их ходе материале не всегда содержатся опухолевые клетки.
- КТ/МРТ. Детальный анализ структуры кости, оценить степень ее разрушения и состояние мягких тканей нижней конечности. Это помогает наиболее точно определить объем резекции и спрогнозировать результаты операции.
- Ангиография. Выявляет дефекты и опухолевые повреждения магистральных сосудов.
- Общеклинические исследования (общий анализ крови и мочи, биохимический анализ крови, ЭКТ, флюорография, УЗИ органов брюшной полости). Необходимы для оценки общего состояния пациента и выявления тяжелых сопутствующих заболеваний.
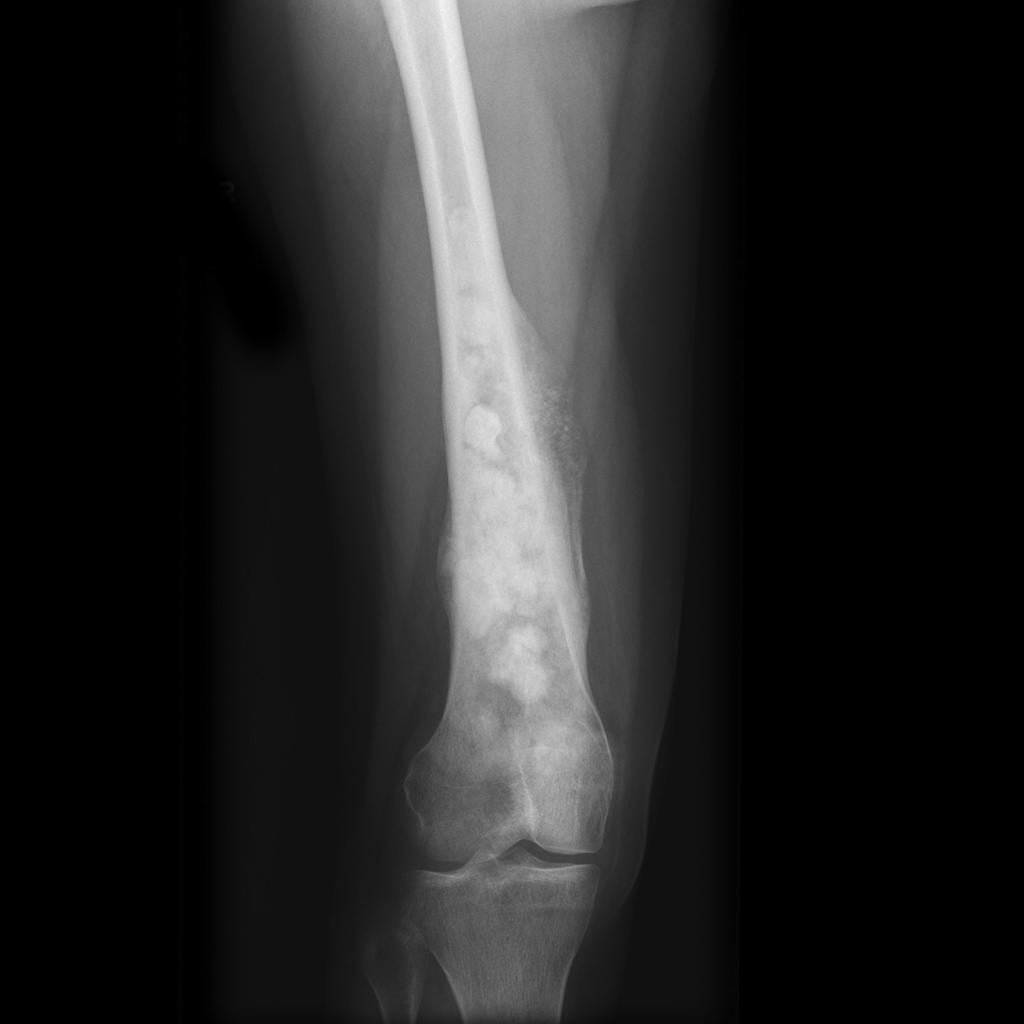
Остеосаркома на рентгене.
Комбинированное лечение опухоли
Для борьбы с опухолями костей используют химиотерапию, лучевую терапию и хирургическое лечение. Их умелое сочетание позволяет проводить органосохраняющие операции даже в тех ситуациях, в которых ранее ампутировали конечность. Химиотерапия позволяет нивелировать последствия перелома или неудачной биопсии.
Онкологические эндопротезы
Импланты, которые используются в онкоортопедии, обычно имеют гораздо больший размер. Это необходимо для замещения удаленных костных тканей. Логично, что мегапротезы нарушают биомеханику сустава, что приводит к нестабильности импланта. При опухолях нижней конечности пациентам могут замещать не только суставы, но и кости. Вид импланта зависит от локализации и размера злокачественного новообразования.
Виды онкологических протезов нижней конечности:
- заменяющие ТБС и часть бедренной кости;
- заменяющие коленный сустав и часть бедренной или большеберцовой кости;
- полностью замещающие бедренную кость;
- спейсеры – замкнутые эндопротезы коленного сустава;
- частично заменяющие и удлиняющие бедренную кость.

Основное отличие онкологических имплантов заключается в их массивности и сложности конструкции.
Производством онкологических протезов занимается несколько компаний: Stryker, ImplantCast, Biomet. Фирмы выпускают модульные эндопротезы, которые можно фиксировать цементным или бесцементным способом.
Особенностью модульных протезов является возможность собрать их во время операции. Это позволяет реконструировать дефекты костей любого размера. Применение модульных эндопротезов дает возможность избежать изготовления индивидуального импланта.
Неожиданные интраоперационные находки в онкологии нередки. Они вынуждают врачей удалять больше костной ткани, чем планировалось. Применение модульных протезов позволяет справиться с этой проблемой с минимальным ущербом для пациента. Чтобы заместить дефект, достаточно всего лишь раздвинуть эндопротез до нужного размера.
Любопытно! В онкоортопедии становятся все популярней эндопротезы с серебряным покрытием. Содержащиеся в нем ионы серебра оказывают антибактериальное действие и снижают риск развития инфекции.
Выполнение операции
Удаление костной ткани и установка протеза при злокачественных новообразованиях происходит совсем не так, как при обычном эндопротезировании. Во время хирургического вмешательства врачи придерживаются целого ряда правил.
Основные правила онкологического эндопротезирования:
- Соблюдение принципа футлярности. Злокачественную опухоль удаляют вместе с окружающими ее фрагментами здоровой костной ткани. Резекцию кости выполняют на расстоянии 5-6 см от новообразования. Вместе с опухолью удаляют зону предшествующей биопсии и все очаги возможной диссеминации.
- Соблюдение правил абластики и асептики. Во время хирургического вмешательства врачи тщательно следят за тем, чтобы опухолевые клетки не проникли в здоровые ткани. Чтобы избежать диссеминации, вначале перевязывают артерии и вены, а лишь затем иссекают опухоль. Параллельно с этим медработники проводят тщательную профилактику инфицирования операционной раны.
- Восстановление двигательной функции конечности. После установки протез прикрывают мышечными лоскутами и делают необходимую пластику. Это позволяет избежать развития инфекционных осложнений и некроза тканей в будущем.
- Адекватное послеоперационное ведение больных. Качественная реабилитация и правильное поведение пациента в послеоперационном периоде помогает восстановить функцию сустава и снизить риск возникновения непредвиденных осложнений.
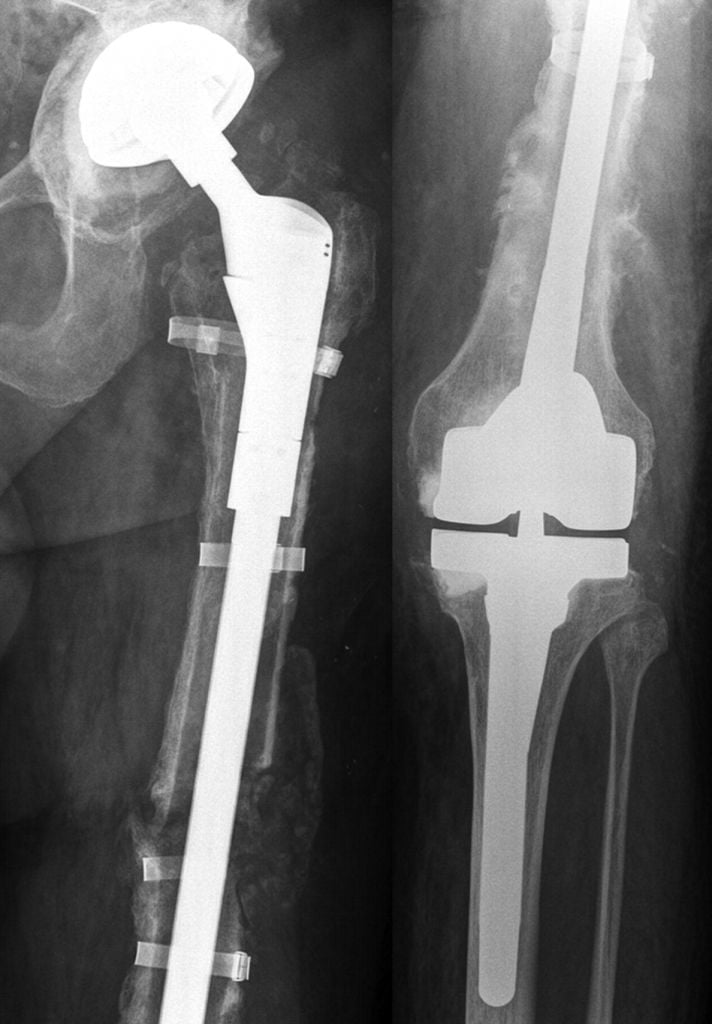
Массивный онкологический эндопротез ТБС.
Факт! Результаты органосохраняющей операции зависят от размера опухоли, степени ее злокачественности, поражения мягких тканей, сосудов и нервов конечности. Немалую роль в успехе лечения играет и внимательность, добросовестность и опытность врачей.
Лечение должно быть как местным, так и системным. При местном лечении курабильность достигается только в 10-20% случаев, и химиотерапия дает более благоприятный прогноз.
Местное лечение саркомы Юинга. В отличие от большинства сарком костей саркома Юинга представляет собой радиочувствительную опухоль. Поэтому основным методом местного лечения является радикальная высоковольтная лучевая терапия. Первичную опухоль облучают в дозах 55-60 Гр, которые даются фракциями по 2 Гр в течение 6-7 недель. Необходимо принять меры к тому, чтобы не облучить в этой дозе все мягкие ткани конечности.
В последние годы у некоторых больных после сеансов лучевой и химиотерапии стали развиваться поздние рецидивы. Поэтому в качестве адъювантного средства при лучевой и химиотерапии все чаще используется хирургическая операция с последующим эндопротезированием кости. В отдельных случаях опухолевый рост удается контролировать с помощью только хирургической операции, однако, учитывая высокую инвазивность опухоли, иногда следует сочетать хирургический метод с лучевой терапией. Еще одна причина отказа от лучевой терапии — риск развития радиационных сарком.
Так, риск развития радиационной саркомы в течение последующих 20 лет после лечения опухоли Юинга у детей, составляет 7%. Проблема состоит в том, что при больших опухолях хирургическим методом невозможно удалить весь пораженный участок, содержащий опухолевые клетки, и поэтому не удается избежать последующего облучения. Таким образом, выбор между хирургией и лучевой терапией сделать сложно, особенно в случаях опухолей костей таза. Злокачественные круглоклеточные опухоли костей лучше лечить в специализированных клиниках, а не в обычных больницах.
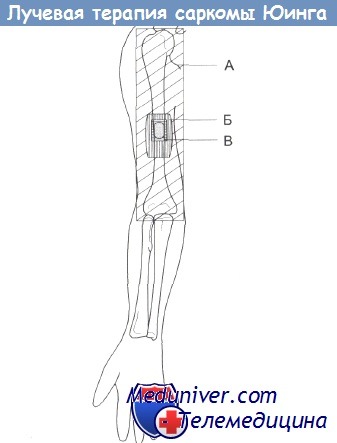
Формирование полей при лучевой терапии саркомы Юинга.
(А) Вся плечевая кость облучается в умеренной дозе (30 Гр)
(Б) Поле сужено до размеров опухоли и примыкающего участка кости (45 Гр)
(В) Облучение опухоли (60-70 Гр). Если опухоль не затрагивает эпифизов, их можно не облучать.
Химиотерапия саркомы Юинга
В последнее время эффективным методом лечения саркомы Юинга, который дает неплохие прогностические результаты, стала адъювантная химиотерапия. Наиболее часто применяются следующие препараты: доксорубицин, циклофосфамид, винкристин, актиномицин D и ифосфамид. Некоторой эффективностью также обладают этопозид, метотрексат и нитрозомочевина.
В настоящее время используется несколько рецептур, но ни одной из них нельзя отдать предпочтение. По-видимому, следует использовать все обычно применяющиеся цитостатики, причем назначать их в максимальных дозах. В последние годы утвердилась тенденция назначать интенсивную химиотерапию на срок 9-12 месяцев вместо приема цитостатиков в небольших дозах на протяжении 1-2 лет. Типичный курс начинается с назначения ифосфамида, доксорубицина и винкристина.
Больные принимают препараты в течение 12 недель, а затем проводится локальное лечение (операция и лучевая терапия). После операции продолжают назначать цитостатики, и когда достигнута максимальная доза доксорубицина, его заменяют актиномицином. В течение всего времени лечения больных необходимо регулярно обследовать: проводить анализы крови и рентгенографию грудной клетки, а при необходимости также сканирование костей. Разработка метода назначения химиопрепаратов в больших дозах с поддержкой аутологичных стволовых клеток периферической крови пока еще находится в стадии эксперимента.
Проводятся клинические испытания на больных, входящих в группу повышенного риска, например, у которых при обследовании в легких было обнаружено несколько метастазов. Предварительные результаты показывают, что для небольшого числа больных метод оказался эффективным. Эта эффективность связана со степенью ремиссии заболевания в период назначения препаратов в высоких дозах.
Прогноз саркомы Юинга
В настоящее время радикальное местное лечение и интенсивная химиотерапия обеспечивают 5-летнюю выживаемость 50-60% больных детей с локализованной опухолью. Большинство их, вероятно, вылечиваются. Хотя на успех лечения влияют многие факторы, несомненно, что наиболее важным из них является химиотерапия.
Для больных с опухолями костей таза прогноз оказывается менее благоприятным, чем для больных с опухолями костей конечностей. В случаях небольших опухолей, например, челюсти, мелких костей кисти и ступни прогноз оказывается благоприятным, и неясно, насколько интенсивной должна быть при этом химиотерапия. Основными прогностическими факторами являются величина опухоли и наличие метастазов. Большие опухоли в большей степени склонны к локальному росту и к метастазированию.
Рецидив метастазирующей опухоли часто приводит к дальнейшему увеличению количества метастазов. При этом методы стандартной химиотерапии почти неэффективны, хотя для больных с несколькими метастазами в легких существует шанс излечения. В настоящее время исследуются возможности применения в этом случае интенсивной химиотерапии.
Саркома Юинга — это злокачественная опухоль, которая чаще всего поражает детей и подростков. Заболевание является очень опасным из-за низкого процента выживаемости и проблем в диагностировании. Его нередко обнаруживают уже на поздней стадии, когда прогноз неутешителен.
Основные симптомы очень легко спутать с последствиями травм, остеопорозом и другими распространенными патологиями костей. Юный возраст большинства заболевших также создает трудности в обнаружении опухоли. Дети и молодые люди обычно не рассматриваются как группа риска в онкологии, а бытовые или спортивные повреждения суставов для них не являются редкостью.
Общие сведения о заболевании
Саркома Юинга может развиваться в любой части скелета и даже в мягких тканях, но чаще всего поражает конечности и длинные трубчатые кости. Еще Джеймс Юинг, открывший ее в 1921 году, писал об этом свойстве опухоли. Болезнь прогрессирует очень быстро с ранним развитием метастаз в костном мозге и легких.

Сама опухоль представляет собой маленькие круглые злокачественные клетки с небольшой цитоплазмой. Для них характерна правильная форма, низкая митотическая активность и перестройка определенной хромосомы (под номером 22). Характерной особенностью новообразования является раннее распространение на окружающие ткани, даже при локализованной форме обнаруживается мягкотканный компонент.
В одну группу заболеваний входят атипичная саркома Юинга и несколько других злокачественных периферических нейроэктодермальных опухолей. В момент постановки диагноза, метастазы обнаруживаются у 15-50% заболевших. Достаточно часто пациенты впервые обращаются за медицинской помощью уже при метастатическом поражении внутренних органов. Современный подход к лечению саркомы Юинга подразумевает наличие отдаленных микрометастазов практически у всех больных с локализованной формой опухоли.
Чаще всего опухоль развивается в следующих областях:
- Большеберцовой или малоберцовой кости (около 10% случаев);
- Костях таза (20-25%);
- Бедренных костях (до 27%);
- Верхних конечностях (15%).
Гораздо реже данный вид саркомы локализуется в ребрах, позвоночнике и ключице. Чем старше пациент, тем вероятнее обнаружить опухоль в нехарактерных для нее костях — черепе, лопатках, стопе, кистях или позвонках. В 2/3 случаев заболеваний отмечается поражение нижних конечностей и области таза. Нетипичными областями поражения являются: желудочно-кишечный тракт, почки, эндометрий, предстательная железа. В зарубежных источниках также упоминается опухоль Аскина, относящаяся к группе сарком Юинга, при которой новообразования распространяются в грудной полости, охватывая легкие и плевру.
Распространенность и группы риска
Пик заболевания приходится на возраст от 10 до 25 лет, период активного роста скелета наиболее опасен. Однако злокачественные образования данного типа могут поражать людей всех возрастов, известны случаи обнаружения опухоли у очень пожилых пациентов и младенцев. У больных старше 30 лет и детей младше 5-ти саркома Юинга встречается крайне редко. Начиная с 14-15 лет юноши болеют чаще девушек в 1,5 раза. Белые подростки подвержены опухоли в гораздо большей степени, чем чернокожие и азиаты.
Примерно у 40% пациентов 
саркома Юинга появляется после травмы. Ученые считают генетическую предрасположенность одним из определяющих факторов. Саркома Юинга является второй по частоте распространения среди опухолей костей у детей и подростков. Все же заболевание встречается достаточно редко — в среднем 0,6-3 случая на 1 млн населения.
Основные симптомы
Одним из первых симптомов заболевания отмечают локальную боль в области поражения. Сначала она носит периодический характер и может самопроизвольно ослабевать, но впоследствии становится интенсивной и постоянной. При поражении костей саркомой Юинга наблюдаются следующие симптомы:
- Небольшой отек в области очага развития опухоли;
- Повышенная температура (38-40С);
- Боль, локализующаяся в месте поражения;
- Расширение вен, расположенных близко к коже;
- Гиперемия участка поражения;
- Потеря в весе на фоне сниженного аппетита;
- Лихорадка;
- Общая слабость;
- Анемия и лейкопения.
Обычно с момента появления первых болевых симптомов до постановки окончательного диагноза проходит 6-12 месяцев. По мере развития заболевания опухоль быстро увеличивается в размерах, становится болезненна при пальпации.

Распространение опухоли в тазовой области провоцирует нарушение работы внутренних органов. Опухоль Аскина, относящаяся к группе сарком Юинга, вызывает дыхательную недостаточность и кровохарканье.
Боль усиливается по мере роста опухоли. Примерно в 1/3 случаев наблюдается локальное повышение температуры в области поражения. На более поздних стадиях (через 3-4 месяца) может происходить патологический перелом, он наблюдается у 5-10% больных.
Диагностика
Дифференциальная диагностика опухоли затруднена из-за ее схожести с другими мелкоклеточными злокачественными образованиями. По этой причине применяется несколько дополнительных исследований для постановки окончательного диагноза. При подозрении на саркому Юинга назначаются следующие виды обследований:
- Рентгенография области, пораженной опухолью;
- Магнитно-резонансная (МРТ) или компьютерная томография (КТ) ;
- Биопсия опухоли и костного мозга;
- Ультразвуковое исследование (УЗИ);
- Биохимический анализ крови;
- Позитронно-эмиссионная томография (ПЭТ);
- Цитогенетическое исследование;
- Иммуногистохимическое обследование;
- Молекулярно-генетический анализ;
- Флуоресцентная гибридизация;
- Миелограмма;
- Электрокардиограмма;
- Ангиография;
- Оостеосцинтиграфия.
Рентгенография места поражения проводится двух проекциях. Обследование должно определить наличие деструкции кости и распространение опухоли на мягкие ткани.

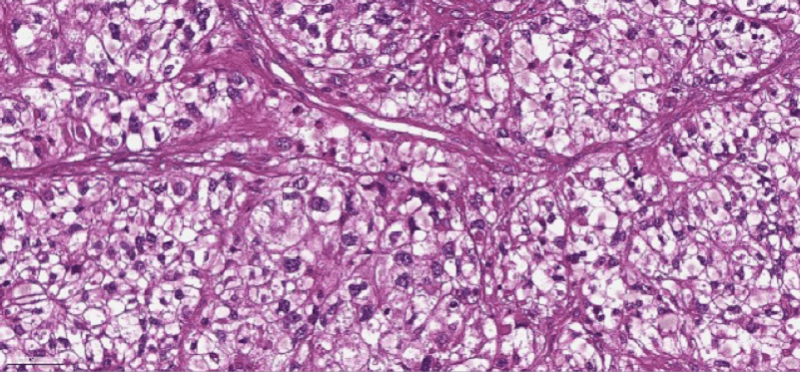
Для постановки диагноза одного гистологического исследования недостаточно. Морфологически саркома Юинга очень схожа с другими злокачественными опухолями, такими как синовиальная саркома, рабдомиосаркома, нейробластома и ряд других. Клетки расположены без видимой структуры и разделены фиброзными прослойками, для них характерен зеркальный вид за счет дисперсии хроматина в клеточных ядрах. Достаточно часто наблюдается некроз опухолевой ткани, при котором жизнеспособные клетки локализуются вокруг сосудов.
Диагностика заболевания требует выполнения расширенного иммуногистохимического исследования. Практически все клетки опухоли (95%) вырабатывают на своей поверхности определенный гликопротеин, который является продуктом онкогена. Для них также характерна экспрессия виментина, что отличает саркому Юинга от нейробластомы. Иммуногистохимический анализ подтверждает диагноз, поставленный на основе рентгенографического обследования.
Для цитологического исследования 
опухоли проводится биопсия. Процедура выполняется только опытным онкологом-ортопедом. Открытая инцизионная методика получения образцов ткани является более предпочтительной, чем тонкоигольная и трепан-биопсия. Многие специалисты также считают необходимым исследование костного мозга, поскольку его поражение является возможным даже при отсутствии метастазов в костях.
Магнитно-резонансная томография применяется для определения стадии заболевания. Метод позволяет оценить степень поражения мягких тканей, размеры опухоли и ее структуру.
Полимеразная цепная реакция используется при исследовании микроскопических метастазов в периферической крови и костном мозге. Биохимический анализ показывает повышение уровня С-реактивного белка, а также мочевины и креатинина, дисбаланс калия, натрия, кальция и другие характерные для опухоли изменения.
Лечение
Основными методами лечения Саркомы Юинга являются:
- Индукционная химиотерапия;
- Лучевая терапия;
- Хирургическая операция с эндопротезированием.
Комбинированное лечение саркомы Юинга является общепринятым, его длительность варьируется от 18 месяцев до 2-х лет. Химиотерапия обычно включает в себя несколько циклов с применением различных комбинаций следующих препаратов:
- Винкристин;
- Циклофосфан;
- Адриамицин;
- Цисплатин;
- Доксорубицин;
- Дактиномицин;
- Ифосфамид;
- Этопозид;
- Актиномицин.

После операции рекомендовано использование лучевой терапии. Объем и интенсивность определяют в зависимости от успеха предшествующего лечения, его показывает гистологическое исследование. При положительном исходе после завершения терапии пациентов обследуют сначала раз в 2-3 месяца в течение 2 лет, затем каждые 3 года.
Прогноз и успешность лечения
Выживаемость и успех лечения во многом зависят от локализации первичной опухоли. Прогноз благоприятнее при поражении длинных трубчатых костей, новообразования в тканях черепа гораздо труднее поддаются лечению. Локализованная форма саркомы Юинга при своевременной комплексной терапии характеризуется 70% выживаемостью. Прогноз значительно хуже для пациентов, лечение которых началось на стадии метастазирования в костный мозг. В этом случае даже химиотерапия в высоких дозах, тотальное облучение и операция по трансплантации не дают результатов выживаемости более 30%.
Однако методики и протоколы 
химиотерапии постоянно совершенствуются. Совсем недавно успешность лечения саркомы Юинга не превышала 10% от общего числа больных с метастатической формой заболевания. До начала применения цитостатических препаратов показатели 5-летней выживаемость оставались крайне низкими.
В борьбе со злокачественными периферическими опухолями костей и мягких тканей достигнут значительный прогресс. Сейчас можно с уверенностью сказать, Саркома Юинга излечима. Многие пациенты живут полноценной жизнью после завершения терапии, если к комплексному лечению приступают на ранней стадии заболевания.

- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
В случае онкологического заболевания в одном из парных органов, его удаление часто позволяет сохранить пациенту жизнь без ущерба для ее качества. Так, например, рак почки эффективно лечится ее удалением, при этом функциональная нагрузка перераспределяется на здоровую почку. Однако в случае с парными конечностями все не так однозначно — ампутация ноги ведет к значительной инвалидизации, депрессии и снижению качества жизни пациента. Для решения данных проблем около 60 лет назад начали применять онкологическое эндопротезирование — замена пораженных опухолью костей и суставов на искусственные конструкции. Клинический случай из моего фоторепортажа наглядно иллюстрирует тактику лечения пациента с учетом перечисленных приоритетов.
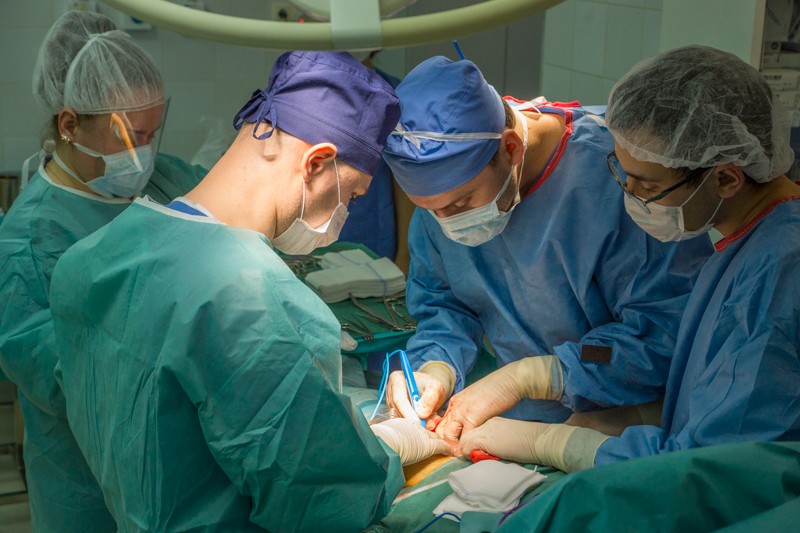
Описание клинического случая
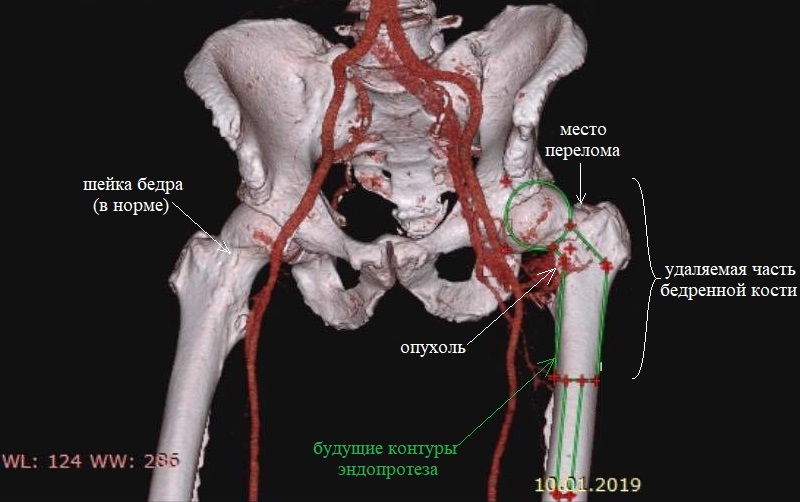
В 2007 году у мужчины была удалена почка по поводу онкологического заболевания. Однако через 10 лет были обнаружены метастазы в легких и левой бедренной кости. С помощью иммунотерапии удалось уменьшить очаги в легких, однако опухоль бедренной кости привела к ее патологическому перелому. На снимке видно густое сосудистое сплетение опухоли, которая прорасла в кость и стала причиной патологического перелома шейки бедра:
Сложность операции обуславливалась тем, что удаление метастазов рака почки сопряжено с крупными кровопотерями. Такая опухоль активно выделяет сосудистый фактор роста и очень обильно кровоснабжается. Интраоперационную кровопотерю корректируют переливанием эритроцитарной массы, а эта процедура, в свою очередь, может осложнять клубочковую фильтрацию почек. Поэтому у возрастного пациента с одной почкой выполнять операцию подобного объема очень опасно — высок риск потерять единственную почку. Именно поэтому ему отказали в ведущих медицинских центрах Украины, РФ и Германии. Однако решительно настроенный мужчина все-таки нашел эксперта в лечении пациентов с такой сложной патологией — члена Восточно-европейской группы по изучению Сарком (EESG) — Петра Сергеева, хирурга-онколога клиники Медицина 24/7.
Этап организации доступа
Пациент уложен на правый бок, операционный доступ организуется с внешней стороны левого бедра. Длинна разреза — от проекции тазобедренного сустава до середины бедра. Вид сзади:
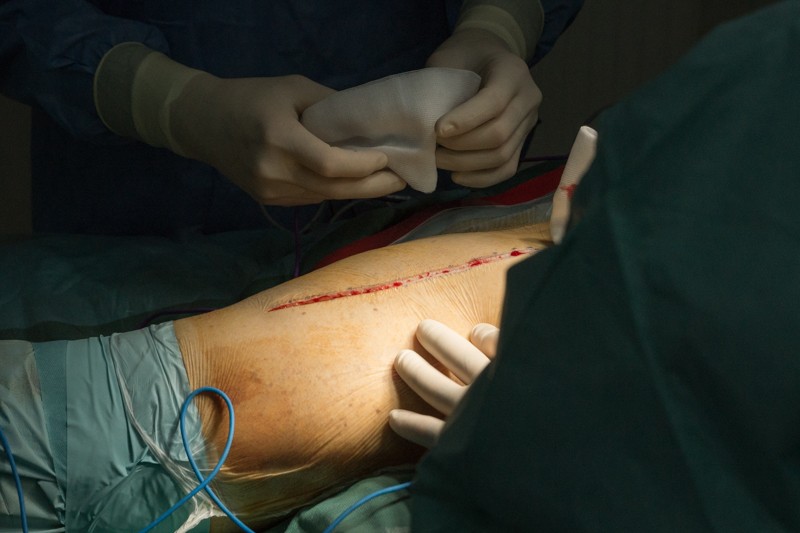
После рассечения кожи и жировой клетчатки хирург разрезает мышцы таким образом, чтобы минимизировать травматичность. От этого будет зависеть скорость последующей реабилитации.
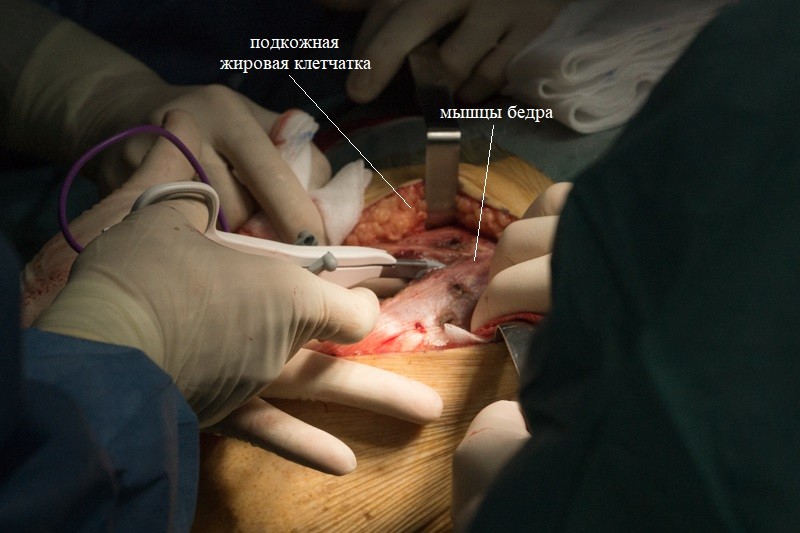
Мышцы обильно кровоснабжаются, поэтому часто приходится работать электрокоагулятором:
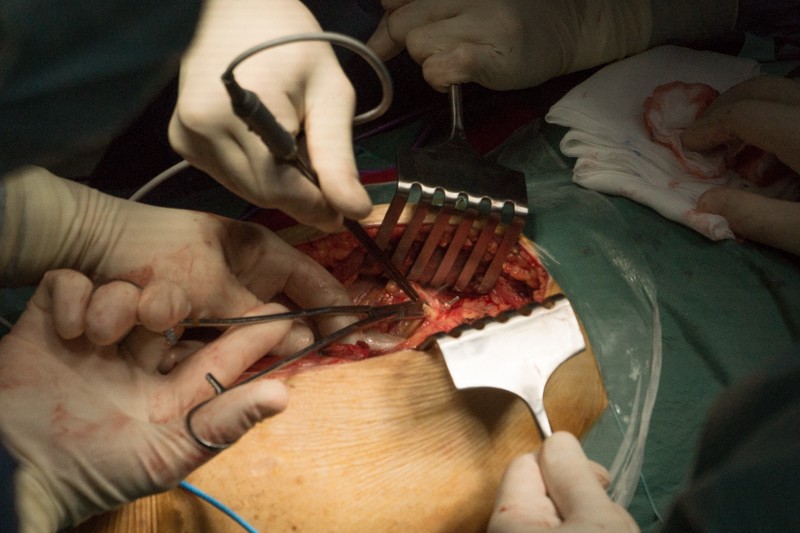
К удаляемой части бедренной кости крепится несколько крупных мышц, а также сосуды и нервы. Их отделение занимает значительное время операции. На снимке показан момент отсечения связок ягодичных мышц, вид спереди:
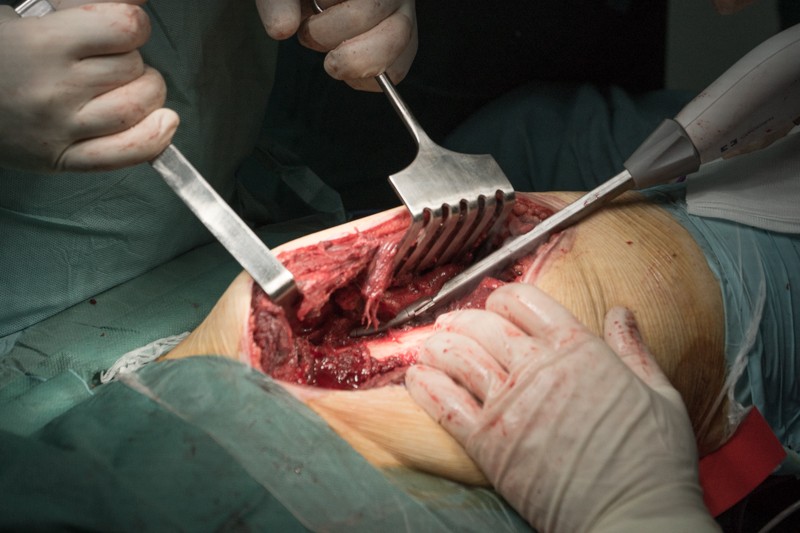
Скелетипрована надкостница, бедренная кость готова к резекции.
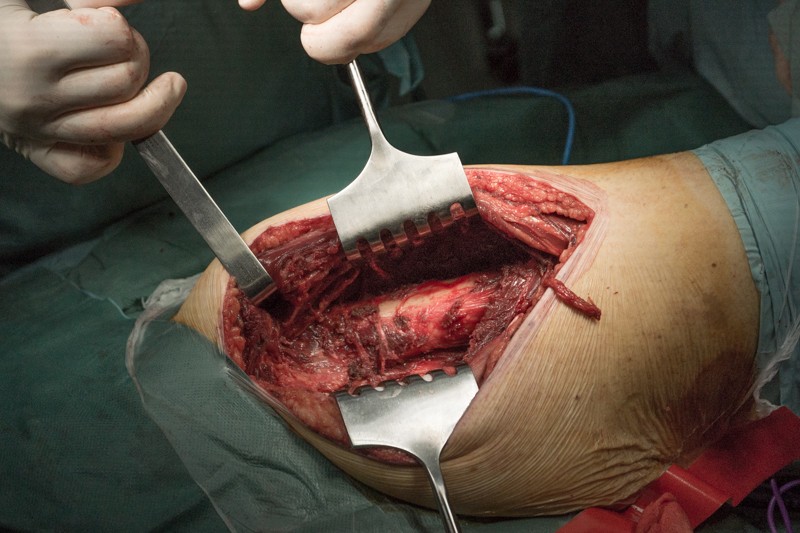
Этап резекции части бедренной кости с опухолью
Хирургическая электрическая пила-дрель для обработки костей:
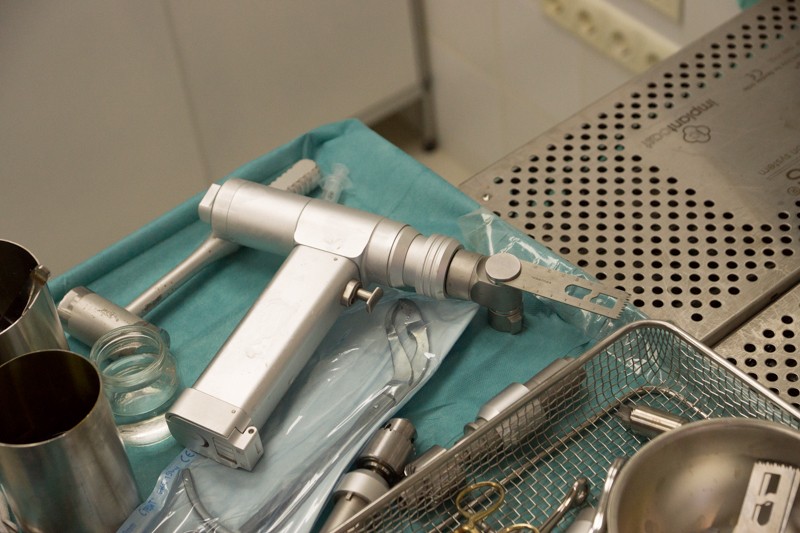
Процесс занимает меньше минуты.
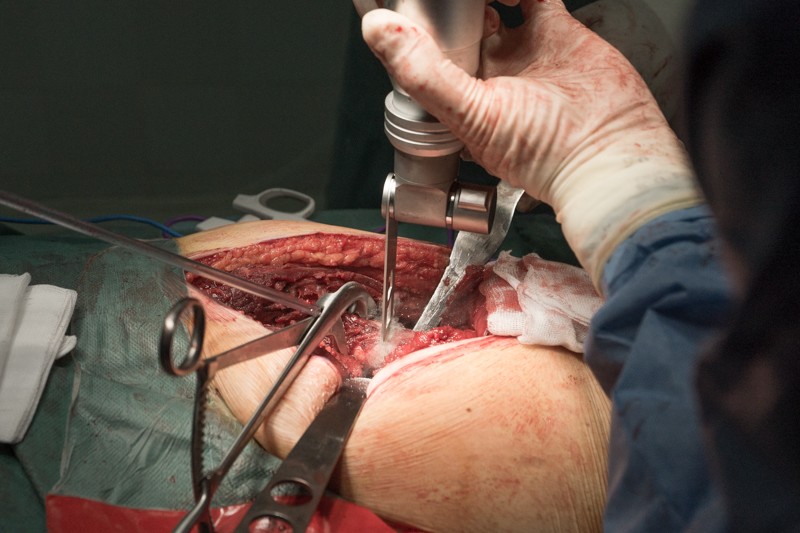
В месте распила хирург берет образцы костного мозга и направляет в лабораторию, чтобы убедиться, что оставшаяся часть бедренной кости не содержит опухолевых клеток.
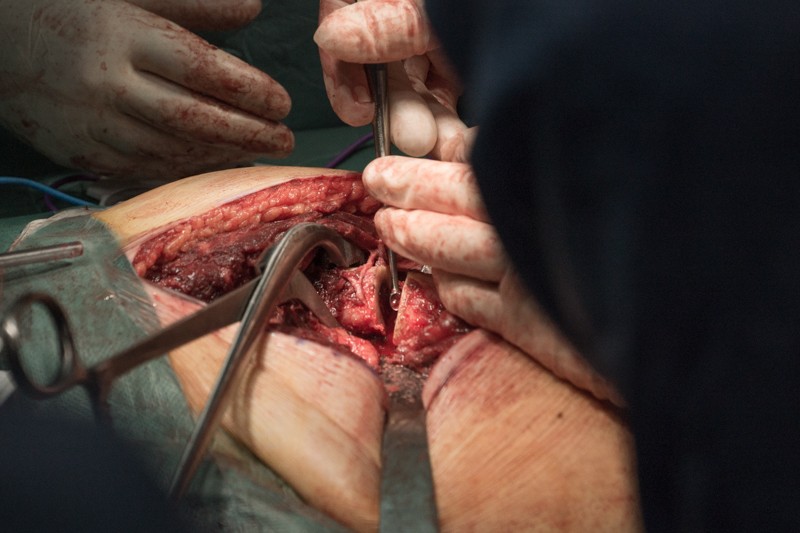
Резецированные связки и фрагмент бедренной кости удаляется вместе с опухолью без вскрытия оболочки кости. На фотографии показаны суставные поверхности тазобедренного сустава:
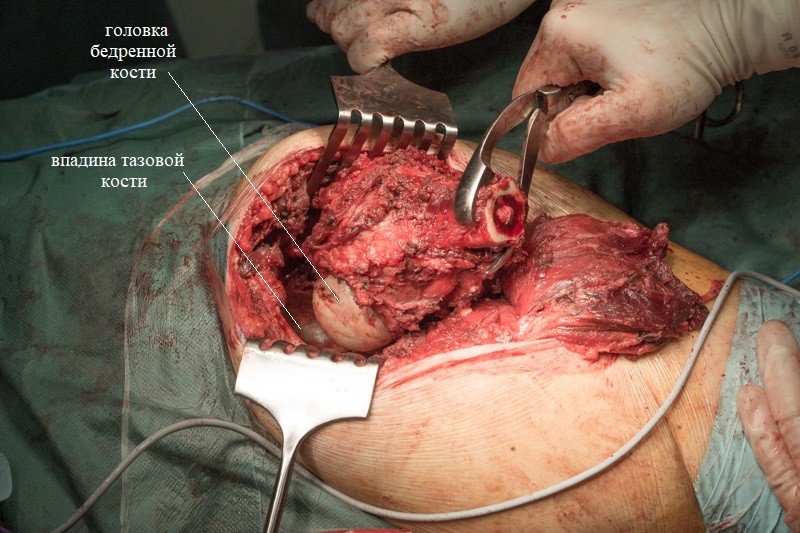
Хирург объясняет, что удаление большого объема мягких тканей вокруг опухоли снижает риск рецидива злокачественного заболевания.
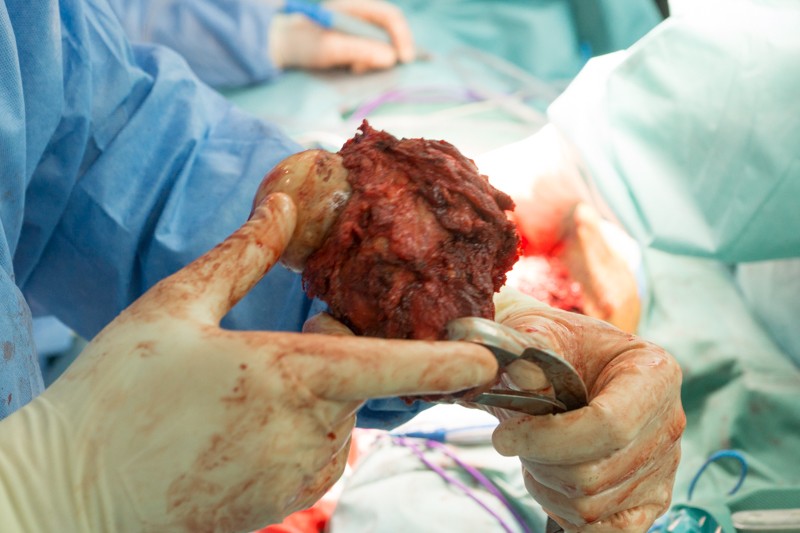
Этап эндопротезирования
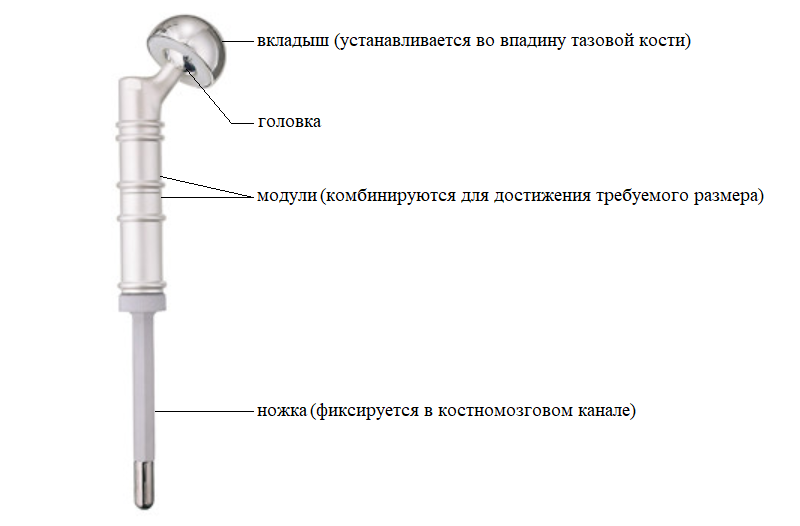
Первые эндопротезы изготавливались заранее под индивидуальный заказ, что не позволяло хирургам пересмотреть планируемый размер резекции кости в ходе операции. Кроме того, необходимо было ждать изготовления изделия не менее 2-х месяцев, что не всегда приемлемо в онкологии. Современные модульные эндопротезы позволяют хирургу прямо во время операции собрать конструкцию с индивидуальными размерами, учитывающими конституцию пациента и особенности клинического случая. Металлические компоненты эндопротеза состоят из сплавов титана, алюминия и никеля, что обеспечивает высокую прочность, низкий вес конструкции, а также инертность в отношении биологических тканей.
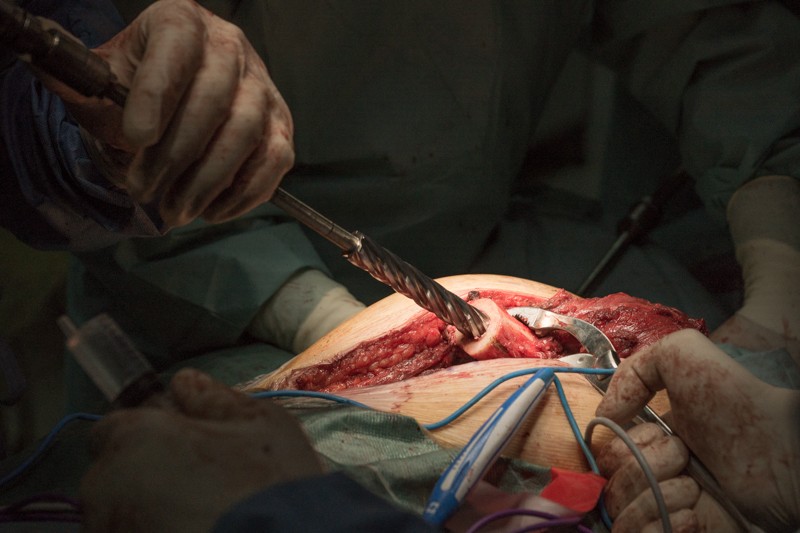
Перед установкой эндопротеза костномозговой канал высверливается для удаления костного мозга.
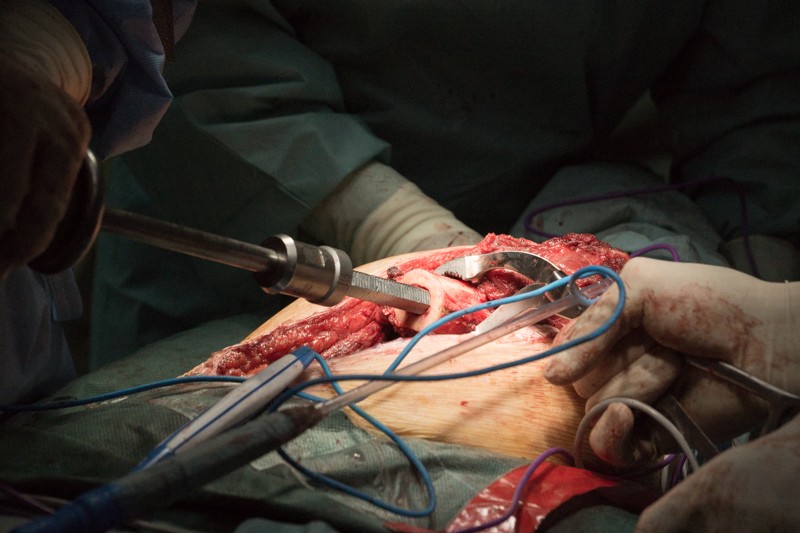
Затем путем многократной обработки костномозговому каналу придается форма шестиугольника — как и у ножки эндопротеза. Такая форма увеличивает площадь контакта ножки эндопротеза с твердыми тканями и обеспечивает более надежную фиксацию.
Специальной насадкой на торце кости формируется фаска для плотного прилегания эндопротеза и равномерного распределения нагрузки:
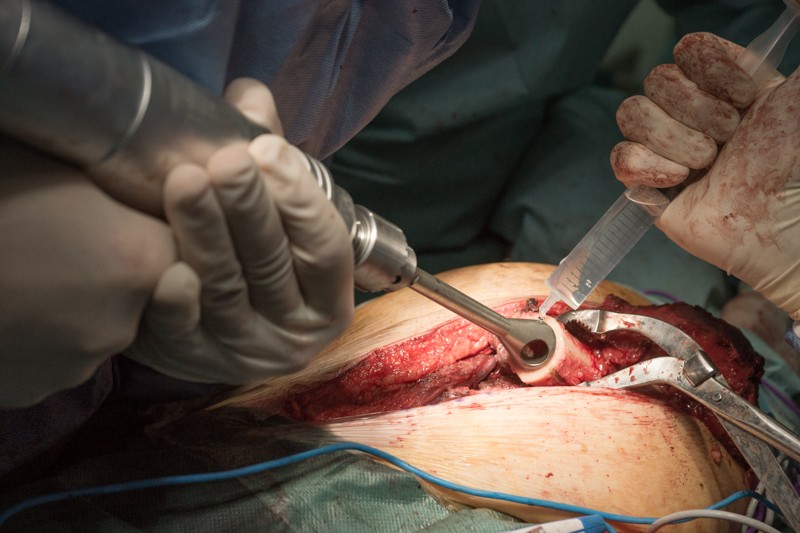
Перед установкой эндопротеза проводится примерка с использованием набора временных компонентов разных размеров:

Временные элементы конструкции установлены для проведения примерки:
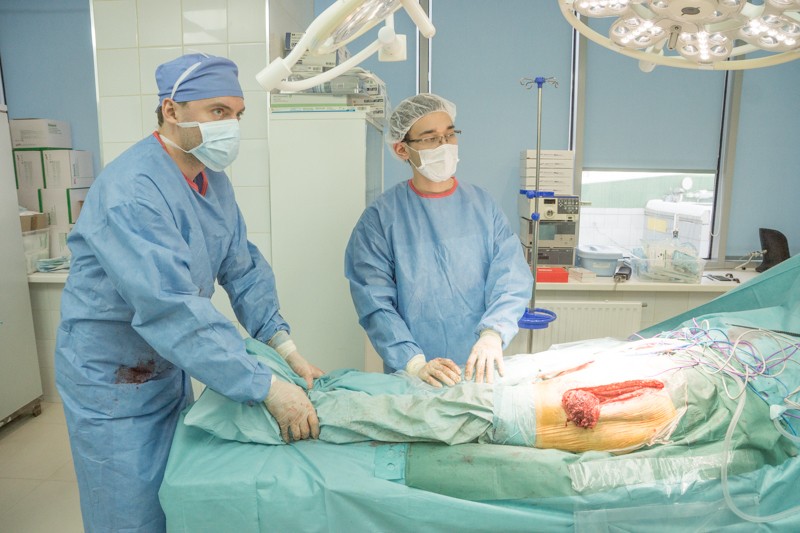
Пациента укладывают на спину, хирург оценивает симметрию и длину ног:
После примерки устанавливаются компоненты эндопротеза с нужными размерами. С учетом удовлетворительного состояния кости хирург принял решение об установке ножки эндопротеза с бесцементной фиксацией. Сначала в костномозговой канал устанавливается ножка эндопротеза. Она имеет матовое напыление гидроксиапатита, чтобы окружающие ткани лучше вросли и зафиксировали эндопротез:
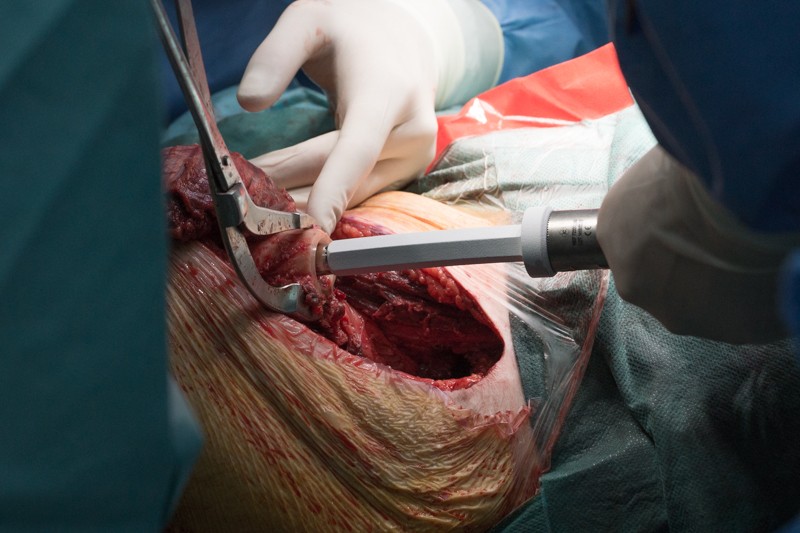
Ножка устанавливается при помощи молотка:
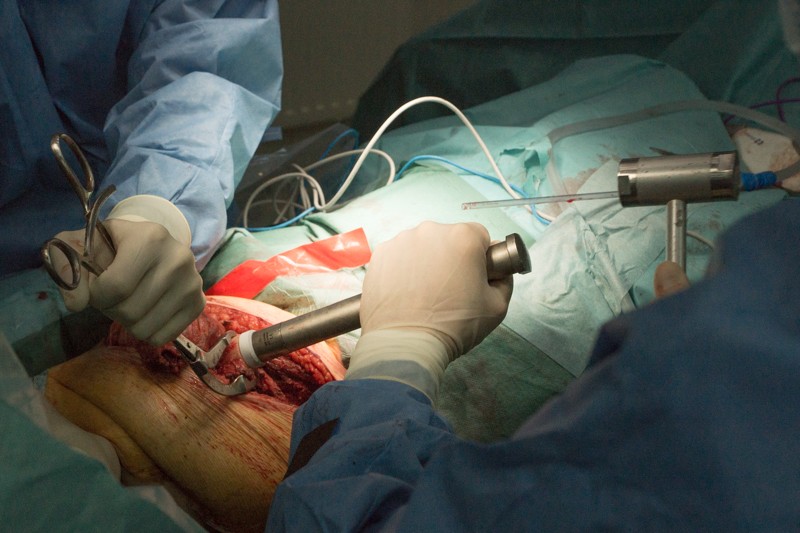
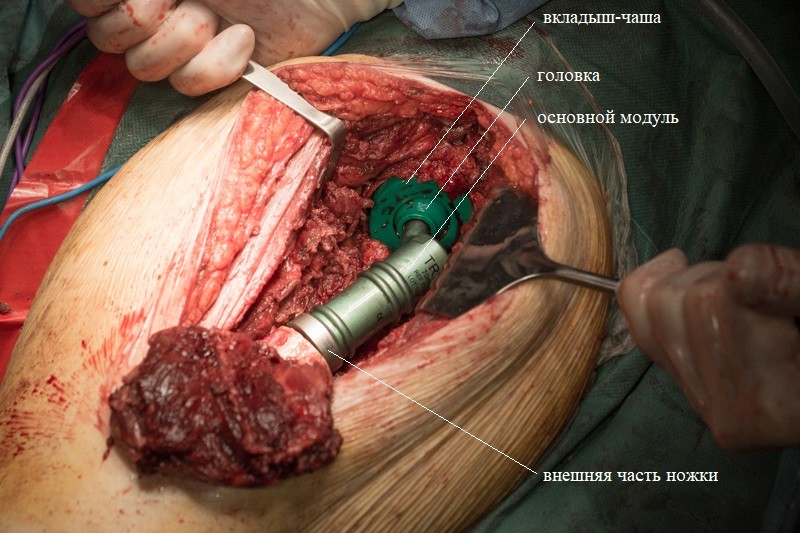
Внешняя часть ножки эндопротеза с креплением:
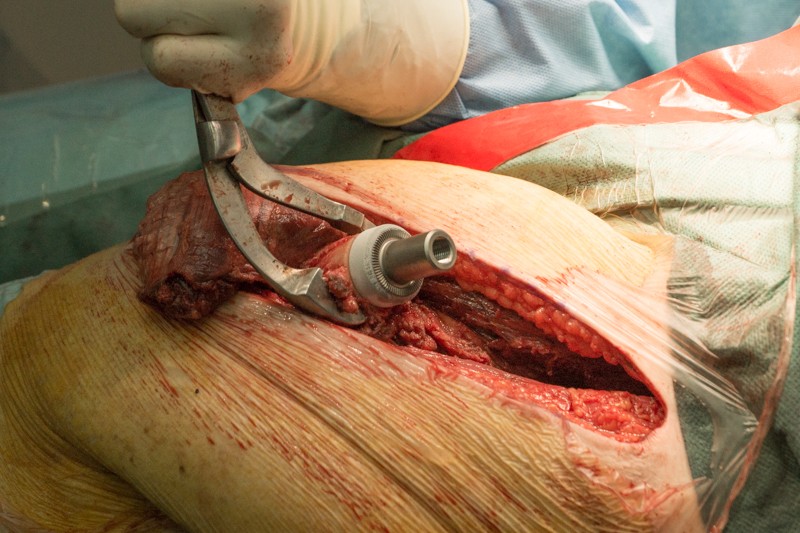
К ножке фиксируется основной модуль:
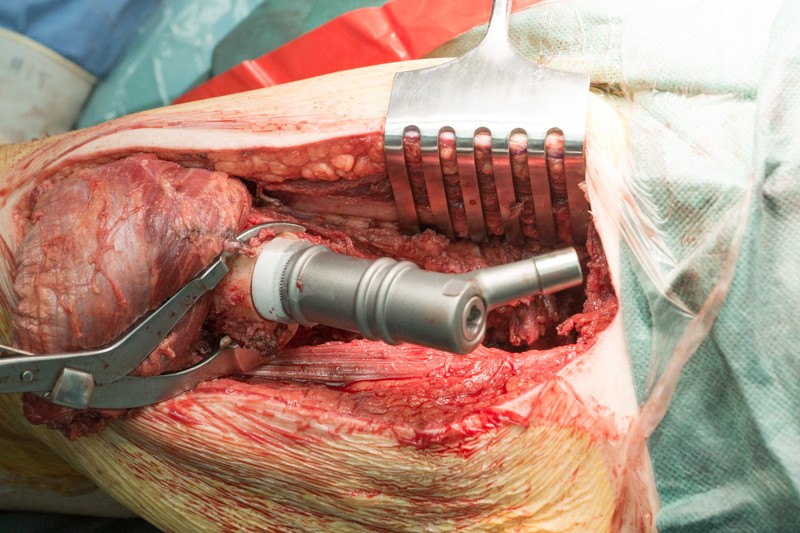
К периметру вертлужной впадины тазовой кости пришивается синтетическая муфта-чулок, которая будет служить основой для формирования новой суставной сумки вокруг эндопротеза.
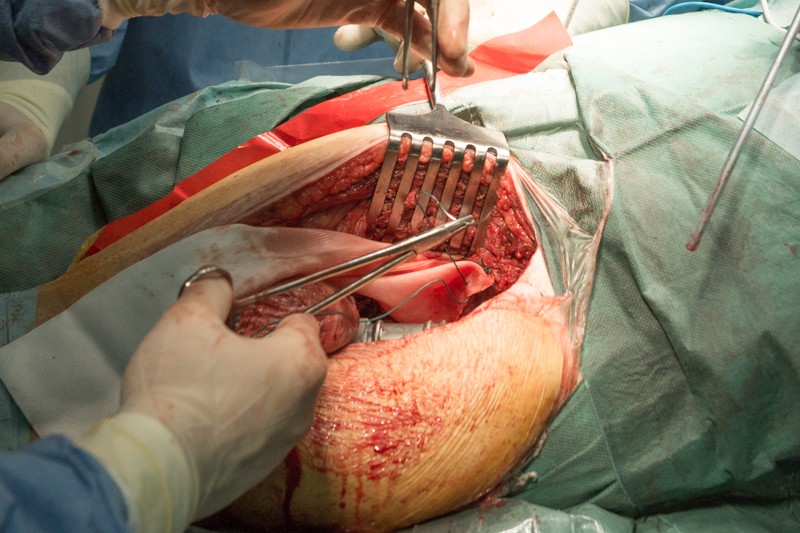
Затем на место удаленной головки бедренной кости в вертлужную впадину тазовой кости устанавливается вкладыш с головкой эндопротеза. Золотистый цвет головке придает напыление нитрида титана — гипоаллергенный и износостойкий материал:
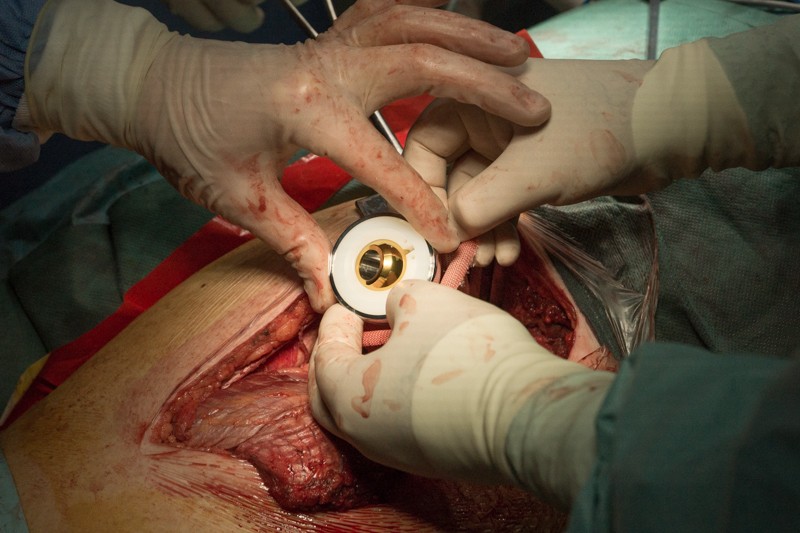
Весь эндопротез укрыт муфтой:
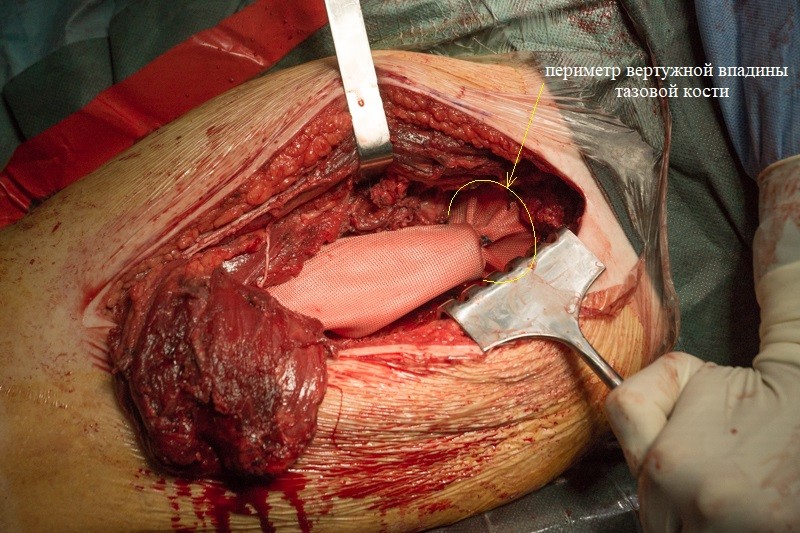
Ранее отсеченные от удаленного фрагмента бедренной кости мышцы подшиваются к муфте. В процессе реабилитации соединительные ткани прорастут в волокна муфты, тем самым образовав прочный связочный аппарат, с помощью которого мышцы смогут вновь управлять конечностью.
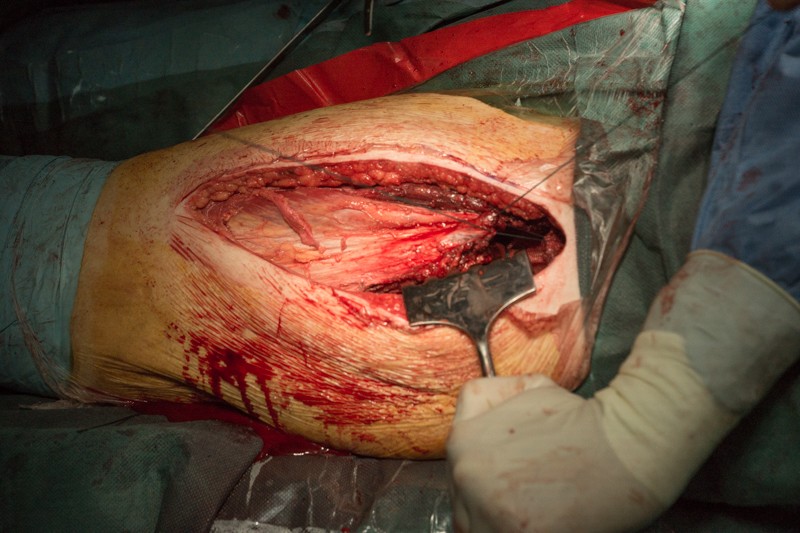
Устанавливается дренаж для отведения экссудата лимфы и крови, а также для промывания операционной раны антисептиками с целью профилактики инфекционных осложнений.
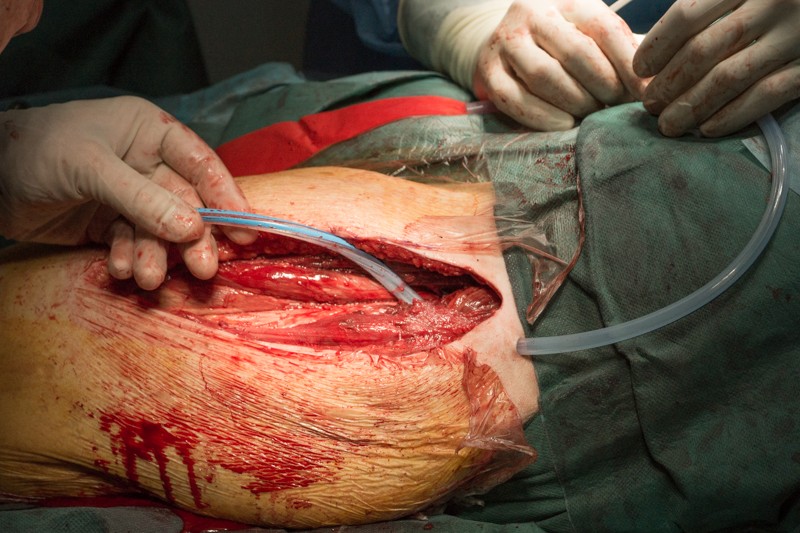
Края кожи ушиваются с помощью хирургического степлера за 30 секунд:
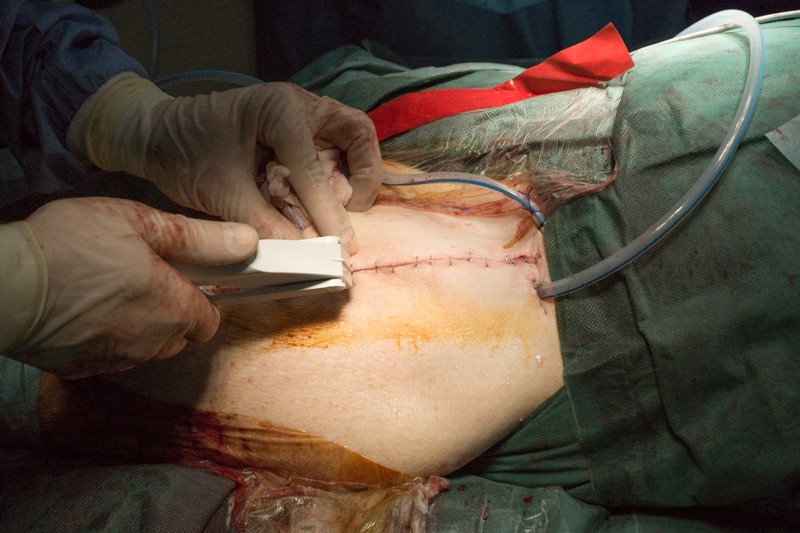
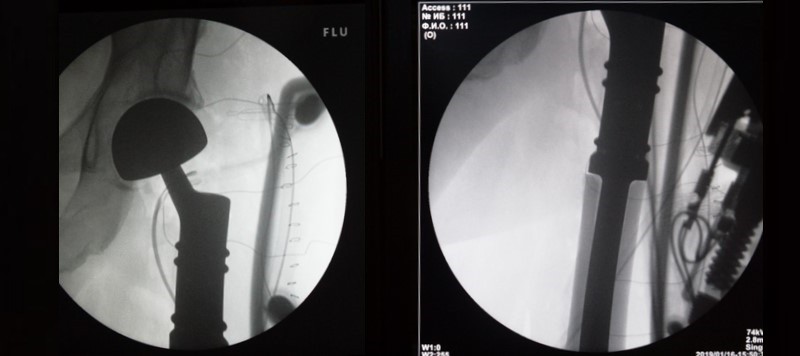
После операции выполняется контрольный снимок эндопротеза в 2-х проекциях:
А пациенту давайте все вместе пожелаем сил и терпения, которые понадобятся ему для длительной реабилитации!
Через неделю после операции:
Читайте также:





