Эндометрий яичника и рак молочной железы
Чекалова М.А., Махова Е.Е., Шабанов М.А.,
Брюзгин В.В., Колпакова М.Н.,
ГУ РОНЦ им.Н.Н.Блохина РАМН, г.Москва
Материалы и методы:
За период с 2001 по 2006 гг. в поликлинике РОНЦ им. Н.Н.Блохина РАМН обследовано 4000 больных РМЖ. Из них 49% - первично обратившихся, 51% находящихся под наблюдением длительностью от 6 месяцев до 10 лет. Средний возраст пациенток составил 52,8 ± 1,7 года, практически половина из них была в возрасте от 40 до 63 лет, в состоянии постменопаузы находились более 50% женщин.
У большинства пациенток установлена I-II стадия заболевания (17,8% и 53%соответственно), в 28,5% наблюдений III-IVстадия.
Морфологическая верификация диагноза РМЖ получена в 100% наблюдений. В числе гистологических вариантов преобладал инфильтративный протоковый РМЖ (62,5%); на долю инфильтративного долькового рака пришлось 25%; в 4,1% диагностирован тубулярный рак; в 4,1 % - крупноальвеолярный и медуллярный. 44% опухолей молочной железы содержали рецепторы прогестерона, а 56%-рецепторы эстрогенов.
Первично-множественные новообразования были диагностированы у 21,9% женщин, при этом: метахронные у 5,6%, синхронные у 1,8%. В 10,7% - опухоли гениталий (рак шейки матки, маточной трубы, яичников, эндометрия), в 11,2% наблюдений помимо РМЖ были выявлены злокачественные опухоли других локализаций и лимфопролиферативные заболевания.
83 % пациенток получали первичное лечение в РОНЦ, 17% - по месту жительства. Комплексное лечение проведено 23% больным, комбинированное – 42,3%, оперативное –34,6%. 54,5% больных получали лечение антиэстрогенными препаратами (тамоксифен) или ингибиторами ароматазы (аримидекс, фемара).
В 23% наблюдений была произведена надвлагалищная ампутация матки с придатками, в 14,1% - экстирпация матки с придатками; у 11% - овариэктомия, 17% имели в анамнезе операцию по поводу заболеваний гениталий.
В обследование женщин, как правило, было включено несколько органов: щитовидная железа, молочные железы с регионарными областями, область послеоперационного рубца, печень, внутренние гениталии. В настоящей работе нами проанализированы данные ультразвуковой томографии (УЗТ) внутренних гениталий, которые были сопоставлены с результатами цитологического исследования эндометриальных аспиратов, гистологического исследования материала, полученного при выскабливании полости матки или другой операции.
Результаты:
Наибольшую часть наших наблюдений составили пациентки, находящиеся под мониторингом после первичного лечения в РОНЦ. Самой распространенной патологией среди них были доброкачественные процессы внутренних гениталий:
- множественная миома матки (24,6%),
- аденомиоз (15%)
- сочетание миомы матки и аденомиоза (20,4%)
- киста яичника (9,7%)
- хронический сальпингоофорит (19,3%)
- гиперплазия эндометрия (16,5%)
- полип эндометрия (6,3%).
Вместе с тем, у 10,7% больных комплексное обследование позволило выявить злокачественную патологию:
- Рак яичников(3,1%)
- Рак шейки матки(2,3%)
- Рак маточной трубы(1,2%)
- Рак эндометрия(2,8%)
- Саркома матки(1,3%)
В большинстве наблюдений это были метахронные опухоли, при этом интервал от лечения РМЖ до диагностики второй опухоли составил от двух до девяти лет. Приоритетное значение на первом этапе выявления этих новообразований, за исключением рака шейки матки, имела эхография. Нами была отмечена некая особенность: немалую долю составили неоплазии I –II стадии заболевания. Объяснением этому, возможно, могут служить лишь субъективные факторы, такие как: повышенная онкологическая настороженность пациенток после перенесенного ранее лечения, а также проводимый врачами активный мониторинг. Приведем клиническое наблюдение.
Больная Ю., 53 лет. Из анамнеза: за два года до обращения в онкоцентр получила комбинированное лечение по поводу РМЖ по месту жительства. Там же была обследована в связи с появившимися кровянистыми выделениями на фоне постменопаузы. При ультразвуковом исследовании внутренних гениталий было обнаружено утолщение срединных маточных структур до 12мм, что указывало на наличие гиперпластических изменений в эндометрии (рис.1).
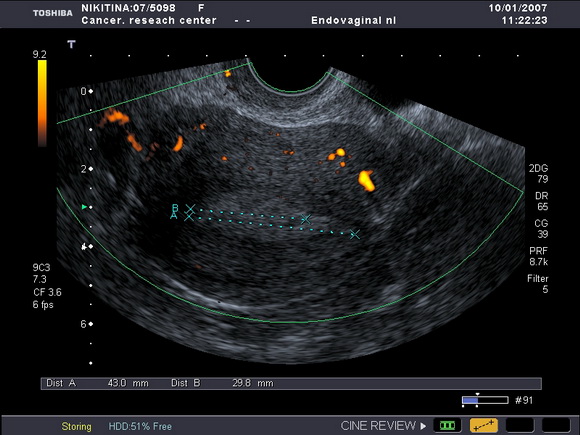
Рис.1
Ультразвуковая томограмма матки, выполненная в поперечной плоскости.
Определяется утолщение эндометрия (рак эндометрия-с учетом гистологического заключения)
В результате гистологического исследования материала, полученного при выскабливании полости матки, выявили умереннодиференцированную аденокарциному. При обследовании в РОНЦ (после раздельного диагностического выскабливания (РДВ)) по данным ультразвуковой томографии: матка не увеличена, с единичным интерстициальным миоматозным узлом диаметром 10мм, типичной структуры, эндометрий не утолщен – 2мм, контур полости матки не деформирован; структура левого яичника изменена – кистозно-солидное образование размерами 56х45мм, правый яичник не изменен, структура его соответствует возрастным нормам. Заключение: подозрение на опухоль яичника (нельзя исключить метастатическое поражение) (рис.2).
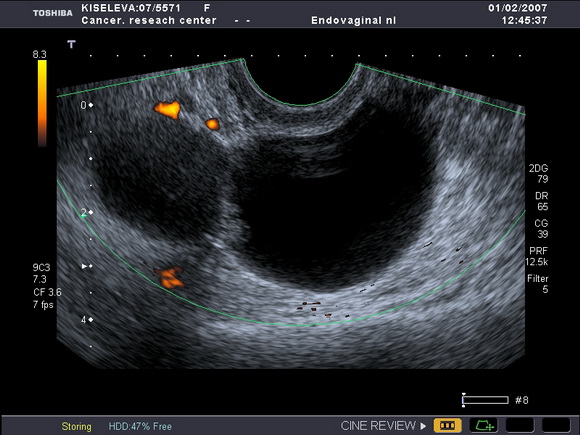
Рис.2
Ультразвуковая томограмма яичника, выполненная в продольной плоскости. Определяется опухоль яичника
В отделении онкогинекологии РОНЦ больной произведена экстирпация матки с придатками, резекция большого сальника.
Диагноз при выписке из РОНЦ: рак молочной железы T 1 N 0 M 0 ; рак эндометрия T 1а N 0 M 0 ; рак яичников T 1а N 0 M 0 .
Приведенный клинический пример убедительно показывает важность активного наблюдения за больными РМЖ с использованием вполне доступных широкому кругу населения диагностических тестов. Подобного рода мониторинг позволяет выявить злокачественную опухоль на ранней стадии, когда прогноз заболевания значительно лучше.
Особого внимания заслуживают вопросы, касающиеся диагностики рака эндометрия.
Применение клинического, цитологического и эхографического исследования позволило нам в 2,8% наблюдений выявить РЭ, причем диагностирован он был через два – три года после РМЖ. Короткий интервал между клиническим проявлением РМЖ (первая опухоль) и РЭ позволяет предположить, что ко времени обнаружения первой опухоли нередко синхронно существует вторая, уже доступная для углубленной диагностики.
Такой короткий интервал между проявлением двух гормонозависимых опухолей вполне может служить подтверждением общности их патогенеза [2] . УЗ – томография не выявила каких – либо индивидуальных особенностей в указанной группе больных, за исключением ранних стадий, для которых характерно диффузное равномерное увеличение толщины эндометрия (ТЭ) до 1,2 – 2,2см (особенно на фоне постменопаузы) (рис.3).
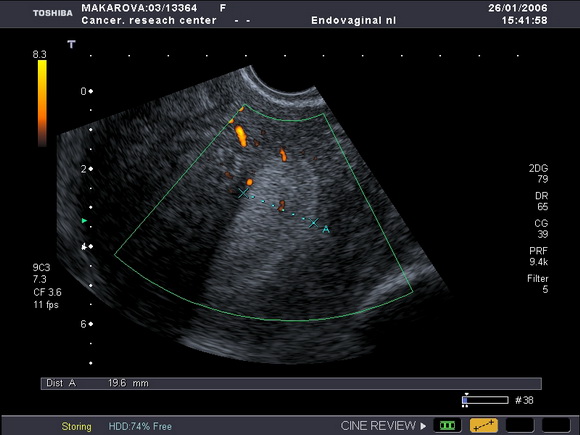
Рис.3
Ультразвуковая томограмма матки, выполненная в продольной плоскости.
Определяется диффузное равномерное увеличение толщины эндометрия
В одном наблюдении визуализировался полип (рис.4) в полости матки на фоне атрофичного эндометрия, а при гистологическом исследовании его были обнаружены фокусы аденокарциномы.
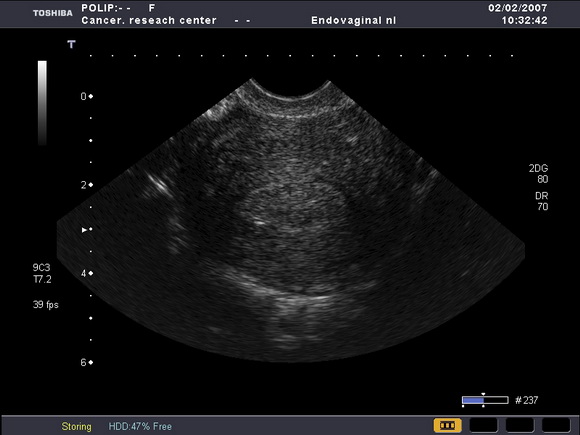
Рис.4
УЗ-томогамма матки, выполненная в поперечной плоскости.
Определяется полип эндометрия чение толщины эндометрия
На имевшемся в нашем распоряжении материале не обнаружено достоверного повышения частоты РЭ под влиянием тамоксифена у больных РМЖ. В то же время выявлено пролиферативное влияние на эндометрий у больных РМЖ.
Трудности, возникающие при интерпретации ультразвуковых данных, полученных при обследовании женщин, принимающих тамоксифен, до сих пор нередко являются предметом дискуссий специалистов.
Дешевым, доступным методом скрининга патологии эндометрия в данном случае является ультразвуковое исследование (УЗИ) органов малого таза влагалищным датчиком.
Среди изменений со стороны эндометрия под влиянием тамоксифена чаще всего встречается гиперплазия эндометрия, диагностируемая только по данным УЗТ, при этом никакой патологии со стороны эндометрия при гистологическом исследовании не обнаруживается.
В нашем исследовании признаки гиперплазии эндометрия визуализировались в 56% наблюдений, при этом большая часть из их пришлась на долю ложноположительных заключений. Так называемая ложноположительная гиперплазия эндометрия встречалась почти у каждой третьей женщины (31,3%), находящейся в периоде постменопаузы.
Ультразвуковая картина изменений эпителия матки при длительном приеме тамоксифена имеет ряд особенностей: гетерогенность структуры; множественные анэхогенные кистозные включения разного диаметра; срединные маточные структуры утолщены в сравнении с нормой в постменопаузе.
Нами было отмечено, что на фоне приема тамоксифена ТЭ может возрастать от атрофичного (1 – 2мм) (рис.5) до 8 – 10 – 15 мм (рис.6).
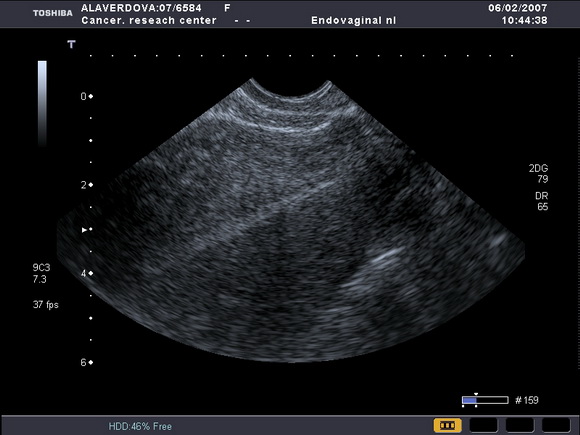
Рис.5
УЗ-томограмма матки, выполненная в продольной плоскости. Определяется атрофичный эндометрий
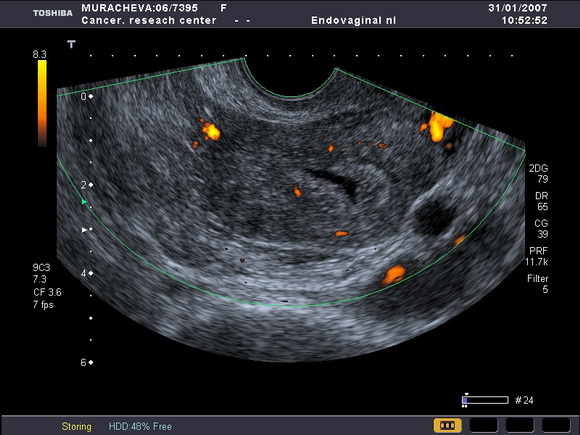
Рис.6
УЗ-томограмма матки. Определяется диффузное утолщение эндометрия
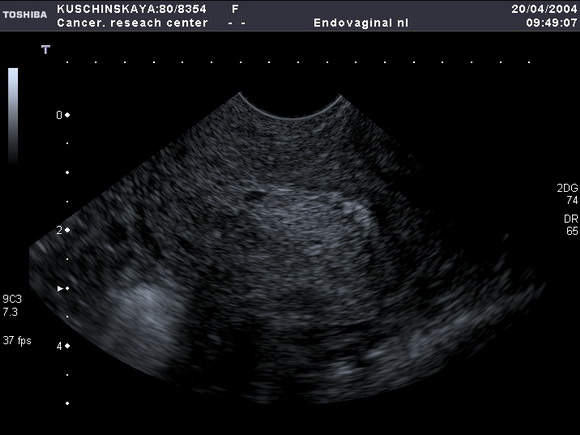
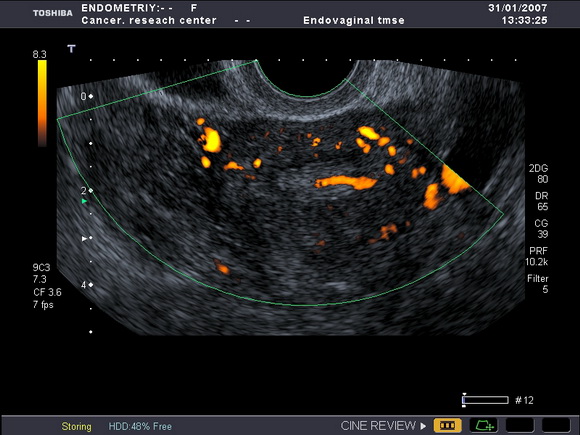
Рис.7 а,б
УЗ-томограммы матки, выполненные в продольной и поперечной плоскостях.
На фоне атрофичного эндометрия определяется полип лючения)
Микроскопически, полип характеризуется фрагментарной перигландулярной конденсацией стромальных клеток, пролиферативной активностью эпителиальных и стромальных клеток и смешанной эпителиальной метаплазией, включая сквамозную, трубную и муцинозную метаплазию (рис.7 в, г).
Рис.7 в,г
Железисто-фиброзный полип эндометрия на фоне приема тамоксифена.
Железы кистозно-расширены или неправильной формы железы, располагаются среди фиброзной стромы
с выраженными сосудами. Характерно расположение длинника желез параллельно поверхностной выстилки полипа.
Окраска гематоксилином и эозином, А. х 60 и В. Х200
Нехарактерно, чтобы эти три микроскопических признака сосуществовали в одном полипе у женщин, не принимающих тамоксифен.
Как было уже сказано, в большинстве наблюдений ультразвуковые заключения оказались ложнополжительными, при этом гистологическое исследование материала, полученного при выскабливании полости матки, выявило у этих пациенток следующую патологию (см. табл. 1).
Таблица 1
Состояние эндометрия по данным цитологического и гистологического исследования аспиратов и соскобов
Злокачественные опухоли молочной железы, яичников и толстого кишечника, появляющиеся одновременно или через некоторое время одна за другой, встречаются у больных раком эндометрия (РЭ) чаще, чем следовало бы ожидать. Обратное утверждение тоже верно: у больных раком молочной железы (РМЖ) или рака яичника (РЯ) наблюдается более высокий, чем следовало бы ожидать, риск первичного рака эндометрия (РЭ).
Следовательно, после выявления рака одной из названных локализаций необходимо обследовать другие органы, в которых может развиться злокачественная опухоль. Для этого следует придерживаться соответствующих скрининговых исследований, например маммографии.
Синхронные злокачественные новообразования яичников и эндометрия выявляют примерно у 8% больных раком эндометрия (РЭ), у пациенток с раком эндометрия (РЭ) этот показатель возрастает в 2 раза. Вовлечение в патологический процесс яичников при раке эндометрия (РЭ) обнаруживают примерно в 40 % вскрытий и в 15 % исследований операционного материала после гистерэктомии. Приблизительно в 1/3 случаев эндометриоидной аденокарциномы яичников диагностируют рак эндометрия (РЭ).
При одновременном выявлении злокачественных опухолей закономерно появляется вопрос, действительно ли они синхронные первично-множественные или же одна представляет метастаз другой. Если речь идет о метастазе, логично предположить, что опухоль распространилась из эндометрия в яичник, но не наоборот. Метастазирование в яичник подозревается, если рак эндометрия (РЭ) поражает значительную толщину миометрия, особенно при наличии инвазии в просветах лимфатических или кровеносных сосудов либо в случае, когда опухоль локализуется на поверхности яичника.
С другой стороны, если рак эндометрия (РЭ) небольшого размера, ограничен эндометрием с поверхностной инвазией в миометрий и окружен участками атипической гиперплазии, а новообразование яичника имеет центральную локализацию, то, скорее всего, опухоли имеют независимое друг от друга происхождение. Чаще всего эти опухоли по происхождению эндометриоидные, но иногда представлены разными гистологическими вариантами.
По данным многих исследований, синхронные злокачественные новообразования яичников и эндометрия, как правило, независимые первичные. Выживаемость больных с этими, как полагают, первично-множественными опухолями соответствует благоприятному прогнозу отдельного варианта рака, свидетельствуя о том, что обе опухоли относятся к I стадии, а не к III стадии одного заболевания. Это, несомненно, характерно для тех случаев, когда синхронные злокачественные опухоли эндометрия и яичников представлены эндометриоидным гистологическим типом. В одном из исследований, охватившем 16 больных, достигнута выживаемость 100%.
В таких случаях отсутствуют признаки прямого распространения какой-либо из опухолей, инвазия в миометрий обычно нехарактерна или поверхностная, нет поражения просветов лимфатических или кровеносных сосудов, атипическая гиперплазия эндометрия связана с аденокарциномой, каждое из новообразований ограничено местом своей первичной локализации с минимальным распространением — яичником или эндометрием.
Независимо от морфологических вариантов — однотипные или разные — терапия должна соответствовать I стадии заболевания, при которой во многих случаях достаточно провести только хирургическое лечение — гистерэктомию с двусторонней аднексэктомией и адекватным хирургическим стадированием.

- Вернуться в оглавление раздела "Онкология"

Красильников Сергей Эдуардович, доктор медицинских наук, профессор ГБУЗ НСО Новосибирский областной клинический онкологический диспансер
Гуляева Людмила Федоровна, доктор биологических наук, профессор Заведующая лабораторией ММК ГУ НИИ Молекулярной биологии и биофизики СО РАМН
Бабаянц Екатерина Владимировна, кандидат медицинских наук ГБУЗ НСО Новосибирский областной клинический онкологический диспансер Лаборатория ММК ГУ НИИ Молекулярной биологии и биофизики СО РАМН
Кедрова Анна Генриховна, доктор медицинских наук, профессор ФГБОУ ДПО Институт повышения квалификации Федерального медико-биологического агентства России, кафедра акушерства и гинекологии
Первое место в структуре онкологической заболеваемости и смертности женщин России в последние десятилетия занимает рак молочной железы (РМЖ), имеющий тенденцию к росту заболеваемости и смертности [7].
Число новых случаев рака молочной железы, ежегодно выявляемых в разных странах мира, в настоящее время превысило 1 млн. и составляет 10% от всех злокачественных опухолей различных локализаций.
В России в 2012 г. зарегистрировано 45 000 новых случаев и 22 000 женщин умерло от этого заболевания. При этом заболеваемость увеличивается ежегодно на 1-2% [7].
Рак молочной железы - одна из самых частых причин смерти женщин по сравнению с другими злокачественными опухолями. Каждый год во всех странах от РМЖ умирает 0,37 млн. женщин [7].
В Новосибирской области в 2013 году впервые выявлено 1324 больных раком молочной железы (11,7% от всех злокачественных новообразований в НСО). В Новосибирской области отмечается следующее распределение рака молочной железы по стадиям онкологического процесса: I стадия – 26%, II стадия – 46,5%, III стадия – 20,8 %, IV стадия – 6,7% пациенток. Свыше 5 лет на учете с диагнозом РМЖ состоят 7051 пациенток (59,7%). Умерло в 2013 году – 383 женщины, что составляет 8,4% от всех умерших от ЗНО в НСО.
В плане комплексного лечения больных раком молочной железы применяется тамоксифен. В литературе нет однозначных данных о так называемой тамоксифен-индуцированной гиперплазии эндометрия. Поэтому целью нашего исследования было: 1) Изучить встречаемость гиперпластических процессов эндометрия у больных раком молочной железы. 2) Оценить методы лечения гиперплазии эндометрия у больных раком молочной железы.
Гиперплазию эндометрия по-прежнему считают основой для формирования злокачественной трансформации слизистой тела матки [8]. Однако наиболее высокая онкологическая настороженность отмечается при атипической гиперплазии (АГ) слизистой. По данным разных авторов, частота перехода этой гиперплазии в рак эндометрия варьирует в пределах 10–40% и определяется ее морфологическими особенностями, длительностью рецидивирования заболевания, возрастом пациенток и наличием сопутствующих эндокринопатий [19].
В настоящее время отмечается рост гиперпластических процессов эндометрия после комплексного лечения рака молочной железы, в частности за счет применения антиэстрогенов и ингибиторов ароматазы. Гиперпластические процессы эндометрия составляют разнообразную группу, в большинстве связанную с гормональными нарушениями [2,6]. Цель лечения ГПЭ ― профилактика рака эндометрия и купирование клинических проявлений патологических изменений эндометрия (менометроррагий у пациенток репродуктивного и пременопаузального возраста) [5].
Лечение гиперпластических процессов эндометрия остаётся одной из важных проблем гинекологии. Лечебная тактика при ГПЭ зависит от патоморфологической характеристики эндометрия, возраста пациентки, этиологии и патогенеза заболевания, сопутствующей гинекологической и экстрагенитальной патологии. Терапия в различные возрастные периоды складывается из остановки кровотечения, восстановления менструальной функции в репродуктивном периоде или стойкой постменопаузы в более старшем возрасте и профилактики рецидива гиперпластического процесса [4].
Традиционно развитие гиперпластических процессов эндометрия ассоциировано с гиперэстрогенемией. Одной из функций поступающих из крови и синтезированных in situ (при участии ароматазы и стероидсульфатазы) эстрогенов является стимуляция пролиферации эндометрия. Этот эффект зависит от наличия ER. Кроме того, эстрогены могут метаболизироваться непосредственно в эндометрии при участии 2- и 4-эстрогенгидроксилаз, превращаясь в катехолэстрогены. Эстрогены ткаже могут подвергаться гидроксилированию в 16-м положении. Дальнейший метаболизм катехолэстрогенов протекает с участием КОМТ и ГТ с образованием неактивных и немутагенных производных. При недостаточной активности этих трансфераз возможны 2 варианта событий. Первый заключается в том, что пролиферативный эффект эстрогенов усиливается катехолэстрогенами и 16-гидроксиметаболитами. Во втором варианте под действием пероксидаз катехолэстрогены првращаются в орто-хиноны, которые обладают генотоксическим эффектом и могут вызывать онкогенные мутации [1,3,9,13].
Материал и методика:
В онкологическом отделении №4 ГБУЗ НСО Новосибирский областной клинический онкологический диспансер за период 2011-2014 г. пролечено 237 женщин с гиперпластическими процессами эндометрия. Из них с диагнозом рак молочной железы и гиперплазия эндометрия – 36 пациенток (15,1%). Средний возраст пациенток в этой группе составил 51,6 лет (от 36 до 68 лет). Всем пациенткам предварительно назначено УЗИ органов малого таза и для исключения РЭ (согласно рекомендациям ВОЗ) выполнена гистероскопия с раздельным диагностическим выскабливанием цервикального канала и стенок полости матки. Диагноз гиперплазии эндометрия установлен гистологическим исследованием.
При сочетании рака молочной железы и гиперплазии эндометрия выявлены следующие гистологические типы: простая железисто-кистозная гиперплазия эндометрия – у 24 (66,3%), сложная железисто-кистозная гиперплазия эндометрия – у 8 (22,6%), атипическая железисто-кистозная гиперплазия
Согласно международным стандартам использовались следующие схемы (приведены ниже) лечения гиперпластических процессов эндометрия
и атипической гиперплазии эндометрия (в репродуктивном, пред -, и климактерическом периодах):
При сочетании рака молочной железы, сложной и атипической железисто-кистозной гиперплазии эндометрия (33%) нами выполнено хирургическое лечение в объеме экстирпации матки с придатками.
1. Берштейн Л.М., Ковалевский А.Ю., Ларионов А.А. Ароматаза в нормальном и малигнизированном эндометрии // Акушерство и гинекология. 2001. №4. С.9–11.
2. Вейн А.М., Воскресенская Т.Г. Гипоталамический синдром // Врач. 2000. №4. С. 12-14.
3. Коломиец Л.А., Чернышева А.Л., Крицкая Н.Г., Бочкарева Н.В. Клинико-морфо-биохимические аспекты гиперпластических процессов и рака эндометрия // Томск: Изд-во НТЛ, 2003. 116 с.
4. Кулаков В.И., Савельева Г.М., Манухин И.Б. Гинекология. Национальное руководство // М.: 2010. С. 1088.
5. Моцкобили Т.А. Возможности сонографии и гистероскопии в диагностике патологических процессов эндометрия у больных раком молочной железы на фоне длительной антиэстрогенной терапии: автореф. дисс. … к.м.н. Москва, 2003.
6. Чепик О.Ф. Морфогенез гиперпластических процессов эндометрия // Практическая онкология. 2004. Т. 5. №1.С.9–15.
8. Шахламова М.Н., Бахтияров К.Р. Вопросы гинекологии, акушерства и перинатологии. 2005, Т.4, С. 2-11.
9. Cavalieri E.L., Rogan E.C., Chakravarti D. Initiation of cancer and other diseases by catechol orthoquinones: a unifying mechanism // Cell. Mol. Life Sci. 2002. Vol. 59. P. 665-681.
13. Hu R, Hilakivi-Clarke L, Clarke R. Molecular mechanisms of tamoxifen-associated endometrial cancer. // Oncol Lett. 2015. Apr; 9(4). Р.1495-1501.
15. Love CDB, Muir BB, Scrimgeour JB: Investigation of endometrial abnormalities in asymptomatic women treated with tamoxifen and an evaluation of the role of endometrial screening // Journal of Clinical Oncology. 1999. №17. Р. 2050-2054.
16. McGonigl KF, Marx HF, Morgan RJ : Uterine effects of tamoxifen: a prospective study. // Gynecological Oncology .1999.74. Р. 324(abstract 33)
17. Neyen P., De Muylder X., Van Belle Y., Campo R., Vanderick G: Tamoxifen and the uterus // BMJ 1994. 309. Р. 1313-4.
19. Sivridis E., Giatromanolaki A: Endometrial adenocarcinoma: an apostasy from early views. // Gynecol Oncol 2004. 95(3). Р. 772–3.

И от каких опасных болезней они защищают
- 27 июня 2019
- 25775
- 19

ОТВЕТЫ НА БОЛЬШИНСТВО ВОЛНУЮЩИХ НАС ВОПРОСОВ мы привыкли искать онлайн. В новой серии материалов задаём именно такие вопросы: животрепещущие, неожиданные или распространённые — профессионалам в самых разных сферах.

Недавно мы расспрашивали эксперта о том, действительно ли применение гормональной контрацепции грозит депрессией или снижением либидо. Как выяснилось, данные противоречивы, а главное, на что они указывают, — необходимость дальнейших исследований. Ещё одна частая причина для сомнений, когда дело касается гормональной контрацепции, — боязнь того, что они могут повысить риск рака груди, рака яичника или других злокачественных опухолей. Разбираемся, так ли это.

На сегодня однозначно известно, что КОК не повышают риск онкозаболеваний в целом и даже снижают его. Это было проиллюстрировано в когортном исследовании Royal College of General Practitioners (RCGP), в которое вошли почти 50 тысяч женщин, наблюдавшихся на протяжении 44 лет. В нём выяснилось, что применение КОК связано со снижением риска колоректального рака, рака эндометрия и рака яичника. Риск рака молочной железы и цервикального канала возрастал у пациенток, применяющих КОК в настоящее время или недавно завершивших приём, но этот риск полностью регрессировал в течение пяти лет. К тому же это компенсируется снижением риска рака эндометрия, яичника и толстой кишки, которое сохраняется по крайней мере тридцать лет.
Данные крупного наблюдательного когортного исследования RCGP, охватившего более 1 миллиона женщино-лет (число, полученное при умножении числа участниц на число лет наблюдения. — Прим. ред.), свидетельствуют о снижении риска любых злокачественных опухолей у пользовательниц оральных контрацептивов на 12 %, а риска гинекологических злокачественных опухолей почти на треть — на 29 %.
Если посмотреть данные по разным диагнозам, то, пожалуй, самые противоречивые они для рака молочной железы. Например, анализ данных 150 тысяч женщин, участвовавших в 54 эпидемиологических исследованиях, показал, что в целом у тех, кто когда-либо применял оральные контрацептивы, было небольшое (7 %) увеличение относительного риска рака молочной железы по сравнению с женщинами, которые никогда их не использовали. По данным этого же анализа, прямо во время приёма оральных контрацептивов риск возрастает на 24 %, но не зависит от продолжительности приёма, а после отмены постепенно снижается и за десять лет становится таким же, как в популяции в целом.
В 2010 году завершилось исследование, в котором за двадцать лет приняли участие более 116 тысяч женщин. У пользовательниц КОК (причём не любых) отмечалось небольшое увеличение риска рака молочной железы (5,6 %). Есть исследования, не показывающие риска, есть показывающие риск, но только в период приёма. Есть, например, исследование, где было отмечено повышение риска РМЖ, но препараты были высокодозными и на сегодняшний день устаревшими. Большинство результатов говорит о том, что приём КОК в прошлом не увеличивает риск. Эксперты приходят к выводу, что небольшой рост риска РМЖ сбалансирован достоверным снижением риска рака яичника и эндометрия.
Данные крупного наблюдательного когортного исследования RCGP свидетельствуют о снижении риска любых злокачественных опухолей у пользовательниц оральных контрацептивов на 12 %
В трёх крупных проспективных когортных исследованиях, включая исследование здоровья медсестёр, исследование RCGP и исследование Ассоциации планирования семьи Оксфорда, ни долгосрочное применение КОК в прошлом, ни текущее использование не было связано с повышенным риском рака молочной железы. В исследовании, где сравнивались 4574 женщины с раком молочной железы и 4682 контрольных участницы, риск развития рака молочной железы оказался одинаковым среди принимавших и не принимавших КОК.
В 2017 году авторы крупного исследования, проведённого в Дании, сообщили о высоком риске рака молочной железы, связанном с современными оральными контрацептивами. В сравнении с теми, кто никогда не принимал КОК, риск был повышен почти на 20 %, а разброс данных составлял от 0 до 60 %. Но датские исследования КОК в целом вызывают много вопросов в научном и медицинском сообществе.
Тем не менее, даже если результаты достоверны, абсолютный прирост РМЖ у пользовательниц КОК был небольшим: 13 на 100 тысяч человеко-лет (примерно один дополнительный случай на 7690 женщин в год). Для женщин в возрасте до 35 лет (возрастная группа, наиболее часто применяющая КОК) риск составил всего 2 случая на 100 тысяч человеко-лет (1 дополнительный случай на 50 тысяч женщин в год).
Риск рака шейки матки при применении КОК возрастает; правда, до сих пор непонятно, есть ли тут причинно-следственная связь, ведь главная причина этого заболевания — вирус папилломы человека. На сегодня известно, что за пять лет приёма КОК риск повышается на 10 %, а при приёме более десяти лет удваивается, и особенно это касается женщин с инфекцией ВПЧ. Наиболее убедительны данные, полученные совместной группой по эпидемиологическим исследованиям рака шейки матки: авторы повторно проанализировали и объединили данные 24 эпидемиологических исследований, включавших 16 573 женщины. Риск инвазивного РШМ повышался с увеличением продолжительности применения КОК. Правда, абсолютное увеличение риска было низким: десять лет использования в возрасте от 20 до 30 лет может повысить совокупную заболеваемость примерно на 1 из 1000 женщин. Риск снижается после отмены КОК и за десять лет становится таким же, как у женщин, не использующих их.
Риск рака шейки матки при применении КОК возрастает; правда, до сих пор непонятно, есть ли тут причинно-следственная связь
У женщин, которые когда-либо применяли КОК, ниже риск развития рака эндометрия, чем у тех, кто никогда не использовал оральные контрацептивы. Риск снижается по крайней мере на 30 %, и чем дольше приём КОК, тем ниже риск. Он особенно сильно снижался у тех, кто курил, у женщин с ожирением или малоподвижным образом жизни. Защитный эффект сохраняется в течение многих лет после прекращения приёма КОК.
У женщин, которые когда-либо применяли КОК, на 30–50 % ниже риск развития рака яичника, чем у тех, кто никогда их не применял, и чем дольше женщина использует этот метод контрацепции, тем выше защита. Защитный эффект сохраняется до тридцати лет после прекращения использования КОК.
Что касается предрасположенности к раку груди или яичника — на сегодня ВОЗ не считает, что наличие мутаций BRCA 1 или 2 не позволяет или ограничивает применение КОК. По данным исследования 2013 года, риск рака молочной железы у принимающих гормональные контрацептивы не повышался при наличии этих мутаций. Поскольку КОК снижают риск рака яичника и у женщин с мутациями генов BRCA1 или BRCA2, обсуждается возможность применять их для профилактики рака у женщин с этими мутациями.
Что касается других онкологических заболеваний, КОК на 15–20 % снижают риск развития колоректального рака, уменьшают риск рака маточных труб. Были опасения о связи применения КОК с повышением риска меланомы, но они опровергнуты.
Читайте также:

