Эмболы в сосудах при раке матки

Эмболизация — малоинвазивная процедура, которая может дополнять хирургическое лечение или использоваться самостоятельно. Хирург через прокол в бедренной артерии проводит специальный катетер в артерии, непосредственно питающие опухоль и через него закрывает их специальными частицами — эмболами, которые перекрывают кровоток. В ряде случаев используют эмболы, способные выделять химиопрепарат в ткань опухоли — такое вмешательство называется химиоэмболизация.
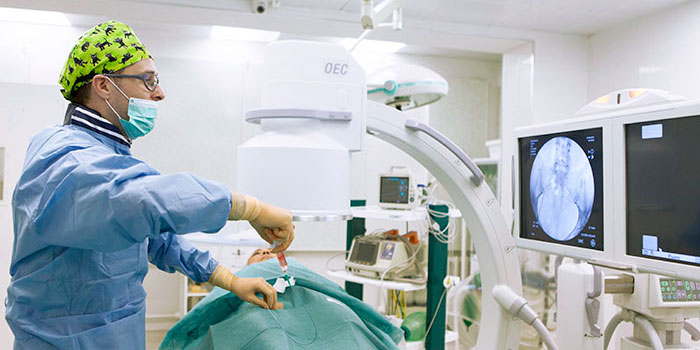
Эмболизация применяется для лечения многих заболеваний. С начала XXI века эта процедура получает все более широкое применение и в онкологии, в первую очередь из-за своей эффективности и малоинвазивности — эмболизации безболезненны, не требуют наркоза, инструмент вводится через пункцию артерии, т. е. нет никакой операционной раны.
Эмболизация у онкологических пациентов
Эмболизация артерий для лечения опухолей и их метастазов помогает решить следующие задачи:
- в качестве самостоятельного метода лечения — эмболизация (чаще всего в варианте химиоэмболизации) может приводить к ишемии ткани опухоли и ее гибели. Для некоторых заболеваний, например, ряд опухолей печени, этот лечения может приводить к полной ремиссии без хирургического лечения.
- в сочетании с хирургическим лечением эмболизация используется как вспомогательная технология — чаще всего для уменьшения кровотечения во время операции за счет деваскуляризации (обескровливания) новообразования;
- в ряде случаев эмболизация, выполненная перед операцией, дает возможность проведения более радикальной операции за счет предварительного уменьшения опухоли;
- эмболизация также может применяться для борьбы с симптомами и осложнениями онкологических заболеваний — это в первую очередь остановка опасных кровотечений, которые угрожают жизни пациента, кроме того — облегчение боли, вызванной злокачественным новообразованием; еще одним эффектом является уменьшение объема и замедление роста опухоли.
Виды эмболизации артерий у онкологических больных:
- предоперационная — выполняется в качестве первого этапа хирургического вмешательства;
- в качестве самостоятельного метода лечения — чаще всего при опухолях печени, почек и ряде других опухолей
- в качестве паллиативного метода лечения — для остановки кровотечений, уменьшения болевого синдрома, уменьшения объемов и темпа роста опухоли.
Как проводится эмболизация артерий?
Эмболизация выполняется врачами-рентгенохирургами в специально оборудованной ангиографической операционной. Перед эмболизацией всегда проводят ангиографию. В сосуды вводят рентгенконтрастное вещество, в ходе чего записывают рентгеновское изображение в цифровом видеоформате. Это помогает врачу оценить расположение и анатомию сосудов, определить, из каких артерий осуществляется кровоснабжение опухоли.
Чаще всего эмболизацию выполняют под местной анестезией. В редких случаях приходится использовать общую анестезию (наркоз). За 4–5 часов до процедуры пациента просят ограничить прием пищи, иногда дают успокоительные препараты.
В большинстве случаев доступ к нужному сосуду получают через бедренную артерию, это самый типичный доступ для всех ангиографических исследований и вмешательств, но могут использовать и другие артерии в других местах (лучевую на запястье, плечевую в области локтевого сгиба и т. п.). Врач обрабатывает кожу антисептиком и делает небольшой прокол, вводит в артерию специальный катетер размером не более 1,5 мм и продвигает его до тех пор, пока не достигнет нужного сосуда. Через катетер в сосуд вводят эмболы, которые перекрывают его просвет.
Существуют разные виды эмболов:
- Поливинилалкоголь (PVA) представляет собой частицы размером от 50 до 1000 мкм. Это относительно недорогой и простой в применении препарат, однако, в настоящее время он считается устаревшим. Сейчас чаще всего применяют сферические эмболы, например, Bead Block и Embozene.
- Спирали из платины и нержавеющей стали. После установки в просвете сосуда на них быстро образуется тромб, который перекрывает кровоток. Иногда такие спирали применяют вместе с желатиновыми губками: сначала устанавливают спираль, а затем через катетер вводят губку — ее частички оседают между витками. Их применяют только для остановки кровотечений, обусловленных опухолями.
- Химиоэмболизация — введение в просвет сосуда эмболов, содержащих химиопрепарат. Таким образом, с одной стороны происходит закупорка сосудов, кровоснабжающих опухоль, а с другой химиопрепарат поступает непосредственно в ткань опухоли и не оказывает побочные эффекты, которые возникают при его введении в вену. При этом в самой опухоли создаются очень высокие концентрации препарата, невозможные при обычном введении. Мы применяем самые современные препараты для химиоэмболизации: DC Beads (Terumo, Япония) и Hepaspheres (Merit Medical, США)., которые высвобождают химиопрепарат в течение длительного времени, в стабильной дозировке.
- Радиоэмболизация — введение эмболов, содержащих радиоактивные изотопы. Эта процедура еще называется внутренней лучевой терапией, так как в опухоль изнутри вводят дозу радиации, разрушающей ее клетки. Для этого обычно используют изотоп Иттрий-90.
К эмболизации артерий наиболее часто прибегают при следующих онкологических заболеваниях:
- В качестве самостоятельного метода лечения: Первичные и метастатические опухоли печени, почек, легких и других локализаций.
- В комбинации с хирургическими методами: Первичные и метастатические опухоли печени, почек, легких, костей, позвоночника, матки, простаты, мочевого пузыря и т. д.
- Для остановки кровотечений при опухолях: малого таза, легких, прямой кишки, толстой кишки, печени, матки, простаты, опухолях головы и шеи. Т. е. практически при любой локализации с целью прекращения кровотечения.
Эмболизация также широко применяется для лечения заболеваний, не связанных с онкологией:
- Миома матки. Эмболизация маточных артерий — наименее травматичный способ лечения миомы матки, обладающий высокой эффективностью — около 98,5% женщин, перенесших эту процедуру, не нуждаются в дополнительном лечении.
- Аденома простаты. Эмболизация - эффективный, малоинвазивный способ лечения аденомы предстательной железы, который сегодня становится все более распространен в развитых странах.
- Варикоцеле — наименее инвазивная альтернатива хирургическому лечению, выполняется амбулаторно за 20–30 минут.
- Сосудистые мальформации различной локализации.
- Аневризмы — в первую очередь аневризмы головного мозга, способные вызвать геморрагический инсульт.
Насколько безопасна эмболизация?
Цель эмболизации в онкологии — не только прекратить приток крови к патологическому очагу, но и сохранить при этом кровообращение в соседних здоровых тканях. Современная техника эмболизации с использованием микрокатетеров позволяет обеспечить необходимую точность эмболизации.
Для того чтобы обеспечить точность в ходе эмболизации всегда проводят ангиографию. Врач внимательно изучает сосудистую сеть, кровоснабжение опухоли и определяет, в какой сосуд должны быть введены эмболы. Эмболы вводятся только после детального изучения сосудистой анатомии опухоли в ходе вмешательства. Перед эмболизацией вам также могут назначить УЗИ, КТ, МРТ и другие исследования.
Существует ряд противопоказаний к проведению эмболизации, но все они являются относительными, то есть процедура, как правило, все же может быть проведена при соблюдении некоторых условий. Например, у пациента с нарушением функции почек должно быть нормализовано артериальное давление, водно-солевой баланс, а во время ангиографии нужно использовать минимальное количество контрастного вещества.
В Европейской клинике с каждым пациентом работают индивидуально. Врач оценивает общее состояние больного, учитывает сопутствующие заболевания, размеры и расположение опухоли, особенности ее кровоснабжения.
Врачи-специалисты Европейской клиники имеют огромный опыт проведения эмболизации артерий при различных видах опухолей. Мы используем значительный собственный и опыт коллег из ведущих зарубежных клиник. Некоторые процедуры, которые мы предлагаем пациентам в Европейской клинике (например, эмболизация при аденоме простаты), даже в Европе, США и Израиле являются прерогативой крупных университетских клиник из-за необходимости иметь хирургов самого высокого уровня.
Нашими врачами были выполнены первые в России эмболизации миомы матки, артерий простаты, мы первыми стали работать с самыми современными препаратами для эмболизации — Bead Block, Embozene, DC Bead и др.
ФАКТОРЫ ПРОГНОЗА У БОЛЬНЫХ РАКОМ ТЕЛА МАТКИ.
Прогноз при раке тела матки и выживаемость больных во многом зависят от стадии заболевания, определенной на основании интраоперационных находок и результатов гистологического исследования.
Не маловажное значение имеет и своевременность точного прогноза. Наиболее точная диагностика с визуализацией опухолей выполняется с помощью позитронно-эмиссионной томографии, совмещенной с компьютерной томографией.
Факторами неблагоприятного прогноза, статистически достоверно влияющими на отдаленные результаты лечения больных раком тела матки I-III клинических стадий, являются стадия, возраст, глубина инвазии миометрия, степень дифференцировки и размер опухоли, наличие опухолевых эмболов в кровеносных и лимфатических сосудах миометрия, опухолевых клеток в смывах из брюшной полости, дис-семинации и лимфогенных метастазов. Метастазы в лимфатических узлах - наиболее важный фактор прогноза при раке тела матки ранних стадий.
Результаты лечения опровергают традиционное представление о благоприятном клиническом течении рака тела матки (РТМ). Так, 5-летняя общая выживаемость больных РТМ I и II стадий составляет 82 и 65% соответственно, а прогрессирование возникает у 25% больных, лечившихся по поводу РТМ ранних стадий [5].рак матки
В мире РТМ занимает 4-е место в структуре заболеваемости женщин злокачественными новообразованиями и 7-е место в структуре смертности от них. РТМ чаще встречается у женщин в пре- и постменопаузе (75%), однако в последние годы отмечается тенденция омоложения больных РТМ. Значительные темпы прироста заболеваемости РТМ отмечаются в возрастных группах 40-49 (на 12,3%) и 50-56 лет (на 15,6%) [2].
Прогноз при РТМ и выживаемость больных во многом зависят от стадии рака тела маткия, определенной на основании интраоперационных находок и результатов гистологического исследования [3]. При этом учитываются глубина инвазии миометрия, состояние придатков и шейки матки, результаты ревизии брюшной полости и малого таза, биопсии всех подозрительных объемных образований и увеличенных тазовых и парааортальных лимфатических узлов [1]. Данные предоперационного обследования и установленная на этом основании клиническая стадия не совпадают с операционными находками и результатами гистологического исследования у 51% больных РТМ [4]. Таким образом, при РТМ оптимальным является определение морфологической стадии заболевания.
Риск метастазов РТМ в регионарных лимфатических узлах, а также прогрессирования болезни определяется в
Длительное время ведутся научные споры об объемах хирургических вмешательств при РТМ. Эта проблема имеет два аспекта: целесообразность расширения их объема с учетом особенностей лимфогенного метастази-рования и возможность выполнения расширенных операций у больных, обычно страдающих выраженными эн-докринно-обменными нарушениями и сопутствующими заболеваниями сердечно-сосудистой системы. Существуют разные методики визуальной и морфологической оценки состояния регионарных лимфатических узлов при РТМ: УЗИ, пальпация и биопсия увеличенных лимфатических узлов, биопсия одного увеличенного лимфатического узла, селективная и тотальная лимфаденэкто-мия. К сожалению, до сих пор нет единых рекомендаций FIGO по определению морфологической стадии РТМ.
С учетом изложенного целью проведенного исследования являлось изучение эффективности трех методик комбинированного лечения РТМ, выявление факторов прогноза и разработка научно обоснованных рекомендаций по выполнению расширенных операций при РТМ.
В исследование включены 395 больных РТМ IA- IIIC стадий в возрасте 30-89 лет, которым проведено лечение в ГУ РОНЦ им. Н. Н. Блохина РАМН с 1995 по 2005 г. Диагноз у всех пациенток установлен впервые на основании результатов гистологического исследования.
Средний возраст пациенток составил 60,4±0,5 года:
15 (3,8%) - в возрасте до 40 лет, 37 (9,4%) - в возрасте 40-49 лет, 143 (36,2%) - в возрасте 50-59 лет, 137 (34,7%) - в возрасте 60-69 лет, 63 (15,9%) - в возрасте 70 лет и старше. Таким образом, подавляющее большинство больных РТМ (343 больные, 86,8%) были в возрасте 50 лет и старше.
Все больные наблюдались от 1 до 10 лет. Пятилетняя общая выживаемость больных РТМ I-III стадий составила 75,9±2,6%, 10-летняя - 71,5±3,2%, 5-летняя безрецидивная выживаемость - 71,3±3,1%.
Стадия заболевания статистически достоверно связана с прогнозом больных РТМ (р = 0,00001). Так, при I стадии заболевания в течение 5 лет без признаков про-грессирования болезни наблюдались 81,3% пациенток. Десятилетняя выживаемость больных в этой группе составила 77,1±3,3%. При III стадии болезни 50% больных умерли от рецидивов и отдаленных метастазов в сроки до 42,5 мес, а 25% больных - в сроки до 20,8 мес. Не выявлено статистически достоверных различий в отдаленных результатах лечения больных РТМ IIA и IIB, IIIA, IIIB и IIIC стадий (p > 0,05). Пятилетняя общая выживаемость больных РТМ IIIA-IIIC стадий статистически достоверно ниже, чем больных РТМ IA-IC (p = 0,0001) и IIA-IIB (p = 0,01) стадий. Аналогичные результаты выявлены при изучении безрецидивной выживаемости больных РТМ. Так, 5-летняя безрецидивная выживаемость больных РТМ I стадии составила 80,5±2,1%, II стадии - 69,8±7,9%, III стадии - 41,9±11,3% (p = 0,00001). Медиана безрецидивного периода при РТМ III стадии составила 27,9 мес.
Пятилетняя общая выживаемость при РТМ T1N0M0 статистически достоверно выше, чем при РТМ T1N1M0 (81,3±2,8 и 30,9±17,9% соответственно, р = 0,001). В связи с небольшим количеством пациенток с опухолями Т2а-3bN1 сравнение результатов лечения в этой группе в зависимости от наличия лимфогенных метастазов не проводили. Однако следует отметить, что при наличии регионарных лимфогенных метастазов 5-летняя выживаемость больных была менее 50%. При опухолях Т3а 5-летняя выживаемость больных РТМ с метастазами и без таковых оказалась сопоставимой.
Статистически достоверные различия выявлены при изучении отдаленных результатов лечения больных РТМ разных возрастных групп. Установлено, что 5-летняя выживаемость больных старше 60 лет статистически достоверно ниже, чем в других возрастных группах (p 0,05). Пятилетняя безрецидивная выживаемость больных аденокарциномой эндометрия I-III стадий составила при высокой дифференцировке опухоли 91,4±3,8%, при умеренной - 70,1±5,4%, при низкой - 65,3±10,9%, при смешанной - 65,2±7,9% (р = 0,04).
При анализе 10-летней общей выживаемости в зависимости от глубины инвазии миометрия отмечено, что она была наибольшей при прорастании менее половины толщины миометрия (80,9±3,4%). Результаты лечения больных, у которых опухоль прорастала более половины толщины миометрия, и больных, у которых опухоль прорастала до серозной оболочки, оказались одинаковыми. Обе больные с прорастанием опухолью серозной оболочки матки умерли от прогрессирования заболевания через 9 и 10 мес. У 11 пациенток инвазии миометрия при гистологическом исследовании не выявлено. При этом метастазы в регионарных лимфатических узлах выявлены у 2 больных, а переход опухоли на шейку матки - у 1. В целом выживаемость в этой группе была низкой и составила 18,2±1,3%, что обусловлено сочетанием неблагоприятных факторов прогноза. Пятилетняя безрецидивная выживаемость больных РТМ в зависимости от глубины инвазии миометрия составила 81,3±2,9% при прорастании опухолью менее половины толщины миометрия и 62,8±5,9% при прорастании опухолью более половины толщины миометрия (р = 0,000001).
Отмечена тенденция к ухудшению отдаленных результатов лечения больных РТМ с переходом на строму шейки матки по сравнению с таковыми у больных с переходом опухоли на слизистую цервикального канала (5-летняя общая выживаемость 55,9±10,1 и 74,6±6,6% соответственно, р = 0,08). Пятилетняя безрецидивная выживаемость больных РТМ при переходе опухоли на слизистую шейки матки составила 71,3±9,3%, на стро-му - 52,1±19,8% (р = 0,061).
Статистически достоверно ухудшают отдаленные результаты лечения больных РТМ опухолевые эмболы в кровеносных и лимфатических сосудах миометрия (р = 0,035). Пятилетняя общая выживаемость больных РТМ в зависимости от наличия опухолевых эмболов различалась недостоверно, в то время как 10-летняя имела достоверные различия (р = 0,013). Пятилетняя безрецидивная выживаемость больных РТМ составила 59,3±9,4 и 75,7±3,3% соответственно (р = 0,049).
По результатам нашего исследования выявлена тенденция к снижению выживаемости больных РТМ с метастазами в яичниках. Пятилетняя безрецидивная выживаемость при наличии метастазов в яичниках составила 68,6±16,8%, в отсутствие метастазов - 81,8±2,5% (р = 0,35).
Регионарные лимфогенные метастазы, по нашим данным, являются одним из наиболее значимых факторов неблагоприятного прогноза, статистически достоверно влияющим на выживаемость больных. Четверть больных РТМ с метастазами в регионарных лимфатических узлах умерли от прогрессирования болезни в сроки до 20 мес, половина - в сроки до 44,5 мес. Пятилетняя общая выживаемость больных РТМ с метастазами в регионарных лимфатических узлах и без них составила 47,6±11,7 и 82,0±6,3% (р = 0,0018), 5-летняя безрецидивная выживаемость - 41,3±12,1 и 80,9±6,9% (р = 0,01), медиана безрецидивного периода - 30,8 мес.
Диссеминация по брюшине статистически достоверно снижает отдаленные результаты лечения больных РТМ (р = 0,00005). Четверть больных этой группы умерли от прогрессирования заболевания в сроки до 9,6 мес. Медиана продолжительности жизни больных этой группы составила всего 21,6 мес, тогда как в группе больных без диссеминации по брюшине не была достигнута. Пятилетняя общая выживаемость больных РТМ при наличии опухолевой диссеминации по брюшине и без нее составила 28,7±17,0 и 77,6±2,6% (р = 0,0025), 5-летняя безрецидивная выживаемость - 24,3±16,8 и 75,4±3,2% (р = 0,00016), медиана безрецидивного периода - 12,5 мес.
Выявлены статистически достоверные различия в выживаемости больных РТМ в зависимости от размеров первичной опухоли. При первичных опухолях более 4 см 5-летняя безрецидивная выживаемость больных составила 61,4±5,2%, при опухолях менее 4 см - 78,9±3,8% (р = 0,018).
Установлена тенденция улучшения 10-летней общей выживаемости больных с опухолями, содержащими рецепторы прогестерона, и ухудшения 5-летней общей выживаемости больных с опухолями, не содержащими рецепторы эстрогенов и прогестерона (р = 0,25). Пятилетняя безрецидивная выживаемость больных РТМ в зависимости от рецепторного статуса опухоли не различалась и составила в группе больных с рецептороотри-цательными опухолями 54,3±11,0%, с опухолями, содержащими только рецепторы прогестерона, - 69,8±12,6%, с опухолями, содержащими только рецепторы эстрогенов, - 65,4±12,9%, с рецептороположительными опухолями - 68,5±8,1%.
Проведенный анализ показал статистически достоверные различия в отдаленных результатах лечения больных РТМ в зависимости от наличия опухолевых клеток в смывах из брюшной полости (р = 0,0001). Так, в отсутствие опухолевых клеток в смывах медиана продолжительности жизни больных не достигнута, а при наличии опухолевых клеток составила 26,7 мес. Пятилетняя общая выживаемость оказалась равной 77,4±2,6 и 30,5±15,0% соответственно (р = 0,00001). Пятилетняя безрецидивная выживаемость больных РТМ составила в отсутствие опухолевых клеток в смывах 84,1±2,7%, при наличии опухолевых клеток в смывах - 26,5±15,7% (р = 0,00012), медиана безрецидивного периода - 19,7 мес.
Таким образом, факторами неблагоприятного прогноза, статистически достоверно влияющими на отдаленные результаты лечения больных РТМ I-III клинических стадий, являются стадия, возраст, глубина инвазии ми-ометрия, степень дифференцировки и размер опухоли, наличие опухолевых эмболов в кровеносных и лимфатических сосудах миометрия, опухолевых клеток в смывах из брюшной полости, диссеминации, лимфогенных метастазов.
Источник
Научная статья для специалистов
Вестник РОНЦ им. Н. Н. Блохина РАМН, т. 17, №3, 2006
А. В. Налбандян, В. В. Кузнецов, В. М. Нечушкина
НИИ клинической онкологии ГУ РОНЦ им. Н. Н. Блохина РАМН, Москва
ЛИТЕРАТУРА
1. Бохман Я. В. Руководство по онкогинекологии. - Л.: Медицина, 1989. - С. 275-340.
2. Трапезников Н. Н., Аксель Е. М. Статистика злокачественных новообразований в России и странах СНГ (состояние онкологической помощи, заболеваемость и смертность). - М., 2001. - 296 с.
3. Cohn D. E, Horowitz N. S, Mutch D. G. et al. Should the presence of lymphovascular space involvement be used to assign patients to adjuvant therapy following hysterectomy for unstaged endometrial cancer? // Gynecol. Oncol. - 2002. - Vol. 87. - P. 243-246.
4. Creasman W. T., Morrow C. P., Bundy B. N. Surgical pathologic spread patterns of endometrial cancer // Cancer. - 1987. - Vol. 60, N 8. - P. 2035-2041.
5. Lurain J. R. Uterine cancer / Berek J., Adashi E., Hillard P. (eds.). Novak‘s Gynecology. - 12th ed. - Baltimore: Williams & Wilkins, 1996. - P. 1057-1092.
6. Mizuuchi H., Nasim S., Kudo R. Clinical implications of K-ras mutations in malignant epithelial tumors of the endometrium // Cancer Res. - 1992. - Vol. 52, N 10. - P. 2777-2781.
Эмболизация при раке
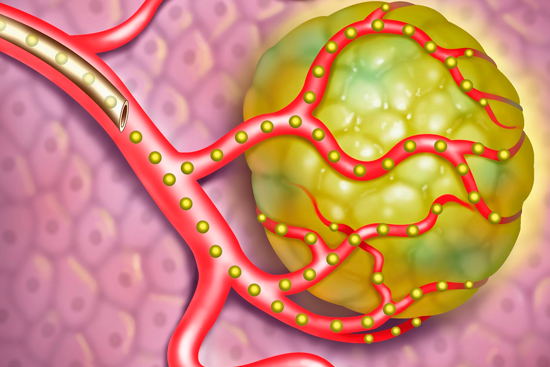
Эмболизация при раке относится к малоинвазивным методикам лечения онкозаболевания, применяется при многих видах раковой опухоли, но в большинстве случаев – при злокачественных новообразованиях печени. Цель процедуры – закупорить (перекрыть) кровеносные сосуды, питающие онкоочаг. Без кровообращения атипичные клетки прекращают распространение, что ведет к уменьшению, разрушению и гибели опухоли.
Эмболизация при раке — это современный прогрессивный метод борьбы с метастазами в труднодоступных местах, когда оперативное удаление опухоли представляет определенные трудности. Методика активно используется при крупных онкообразованиях, во время подготовки к оперативному вмешательству.
Эмболизация при раке осуществляется тремя способами:
- Артериальная или трансартериальная (ТАЭ) эмболизация – применяется при опухолях печени и матки. В артерию вводится катетер, через который подается эмболизирующий агент, приводящий к обструкции сосуда.
- Химиоэмболизация – комбинация ТАЭ и химиотерапии проводится одним из двух вариантов. Первый – цитостатики предварительно покрывают частицами эмболизирующего вещества. Второй – через катетер в артерию вводят химиопрепарат, затем просвет сосуда закупоривают.
- Радиоэмболизация – комбинация эмболизации и облучения заключается в доставке микросфер (радиоактивные частицы) в артерию, которые оседают рядом с онкоочагом, выделяя радиоактивное излучение на протяжении нескольких часов или дней.
Эмболизация при раке используется в трех вариантах:
- Основной самостоятельный метод лечения.
- Паллиативная помощь – на последних стадиях онкопроцесса для устранения болевого синдрома, купирования кровотечения, уменьшения побочных эффектов и осложнений болезни.
- Предоперационная эмболизация – используется при больших объемах опухоли для уменьшения ее размеров и улучшения операционного доступа, а также для снижения кровопотери во время операции.
Ее применяют как отдельный метод, так и в составе комплексного лечения, сочетая с лучевой или химиотерапией
Эмболизация при раке является перспективной альтернативой хирургическому вмешательству в онкологии благодаря своим преимуществам:
- Малотравматичная технология, не оставляющая рубцов, как после операции.
- Минимальный риск инфицирования и других осложнений.
- Отсутствие кровотечения после процедуры.
- Нет особой необходимости в применении общей анестезии. Это особенно актуально для лиц с непереносимостью медикаментозных средств.
- Восстановление в кратчайший период.
- Высокая эффективность.
- Сохранение целостности тканей.
- Возможность применения при неоперабельных формах онкозаболеваний.
- Минимальное токсическое воздействие.
- Возможность подбора доз эмболизирующего агента индивидуально, в зависимости от вида новообразования, локализации, стадии.
- Вероятность развития побочных эффектов сведена к минимуму.
- Не требуется длительная госпитализация.
- Возможность проведения манипуляции несколько раз до получения терапевтического эффекта без вреда для других органов и организма в целом.
Недостатки эмболизации немногочисленны. Назначается процедура индивидуально и подходит не для всех случаев. Проводить манипуляцию должен высококвалифицированный опытный специалист. При неопытности хирурга эмбол может проникнуть в здоровые ткани, и привести к осложнениям.
Химиоэмболизация при раке печени эффективна благодаря анатомическим особенностям. Ветви печеночной артерии кровоснабжают новообразования печени. Трансартериальная эмболизация закупоривает ветви, при этом не нарушая работу здоровых тканей, которые кровоснабжаются другим источником (ветвями воротной вены). При некоторых видах опухолей печени можно рассчитывать на полное выздоровление благодаря ТАЭ.
Эмболизация при раке шейки матки чаще сочетается с химиотерапией и лучевой терапией, включает три этапа. Первый этап – проведение двух курсов химиотерапии. Второй этап – двухсторонняя эмболизация маточных артерий при раке шейки матки, проводится через день—два после второго курса химиотерапии в рентген операционной. Третий этап – через неделю после ТАЭ выполняется облучение. Недостаток данного метода – системное воздействие цитостатика на организм.
Эмболизация при раке легких показана, когда у больного наблюдается кровохарканье, либо имеются противопоказания к операции или облучению. Для механической окклюзии используются в основном микроскопические волокна тефлонового велюра. Для химической – гипертонический раствор или этиловый спирт. Эмболизацию бронхиальных артерий проводят с гемостатической целью и с целью введения химиопрепаратов в зону опухоли. Улучшение наблюдается у 90% пациентов.
Эмболизация при раке почки показана при невозможности проведения полноценного оперативного вмешательства по тем или иным причинам. Через катетер, подведенный к сосудам пораженной почки, вводят эмбол (желатинообразный, пластиковый шарик), который закупоривает сосуд. Развитие опухоли замедляется или полностью останавливается. Когда состояние больного позволяет проводят нефрэктомию. В некоторых случаях методику используют перед оперативным вмешательством для снижения уровня кровопотери.
Эмболизация используется в различных областях медицины, например, в сосудистой хирургии вен нижних конечностей, в гинекологии при миоме матки, но в онкологии эту методику считают экспериментальной. Еще нет достаточных исследований, долгосрочных прогнозов, поэтому возможность проведения этой малоинвазивной операции рассматривают у каждого больного в отдельности.
Ограничения к выполнению процедуры связаны с конкретным диагнозом. Противопоказания в основном относительные:
- Гепатит, цирроз.
- Декомпенсированная почечная, печеночная, сердечная, дыхательная недостаточность.
- Асцит.
- Венозное кровотечение при варикозной болезни.
- Бронхолегочная эмболия.
- Объемные полости распада в онкоочаге.
- Невозможность надежной фиксации катетера.
- Генерализованный онкопроцесс.
- Непереносимость рентгеноконтрастного вещества.
- Аномалии артерий.
- Острый инфекционный процесс.
- Беременность.
- Болезни, связанные с нарушением свертываемости крови.
- Операбельный рак матки.
Вопрос о целесообразности эмболизации решается в каждом конкретном случае и зависит от состояния пациента.
Эмболизация при раке осуществляется в основном амбулаторно. Предварительно проводится диагностика. Главный метод обследования – ангиография с контрастированием, позволяющая оценить состояние сосудов, выявить источники кровоснабжения ракового очага.
Особой подготовки не требуется, но больной не должен есть и пить за 4–5 часов до операции. Для выполнения манипуляции общий наркоз используется редко, чаще – местное обезболивание. После обезболивания прокалывают артерию в нужном месте, вводят микрокатетер, через который запускается эмбол. В качестве эмболизирующих материалов используются:
- Жидкие вещества – удобны тем, что свободно проникают через сосудистые разветвления.
- Клееподобные вещества – превращаются в полимер после реакции с ионами.
- Вязкие материалы – применяются в качестве химиоэмболизации преимущественно при онкозаболеваниях печени.
- Склерозирующие – уплотняют эндотелий, используются для эмболизации некрупных сосудов.
- Микрочастицы – нужны для окклюзии мелких сосудов.
- Желатиновая губка или гель-пена – вызывает временную закупорку.
- Акриловые микросферы – вызывают постоянную окклюзию.
- Спирали – приводят к мгновенному тромбообразованию.
Для предупреждения осложнений после эмболизации ее проводят на фоне антибиотикотерапии.
По данным исследований и наблюдений, если процедура прошла успешно, и удалось закупорить сосуд, по которому происходит кровообращение опухоли, то пациент начинает чувствовать себя лучше, отмечается уменьшение болевого синдрома. У некоторых больных боли проходят довольно быстро, если удается полностью закупорить все сосуды, питающие опухоль. В некоторых случаях, если образование получает кровоснабжение из нескольких ветвей или хорошо развиты коллатерали, манипуляция оказывается неэффективной.
Эффективность эмболизации оценивается по следующим критериям:
- Регрессия полная – исчезновение проявлений заболевания, выздоровление.
- Регрессия частичная – уменьшение размеров онкоочага на 50% и более, отсутствие других очагов поражения.
- Стабилизация – объем пораженного органа уменьшается менее, чем наполовину, отсутствие новых очагов.
- Прогрессирование – увеличение объемов пораженного органа на 25% и более, появление новых онкоочагов.
Неэффективность эмболизации может быть связана с анатомическими особенностями, формой раковой опухоли, отсутствием опыта у врача. Некоторые виды опухолей при метастазировании могут трансформироваться в быстрорастущую форму, поэтому перед процедурой следует провести тщательное обследование больного.
Метод эмболизации исследуется и апробируется врачами-исследователями разных стран. Специалисты считают, что в скором времени с развитием микроэндоскопической техники, его можно будет использовать для лечения рака разных локализаций. Уже сейчас в ведущих онкологических центрах для визуализации кровеносного русла используют новейшую аппаратуру, работающую по принципу МРТ в режиме реального времени. Это облегчает проведение и улучшает эффективность процедуры.
Читайте также:

