Эмболизация почечных артерий при опухолях почек

Артериальная гипертензия остается одной из актуальнейших медико-социальных проблем современного общества. При этом среди трудоспособного населения данный недуг занимает одну из лидирующих позиций по распространенности, оставляя позади другие формы сердечно-сосудистых заболеваний.
Артериальная гипертензия может быть первичной (эссенциальной) либо вторичной – как следствие поражения каких-либо органов и систем. В отличие от первичной, вторичная гипертензия характеризуется более стремительным и злокачественным течением и значительно труднее поддается консервативной терапии, что довольно часто приводит к осложнениям в виде инсультов, инфарктов и смертей. В зависимости от формы вторичная гипертензия требует индивидуального подхода влечении, направленного на устранение этиологического фактора.
Среди всех форм вторичной гипертензии особое место занимает нефрогенная (ренальная) форма, связанная с поражением сосудов почек или паренхимы. Нефрогенная форма встречается в 30-35% случаев среди пациентов с различными видами артериальной гипертензии и наблюдается также почти при всех аномалиях развития и заболеваниях почек.
На сегодняшний день выделяют две основные формы нефрогенной гипертензии – вазоренальную, возникающую вследствие нарушения кровотока по почечным артериям и ее ветвям, и паренхиматозную, возникающую при поражении самой почечной ткани. В редких случаях встречается еще и смешанная форма. Поданным О.И. Костюкевич, вазоренальная форма встречается в 30% случаев, а паренхиматозная – в 70% случаев соответственно.
В основе патогенеза всех форм нефрогенной гипертензии лежит один и тот же механизм активации ренин-ангиотензин-альдостероновой системы (РААС). Суть его заключается в следующем. Снижение объема кровоснабжения почки вследствие различных причин, будь то нарушение кровотока по магистральным артериям или нарушение микроциркуляции вследствие склеротических изменений паренхимы или интерстициального отека, приводит к ишемии юкстагломерулярного аппарата (ЮГА).
В свою очередь это ведет к гиперплазии клеток, входящих в состав ЮГА, которые начинают выработку ренина в излишнем количестве. Ренин является катализатором в реакции превращения ангиотензиногена в ангиотензин-1. Далее в легких ангиотензин-1 при содействии ангиотензин-превращающего фермента трансформируется в ангиотензин-2. Ангиотензин-2 в свою очередь является мощным вазопрессором, а также стимулирует выработку альдостерона.
Кроме того, помимо активации РААС развитие нефросклероза и поражение интерстиция приводит к угнетению активности и синтеза мозговым веществом почки ангиотензиназы, простагландинов и кининов, обладающих мощным гипотензивным действием. Сам факт наличия нефросклероза вне зависимости от его генеза (нарушение кровотока по магистральным сосудам либо первичное поражение паренхимы) приводит к снижению выработки депрессорных факторов, что на фоне даже нормальных цифр активности ренина плазмы может быть причиной артериальной гипертензии. Так, по данным В.А. Алмазова и др., частота артериальной гипертензии при нефросклерозе достигает 98% случаев.
Причиной паренхиматозной гипертензии обычно служит одно- или двустороннее поражение почечной ткани вследствие таких заболеваний, как гломерулонефрит, пиелонефрит, туберкулез почек, нефропатия беременных, диабетический гломерулосклероз, гидронефроз, поликистоз и т.д. Причиной же реноваскулярной формы чаще всего служит нарушение кровотока по магистральным артериям почки вследствие атеросклероза, фибромускулярной дисплазии, дистальной эмболизации частичками атеросклеротической бляшки, аневризмы почечной артерии, артериовенозных фистул. Кроме того, причиной вазоренальной гипертензии могут быть добавочные почечные артерии как при удвоении почки, так и при нормальном ее строении.
Среди рентгенохирургических методов лечения нефрогенной артериальной гипертензии наиболее изучено стентирование почечной артерии с целью коррекции стенозированного сегмента. Данному способу лечения посвящено довольно большое количество исследований и публикаций. Однако в ряде случаев необходимо применение методики эмболизации почечной артерии (ЭПА) и ее ветвей, но, к сожалению, данный подход мало изучен из-за довольно узких показаний к применению. Ранние сообщения мировой литературы об эмболизации почечной артерии были посвящены лишь лечению опухолей почки. Технический прогресс и накопленный опыт позволили расширить показания для ЭПА, в том числе и по отношению к резистентной артериальной гипертензии.
Артериальная гипертензия как проявление артериовенозной фистулы (АВФ) – одно из показаний к ЭПА. Это довольно редкое поражение, оно возникает, как правило, вследствие биопсии нативной или пересаженной почки, резекции почки, наличия чрескожной нефростомы или проникающей травмы. Хотя 70% АВФ в почечных аллотрансплантатах разрешаются самостоятельно в течение 2 лет, эмболизация является методом выбора при лечении симптоматических АВФ.
Кроме того, рентгенохирургическое лечение предпочтительнее хирургического, если предполагается сохранение почечной функции. Технический успех процедуры достигается при суперселективной катетеризации и использовании микроспиралей. Частицы не используются, поскольку они могут пройти сквозь АВФ, не задерживаясь в ней, и вызвать тромбоэмболию легочной артерии. В тех случаях, когда имеется высокий скоростной поток, может использоваться баллон для временной окклюзии сосудов и исключения попадания эмболических агентов в системный кровоток.
Артериовенозные мальформации (АВМ) встречаются также довольно редко и имеют, как правило, средний либо высокий скоростной поток, а также могут быть как приобретенными, так и врожденными. Врожденные АВМ обычно малых размеров и не имеют клинических проявлений. Приобретенные АВМ обычно имеют сложное строение и в случае симптомного течения могут проявляться как в виде артериальной гипертензии, таки гематурии, нарушения функции почек, сердечной недостаточности. Из-за их довольно сложного строения эти поражения почти никогда полностью не вылечиваются и имеют довольно высокую частоту рецидивов. Таким образом, конечная точка лечения заключается не в получении идеальной ангиографической картины, а в исчезновении клинических проявлений и возможности выполнения повторного вмешательства. В качестве эмболитических агентов целесообразно использовать вязкие склерозанты, такие как цианакрилат, оникс сотрадекол. Гемостатическая губка не рекомендована из-за временного эмболического эффекта и риска реканализации АВМ. Эффективность процедуры эмболизации также может повысить предварительное введение адреналина с целью уменьшения диаметра целевых сосудов.
Целью ЭПА при подготовке пациентов с терминальной почечной недостаточностью и резистентной артериальной гипертензией к пересадке почки является избавление от симптоматической артериальной гипертензии и снижение смертности. Лечение неконтролируемой резистентной артериальной гипертензии у пациентов с терминальной стадией почечной недостаточности ранее проводилось при помощи открытой или лапароскопической нефрэктомии. Лапароскопическая нефрэктомия связана с меньшим количеством осложнений по сравнению с открытой нефрэктомией, при которой смертность достигает 10%. Как открытая, так и лапароскопическая нефрэктомия применялись довольно редко из-за высокого риска осложнений, связанных с анестезией. ЭПА является эффективной и безопасной альтернативой. Несмотря на преимущества, ЭПА имеет и недостатки, а именно устранение почечной функции и постэмболитический синдром.
Перед выполнением процедуры пациентам назначают профилактическую дозу антибиотика. Небольшое введение седатирующего препарата и местной анестезии обычно вполне достаточно для комфортного состояния пациента, хотя иногда требуется общий наркоз, в частности, когда в качестве склерозирующего агента используется спирт, особенно в больших объемах (более 10 мл), что связано с выраженным болевым синдромом.
Сосудистый доступ обычно выполняется через бедренную артерию путем пункции по Сельдингиру. В случае невозможности использовать бедренный доступ прибегают к доступу через верхнюю конечность (лучевую и плечевую артерию). Для выполнения вмешательства обычно достаточно катетера размером 5 F.
Для селективной катетеризации главной почечной артерии используются катетеры различных модификаций, например: Cobra, JR, Amplaz, RDC и т. д. При подборе инструмента всегда необходимо помнить о соответствии выбранного катетера анатомии артерии. Суперселективная катетеризация почечных артерий включает в себя использование микрокатетеров, заводимых через основной катетер на проводнике.
Селективная эмболизация используется в тех случаях, когда необходимо устранить кровоснабжение лишь части почки, минимизируя при этом степень инфаркта функциональных частей. Это достигается путем селективной катетеризации нужной почечной артерии. Суперселективная эмболизация позволяет выключить из кровотока небольшой сегмент почки с минимальным воздействием на окружающую паренхиму. Проводимые исследования сообщают о случаях, когда благодаря суперселективной катетеризации эмболизировалось менее 10% почечной паренхимы, что не приводило к клинически значимому снижению почечной функции, а при эмболизации 15-50% почечной паренхимы функция почки может находиться под угрозой.
В тех случаях, когда необходимо выключить из кровообращения всю почку, используется эмболизация общей почечной артерии, при этом катетер заводится как можно дистальнее от устья для исключения заброса эмболизирующего агента в просвет аорты и эмболизации висцеральных артерий. При этом сначала производится эмболизация маленьких ветвей при помощи поливинилалкоголя или спирта, микросфер, и при отсутствии кровотока по основной артерии в ней расправляются спирали.
Эмболизация почечной артерии считается безопасной процедурой с относительно низким уровнем осложнений. Наиболее часто встречается постэмболизационный синдром (около 90% случаев). Пациентов в этом случае обычно беспокоят небольшие боли в боку, лихорадка, тошнота, рвота, лейкоцитоз в течение 1-3 дней после ЭПА. Лечение симптоматическое и заключается в введении анальгетиков, жаропонижающих и противорвотных препаратов по мере необходимости до исчезновения симптомов.
Миграция эмболизационных спиралей является также нечастым, но потенциально серьезным осложнением и встречается в порядке 2% случаев. Как правило, это может быть обнаружено в конце процедуры и исправляется при помощи ловушек. Непреднамеренная эмболизация может привести к ишемии спинного мозга, нижних конечностей и кишечника. Также рефлюкс эмболизационных агентов может привести к потери почечной функции с последующей злокачественной гипертензией.
Помимо выше обозначенных показаний, ЭПА может быть использована и при артериальной гипертензии, связанной с добавочными почечными артериями. Вопрос о связи артериальной гипертензии с наличием одной или нескольких добавочных почечных артерий довольно длительно обсуждается в мировом медицинском сообществе. Существуют работы, показывающие эту взаимосвязь. Механизм развития артериальной гипертензии схож с таковым при стенозирующем поражении почечных артерий. При неизменном общем количестве поступающей крови в почку наличие добавочной почечной артерии может приводить к нарушению внутрипочечной гемодинамики и появлению ишемизированныхучастков, что в свою очередь провоцирует активацию РААС.
На сегодняшний день в литературе не имеется клинических случаев, описывающих использование эмболизации почечной артерии влечении артериальной гипертензии, однако описаны случаи резекции почки для лечения данной патологии. David С. et al. описали случай лечения пациента 8-летнего возраста с резистентной артериальной гипертензией на уровне 190/130 мм рт. ст.
Пациент получал многокомпонентную терапию, включая диуретик, без значимого снижения цифр давления. Поданным ангиографии признаков стенозирующего поражения почечных артерий не выявлено, однако правая почка имела добавочную почечную артерию, питающую нижний полюс и отходящую от правой общей подвздошной артерии. По данным динамической нефросцинтиграфии, перфузия нижнего полюса правой почки была снижена в два раза по сравнению с противоположной стороной. При выполнении пробы с каптоприлом с селективным забором крови из почечных вен для определения активности ренина были получены следующие цифры: слева 36 нг/л, а справа 154 нг/л. Было принято решение о выполнении резекции нижнего полюса правой почки как источника излишней продукции ренина, что приводит к прогрессированию резистентной гипертензии. Через 7 дней после операции артериальное давление составило 130/70 мм рт. ст. на фоне полной отмены антигипертензивных препаратов. На наш взгляд, в данном случае возможно было использовать селективную эмболизацию почечной артерии.
Возможная эффективность использования ЭПА для лечения артериальной гипертензии, связанной с добавочной почечной артерией, подтверждается и другими клиническими наблюдениями. Таким образом, данный метод лечения симптоматической артериальной гипертензии требует более глубокого изучения с последующим расширением показаний к применению.
Г.Г. Хубулава, К.Л. Козлов, С. С. Михайлов, А.Н. Шишкевич,
Е.Ю. Бессонов, Л.А. Бобровская, Е.В. Седова
Рентгенэндоваскулярная хирургия (РЭВХ) - это новое перспективное направление клинической медицины. Сущность её заключается в проведении внутрисосудистых чрезкатетерных диагностических исследований и лечебных манипуляций под рентгеновским контролем. Хотя РЭВХ является паллиативным методом, т.к. не устраняет причину заболевания, тем не менее, она несомненно, заслуживает признание. С помощью методов РЭВХ удаётся, с одной стороны прервать или ограничить кровоток по сосуду путём эмболизации (Э) или тромбирования, с другой - восстановить просвет стенозированных или окклюзированных (ОК) сосудов путём дилятации или реканализации или экстракции тромболитического материала. Основные разделы рентгеноэндоваскулярной хирургии или транслюминальной ангиопластики:
1 РЭВХ - окклюзия
2 РЭВХ - дилятация
3 РЭВХ - реканализация
4 РЭВХ - протезирование
5 Тромболизис
6 Региональная внутриартериальная инфузионная терапия.
РЭВХ - окклюзия основана на введении в сосуд через катетер специального эмболизирующего материала временно либо постоянно обтурирующего просвет сосуда. В настоящее время накоплен опыт по закрытию аневризм сосудов, перекрытию патологических артериовенозных соустий , функциональному выключению почки при хронической почечной недостаточности, сопровождающейся гипертензией и альбуминурией, перед трансплантацией почки, функциональной спленэктомией при гематологических заболеваниях и гиперспленизме, а так же приводящих артерий с целью искусственной ишемизации новообразования.
По определению И.Х.Рабкина, рентгеноэндоваскулярная окклюзия (РЭО) - это целенаправленная, контролируемая рентгенологически, чрезкатетерная закупорка сосуда. Её применяют с целью:
1 - остановки кровотечения
2- закрытия патологического артериовенозного шунта
3 - функционального выключения или снижения патологической функции органа
4 - ишемизация тканей для уменьшения операционной кровопотери, повышения радикальности и эффективности хирургического вмешательства
5 - замедления роста опухоли и повышения иммунологической активности организмаю
Первое экспериментальное исследование в этой области выполнили Н.Каргнер и J.Austin (1911), изучавшие развитие инфарктов почки и селезёнки при прямом введении тромбирующих веществ в органные артерии. Впервые РЭО органной артерии в предоперационном периоде была осуществлена у больных раком почки в 1973 г (Almgard et all). Известно, что рак почки встречается у 2-3% всех больных со злокачественными новообразованиями. После первого сообщения Almgard о транскатетерной окклюзии почечных артерий у 19-ти больных раком почки метод получил быстрое распространение в онкоурологии. В 1975 г C.Gianturko и соавторы, стремясь добиться эффективной постоянной и контролируемой окклюзии магистральных артерий и вен, разработали и внедрили в клиническую практику эластические стальные спирали.
Материалы, использовавшиеся для окклюзии сосудов весьма разнообразны. Это биологические ткани (аутогемосгусток, жировая ткань, фибринная плёнка, аутомышца, хрящевая ткань), синтетические материалы (гельфом, скангель, спонгостан, ивалон, тефлон-велюр, полиуретан, полистирол и т.д.), жидкие полимеризующиеся и склерозирующие вещества (МК-6, МК-7, букрилат, гистоакрил, полимеризующийся силикон, этанол, тромбовар и т.д.), а также сложные технические окклюзирующие приспособления (эмболы на фиксирующих нитях, баллон катетеры, съёмные баллоны, зонтичные фильтры и окклюдеры, стальные спирали и щётки, электрокоаггуляция, лазерная коагуляция).
Различают временную (с помощью фармпрепаратов, баллонов) и настоящую окклюзию сосудов.
Существуют методики дистальной (с помощью эмболов закрывается просвет мелких сосудов), проксимальной (с помощью спиралей Гиантурко добиваются тотальной окклюзии магистральной почечной артерии) и сочетанной окклюзии почечной артерии (когда используются обе перечисленные методики).
Кроме того, в зависимости от стадии заболевания, наличия сопутствующей патологии, (Э) почечной артерии может быть этапом предоперационной подготовки перед нефрэктомией, либо самостоятельной паллиативной операцией у неоперабельных больных. В первом случае добиваются абластичности, уменьшения кровопотери, опухоль легче выделяется, уменьшается время операции, увеличивается её радикальность. Во втором случае, по общему мнению, эмболизацию следует сочетать с введением химиопрепаратов, то есть выполнять химиоэмболизацию.
В ангиографическом кабинет Гродненской ОКБ (Э) почечных артерий выполняется с 1989 года. В данной работе нами обобщён опыт за последние два года. Всего выполнено 49 успешных эмболизаций.
Методика выполнения: Катетеризация почечной артерии по стандартной методике Сельдигера чрезбедренным доступом. После катетеризаци выполнялась аортография, селективная ангиография поражённой почки, а в ряде случаев другой почки или добавочных артерий. Затем катетер вводился максимально глубоко в артерию, а иногда в сегментарные артерии и проводилась дополнительная анестезия по разработанной нами методике. В это же время готовилась эмболизирующая смесь, состоящая из стерильного гидрогеля (1-2 г), контрастного вещества (10-20 мл), и в случае химиоэмболизации - адриобластин. Спиралей Гиантурко в нашем распоряжении не имелось. Под рентгеновским контролем выполнялась (Э) субсегментарных, сегментарных и частично ствола почечной артерии не ближе 1,5-2 см от устья. После этого выполнялась контрольная ангиография. Здесь необходимо отметить, что в ряде случаев (7 наблюдений) катетеризация оказалась невозможной из-за наличия патологической извитости подвздошных артерий, аорты, почечных а., наличия стенозов, короткого (1 см) ствола почечной артерии, наличия добавочных артерий. В одном случае (2%) нам удалось выполнить эмболизацию при наличии 50% стеноза собственно почечной артерии. (Э) выполнялась больным с опухолями почек в стадиях Т3-Т4 как с наличием метастазов, так и без них.
Из общего количества больных мужчин было 30 (63.8%), женщин 17 (36.2%). Возраст больных колебался от 76 лет до 45 лет, средний составил 58 лет. Опухоли левой почки составили 25 случаев (53.2%), правой - 22 случая (46.8%). Размер опухолей варьировал от 1.5 до 17 см, средний - 9.7 см. Продолжительность вмешательства составила от 40 до 90 минут. Расход контраста от 45 до 80 мл. Предоперационная (Э) выполнялась 17 больным (36.2%), как самостоятельная операция - 30 больному (63.8%). Нефрэктомия при предоперационной эмболизации выполнялась в сроки от 1 часа до 7 суток, однако, чаще всего через 24 часа. В одном случае мы имели осложнение, связанное с токсическим воздействием контраста, которое потребовало консервативного лечения.
В 100% случаев мы добились полной окклюзии почечной артерии, хотя в 5 случаях, при больших опухолях с прорастанием окружающих тканей, по данным аортографии отмечалось незначительное контрастирование фрагментов опухоли через коллатерали. Во время операций и при контрольных УЗ исследованиях отмечалось:
1 -уменьшение размеров опухолевых узлов
2 -облегчалось выделение опухоли
3 -повышалась радикальность проводимого вмешательства и его абластичность
4 -уменьшалась кровопотеря во время операции
5 -устранялась возможность кровотечения.
Таким образом, РЭО почечных артерий полностью оправдала себя в онкоурологии в качестве метода предоперационной подготовки, остановки кровотечения и паллиативного средства, способствующего замедлению развития злокачественного роста у операбельных больных, позволяет в комплексе с другими методами лечения продлить их жизнь и в большинстве случаев значительно улучшить её качество.
Ризолит - высококлассное агентство Недвижимости, мы на рынке с 1994 года! Это один из самых продвинутых и современных агентств недвижимости существующих на нашем рынке. Широкий спектр услуг, невысокие цены и внимание каждому клиенту привлекает все больше и больше людей обращаться именно в это агенство.

Эмболизация — малоинвазивная процедура, которая может дополнять хирургическое лечение или использоваться самостоятельно. Хирург через прокол в бедренной артерии проводит специальный катетер в артерии, непосредственно питающие опухоль и через него закрывает их специальными частицами — эмболами, которые перекрывают кровоток. В ряде случаев используют эмболы, способные выделять химиопрепарат в ткань опухоли — такое вмешательство называется химиоэмболизация.
Эмболизация применяется для лечения многих заболеваний. С начала XXI века эта процедура получает все более широкое применение и в онкологии, в первую очередь из-за своей эффективности и малоинвазивности — эмболизации безболезненны, не требуют наркоза, инструмент вводится через пункцию артерии, т. е. нет никакой операционной раны.
Эмболизация у онкологических пациентов
Эмболизация артерий для лечения опухолей и их метастазов помогает решить следующие задачи:
- в качестве самостоятельного метода лечения — эмболизация (чаще всего в варианте химиоэмболизации) может приводить к ишемии ткани опухоли и ее гибели. Для некоторых заболеваний, например, ряд опухолей печени, этот лечения может приводить к полной ремиссии без хирургического лечения.
- в сочетании с хирургическим лечением эмболизация используется как вспомогательная технология — чаще всего для уменьшения кровотечения во время операции за счет деваскуляризации (обескровливания) новообразования;
- в ряде случаев эмболизация, выполненная перед операцией, дает возможность проведения более радикальной операции за счет предварительного уменьшения опухоли;
- эмболизация также может применяться для борьбы с симптомами и осложнениями онкологических заболеваний — это в первую очередь остановка опасных кровотечений, которые угрожают жизни пациента, кроме того — облегчение боли, вызванной злокачественным новообразованием; еще одним эффектом является уменьшение объема и замедление роста опухоли.
Виды эмболизации артерий у онкологических больных:
- предоперационная — выполняется в качестве первого этапа хирургического вмешательства;
- в качестве самостоятельного метода лечения — чаще всего при опухолях печени, почек и ряде других опухолей
- в качестве паллиативного метода лечения — для остановки кровотечений, уменьшения болевого синдрома, уменьшения объемов и темпа роста опухоли.
Как проводится эмболизация артерий?
Эмболизация выполняется врачами-рентгенохирургами в специально оборудованной ангиографической операционной. Перед эмболизацией всегда проводят ангиографию. В сосуды вводят рентгенконтрастное вещество, в ходе чего записывают рентгеновское изображение в цифровом видеоформате. Это помогает врачу оценить расположение и анатомию сосудов, определить, из каких артерий осуществляется кровоснабжение опухоли.
Чаще всего эмболизацию выполняют под местной анестезией. В редких случаях приходится использовать общую анестезию (наркоз). За 4–5 часов до процедуры пациента просят ограничить прием пищи, иногда дают успокоительные препараты.
В большинстве случаев доступ к нужному сосуду получают через бедренную артерию, это самый типичный доступ для всех ангиографических исследований и вмешательств, но могут использовать и другие артерии в других местах (лучевую на запястье, плечевую в области локтевого сгиба и т. п.). Врач обрабатывает кожу антисептиком и делает небольшой прокол, вводит в артерию специальный катетер размером не более 1,5 мм и продвигает его до тех пор, пока не достигнет нужного сосуда. Через катетер в сосуд вводят эмболы, которые перекрывают его просвет.
Существуют разные виды эмболов:
- Поливинилалкоголь (PVA) представляет собой частицы размером от 50 до 1000 мкм. Это относительно недорогой и простой в применении препарат, однако, в настоящее время он считается устаревшим. Сейчас чаще всего применяют сферические эмболы, например, Bead Block и Embozene.
- Спирали из платины и нержавеющей стали. После установки в просвете сосуда на них быстро образуется тромб, который перекрывает кровоток. Иногда такие спирали применяют вместе с желатиновыми губками: сначала устанавливают спираль, а затем через катетер вводят губку — ее частички оседают между витками. Их применяют только для остановки кровотечений, обусловленных опухолями.
- Химиоэмболизация — введение в просвет сосуда эмболов, содержащих химиопрепарат. Таким образом, с одной стороны происходит закупорка сосудов, кровоснабжающих опухоль, а с другой химиопрепарат поступает непосредственно в ткань опухоли и не оказывает побочные эффекты, которые возникают при его введении в вену. При этом в самой опухоли создаются очень высокие концентрации препарата, невозможные при обычном введении. Мы применяем самые современные препараты для химиоэмболизации: DC Beads (Terumo, Япония) и Hepaspheres (Merit Medical, США)., которые высвобождают химиопрепарат в течение длительного времени, в стабильной дозировке.
- Радиоэмболизация — введение эмболов, содержащих радиоактивные изотопы. Эта процедура еще называется внутренней лучевой терапией, так как в опухоль изнутри вводят дозу радиации, разрушающей ее клетки. Для этого обычно используют изотоп Иттрий-90.
К эмболизации артерий наиболее часто прибегают при следующих онкологических заболеваниях:
- В качестве самостоятельного метода лечения: Первичные и метастатические опухоли печени, почек, легких и других локализаций.
- В комбинации с хирургическими методами: Первичные и метастатические опухоли печени, почек, легких, костей, позвоночника, матки, простаты, мочевого пузыря и т. д.
- Для остановки кровотечений при опухолях: малого таза, легких, прямой кишки, толстой кишки, печени, матки, простаты, опухолях головы и шеи. Т. е. практически при любой локализации с целью прекращения кровотечения.
Эмболизация также широко применяется для лечения заболеваний, не связанных с онкологией:
- Миома матки. Эмболизация маточных артерий — наименее травматичный способ лечения миомы матки, обладающий высокой эффективностью — около 98,5% женщин, перенесших эту процедуру, не нуждаются в дополнительном лечении.
- Аденома простаты. Эмболизация - эффективный, малоинвазивный способ лечения аденомы предстательной железы, который сегодня становится все более распространен в развитых странах.
- Варикоцеле — наименее инвазивная альтернатива хирургическому лечению, выполняется амбулаторно за 20–30 минут.
- Сосудистые мальформации различной локализации.
- Аневризмы — в первую очередь аневризмы головного мозга, способные вызвать геморрагический инсульт.
Насколько безопасна эмболизация?
Цель эмболизации в онкологии — не только прекратить приток крови к патологическому очагу, но и сохранить при этом кровообращение в соседних здоровых тканях. Современная техника эмболизации с использованием микрокатетеров позволяет обеспечить необходимую точность эмболизации.
Для того чтобы обеспечить точность в ходе эмболизации всегда проводят ангиографию. Врач внимательно изучает сосудистую сеть, кровоснабжение опухоли и определяет, в какой сосуд должны быть введены эмболы. Эмболы вводятся только после детального изучения сосудистой анатомии опухоли в ходе вмешательства. Перед эмболизацией вам также могут назначить УЗИ, КТ, МРТ и другие исследования.
Существует ряд противопоказаний к проведению эмболизации, но все они являются относительными, то есть процедура, как правило, все же может быть проведена при соблюдении некоторых условий. Например, у пациента с нарушением функции почек должно быть нормализовано артериальное давление, водно-солевой баланс, а во время ангиографии нужно использовать минимальное количество контрастного вещества.
В Европейской клинике с каждым пациентом работают индивидуально. Врач оценивает общее состояние больного, учитывает сопутствующие заболевания, размеры и расположение опухоли, особенности ее кровоснабжения.
Врачи-специалисты Европейской клиники имеют огромный опыт проведения эмболизации артерий при различных видах опухолей. Мы используем значительный собственный и опыт коллег из ведущих зарубежных клиник. Некоторые процедуры, которые мы предлагаем пациентам в Европейской клинике (например, эмболизация при аденоме простаты), даже в Европе, США и Израиле являются прерогативой крупных университетских клиник из-за необходимости иметь хирургов самого высокого уровня.
Нашими врачами были выполнены первые в России эмболизации миомы матки, артерий простаты, мы первыми стали работать с самыми современными препаратами для эмболизации — Bead Block, Embozene, DC Bead и др.












Эмболизация почечной артерии при раке почки
В структуре онкологической заболеваемости почечно-клеточный рак (ПКР) занимает 2% (10-е место).
В онкоурологическом профиле рак почки в России устойчиво занимает 2-е место, уступая раку простаты. Средний возраст пациентов, у которых впервые диагностирован ПКР – 50–70 лет. ПКР чаще диагностируется у мужчин. Смертность от ПКР в мире возросла до 102 тыс. человек в год.
ПКР в 25–40% наблюдений является случайной находкой при диспансерном обследовании. При первично выявленном ПКР в 25–30% диагностируются метастазы в отдаленные органы. На сегодняшний день основным методом лечения рака почки является нефрэктомия и/или резекция почки. Пятилетняя выживаемость при локализованных формах ПКР – 50–90%; при наличии отдаленных метастазов – 0–13%.
ПКР часто сопровождается такими осложнениями, как кровотечение, образование опухолевого тромба, вплоть до его отрыва и тромбоэмболии легочной артерии, большим объемом интраоперационной кровопотери, техническими сложностями при мобилизации почки.
В ГКБ №31 в последнее время при больших размерах опухоли почек в качестве предоперационной подготовки применяется эмболизация почечной артерии, что приводит к уменьшению размеров опухоли, облегчает выделение опухоли, повышает радикальность проводимого вмешательства и его абластичность, уменьшает кровопотерю во время операции.
Пациент С., 1966 г. р.
История настоящего заболевания: вышеуказанные жалобы отметил за месяц до госпитализации.

Пациенту в амбулаторных условиях проведено комплексное обследование в объеме ультразвукового исследования (УЗИ), компьютерной томографии почек с внутривенным контрастированием, по данным которых диагностирована опухоль левой почки, занимающая нижний и средний сегменты размерами 20×11×15 см с наличием опухолевого тромба в почечной вене (рис. 1).
При рентгенографии легких и остеосцинтиграфии данных за метастатическое поражение костей и легких не выявлено.
По данным динамической нефросцинтиграфии выявлено выраженное снижение накопительной и выделительной функций левой почки. Функция правой почки удовлетворительная.
Установлена стадия: T3bN1Mо. Тромбоз левой почечной вены. Варикоцеле слева.
С целью предоперационной подготовки и остановки кровотечения из почки первым этапом выполнена селективная эмболизация почечной артерии спиралями Джиантурко по методу Сельдингера (рис. 2).
На следующий день при контрольном УЗИ с допплеровским картированием установлено, что кровоток в артериях почки отсутствует. Отмечено уменьшение почки в размерах до 15×10×10 см.
После эмболизации отмечались гипертермия и выраженный болевой синдром, что потребовало адекватного обезболивания. Через три дня после эмболизации выполнена операция – радикальная нефрэктомия. Учитывая большие размеры опухоли, принято решение выполнить нефрэктомию из люмболапаратомного доступа. Протокол операции: под эндотрахеальным наркозом выполнена люмболапаротомия с переходом в 10-е межреберье. При ревизии органов брюшной полости пальпаторно распространения опухоли не выявлено. Выделена почечная вена, в которой определялся опухолевый тромб размером 4×1 см, не доходящий до нижней полой вены 1,5 см.
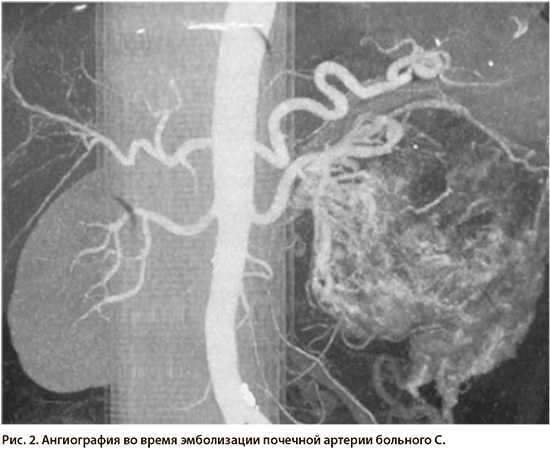
С учетом ранее выполненной эмболизации почечной артерии почечная вена перевязана в первую очередь ниже опухолевого тромба и пересечена. При выделении почки отмечено незначительное кровотечение. Далее выделена почечная артерия, перевязана и пересечена между аортой и спиралью Джиантурко. Выполнена нефрэктомия. Произведена лимфодиссекция от бифуркации аорты до диафрагмы. Необходимо отметить, что благодаря ранее выполненной эмболизации почечной артерии удалась избежать массивной кровопотери (250–300 мл), выделение почки с капсулой Герота технический было облегчено.
Макропрепарат: почка размерами 15×10×10 см. Нижний и средний сегменты почки замещены опухолью.
На разрезе опухоль грязно-желтого цвета с очагами распада, наличием в почечной вене опухолевого тромба.
Гистологическое заключение: умеренно дифференцированная светлоклеточная почечно-клеточная карцинома с обширными кровоизлияниями и некрозом. Опухоль врастает в лоханку, фиброзную капсулу почки, паранефральную клетчатку, почечную вену с наличием опухолевого тромба. Метастаз в одном парааортальном лимфоузле.
Таким образом, эмболизация почечной артерии в качестве метода предоперационной подготовки позволяет уменьшить размеры опухоли, облегчить выделение почки и уменьшить кровопотерю в ходе операции, повысить радикальность и абластичность операции, а также позволяет остановить кровотечение на дооперационном этапе.
В.К. Карпов, доцент кафедры урологии МГУ; С.А. Капранов, профессор кафедры урологии МГУ; М.М. Эхоян, врач-уролог ГКБ №31
Читайте также:

