Электронная формула калия с хлором
Степени окисления. Все галогены в галогенидных соединениях имеют степень окисления - 1. Такое состояние окисления для фтора в соединениях вообще является единственно возможным. Другие галогены могут существовать еще в состояниях с положительными степенями окисления. Эти состояния возникают в результате промотирования электронов с -орбиталей атомов галогенов на их вакантные (незанятые электронами) d-орбитали (рис. 16.2). В атомах галогенов d-орбитали имеют сравнительно низкую энергию и поэтому оказываются легко доступными для заселения промотированными электронами.
У хлора и брома возможны устойчивые состояния со следующими степенями окисления: Иод обнаруживает степени окисления .
Рис. 16.2. Промотирование -электронов хлора в состояниях с высокими степенями окисления.
В табл. 16.12 приведены систематические и традиционные названия кислородсодержащих кислот хлора и их солей. Чем выше степень окисления хлора в этих кислотах, тем выше их термическая устойчивость и сила кислоты:
Сильные кислоты, причем одна из самых сильных среди всех известных кислот. Остальные две кислоты лишь частично диссоциируют в воде и
Таблица 16.12. Кислородсодержащие кислоты хлора и их анионы
существуют в водном растворе преимущественно в молекулярной форме. Среди кислородсодержащих кислот хлора только удается выделить в свободном виде. Остальные кислоты существуют только в растворе.
Окислительная способность кислородсодержащих кислот хлора уменьшается с возрастанием его степени окисления:
Особенно хорошие окислители. Например, кислый раствор :
1) окисляет ионы железа (II) до ионов железа (III):
2) на солнечном свету разлагается с образованием кислорода:
3) при нагревании приблизительно до 75 °С он диспропорционирует на хлорид-ионы и хлорат -ионы:
Эти соли обычно более устойчивы, чем сами кислоты. Исключением являются твердые соли хлораты (III), которые детонируют при нагревании и при соприкосновении с горючими материалами. В растворах окислительная способность кислородсодержащих солей хлора тем больше, чем больше в этих солях степень окисления хлора. Однако они не являются столь хорошими окислителями, как соответствующие кислоты.
Натриевые и калиевые соли имеют важное промышленное значение. Их производство и применения описаны в следующем разделе. Хлорат (V) калия обычно используют для лабораторного получения кислорода, в присутствии оксида в качестве катализатора:
При нагревании этой соли до более низкой температуры в отсутствие катализатора происходит образование калия:
Иодат (V) калия калия сильные окислители, и в качестве окислителей они используются в количественном анализе.
Итак, повторим еще раз
1. Свойства галогенидов различных элементов при перемещении слева направо в пределах одного периода изменяются следующим образом:
а) характер химической связи становится все более ковалентным и все менее ионным;
б) водные растворы галогенидов становятся все более кислыми из-за гидролиза.
2. Свойства различных галогенидов одного и того же элемента при перемещении к нижней части VII группы изменяются следующим образом:
а) характер химической связи галогенидов становится все более ковалентным:
б) прочность связи в молекулах галогеноводородов уменьшается;
в) кислотность галогеноводородных кислот уменьшается;
г) легкость окисления галогеноводородов возрастает.
3. По мере возрастания степени окисления галогена происходят следующие изменения:
а) термическая устойчивость его кислородсодержащих кислот возрастает;
б) кислотность его кислородсодержащих кислот возрастает;
в) окислительная способность его кислородсодержащих кислот уменьшается;
г) окислительная способность солей его кислородсодержащих кислот возрастает.
4. Галогениды можно получать прямым синтезом из образующих их элементов.
5. Для получении галогеноводородов может использоваться реакция вытеснения из галогенидной соли менее летучей кислотой.
6. Аномальные свойства соединений фтора:
а) фторид серебра растворим в воде, а фторид кальция нерастворим;
б) фтороводород имеет аномально высокие температуры плавления и кипения;
в) водный раствор фтороводорода имеет низкую кислотность;
г) фтор обнаруживает только одно устойчивое состояние окисления. Другие галогены обнаруживают множество состояний окисления, что объясняется промотированием их -электронов на легко доступные -орбитали, обладающие низков энергией.
Хлорная кислота (формула HClO4) - это одноосновная безводная кислота. Содержит в себе хлор (Cl) в высшей степени окисления, по этой причине является сильнейшим окислителем. Взрывоопасна.
Свойства хлорной кислоты
1. Это летучая жидкость без цвета, в воздухе сильно дымит, мономерна в парах. Неустойчива и очень реакционна. Для этой кислоты характерна автодегидратация:
3HClO4 = H3O+ (катион) + ClO- (анион) + Cl2O7 (оксид хлора)
2. Данное вещество хорошо растворимо в хлор- и фторорганических растворителях, таких как CH2Cl2 (хлористый метилен), CHCl3 (хлороформ) и другие. Смешивается и с другими растворителями, проявляет восстановительные свойства, при неосторожном обращении может привести к взрыву или воспламенению.
3. Хорошо смешивается с водой (H2O) в любых соотношениях. Образует несколько гидратов. Концентрированные растворы данной кислоты обладают немного маслянистой консистенцией. Растворы водные данной кислоты обладают хорошей устойчивостью и низкой окислительной способностью. С водой рассматриваемое нами вещество образует азеотропную смесь, которая при температуре 203 градуса кипит и содержит 72 процента HClO4.
4. Хлорная кислота (формула HClO4) является одной из Из-за этого в ее среде некоторые кислотные соединения ведут себя подобно основаниям.
5. В условиях пониженного давления при слабом нагревании смеси кислоты хлорной с фосфорным ангидридом образуется маслянистая бесцветная жидкость - ангидрид хлорный:
2HClO4 (кислота хлорная) + P4O10 (ангидрид фосфорный) = Cl2O7 (ангидрид хлорный) + H2P4O11
Способы получения
1. Водные растворы данного вещества можно получить двумя способами. Первый заключается в электрохимическом окислении хлора или соляной кислоты в концентрированной соляной кислоте, а второй - в обменном разложении перхлоратов натрия или калия неорганическими сильными кислотами.
2. Хлорную безводную кислоту можно получить тоже двумя способами. Первый заключается во взаимодействии перхлоратов калия (K) или натрия (Na) с серной кислотой в концентрированной виде, а второй - во взаимодействии олеума с водным раствором хлорной кислоты:
KClO4 (водный раствор хлорной кислоты) + H2SO4 = KHSO4 (калия гидросульфат) + HClO4 (хлорная кислота)
Применение хлорной кислоты
Концентрированные растворы широко используют для получения перхлоратов (соли данной кислоты) и в аналитической химии;
Хлорная кислота используется при разложении руд, в качестве катализатора и при анализе минералов;
Перхлорат калия (формула: KClO4), соль данной кислоты, применяется при создании а магния перхлорат (ангидрон, Mg(ClO4)2) используется в качестве осушителя.
Безопасность при работе
Хлорную безводную кислоту нельзя долго хранить и перевозить, так как при стандартных условиях она быстро разлагается и может впоследствии самопроизвольно взорваться.
1. (формула: HCl) - одноосновная едкая, дымящая на воздухе жидкость. Применяют в гальванопластике (декапирование, травление) и в гидрометаллургии, для очистки металлов при лужении и паянии, для получения хлоридов марганца, цинка, железа и других металлов. В пищевой промышленности данное вещество зарегистрировано в качестве пищевой добавки Е507.
2. Хлорноватистая кислота (формула: HClO) - одноосновная очень слабая кислота. Может существовать только в растворах. Используется для санитарных целей, а также для отбеливания тканей и целлюлозы.
3. Хлористая кислота (HClO2) - кислота одноосновная средней силы. Неустойчива в свободном виде, в разбавленном водном растворе обычно быстро разлагается. Ангидрид этой кислоты до сих пор неизвестен.
4. Хлорноватая кислота (HClO3) - одноосновная сильная кислота. Не получена в свободном виде, так как распадается в В водных растворах существует при концентрации ниже 30 процентов. Довольно устойчива при низких температурах.
Хлор образует четыре кислородсодержащие кислоты: хлорнотистую, хлористую, хлорноватую и хлорную.
Хлорноватистая кислота НСlO образуется при взаимодействии хлора с водой, а также ее солей с сильными минеральными кислотами. Она относится к слабым кислотам, очень неустойчива. Состав продуктов реакции ее разложения зависит от условий. При сильном освещении хлорноватистой кислоты, наличии в растворе восстановителя, а также длительном стоянии она разлагается с выделением атомарного кислорода: НСlO = HСl + O
В присутствии водоотнимающих веществ образуется оксид хлора (I): 2 НСlO = 2 Н2О + Сl2O
Поэтому при взаимодействии хлора с горячим раствором щелочи образуется соли не соляной и хлорноватистой, а соляной и хлорноватой кислот: 6 NаОН + 3 Сl2 = 5 NаСl + NаСlО3 + 3 Н2О
Соли хлорноватистой кислоты - г и п о х л о р и т ы - очень сильные окислители. Они образуются при взаимодействии хлора со щелочами на холоду. Одновременно образуются соли соляной кислоты. Из таких смесей наибольшее распространение получили хлорная известь и жавелевая вода.
Хлористая кислота НСlO2 образуется при действии концентрированной серной кислоты на хлориты щелочных металлов, которые получаются как промежуточные продукты при электролизе растворов хлоридов щелочных металлов в отсутствие диафрагмы между катодным и анодным пространствами. Это слабая, неустойчивая кислота, очень сильный окислитель в кислой среде. При взаимодействии ее с соляной кислотой выделяется хлор: НСlO2 + 3 НС1 = Сl2 + 2 Н2О
Хлорноватая кислота НСlO3 образуется при действии на ее соли -х л о р а т ы - серной кислоты. Это очень неустойчивая кислота, очень сильный окислитель. Может существовать только в разбавленных растворах. При упаривании раствора НСlO3 при низкой температуре в вакууме можно получить вязкий раствор, содержащий около 40 % хлорной кислоты. При более высоком содержании кислоты раствор разлагается со взрывом. Разложение со взрывом происходит и при меньшей концентрации в присутствии восстановителей. В разбавленных растворах хлорная кислота проявляет окислительные свойства, причем реакции протекают вполне спокойно:
НСlO3 + 6 НВr = НСl + 3 Вr2 + 3 Н2О
Соли хлорноватой кислоты - хлораты - образуются при электролизе растворов хлоридов в отсутствие диафрагмы между катодным и анодным пространствами, а также при растворении хлора в горячем растворе щелочей, как показано выше. Образующийся при электролизе хлорат калия (бертолетова соль) слабо растворяется в воде и в виде белого осадка легко отделяется от других солей. Как и кислота, хлораты - довольно сильные окислители:
КСlO3 + 6 НСl = КСl + 3 Сl2 + 3 Н2О
Хлораты применяются для производства взрывчатых веществ, а также получения кислорода в лабораторных условиях и солей хлорной -кислоты - п е р х л о р а т о в. При нагревании бертолетовой соли в присутствии диоксида марганца МпО2, играющего роль катализатора, выделяется кислород. Если же нагревать хлорат калия без катализатора, то он разлагается с образованием калиевых солей хлороводородной и хлорной кислот:
2 КСlО3 = 2 КСl + 3 O2
4 КСlO3 = КСl + 3 КСlO4
При обработке перхлоратов концентрированной серной кислотой можно получить хлорную кислоту:
КСlO4 + Н2SO4 = КНSO4 + НСlO4
Это самая сильная кислота. Она наиболее устойчива из всех кислород содержащих кислот хлора, однако безводная кислота при нагревании, встряхивании или контакте с восстановителями может разлагаться со взрывом. Разбавленные растворы хлорной кислоты вполне устойчивы и безопасны в работе. Хлораты калия, рубидия, цезия, аммония и большинства органических оснований плохо растворяются в воде.
В промышленности перхлорат калия получают электролитическим окислением бертолетовой соли:
2 Н+ + 2 е- = Н2 (на катоде)
СlО3- - 2 е- + Н2О = СlO4- + 2 Н+ (на аноде)
Биологическая роль.
он относится к жизненно необходимым незаменимым элементам. В организме человека 100 г.
Ионы хлора играют весьма важную биологическую роль. Входя вместе с ионами К+, Mg2+, Са2+, НСО
, Н3Р04 и белками играют главенствующую роль в создании определенного уровня осмотического давления (осмотический гомеостаз) плазмы крови, лимфы, спиномозговой жидкости и т. д.
Хлор-ион участвует в регуляции водно-солевого обмена и объема жидкости, удерживаемой тканями, подержании рН внутриклеточной жидкости и мембранного потенциала, создаваемого работой натрий-калиевого насоса, что объясняется (как и в случае его участия в осмосе) способностью диффундировать через клеточные мембраны подобно тому, как это делают ионы Na+, К+. Ион хлора - необходимый компонент (совместно с ионами Н2Р04, HSO4, ферментами и др.) желудочного сока, входящий в состав соляной кислоты.
Способствуя пищеварению, соляная кислота уничтожает и разнообразные болезнетворные бактерии.
Общие сведения о строении атома хлора
Относится к элементам p-семейства. Неметалл. Элементы-неметаллы, входящие в эту группу, носят общее название галогены. Обозначение – Cl. Порядковый номер – 17. Относительная атомная масса – 35,453 а.е.м.
Электронное строение атома хлора
Атом хлора состоит из положительно заряженного ядра (+17), состоящего из 17 протонов и 18 нейтронов, вокруг которого по 3-м орбитам движутся 17 электронов.
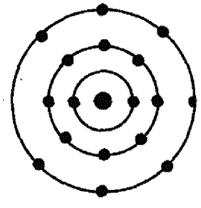
Рис.1. Схематическое строение атома хлора.
Распределение электронов по орбиталям выглядит следующим образом:
На внешнем энергетическом уровне атома хлора находится семь электронов, все они считаются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
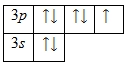
Наличие одного неспаренного электрона свидетельствует о том, что хлор способен проявлять степень окисления +1. Также возможно несколько возбужденных состояний из-за наличия вакантной 3d-орбитали. Сначала распариваются электроны 3p -подуровня и занимают свободные d-орбитали, а после – электроны 3s-подуровня:
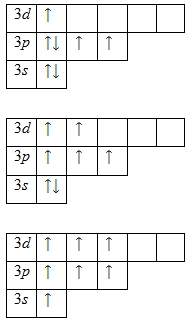
Этим объясняется наличие у хлора ещё трех степеней окисления: +3, +5 и +7.
Примеры решения задач
| Задание | Даны два элемента с зарядами ядер Z=17 и Z=18. Простое вещество, образованное первым элементом, — ядовитый газ с резким запахом, а вторым – не ядовитый, лишенный запаха, не поддерживающий дыхания газ. Напишите электронные формулы атомов обоих элементов. Какой из них образует ядовитый газ? |
| Решение | Электронные формулы заданных элементов будут записываться следующим образом: |
Заряд ядра атома химического элемента равен его порядковому номеру в Периодической таблице. Следовательно, это хлор и аргон. Два атома хлора образуют молекулу простого вещества – Cl2, которое представляет собой ядовитый газ с резким запахом
| Задание | Назовите элементы, в атомах которых распределение электронов по энергетическим уровням в основном состоянии соответствует рядам чисел: а) 2,8,7; б) 2,8,8,1; в) 2,8,13,1; г)2,8,18,1. Какие из них относятся к одной группе? Какие находятся в одном периоде? |
| Ответ | Определить положение химического элемента в Периодической таблице можно сложив все электроны, имеющиеся в атоме, не учитывая их распределения по энергетическим уровням: |
а) 2+8+7 =17. Это хлор.
б) 2+8+8+1 =19. Это калий.
в) 2+8+13+1 = 24. Это хром.
В одной группе –первой, но разных подгруппах расположены калий и медь. Калий и хром находятся в одном периоде – четвертом.
Калий в таблице менделеева занимает 19 место, в 4 периоде.
| Символ | K |
| Номер | 19 |
| Атомный вес | 39.0983000 |
| Латинское название | Kalium, Calium |
| Русское название | Калий |
Электронная схема калия
K: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
Короткая запись:
K: [Ar]4s 1
Одинаковую электронную конфигурацию имеют атом калия и Cl -2 , Sc +2 , Ti +3 , V +4 , Mn +6
Порядок заполнения оболочек атома калия (K) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ - до 6, на ‘d’ - до 10 и на ‘f’ до 14
Калий имеет 19 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
1 электрон на 4s-подуровне
Степень окисления калия
Атомы калия в соединениях имеют степени окисления 1, -1.
Степень окисления - это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы калия
Валентность K
Атомы калия в соединениях проявляют валентность I.
Валентность калия характеризует способность атома K к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа K
Квантовые числа определяются последним электроном в конфигурации, для атома K эти числа имеют значение N = 4, L = 0, Ml = 0, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат: 
Энергия ионизации
Чем ближе электрон к центру атома - тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации - это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Хлорид калия, характеристика, свойства и получение, химические реакции.










Хлорид калия – неорганическое вещество, имеет химическую формулу KCl.
Краткая характеристика хлорида калия:
Хлорид калия – неорганическое вещество белого цвета.
Химическая формула хлорида калия KCl.
Хлорид калия – неорганическое химическое соединение, соль хлороводородной (соляной) кислоты и калия, бинарное соединение калия и хлора.
Хорошо растворяется в воде. Практически не растворяется в ацетоне, этаноле, метаноле.
Кристаллогидратов не образует.
Негорюч, пожаро- и взрывобезопасен.
Хлорид калия по степени воздействия на организм относится к 3-му классу опасности по ГОСТ 12.1.007 как умеренно опасное вещество. Не образует токсичных соединений в воздушной среде.
Не является коррозионным веществом.
Хлорид калия является пищевой добавкой Е508.
Хлорид калия встречается в природе в виде минералов сильвина и карналлита, а также входит в состав сильвинита.
Физические свойства хлорида калия:
| Наименование параметра: | Значение: |
| Химическая формула | KCl |
| Синонимы и названия иностранном языке | potassium chloride (англ.) |
Получение хлорида калия:
В промышленности хлорид калия получают из природного минерала сильвинита методами галургии и флотации. При этом галургический метод получения хлорида калия основан на различной растворимости KCl и NaCl в воде при повышенных температурах.
Хлорид калия получают в результате следующих химических реакций:
- 1. взаимодействия калия, оксида калия и гидроксида калия с соляной кислотой.
- 2. взаимодействия калия и хлора:
- 3. взаимодействия гидроксида калия и хлорида алюминия:
- 4. взаимодействия йодида калия и хлорида свинца:
Химические свойства хлорида калия. Химические реакции хлорида калия:
Химические свойства хлорида калия аналогичны свойствам хлоридов других металлов . Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия хлорида калия и натрия:
KCl + Na → K + NaCl (t = 760-890 °C).
В результате реакции образуются калий и хлорид натрия. В ходе реакции газообразным натрием воздействуют на расплав хлорида калия.
2. реакция взаимодействия хлорида калия и нитрита натрия:
В результате реакции образуются нитрит калия и хлорид натрия.
3. реакция взаимодействия хлорида калия и хлорида цинка:
В результате реакции образуется тетрахлорцинкат калия.
4. реакция взаимодействия хлорида калия и хлорида алюминия:
В результате реакции образуется тетрахлороалюминат калия.
5. реакция взаимодействия хлорида калия и хлорида палладия:
В результате реакции образуется тетрахлоропаладат калия. В ходе реакции используется концентрированный раствор хлорида калия.
6. реакция взаимодействия хлорида калия и хлорида платины:
В результате реакции образуется гексахлороплатинат калия. В ходе реакции используется концентрированный раствор хлорида калия.
7. реакция взаимодействия хлорида калия, хлорида железа и воды:
В результате реакции образуется пентахлороакваферрат калия. В ходе реакции используется насыщенные растворы хлорида калия и хлорида железа.
8. реакция взаимодействия хлорида калия с минеральными кислотами:
Хлорид калия взаимодействует с минеральными кислотами.
9. реакция электролиза водного раствора хлорида калия:
KCl + 3H2O ± 6е – → 3H2 + KClO3 (t = 760-890 °C),
В результате первой реакции образуются водород и хлорат калия, в результате второй – водород , хлор и гидроксид калия .
10. реакция электролиза расплава хлорида калия:
2KCl ± 2е – → 2K + Cl2.
В результате реакции образуются водород и хлор.
Применение и использование хлорида калия:
Хлорид калия используется во множестве отраслей промышленности и для бытовых нужд:
– в медицине как составляющая медицинских лекарств, назначаемых при нарушениях сердечного ритма, недостатке калия в организме и пр.;
– в сельском хозяйстве как компонент минеральных удобрений и как распространенное минеральное калийное удобрение ;
– при строительстве и ремонте нефтяных скважин в качестве ингибирующего компонента бурового раствора;
– в химической промышленности для производства гидроксида калия методом электролиза.










хлорид калия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие хлорида калия
реакции
- ← Сероводород, свойства, получение и применение
- Воздух, свойства и химический состав →
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (105 890)
- Экономика Второй индустриализации России (101 445)
- Программа искусственного интеллекта ЭЛИС (22 634)
- Метан, получение, свойства, химические реакции (15 894)
- Мотор-колесо Дуюнова (15 104)
- Гидротаран – самодействующий энергонезависимый водяной насос (14 463)
- Природный газ, свойства, химический состав, добыча и применение (13 932)
- Крахмал, свойства, получение и применение (13 503)
- Прямоугольный треугольник, свойства, признаки и формулы (13 059)
- Целлюлоза, свойства, получение и применение (11 905)
- Пропилен (пропен), получение, свойства, химические реакции (11 650)
- Этилен (этен), получение, свойства, химические реакции (11 166)
- Бутан, получение, свойства, химические реакции (9 847)
- Оксид алюминия, свойства, получение, химические реакции (9 364)
- Оксид железа (III), свойства, получение, химические реакции (9 137)
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Хлор — элемент 3-го периода и VII А-группы Периодической системы, порядковый номер 17. Электронная формула атома [10Ne ]3s 2 Зр 5 , характерные степени окисления 0, -1, + 1, +5 и +7. Наиболее устойчиво состояние Cl -1 . Шкала степеней окисления хлора:
+ 1 – Cl2O , ClO — , HClO , NaClO , Ca(ClO)2
— 1 – Cl — , HCl, KCl , PCl5
Хлор обладает высокой электроотрицательностью (2,83), проявляет неметаллические свойства. Входит в состав многих веществ — оксидов, кислот, солей, бинарных соединений.
В природе — двенадцатый по химической распространенности элемент (пятый среди неметаллов). Встречается только в химически связанном виде. Третий по содержанию элемент в природных водах (после О и Н), особенно много хлора в морской воде (до 2 % по массе). Жизненно важный элемент для всех организмов.
Хлор С12 . Простое вещество. Желто-зеленый газ с резким удушливым запахом. Молекула Сl2 неполярна, содержит σ-связь С1-С1. Термически устойчив, негорюч на воздухе; смесь с водородом взрывается на свету (водород сгорает в хлоре):
Хорошо растворим в воде, подвергается в ней дисмутации на 50 % и полностью — в щелочном растворе:
Хлор очень сильный окислитель по отношению к металлам и неметаллам:
Сl2 + РЬ→PbCl2 (300 °С)
Реакции с соединениями других галогенов:
Качественная реакция — взаимодействие недостатка СL2 с КI (см. выше) и обнаружение йода по синему окрашиванию после добавления раствора крахмала.
Получение хлора в промышленности:
2NаСl (расплав)→ 2Nа + Сl2 (электролиз)
2NaCl+ 2Н2O→Н2↑ + Сl2↑ + 2NаОН (электролиз)
и в лаборатории:
(аналогично с участием других окислителей; подробнее см. реакции для НСl и NaСl).
Хлор относится к продуктам основного химического производства, используется для получения брома и йода, хлоридов и кислородсодержащих производных, для отбеливания бумаги, как дезинфицирующее средство для питьевой воды. Ядовит.
Качественная реакция на ион Сl — — образование белых осадков АgСl и Нg2Сl2, которые не переводятся в раствор действием разбавленной азотной кислоты.
Хлороводород служит сырьем в производстве хлоридов, хлорорганических продуктов, используется (в виде раствора) при травлении металлов, разложении минералов и руд. Уравнения важнейших реакций:
Получение НСl в промышленности — сжигание Н2 в Сl2 (см.), в лаборатории — вытеснение из хлоридов серной кислотой:
Хлорид натрия NaСl. Бескислородная соль. Бытовое название поваренная соль. Белый, слабогигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, растворимость мало зависит от температуры, раствор имеет характерный соленый вкус. Гидролизу не подвергается. Слабый восстановитель. Вступает в реакции ионного обмена. Подвергается электролизу в расплаве и растворе.
Применяется для получения водорода, натрия и хлора, соды, едкого натра и хлороводорода, как компонент охлаждающих смесей, пищевой продукт и консервирующее средство.
В природе — основная часть залежей каменной соли, или галита, и сильвинита (вместе с КСl),рапы соляных озер, минеральных примесей морской воды (содержание NaСl=2,7%). В промышленности получают выпариванием природных рассолов.
Уравнения важнейших реакций:
NaCl(ж)→2Na+Cl2↑ (850°С, электролиз )
2NаСl + 2Н2O→Н2↑ + Сl2↑ + 2NаОН (электролиз )
2NаСl(р,20%)→ Сl2↑+ 2Nа(Нg) “амальгама”(электролиз ,на Hg-катоде)
Хлорид калия КСl. Бескислородная соль. Белый, негигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, раствор имеет горький вкус, гидролиза нет. Вступает в реакции ионного обмена. Применяется как калийное удобрение, для получения К, КОН и Сl2. В природе основная составная часть (наравне с NаСl) залежей сильвинита.
Уравнения важнейших реакций одинаковы с таковыми для NаСl.
Уравнения важнейших реакций:
СаСl2(ж) → Са + Сl2 ↑(электролиз ,800°С)
Качественная реакция на ион Аl 3+ — образование осадка АlРO4, который переводится в раствор концентрированной серной кислотой.
Применяется как сырье в производстве алюминия, катализатор в органическом синтезе и при крекинге нефти, переносчик хлора в органических реакциях. Уравнения важнейших реакций:
АlСl3 . 6Н2O →АlСl(ОН)2 (100-200°С, —HCl,H2O)→Аl2O3(250-450°С, -HCl,H2O)
2АlСl3→2Аl + 3Сl2↑(электролиз,800 °С ,в расплаве NаСl)
Получение АlСl в промышленности — хлорирование каолина, глинозёма или боксита в присутствии кокса:
Хлорид железа(II) FеСl2. Бескислородная соль. Белый (гидрат голубовато-зеленый), гигроскопичный. Плавится и кипит без разложения. При сильном нагревании летуч в потоке НСl. Связи Fе — Сl преимущественно ковалентные, пар состоит из мономеров FеСl2 (линейное строение, sр-гибридизация) и димеров Fе2Сl4. Чувствителен к кислороду воздуха (темнеет). Хорошо растворим в воде (с сильным экзо-эффектом), полностью диссоциирует на ионы, слабо гидролизуется по катиону. При кипячении раствора разлагается. Реагирует с кислотами, щелочами, гидратом аммиака. Типичный восстановитель. Вступает в реакции ионного обмена и комплексообразования.
Применяется для синтеза FеСl и Fе2О3, как катализатор в органическом синтезе, компонент лекарственных средств против анемии.
Уравнения важнейших реакций:
FеСl2 (конц.) + Н2O=FеСl(ОН)↓ + НСl↑ (кипячение)
FеСl2 + 2NаОН (разб.) = Fе(ОН)2↓+ 2NaСl (в атм. N2)
FеСl2 + Н2 = 2НСl + Fе (особо чистое,выше 500 °С)
5Fе 2+ + 8Н + + МnО — 4 = 5Fе 3+ + Мn 2+ + 4Н2O
6Fе 2+ + 14Н + + Сr2O7 2- = 6Fе 3+ + 2Сr 3+ +7Н2O
Fе 2+ + S 2- (разб.) = FеS↓
FеСl2 →Fе↓ + Сl2↑ (90°С, в разб. НСl, электролиз)
Получение: взаимодействие Fе с соляной кислотой:
(в промышленности используют хлороводород и ведут процесс при 500 °С).
Хлорид железа(III) FеСl3. Бескислородная соль. Черно-коричневый (темно-красный в проходящем свете, зеленый в отраженном), гидрат темно-желтый. При плавлении переходит в красную жидкость. Весьма летуч, при сильном нагревании разлагается. Связи Fе — Сl преимущественно ковалентные. Пар состоит из мономеров FеСl3 (треугольное строение, sр 2 -гибридизация, преобладают выше 750 °С) и димеров Fе2Сl6 (точнее, Сl2FеСl2FеСl2, строение — два тетраэдра с общим ребром, sр 3 -гибридизация, преобладают при 316-750 °С). Кристаллогидрат FеСl . 6Н2O имеет строение [Fе(Н2O)4Сl2]Сl • 2Н2O. Хорошо растворим в воде, раствор окрашен в желтый цвет; сильно гидролизован по катиону. Разлагается в горячей воде, реагирует со щелочами. Слабый окислитель и восстановитель.
Применяется как хлорагент, катализатор в органическом синтезе, протрава при крашении тканей, коагулянт при очистке питьевой воды, травитель медных пластин в гальванопластике, компонент кровоостанавливающих препаратов.
Уравнения важнейших реакций:
FеСl3 + 3NaОН (разб.) = FеО(ОН)↓ + Н2O + 3NаСl (50 °С)
Хлорид аммония NН4Сl. Бескислородная соль, техническое название нашатырь. Белый, летучий, термически неустойчивый. Хорошо растворим в воде (с заметным эндо-эффектом, Q = -16 кДж), гидролизуется по катиону. Разлагается щелочами при кипячении раствора, переводит в раствор магний и гидроксид магния. Вступает в реакцию кон мутации с нитратами.
Качественная реакция на ион NН4 + — выделение NН3 при кипячении со щелочами или при нагревании с гашёной известью.
Применяется в неорганическом синтезе, в частности для создания слабокислотной среды, как компонент азотных удобрений, сухих гальванических элементов, при пайке медных и лужении стальных изделий.
Уравнения важнейших реакций:
Получение: взаимодействие NH3 с НСl в газовой фазе или NН3 Н2О с НСl в растворе.
Гипохлорит кальция Са(СlО)2. Соль хлорноватистой кислоты НСlO. Белый, при нагревании разлагается без плавления. Хорошо растворим в холодной воде (образуется бесцветный раствор), гидролизуется по аниону. Реакционноспособный, полностью разлагается горячей водой, кислотами. Сильный окислитель. При стоянии раствор поглощает углекислый газ из воздуха. Является активной составной частью хлорной (белильной) извести — смеси неопределенного состава с СаСl2 и Са(ОН)2. Уравнения важнейших реакций:
Хлорат калия КСlO3. Соль хлорноватой кислоты НСlO3, наиболее известная соль кислородсодержащих кислот хлора. Техническое название — бертоллетова соль (по имени ее первооткрывателя К.-Л. Бертолле, 1786). Белый, плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (образуется бесцветный раствор), гидролиза нет. Разлагается концентрированными кислотами. Сильный окислитель при сплавлении.
Применяется как компонент взрывчатых и пиротехнических смесей, головок спичек, в лаборатории — твердый источник кислорода.
Уравнения важнейших реакций:
4КСlO3 = ЗКСlO4 + КСl (400 °С)
2КСlO3 = 2КСl + 3O2 (150-300 °С, кат. МпO2)
(диоксид хлора на свету взрывается: 2СlO2(Г) = Сl2 + 2O2)
2КСlO3 + Е2(изб.) = 2КЕO3 + Сl2↑ (в разб. НNO3, Е = Вr, I)
Получение КСlO3в промышленности — электролиз горячего раствора КСl (продукт КСlO3 выделяется на аноде):
Бромид калия КВr. Бескислородная соль. Белый, негигроскопичный, плавится без разложения. Хорошо растворим в воде, гидролиза нет. Восстановитель (более слабый, чем
Качественная реакция на ион Вr — вытеснение брома из раствора КВr хлором и экстракция брома в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в бурый цвет).
Применяется как компонент травителей при гравировке по металлам, составная часть фотоэмульсий, лекарственное средство.
Уравнения важнейших реакций:
5Вr — + 6Н + + ВrО3 — = 3Вr 2 + 3Н2O
КВr + 3Н2O→3Н2↑ + КВrО3 (60-80 °С, электролиз)
Иодид калия КI. Бескислородная соль. Белый, негигроскопичный. При хранении на свету желтеет. Хорошо растворим в воде, гидролиза нет. Типичный восстановитель. Водный раствор КI хорошо растворяет I2 за счет комплексообразования.
Качественная реакция на ион I — вытеснение иода из раствора КI недостатком хлора и экстракция иода в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в фиолетовый цвет).
Уравнения важнейших реакций:
10I — + 16Н + + 2МnO4 — = 5I2↓ + 2Мn 2+ + 8Н2O
I — + Аg + = АgI (желт.)↓
Читайте также:

