Экстраплевральная солитарная фиброзная опухоль
Солитарная фиброзная опухоль плевры - редкая первичная мезенхимальная опухоль висцеральной плевры, вторая по распространенности после злокачественной мезотелиомы.
Чиайте так же обзорную публикацию - солитарная фиброзная опухоль
В отличии от мезотелиомы курение и воздействие асбеста не являются предрасполагающими факторами.
Чаще встречается у пациентов старше 50 лет.
- мягкотканная опухоль с четким дольчатым краем
- различный размер
- обычно формируется в висцеральном листке плевры
- часто выявляется сосудистая ножка (до 50% случаев)
- на срезе поверхность серовато‐белая,структура извитая или узловатая
- зоны некроза, кровоизлияние, кистозная дегенерация
- происходит из субмезотелиальной соединительной ткани
- высокодифференцированное новообразование с вариабельным гистологическим строением
- овоидные или веретеновидные клетки с круглыми или овальными ядрами
- цитоплазма скудная, контур клетки неразличим
- клетки окружены различным количеством коллагеновых волокон
- расположение опухолевых клеток хаотичное
- гиперклеточные зоны с крупными сосудами, напоминающими оленьи рога (по типу гемангиоперицитомы)
- гиперклеточность
- полиморфизм > 4 митозов в 10 полях зрения под большим увеличением
- положительная реакция на CD34 и bcl‐2
- в 50% случаев характеризуются бессимптомным течением и выявляется случайно
- при крупных размерах может проявлятся кашлем, одышкой, болевыми ощущениями или дискомфортом в груди, гипогликемией (за счет продукции инсулиноподобных протеинов), гипертрофической остеоартропатией
- паранеопластический синдром
- озноб, потливость
- слабость
- потеря веса.
- синдром Деге–Поттера: продукция инсулиноподобного фактора роста II (IGF II)
- синдром Пьера Мари–Бамбергера
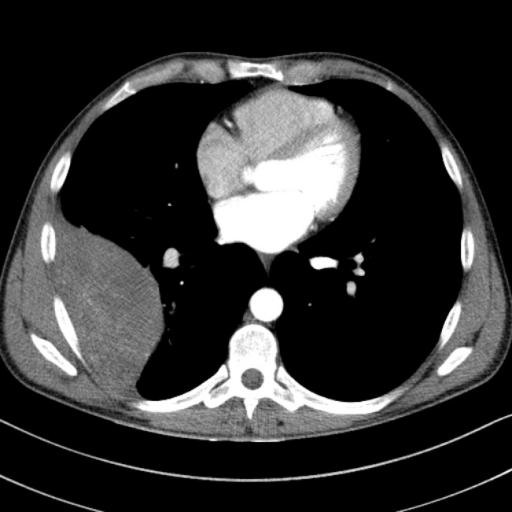
- хорошо отграниченное мягкотканное образование с четкими контурами, прилежащее с плевральной поврехности, в том числе в области борозд
- угло образуемый опухолевым узлом и грудной стенкой может быть острым и тупым
- опухоль может достигать гигантских размеров и занимать до половины гемиторокса
- плевральный выпот встречается в 2%–17% случаев
- мягкотканное образование прилежащее к плевральной поверхности
- может иметь дольчатый контур
- выраженное контрастное усиление, возможно наличие гиподенсивных зон некрозов или кровоизлияний
- крупные опухоли чаще имеют зоны некроза
- как минимум один угол с плеврой острый
- может выявлятся небольшой плевральный выпот
- кальцификаты встречаются редко (менее 26% случаев)
- иногда может визуализироваться ножка опухоли, прикрепляющаяся к плевре
- T1: промежуточная интенсивность МР сигнала
- T2: низкая интенсивность МР сигнала
- выраженное изменение интенсивности МР сигнала после введения препаратов гадолиния
- позволяет определить источник кровоснабжения опухоли и провести предоперационную эмболизацию крупных афферентных сосудов
- мезотелиома плевры
- липома грудной стенки
- плотность образования и интенсивность МР сигнала соответствуют жировой ткани
- метастатическое поражение грудной стенки
- деструкция костей скелета или вовлечение в опухолевый процесс мягких тканей
- тимома
- характерная локализация образования в переднем средостении
- нейрогенная опухоль:
- паравертебральная локализация
- рак легких
- прогноз благоприятный: показатель пятилетней выживаемости достигает 97% при радикальной резекции
- в 12% случаев рецидивирующие или нерезектабельные опухоли приводят к летальному исходу
- рецидивирование наблюдается в 23–20% случаев
- в большинстве случаев рецидивирование происходит в течение 24 месяцев после резекции
- рецидивирующая опухоль чаще формируется на стороне поражения; в редких случаях — в легком
- злокачественные солитарные фиброзные опухоли могут давать отдаленные метастазы.
- Солитарная фиброзная опухоль плевры
- Локализованная фиброзная опухоль плевры
- Фиброма плевры
Определение:
Второе по частоте первичное новообразование плевры, 4 митозов в 10 полях зрения под большим увеличением.
Проявления:
Наиболее частые проявления:
- До 50% опухолей характеризуются бессимптомным течением; небольшие ЛФОП.
- Крупные ЛФОП обычно характеризуются наличием симптомов.
- − Кашель, одышка, боли или дискомфорт в груди.
Другие симптомы:
- Озноб, потливость.
- Слабость.
- Потеря веса.
Паранеопластические синдромы, обычно встречаются при крупных ЛФОП.
Синдром Деге–Поттера: продукция инсулиноподобного фактора роста II.
- Гипертрофическая остеоартропатия, 17–35% случаев.
Синдром Пьера Мари–Бамбергера: продукция вещества, подобного гормону роста.
- Симптом барабанных палочек.
- Данное образование периферической локализации; симптом неполного контура.
- Узелок или объемное образование в области междолевой борозды без плеврального выпота.
- Изменение формы/локализации образования в зависимости от положения тела; наличие короткой ножки.
- Крупное объемное образование внутригрудной локализации, характеризующееся отсутствием местнодеструирующего роста или лимфаденопатии.
- Отсутствие вовлечения в опухолевый процесс грудной стенки.
Локализация
- Прилежит к плевре
- Преимущественная локализация в средних и нижних отделах грудной полости
Размер
- Размер вариабелен; рост медленный
КТ
- Мягкотканные узелок или объемное образование (в редких случаях множественные).
- Различный размер.
- Четкий дольчатый контур.
- На поперечном срезе имеет извитую волокнистую структуру.
- Участки низкой плотности за счет кистозных изменений, кровоизлияния, зон некроза.
- Кальцификаты (до 26% случаев): точечные, линейные, грубые.
- Объемное воздействие без признаков местнодеструирующего роста.
- Ножка опухоли визуализируется редко.
- Несмотря на то что типичным для данных опухолей является образование тупого угла с плеврой, острый угол наблюдается чаще.
- Контур образования постепенно переходит в контур плевры.
- Небольшие ЛФОП чаще образуют тупой угол.
- Крупные ЛФОП чаще прилежат под острым углом.
- В редких случаях определяется изолированный склероз прилежащих костных структур.
Нативная КТ
- Структура небольших образований часто гомогенна
- Крупные и злокачественные ЛФОП по структуре часто гетерогенны
- КТ с контрастным усилением
- Обычно гетерогенный характер контрастирования
- Улучшает визуализацию гетерогенности структуры и зон пониженной плотности
- Форма картообразная, сферичная или линейная
- Гетерогенность более характерная для злокачественных ЛФОП.
- Кистозные изменения,кровоизлияние, зоны некроза и миксоидная дегенерация.
- Накопление контрастного вещества сосудами в структуре опухоли.
КТ‐ангиография
КТ‐ангиография выполняется для оценки кровоснабжения опухоли.
Магнитно-резонансная томография (МРТ):
- Оптимальна для установления тканевых особенностей.
- Выявление внутригрудной локализации юкстадиафрагмальных ЛФОП.
- Исключение инвазии прилежащих структур, в особенности при использовании мультипланарной реконструкции.
- На Т1ВИ и Т2ВИ сигнал характеризуется гетерогенной интенсивностью.
- На Т2ВИ интенсивность сигнала выше, чем на Т1ВИ.
- Гипоинтенсивный сигнал на Т2ВИ: фиброзные перегородки, капсула опухоли.
- Гиперинтенсивный сигнал на Т2ВИ: кистозные изменения, кровоизлияние, зоны некроза, миксоидная дегенерация, гиперклеточные участки.
- Гетерогенный характер контрастрования.
ПЭТ/КТ:
Ангиография:
- Ангиография выполняется перед хирургическим вмешательством с целью определения источника кровоснабжения опухоли: аорта, внутренняя грудная, диафрагмальные или бронхиальные артерии.
- Сообщалось о выполнении предоперационной эмболизации при крупных ЛФОП.
Солитарная фиброзная опухоль
- злокачественной мезотелиомой, имеющей диффузный характер и дающей положительную реакцию на кератин и калретинин при иммуногистохимическом исследовании;
- низкодифференцированной фибросаркомой, клетки которой негативны к CD34;
- монофазной синовиальной саркомой, клетки которой могут давать положительную реакцию на кератин.
Злокачественная мезотелиома
Злокачественная эмбриональная опухоль
Злокачественная плеоморфная фиброзная гистиоцитома - диагноз исключения, который ставят в том случае, когда иммуногистохимическими исследованиями нельзя подтвердить специфическую дифференцировку клеток. В то время, когда иммуногистохимические исследования не были доступными, недифференцированная сар.
Опухоли сердца нередко обнаруживают у детей до 18 лет. По данным университета г. Падуя, эти опухоли, как правило, доброкачественные, и составляют 15% всех опухолей сердца. Миксома характерна для взрослых, но может развиваться и в течение первых двух десятилетий жизни (7% всех миксом сердца и 30% все.
Миксома - пример доброкачественной внутриполостной опухоли сердца. Обычно она локализуется в предсердии, в связи с чем ее также называют миксомой предсердий. Тем не менее это название неправильное, поскольку оно основано на присутствии в опухоли слизистых компонентов и коллагена, но не отражает точн.
Солитарная фиброзная опухоль (доброкачественная мезотелиома, фиброзная мезотелиома, субмезотелиальная фиброма) - четко отграниченное от окружающих тканей очень большое плотное образование с локальной инвазией. Клинические признаки связаны с влиянием опухоли на перикард.
При злокачественных опухолях сердца и отсутствии внесердечных метастазов можно выполнить хирургическую резекцию и даже трансплантацию сердца. В остальных случаях единственным терапевтическим методом лечения служит химио- и лучевая терапия.
Фибросаркома представлена злокачественной пролиферацией мезенхимальных клеток, напоминающих фибробласты, и извилистыми, расположенными в виде елочки пучками опухолевых клеток в коллагеновой строме. Эта опухоль составляет около 5% всех первичных злокачественных новообразований сердца
До настоящего времени данные о распространенности опухолей сердца в основном опираются на результаты патологоанатомических исследований. В период с 1972 по 1991 г. Лам (Lam) и его коллеги провели 12 485 вскрытий. Распространенность первичных опухолей составила 0,056%, вторичных - 1,23%.
Солитарная фиброзная опухоль первоначально была описана как новообразование плевры, позже она была обнаружена в других областях организма. В настоящее время она все чаще выявляется в глазнице (1-24).
В собственной серии наблюдений авторов среди 1264 новообразований глазницы была диагностирована только одна солитарная фиброзная опухоль. Но на основании многочисленных недавно опубликованных сообщений мы предполагаем, что некоторые случаи в нашей серии наблюдений были отнесены к другим веретеноклеточным опухолям еще до того, как солитарная фиброзная опухоль стала широко известной.
Furusato et al. провели недоступные ранее иммуногистохимические исследования 41 опухоли, ранее диагностированных как фиброзная гистиоцитома, гемангиоперицитома и гигантоклеточная ангиофиброма; оказалось, что все эти опухоли соответствуют диагностическим критериям солитарной фиброзной опухоли (7).
а) Клиническая картина. Солитарная фиброзная опухоль глазницы развивается монолатерально как у детей, так и у взрослых (4-24). У пациента обычно развивается экзофтальм и смещение глазного яблока. В большинстве случаев опухоль развивается медленно и не сопровождается выраженными болями или ухудшением зрения.
Развиваясь в верхневисочной части глазницы, эта опухоль может симулировать эпителиальную опухоль слезной железы. Опухоль может одновременно поражать полость носа и глазницу. Изредка солитарная фиброзная опухоль может вести себя агрессивно и прорастать из глазницы в центральную нервную систему. Злокачественная трансформация и метастазирование наблюдается редко.
В одной работе проанализировано 153 случая солитарной фиброзной опухоли шеи и головы — личные наблюдения и случаи, описанные в английской литературе (5). Средний возраст на момент манифестации опухоли составлял 50 лет, соотношение женщин: мужчин составляло 5:4. Средний размер опухоли составил 2,6 см.
Во всех случаях наблюдалась экспрессия цитоплазматического CD34. После хирургического удаления рецидивы наблюдались лишь в 4 (из 9) случаях с наличием опухолевых клеток в краях удаленной опухоли и только одна (из 10) опухоль классифицирована как злокачественная (5).
Клинически солитарная фиброзная опухоль проявляется аналогично другим четко отграниченным опухолям глазницы. Показан пример клиникопатологической корреляции.
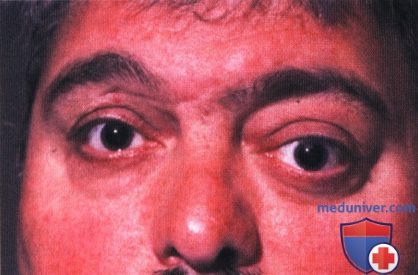
Внешний вид мужчины средних лет с левосторонним экзофтальмом. 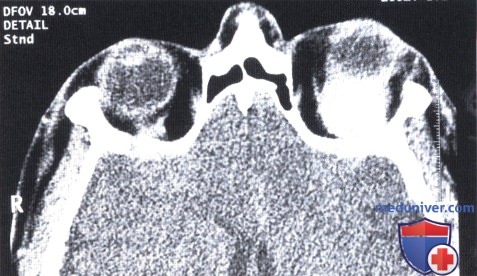
КТ, аксиальная проекция: сверху от глазного яблока определяется округлее объемное образование. 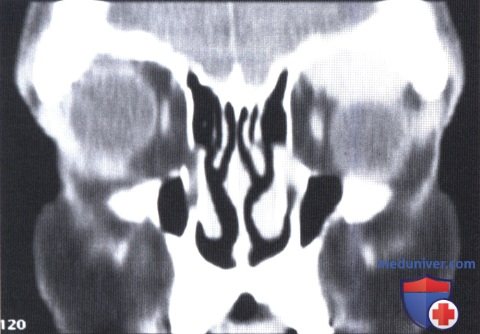
КТ, корональная проекция: в верхней части глазницы визуализируется овоидное четко отграниченное объемное образование. 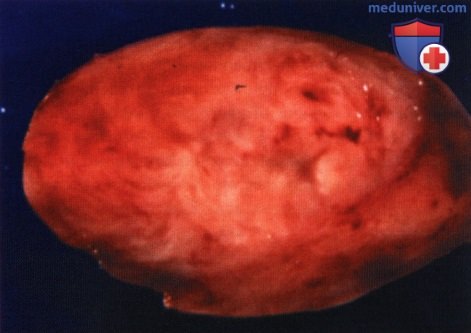
Фотография новообразования, полностью удаленного доступом через верхнелатеральную орбитотомию. 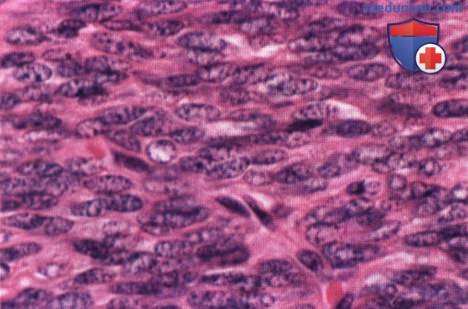
На микропрепарате видны однотипные плотно упакованные веретенообразные клетки с типичными для солитарной фиброзной опухоли признаками (гематоксилин-эозин, х200). 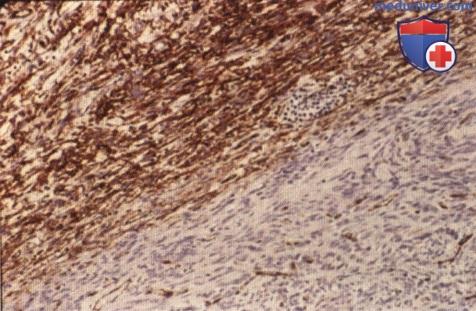
Иммуногистохимическая реакция на антиген к CD34: отмечается выраженная положительная реакция ткани опухоли (вверху фотографии). В опухолевой ткани внизу фотографии наблюдается менее выраженная реакция (х100).
Солитарная фиброзная опухоль — новообразование низкой степени злокачественности. Рекомендуется полная хирургическая резекция. В обоих представленных внизу случаях была выполнена почти полная хирургическая резекция, у обоих пациентов несколько лет спустя медленно развился рецидив.
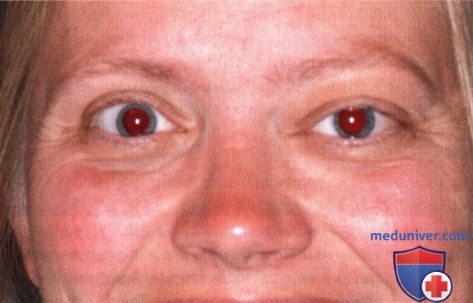
Внешний вид женщины средних лет с левосторонним экзофтальмом. 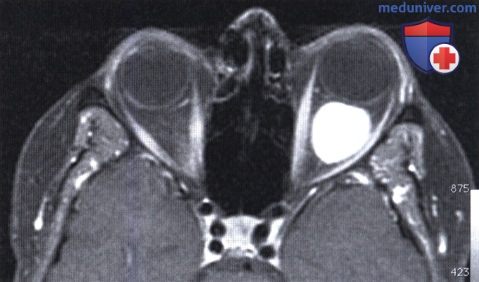
Та же пациентка, что и на рис. выше, МРТ с гадолиниевым усилением: в мышечном конусе определяется четко отграниченное мягкотканное объемное образование. 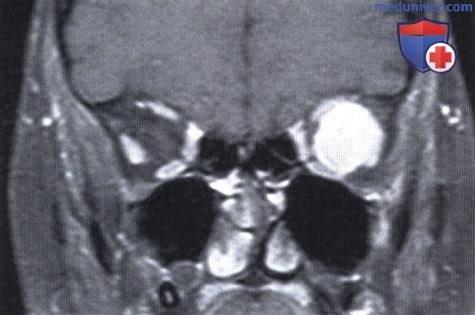
На корональной МР-томограмме в мышечном конусе определяется округлое четко отграниченное контрастное объемное образование. 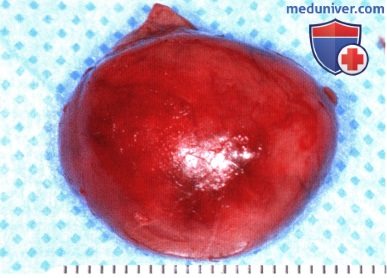
После резекции был подтвержден диагноз солитарной фиброзной опухоли. При гистологическом исследовании установлено, что опухоль распространялась далее заднего края резецированных тканей. Повторная операция для удаления рецидивировавшей опухоли проведена через три года. 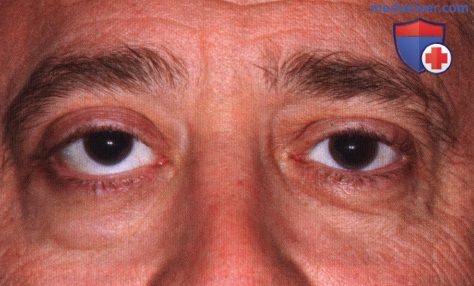
Внешний вид мужчины средних лет с небольшим экзофтальмом справа. 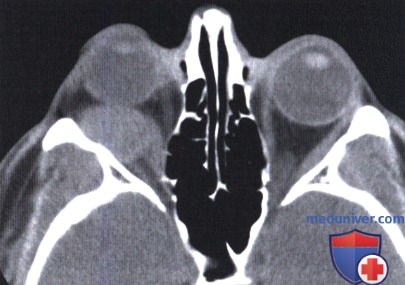
Аксиальная КТ: тотже пациент; внутри мышечного конуса — отграниченное мягкотканное образование. После удаления опухоли при гистологическом исследовании обнаружены опухолевые клетки по заднему краю макропрепарата.
б) Диагностика. При лучевых исследованиях солитарная фиброзная опухоль глазницы выглядит как округлое или овоидное четко отграниченное объемное образование, чаще локализующееся вне мышечного конуса. Часто наблюдается гладкая деформация прилегающей кости, что указывает на доброкачественное течение солитарной фиброзной опухоли.
Опухоль не имеет патогномоничных признаков на МРТ, некоторые авторы выделяют такие специфические признаки, как гетерогенность ткани опухоли и в целом низкая интенсивность сигнала в режиме Т2 (6).
в) Патологическая анатомия. Результаты гистологических и иммуногистохимических исследований широко обсуждались в последние годы. Многие случаи гемангиоперицитом и других веретеноклеточных новообразований были исследованы повторно и переклассифицированы в солитарную фиброзную опухоль (7-9).
Слабоположительная реакция на CD34 может наблюдаться при гемангиоперицитоме и других веретеноклеточных опухолях, но она не столь выражена, как при солитарной фиброзной опухоли. Также при солитарной фиброзной опухоли наблюдается положительная реакция на виметин, но реакции на протеин S-100, мышечные и эпителиальные маркеры отрицательны.
г) Лечение. Полная хирургическая резекция — метод выбора при лечении солитарной фиброзной опухоли. На основании результатов лучевых исследований следует тщательно спланировать оперативный доступ. Неполная резекция может привести к рецидиву опухоли и инфильтрации ею окружающих тканей и кости (16).
д) Список использованной литературы:
1. Shields JA, Shields CL, Scartozzi R. Survey of 1264 patients with orbital tumors and simulating lesions: the 2002 Montgomery Lecture, part 1. Ophthalmology 2004; 111: 997-1008.
2. Shields JA, Bakewell B, Augsburger JJ, et al. Classification and incidence of space-occupying lesions of the orbit. A survey of 645 biopsies. Arch Ophthalmol 1984;102: 1606-1611.
3. Shields JA, Bakewell B, Augsburger JJ, et al. Space-occupying orbital masses in children: A review of 250 consecutive biopsies. Ophthalmology 1986;93:379-384.
4. Bowe SN, Wakely PE, Ozer E. Head and neck solitary fibrous tumors: diagnostic and therapeutic challenges. Laryngoscope 2012;122:1748-1755.
5. Cox DP, Daniels T, Jordan RC. Solitary fibrous tumor of the head and neck. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2010;110:79-84.
6. Gigantelli JW, Kincaid MC, Soparkar CN, et al. Orbital solitary fibrous tumor: radiographic and histopathologic correlations. Ophthal Plast Reconstr Surg 2001; 17:207-214.
7. Furusato Е, Valenzuela IA, Fanburg-Smith JC, et al. Orbital solitary fibrous tumor: encompassing terminology for hemangiopericytoma, giant cell angiofibroma, and fibrous histiocytoma of the orbit: reappraisal of 41 cases. Hum Pathol 2011;42: 120-128.
8. Goldsmith JD, van de Rijn M, Syed N. Orbital hemangiopericytoma and solitary fibrous tumor: a morphologic continuum. Int J Surg Pathol 2001;9:295-302.
9. Heathcote JG. Pathology update: solitary fibrous tumour of the orbit. Can J Ophthalmol 1997;32:432-435.
10. Krishnakumar S, Subramanian N, Mohan ER, et al. Solitary fibrous tumor of the orbit: a clinicopathologic study of six cases with review of the literature. Surv Ophthalmol 2003;48:544-554.
11. Bernardini FP, de Conciliis C, Schneider S, et al. Solitary fibrous tumor of the orbit: is it rare? Report of a case series and review of the literature. Ophthalmology 2003; 110:1442-1448.
12. Polito E, Tosi M, Toti P, et al. Orbital solitary fibrous tumor with aggressive behavior. Three cases and review of the literature. Graefes Arch Clin Exp Ophthalmol 2002; 240:570-574.
13. Hayashi S, Kurihara H, Hirato J, et al. Solitary fibrous tumor of the orbit with extraorbital extension: case report. Neurosurgery 2001;49:1241-1245.
14. Lucci LM, Anderson RL, Harrie RP, et al. Solitary fibrous tumor of the orbit in a child. Ophthal Plast Reconstr Surg 2001;17:369-373.
15. Alexandrakis G, Johnson ТЕ. Recurrent orbital solitary fibrous tumor in a 14-year old girl. Am J Ophthalmol 2000;130:373-376.
16. DeBacker CM, Bodker F, Putterman AM, et al. Solitary fibrous tumor of the orbit. Am J Ophthalmol 1996;121:447-449.
17. Ing EB, Kennerdell JS, Olson PR, et al. Solitary fibrous tumor of the orbit. Ophthal Plast Reconstr Surg 1998;14:57-61.
18. Le CP, Jones S, Valenzuela AA. Orbital solitary fibrous tumor: a case series with review of the literature. Orbit 2014;33:145-151.
19. Ali MJ, Honavar SG, Naik MN, et al. Orbital solitary fibrous tumor: a rare clinicopathologic correlation and review of literature. J Res Med Sci 2013;18:529-531.
20. Polomsky M, Sines DT, Dutton JJ. Solitary fibrous tumor of the orbit with multiple cavities. Ophthal Plast Reconstr Surg 2013;29: el 17-e119.
21. Patel MM, Jakobiec FA, Zakka FR, et al. Intraorbital metastasis from solitary fibrous tumor. Ophthal Plast Reconstr Surg 2013;29: e76-e79.
22. Young TK, Hardy TG. Solitary fibrous tumor of the orbit with intracranial involvement. Ophthal Plast Reconstr Surg 2011;27: e74-e76.
23. Feuerman JM, Flint A, Elner VM. Cystic solitary fibrous tumor of the orbit. Arch Ophthalmol 2010;128:385-387.
24. Demirci H, Shields CL, Eagle RC Jr, et al. Giant cell angiofibroma, a variant of solitary fibrous tumor, of the orbit in a 16-year-old girl. Ophthal Plast Reconstr Surg 2009;25:402-404.
Редактор: Искандер Милевски. Дата публикации: 24.5.2020
- ЖАНРЫ 360
- АВТОРЫ 262 262
- КНИГИ 605 747
- СЕРИИ 22 723
- ПОЛЬЗОВАТЕЛИ 570 541
: 01.1. АНАТОМИЯ И ГИСТОЛОГИЯ ЛЕГКИХ
Анатомия, топографическая анатомия легких и структура их отдельных элементов изучены достаточно подробно и представлены в учебниках, руководствах и атласах по анатомии человека. В главе будут рассмотрены анатомия и гистология воздухопроводящих путей (трахея, бронхи, альвеолярные ходы), респираторной части легких (альвеолярные ходы, мешочки, альвеолы, аэрогематический барьер), сосудов легких, нервной и лимфатической системы легких, плевры и диафрагмы.
Воздухоносные пути - это структуры между окружающей средой и терминальной респираторной единицей (ТРЕ). ТРЕ является структурнофункциональным образованием, которое включает в себя 100 альвеолярных ходов и около 2000 альвеол, расположенных дистальнее респираторных бронхиол первого порядка. В легких насчитывается всего 150 000 ТРЕ. Эту структурнофункциональную единицу клинические физиологи, анатомы и патологоанатомы традиционно выделяют как основную структурную единицу - ацинус [1].
Трахея является продолжением гортани, представляет собой полую эластическую трубку, которая начинается от перстневидного хряща и заканчивается бифуркацией на уровне IV грудного позвонка, разделяясь на два главных бронха под углом 65 - 95 0 ;. Длина трахеи у взрослого человека колеблется от 90 до 150 мм, диаметр от 15 до 16 мм. Остов трахеи состоит из 16 - 20 хрящевых неполных колец, обращенных к пищеводу и соединенных между собой кольцевидными связками [2]. Задняя стенка ее представлена мембранозной частью, состоящей из коллагеновых, эластических и гладкомышечных волокон. Такое строение трахеи позволяет ей при разных условиях менять свою конфигурацию, а следовательно, и воздушный поток. Минимальный размер трахеи соответствует фазе выдоха, максимальный - фазе вдоха. При кашлевом толчке просвет трахеи уменьшается в 3 - 10 раз в зависимости от возраста человека (чем моложе, тем больше сужается просвет). Во время вдоха бифуркация трахеи смещается вниз и на 2 - 3 см кпереди.
БРОНХИАЛЬНОЕ ДЕРЕВО
Бронхиальное дерево состоит из двух главных бронхов (правого и левого) и 23 - 26 генераций ветвлений, включая бронхиолы и альвеолярные ходы (рис. 1-1). Общее число ветвлений равно 223, т.е. около 8x10 6 [3]. Правый главный бронх отходит под углом 15 - 40 0 , длина его 28 - 32 мм, диаметр 12 - 22 мм. Левый отходит под углом 50 - 70 0 , длина составляет 40 - 50 мм, а диаметр - 8 - 16 мм [4]. Таким образом, правый главный бронх короче, шире и имеет более вертикальное направление, чем левый. Главные бронхи делятся, как правило, дихотомически на долевые, сегментарные, субсегментарные и на бронхи более мелких генераций, вплоть до терминальных и респираторных бронхиол. В стенках респираторных бронхиол I, II и III порядка уже появляются альвеолы. Респираторные бронхиолы и их альвеолы одновременно выполняют воздухопроводящую и газообменную функцию. На протяжении субсегментарных бронхов может насчитываться до 5 делений, в малых (мышечных) бронхах - до 15 делений. По мере ветвления бронхов закономерно уменьшается и их диаметр. Размерные взаимоотношения предыдущей и последующей генераций бронхов оптимальны для того, чтобы обеспечить должный поток воздуха с минимальными затратами энергии на этот процесс [5].
Рис. 1-1. Строение дыхательных путей (по Э.Р. Вейбелю, 1970 [3]).
Бронхи с 4й по 13ю генерацию имеют диаметр до 2 мм; общее число таких бронхов около 400. Наибольшее число бронхов диаметром 2 мм наблюдается с 7й по 9ю генерацию [3]. В терминальных бронхиолах диаметр колеблется от 0,5 до 0,6 мм, диаметр респираторных бронхиол (17 - 19я генерации) и альвеолярных ходов от 0,2 до 0,6 мм. Длина воздухоносных путей от гортани до ацинусов составляет 23 - 38 см, протяженность от 9й генерации бронхов до респираторных бронхиол около 5 см. В воздухоносных путях выделяют около 50 типов клеток, 12 из которых относятся к эпителиальным [6].
По мере уменьшения калибра бронхов и бронхиол хрящевая пластинка в них сначала уменьшается в размерах, а в терминальных бронхиолах исчезает. Для того чтобы бронхиолы не спадались при вдохе, они располагаются внутри легочной паренхимы, которая за счет эластической тяги расправляется при вдохе и расширяет бронхи. Кроме того, в хрящевых бронхах мышечная оболочка не столь мощная, как в бронхиолах, в стенке мало сосудов, и каждый бронх имеет адвентицию. В стенках мелких бронхов много сосудов и отсутствует адвентиция [7].
Эпителиальная выстилка трахеи и бронхов образована многорядным реснитчатым эпителием с бокаловидными, промежуточными и базальными клетками. Указывается также на наличие нейроэндокринных клеток. На уровне сегментарных бронхов толщина эпителия составляет от 37 до 47 мкм. Собственная пластинка слизистой оболочки трахеи и бронхов уплотнена и образует отчетливую базальную мембрану, толщина которой колеблется от 3,7 до 10,6 мкм. Ткань, расположенная глубже, называется подслизистой основой. В нее погружены секреторные отделы многочисленных белково-слизистых желез, расположенные в треугольнике между двумя хрящами [8].
Белковослизистые железы являются дериватом секреторных клеток слизистой оболочки воздухоносных путей и функционально взаимосвязаны с ней. Железы имеют альвеолярно-трубчатую структуру и состоят из ацинусов, содержат серозные и слизистые клетки, расположенные на базальной мембране. Серозные клетки имеют призматическую форму, эллипсоидное ядро и пиронинофильную цитоплазму. Белковослизистые железы выделяют смешанный белково-мукополисахаридный секрет, в котором преобладают муцины. Секреция осуществляется по мерокриновому и апокриновому типам. Выводные протоки желез выстланы мерцательным кубическим однослойным эпителием, расположенным на базальной мембране; в стенке протоков содержится сеть эластических волокон. По периферии подслизистых желез расположены соединительная ткань, подразделяющая их на дольки, а также скопления лимфоидных клеток (особенно в области протоков), единичные макрофаги, тучные клетки, плазмоциты. Между эпителиальными клетками и базальной мембраной располагаются миоэпителиальные клетки, сокращение которых способствует выведению секрета из концевых отделов желез, протоки которых открываются на внутренней поверхности трахеи и бронхов [9].
Структурная организация всех слоев стенки воздухоносных путей обеспечивает три основные функции: барьернозащитную с обеспечением мукоцилиарного клиренса, контроль за калибром бронхов и бронхиол, механическую стабильность воздухоносных путей.
Эпителиальная выстилка воздухоносных путей здорового человека включает следующие разновидности клеток: реснитчатые (РК), секреторные (бокаловидные) (СК), переходные, или промежуточные (ПК), базальные (БК), нейроэндо-кринные (НЭК) (рис. 1-2) [10].
При изучении поверхности эпителиального пласта воздухоносных путей человека и экспериментальных животных был выявлен ряд закономерностей [11, 12]:
---вопервых, все клетки эпителиальной выстилки воздухоносных путей имеют на своей апикальной поверхности микроворсинки - небольшие выросты цитоплазмы. Наличие этих структур способствует увеличению поверхности эпителиального пласта, соприкасающегося с жидким надэпителиальным секреторным покрытием, и указывает на возможность всасывания путем эндоцитоза жидкой части секрета из просвета бронхов;
---вовторых, межклеточные контакты плотные и представлены в виде валикообразных структур или черепицеобразных наложений, что обеспечивает непрерывность эпителиальной выстилки и позволяет ей выполнять барьернозащитную функцию;
Читайте также:





