Экспрессия при раке молочной железы
Экспрессия запрограммированного лиганда 1 рецептора гибели клеток (PDL1) едва ли изучалась при раке молочной железы. Недавно ингибиторы PD1 / PDL1 показали многообещающие результаты в различных карциномах с корреляцией между экспрессией опухолей PDL1 и ответами. Мы ретроспективно проанализировали экспрессию мРНК PDL1 в 45 клеточных линиях рака молочной железы и 5454 рака молочной железы, профилированных с использованием микрочипов ДНК. По сравнению с обычными образцами молочной железы экспрессия PDL1 повышалась в 20% клинических образцов и 38% базальных опухолей. Высокая экспрессия была связана с плохими прогнозами (большой размер опухоли, высокий уровень, ER-негативный, PR-отрицательный, ERBB2-положительный статус, высокая пролиферация, базальные и ERBB2-обогащенные подтипы). Усиление PDL1 было связано с биологическими признаками сильного цитотоксического локального иммунного ответа. Усиление PDL1 не было связано с выживаемостью во всей популяции, но было связано с лучшими метастазами и общими специфическими пережитками в базальных опухолях, независимо от клинико-патологических особенностей. Патологический полный ответ после неоадъювантной химиотерапии был выше в случае регуляции PDL1 (50% против 21%). В заключение, повышенная регуляция PDL1, более частая в базальных раках молочной железы, была связана с увеличением Т-клеточного цитотоксического иммунного ответа. В этом агрессивном подтипе повышенная регуляция была связана с лучшей выживаемостью и реакцией на химиотерапию. Реактивация неактивных опухолепроникающих лимфоцитов ингибиторами PDL1 может представлять собой перспективную стратегию в PDL1-upregulated базальном раке молочной железы.
Несмотря на недавние успехи, почти 20% пациентов с раком молочной железы все еще развивают метастазы и умирают от прогрессирования заболевания. В течение последних десятилетий были выявлены молекулярные изменения, связанные с онкогенезом молочной железы и метастатическим прогрессированием, что привело к значительным терапевтическим прогрессиям, таким как гормональная терапия, нацеленная на рецептор эстрогена (ER) и целевые терапии, направленные против онкогенных белков (ERBB2, EGFR, VEGF и PI3K / AKT / mTOR). Тем не менее, если вначале нет, устойчивые клоны возникают в большинстве случаев из-за высокой мутагенной и адаптируемой способности раковых клеток, что делает временные реакции опухоли. Благодаря адаптируемости иммунного ответа, терапия рака может теоретически решить эту проблему. Рак молочной железы менее иммуногенен, чем меланома или карцинома почек, а результаты приемной иммунотерапии (интерлейкин 2, интерфероны и вакцины) были относительно неутешительными. Тем не менее, роль иммунитета возникла в течение последнего десятилетия с демонстрацией благоприятного прогностического воздействия на присутствие инфильтрационных опухолей лимфоцитов (ТИЛ) 1 и сигнатур экспрессии гена иммунного ответа, особенно для ER-негативных , высоко пролиферативные опухоли 5.
Иммунный ответ представляет собой сложное явление, основанное на балансе между активаторными и ингибиторными путями, которые регулируют активность TIL. Этот баланс может быть нарушен в некоторых патологических состояниях, таких как рак, где ингибирование иммунной системы будет способствовать прогрессированию опухоли. Одним из ключевых ингибиторов является путь PD1-PDL1. PD1 (запрограммированная клеточная смерть 1) представляет собой белок клеточной поверхностной мембраны, экспрессируемый различными иммунными клетками, включая Т-клетки; он активируется его лигандами PDL1 и PDL2, которые экспрессируются антигенпредставляющими клетками, такими как макрофаги или В-клетки. После взаимодействия лигандами PD1 ослабляет активацию лимфоцитов 12 и способствует развитию и функционированию T-регуляторных клеток, что позволяет прекратить иммунный ответ. Недавние работы предположили, что он может стать основным действующим лицом в развитии рака через антираковое ингибирование иммунного ответа [10, 14, 15]. Действительно, опухолевые клетки из разных мест экспрессируют PDL1 и, таким образом, могут ингибировать иммунный ответ. Клинические испытания, тестирующие анти-PD1 или анти-PDL1-препараты для восстановления противоракового иммунитета, показали очень многообещающие результаты с долговременными ответами, особенно в отношении меланомы и рака почек, легких, предстательной железы и мочевого пузыря 16, а исследования фазы III продолжаются , Кроме того, сообщалось о связи между экспрессией PDL1 на опухолевых и / или иммунных клетках и объективным ответом [16, 17, 19-21].
Экспрессия PDL1 изучалась при различных раковых заболеваниях, таких как почки, легкие, поджелудочная железа, пищевод, яичник, колоректальный рак, голова и шея и плоскоклеточный рак, меланомы и глиомы 25, с подтверждением корреляций с клинико-патологическими проявлениями опухоли в нескольких исследованиях , При раке молочной железы путь PD1-PDL1 был очень мало изучен 34; только два прогностических исследования, в том числе 650 случаев, проанализированных на уровне белка (иммуногистохимия, IHC) [39] и 398 случаев на уровне мРНК [36], недавно рассмотрели прогностическую проблему, но дали разные результаты.
Здесь мы проанализировали экспрессию мРНК PDL1 в 45 клеточных линиях рака молочной железы и 5454 рака молочной железы, профилированных с использованием микрочипов ДНК. Мы искали корреляции между экспрессией PDL1 и геномными и клинико-патологическими данными, включая выживаемость и ответ на химиотерапию.
Установление ассоциации экспрессии генов семейства GST и клинико-морфологических характеристик у пациенток с отечно-инфильтративным и первично-диссеминированным раком молочной железы
Следует отметить, что в представленных исследованиях при изучении роли глутатион-S-трансферазы (GST) в разивитии химиорезистентности при раке молочной железы (РМЖ) проводилось определение полиморфизма генов GST у пациенток с раком молочной железы, а также иммуногистохимическое определение экспрессии изоферментов GST, однако не проводилось определения экспрессии генов суперсемейства GST.
В качестве материала для исследования использованы парафинфиксированные срезы образцов опухолевой ткани пациенток.
Таблица 8. Экспрессия генов семейства GST у пациенток с ОИФ РМЖ (сТ4N0-3М0)

Таблица 9. Экспрессия генов семейства GST у пациенток с раком молочной железы с наличием отдаленных метастазов (сТлюбаяТлюбаяМ1, IV стадия)

Расчет процента уровня нормализованной экспрессии генов семейства GST проводился по формуле:
2 - (Ct интересующего гена образца - Ct гена HGUS образца) х 100%,
где Ct - пороговый цикл (cycle threshold).
В связи высоким процентом отсутствия экспрессии гена GSTM1 (63,3%) у пациенток с ОИФ и ПД РМЖ при статистической обработке данный ген рассматривался как номинальный.
При анализе взаимосвязи экспрессии генов семейства GST с гормон-рецепторным статусом опухоли у пациенток с ПД РМЖ (табл. 10) определены статистически значимые различия в нормализованной экспрессии гена GSTP1 в зависимости от эстроген- (p = 0,002) и прогестерон-рецепторного статуса (p = 0,001): так в эстроген- и прогестерон-негативных опухолях отмечена более высокая экспрессия данного гена, чем в эстроген- и прогестерон-позитивных новообразованиях (рис. 21), что согласуется с данными W. H. Peters (1993), L. Gilbert (1993), R. Silvestrini (1997).
Таблица 10. Экспрессия генов GST в зависимости от гормон-рецепторного статуса опухоли у пациенток с IV стадией РМЖ


Рис. 21. Экспрессия гена GSTP1 в зависимости от рецепторного статуса опухоли у пациенток с раке молочной железы IV стадии
Следует отметить, что определение экспрессии GSTP1 в данных исследованиях проводилось иммуногистохимическим методом. При этом у пациенток с ОИФ РМЖ данная ассоциация экспрессии гена GSTP1 с гормон-рецепторным статусом опухоли отсутствовала. Для генов GSTM1 и GSTT1 статистически значимых различий в экспрессии у пациенток с ОИФ и ПД РМЖ в зависимости от рецепторного статуса опухоли выявлено не было.
При анализе взаимосвязи нормализованной экспрессии генов GST с экспрессией белка Her2neu в опухоли у пациенток с ОИФ и ПД РМЖ статистически значимых различий в экспрессии в зависимости от рецепторного статуса опухоли выявлено не было. При этом в исследованиях A. Romero и S. Lizard-Nacol также не найдено ассоциации между экспрессией GSTT1, GSTM1 и характеристиками опухолевого процесса, а в исследованиях C. Bellamy, R. L. Franco и J. Huang не выявлено ассоциации экспрессии GSTP1 и онкобелка Her2-neu.
Выявлены статистически значимые различия в нормализованной экспрессии гена GSTP1 в зависимости от молекулярно-генетических подтипов опухоли (рис. 22) у пациенток с ПД РМЖ (p = 0,005).

Рис. 22. Экспрессия гена GSTP1 в зависимости от молекулярно-генетических подтипов опухоли у пациенток с ПД РМЖ
Так люминальный подтип опухоли характеризуется низкой нормализованной экспрессией гена GSTP1 (73,22% (9,31-1611,13%)), в то время как при базальноподобном подтипе опухоли наблюдается высокая экспрессия гена GSTP1 (284,87% (15,5-912,61%)). Для других генов семейства GST статистически значимых различия в нормализованной экспрессии генов выявлено не было (p > 0,05).
Полученные данные согласуются с результатами исследования T. Miyake et al., согласно которым люминальный А-, люминальный B- и HER2-позитивные злокачественные новообразования были значительно реже 08ТР1-позитивны (по данным иммуногистохимического метода исследования), чем базальный тип опухолей (р = 0,002, p 0,05). Для других генов семейств GST у пациенток с ОИФ и ПД РМЖ статистически значимых различии в нормализованной экспрессии генов в зависимости от гистологических параметров опухоли выявлено не было (p > 0,05).
Определены статистически значимые различия в экспрессии гена GSTT1 у пациенток с ОИФ РМЖ в зависимости от вовлеченности в опухолевый процесс регионарного лимфатического аппарата (p = 0,037) (табл. 11): при более распространенном опухолевом поражении cN3 отмечена более низкая экспрессия гена GSTT1 (12,76% (0-75,79%)), при этом данная зависимость у пациенток с ПД РМЖ отсутствовала (p > 0,05). В проведенных ранее исследованиях не выявлено взаимосвязи между экспрессией гена GSTT1 и поражением лимфатического коллектора.
Таблица 11. Экспрессия генов семейства GST в зависимости от степени поражения лимфатического аппарата (cN) у пациенток с ОИФ РМЖ

При анализе взаимосвязи нормализованной экспрессии генов семейства GST с размерами первичного очага (табл. 12) статистически значимые различия в нормализованной экспрессии выявлены для гена GSTP1 (p = 0,041) у пациенток с ПД РМЖ.
Таблица 12. Экспрессия генов GSTв зависимости от размеров первичного очага и поражения регионарных лимфатических узлов у пациенток с раком молочной железы IV стадии

При распространении первичной опухоли на грудную стенку и/или кожу (Т4) отмечена более высокая экспрессия гена GSTP1 (202,1% (9,31-1611,13%)) (рис. 23). Для других генов семейства GST статистически значимых различия в нормализованной экспрессии генов в зависимости от размеров первичного очага выявлено не было (p > 0,05).

Рис. 23. Экспрессия гена GSTP1 в зависимости от размеров первичного очага у пациенток с раком молочной железы IV стадии
Полученные данные о более высокой экспрессии гена GSTP1 у пациенток с ПД РМЖ при сТ4 (p = 0,041) находятся в соответствии с результатами исследования B. V. Jardim, в котором продемонстрировано, что высокий уровень экспрессии 08ТР1 (по данным иммуногистохимического метода исследования) был ассоциирован с III стадией и большим размером новообразования (р 0,05) (табл. 13).
Таблица 13. Ассоциация экспрессии генов семейства GST с общей выживаемостью и выживаемостью без прогрессирования у пациенток с ОИФ РМЖ

При унивариантном анализе влияния экспрессии генов семейства GST на общую выживаемость у пациенток с ПД РМЖ, получавших как часть специального лечения полихимиотерапии (ПХТ) с включением антрациклинов (табл. 14), статистически значимых различий выявлено не было (p
План лечения составляют с учётом стадии опухолевого процесса, морфологической структуры опухоли, возраста больной, сопутствующих заболеваний, общего состояния пациентки. Применяют следующие методы лечения: хирургический, комбинированный (сочетание операции с лучевой или лекарственной терапией) и ком.
По данным многочисленных публикаций, этиология и патогенез РМЖ сложны и определяются сочетанием многих факторов. Гормональная регуляция функции молочных желез значительно сложнее, чем эндометрия. Помимо эстрогенов и прогесторона, развитие молочных желез в пубертатном периоде, их функция во время бер.
Гистологическую градацию рака молочной железы впервые ввел R.B. Greenough из Бостона, который в 1925 г. опубликовал анализ 73 случаев рака молочной железы. Несмотря на то что прошло много времени и опубликовано большое количество работ о применении гистологической градации рака молочной железы, ниче.
При анализе данных, получаемых с помощью ультразвукового исследования, целесообразно выделить ряд диагностических задач, решение которых позволит получить полный комплекс эхографических признаков рака молочной железы и метастатических лимфатических узлов, по которым в дальнейшем будет производиться .
Патологические процессы в молочной железе отличаются многообразными клиническими проявлениями, что норой создает серьезные дифференциально-диагностические трудности. Для гипеколога важнее всего заметить (не пропустить!) патологию молочных желез, что приведет в движение систему методов уточня.
Доброкачественные изменения молочных желез относятся к наиболее распространенным заболеваниям и включают различные по клиническим, морфологическим и этиологическим признакам процессы. Отличительной особенностью молочной железы является сложность четкой дифференцировки физиологических и патологически.
Рак молочной железы развивается из эпителия млечных протоков и альвеол. Патоморофологическая характеристика рака молочной железы включает такие параметры, как размер первичного очага, его локализацию в молочной железе, тип роста, морфологическое строение, степень дифференцировки, наличие регионарных.
Условия подготовки определяются лечащим врачом.
Иммуногистохимическое исследование проводится после гистологического исследования. В лабораторию передаются фрагменты органов и тканей, заключённые в парафиновые блоки и гистологические препараты (стёкла), приготовленные в ходе гистологического исследования.
Метод исследования: Иммуногистохимическое исследование.
Рак молочной железы – злокачественная опухоль железистой ткани молочной железы, является ведущей онкологической патологией у женщин. По данным Всемирной Организации Здравоохранения каждая восьмая женщина рискует заболеть этой патологией, независимо от возраста. Ежегодно в мире регистрируется от 800 тыс. – до 1 млн. новых случаев рака молочной железы (ВОЗ).
В настоящее время заболеваемость раком молочной железы возрастает в связи с проведением маммографического скрининга и общего старения населения (по данным European Society For Medical Oncology).
PR – рецептор к прогестерону.
ER – рецептор к эстрогену.
Ki67 – онкогенный белок.
HER-2 – Рецептор второго типа к человеческому эпидермальному фактору роста (human epidermal growth factor receptor 2).
Опухоли молочной железы являются гормонозависимыми опухолями. Эстроген и прогестерон оказывают стимулирующее действие на рост опухоли молочной железы. Белок Ki 67 является показателем пролиферативной активности опухолевых клеток. Повышенная экспрессия HER-2 характеризуется усилением пролиферации клеток, уменьшением количества рецепторов эстрогенов в опухоли, снижением эффективности химио- и гормонотерапии, таким образом, служит маркером неблагоприятного прогноза и повышенного риска рецидива заболевания.
На основании иммуногистохимического исследования (ИГХ) выделяют 4 подтипа рака молочной железы. Каждый подтип имеет свои особенности клинической картины, прогноз и тактику лечения.
Известно, что люминальные типы РМЖ имеют менее агрессивное течение и благоприятный прогноз по сравнению с HER-2 положительным и трижды негативным РМЖ. Особо обращает на себя внимание трижды негативный рак молочной железы (отрицательные РЭ, РП, HER2), который отличается агрессивным течением, ранним появлением метастазов и неблагоприятным прогнозом.
Молекулярно-биологические подтипы рака молочной железы
| Молекулярный подтип | Иммуногистохимический фенотип | ||
|---|---|---|---|
| ER | PR | HER-2 | |
| Люминальный А | + | + | - |
| Люминальный B | + | + | + |
| HER 2 + | - | - | + |
| Трижды негативный РМЖ (ТН РМЖ) | - | - | - |
Определение в опухоли молочной железы экспрессии РЭ, РП, HER2 и Кi 67 является обязательным при диагностике РМЖ. Данное исследование включено в алгоритм диагностики и лечения рака молочной железы.
В заключении об исследовании должна содержаться информация не только о процентном содержании клеток, положительных по РЭ и РП, но и об интенсивности окрашивания. При сомнительном результате ИГХ исследования экспрессии HER2, рекомендуется проводить определение амплификации гена HER2 методом гибридизации in situ (FISH). (Согласно Практическим рекомендациям по лекарственному лечению инвазивного рака молочной железы, 2019 г.).
Для интерпретации результатов иммуногистохимического исследования рецепторного статуса опухоли молочной железы применяется шкала Allred, с помощью которой оценивается количество клеток, с рецепторами гормонов и интенсивность окрашивания при определении рецепторов. В данной шкале процент положительных клеток оценивается от 0 до 5 баллов, а интенсивность окрашивания от 0 до 3.
Показания к исследованию
- Определение экспрессии PR, ER, Ki67, HER-2 при раке молочной железы используется для выбора тактики назначения адъювантной терапии.
Адъювантная терапия – лекарственная терапия, которая назначается в дополнение к хирургическому и лучевому методам лечения и направлена на снижение риска рецидива болезни.
План адъювантной лекарственной терапии основывается на принадлежности опухоли к одному из молекулярно-биологических подтипов и стадии заболевания. (“Практические рекомендации по лекарственному лечению инвазивного рака молочной железы”, 2019 г.
Требования к оформлению направительного бланка:
В направительном бланке обязательны к заполнению следующие поля:
- Название направляющего учреждения;
- Код направляющего учреждения;
- Ф.И.О. врача, направившего материал на исследование, его контактный телефон;
- Ф.И.О. пациента;
- Пол пациента;
- Дата рождения пациента;
- Дата направления образца в CMD;
- Время и дата получения биопсийного (операционного) материала;
Кроме перечисленных выше требований, в направительном бланке указывают:
- Количество и номера отправляемых для исследования стекол;
- Количество и номера отправляемых для исследования парафиновых блоков;
- Способ получения биопсийного (операционного) материала;
- Время и дата получения материала;
- Клинический диагноз;
- Код по МКБ;
- Первично вынесенное патогистологическое заключение с обязательным указанием номера;
- Клинические данные;
- Информация о специфической терапии (лекарственное, лучевое, оперативное и др., дозы, сроки);
- Для исследования материала опухолей, вторичных или пограничных процессов указать локализацию, распространенность опухоли и ее стадию;
- При исследовании материала больных с онкогематологическими заболеваниями указать данные гемограммы, миелограммы, биохимических, молекулярно-биологических и молекулярно-генетических исследований;
По возможности приложите ксерокопию гистологического заключения.
" ["serv_cost"]=> string(5) "10650" ["cito_price"]=> NULL ["parent"]=> string(3) "411" [10]=> string(1) "1" ["limit"]=> NULL ["bmats"]=> array(2) < [0]=>array(3) < ["cito"]=>string(1) "N" ["own_bmat"]=> string(2) "12" ["name"]=> string(21) "Блок+стекло" > [1]=> array(3) < ["cito"]=>string(1) "N" ["own_bmat"]=> string(2) "12" ["name"]=> string(54) "Микропрепараты (блок + стекло)" > > >
Условия подготовки определяются лечащим врачом.
Иммуногистохимическое исследование проводится после гистологического исследования. В лабораторию передаются фрагменты органов и тканей, заключённые в парафиновые блоки и гистологические препараты (стёкла), приготовленные в ходе гистологического исследования.
Метод исследования: Иммуногистохимическое исследование.
Рак молочной железы – злокачественная опухоль железистой ткани молочной железы, является ведущей онкологической патологией у женщин. По данным Всемирной Организации Здравоохранения каждая восьмая женщина рискует заболеть этой патологией, независимо от возраста. Ежегодно в мире регистрируется от 800 тыс. – до 1 млн. новых случаев рака молочной железы (ВОЗ).
В настоящее время заболеваемость раком молочной железы возрастает в связи с проведением маммографического скрининга и общего старения населения (по данным European Society For Medical Oncology).
PR – рецептор к прогестерону.
ER – рецептор к эстрогену.
Ki67 – онкогенный белок.
HER-2 – Рецептор второго типа к человеческому эпидермальному фактору роста (human epidermal growth factor receptor 2).
Опухоли молочной железы являются гормонозависимыми опухолями. Эстроген и прогестерон оказывают стимулирующее действие на рост опухоли молочной железы. Белок Ki 67 является показателем пролиферативной активности опухолевых клеток. Повышенная экспрессия HER-2 характеризуется усилением пролиферации клеток, уменьшением количества рецепторов эстрогенов в опухоли, снижением эффективности химио- и гормонотерапии, таким образом, служит маркером неблагоприятного прогноза и повышенного риска рецидива заболевания.
На основании иммуногистохимического исследования (ИГХ) выделяют 4 подтипа рака молочной железы. Каждый подтип имеет свои особенности клинической картины, прогноз и тактику лечения.
Известно, что люминальные типы РМЖ имеют менее агрессивное течение и благоприятный прогноз по сравнению с HER-2 положительным и трижды негативным РМЖ. Особо обращает на себя внимание трижды негативный рак молочной железы (отрицательные РЭ, РП, HER2), который отличается агрессивным течением, ранним появлением метастазов и неблагоприятным прогнозом.
Молекулярно-биологические подтипы рака молочной железы
| Молекулярный подтип | Иммуногистохимический фенотип | ||
|---|---|---|---|
| ER | PR | HER-2 | |
| Люминальный А | + | + | - |
| Люминальный B | + | + | + |
| HER 2 + | - | - | + |
| Трижды негативный РМЖ (ТН РМЖ) | - | - | - |
Определение в опухоли молочной железы экспрессии РЭ, РП, HER2 и Кi 67 является обязательным при диагностике РМЖ. Данное исследование включено в алгоритм диагностики и лечения рака молочной железы.
В заключении об исследовании должна содержаться информация не только о процентном содержании клеток, положительных по РЭ и РП, но и об интенсивности окрашивания. При сомнительном результате ИГХ исследования экспрессии HER2, рекомендуется проводить определение амплификации гена HER2 методом гибридизации in situ (FISH). (Согласно Практическим рекомендациям по лекарственному лечению инвазивного рака молочной железы, 2019 г.).
Для интерпретации результатов иммуногистохимического исследования рецепторного статуса опухоли молочной железы применяется шкала Allred, с помощью которой оценивается количество клеток, с рецепторами гормонов и интенсивность окрашивания при определении рецепторов. В данной шкале процент положительных клеток оценивается от 0 до 5 баллов, а интенсивность окрашивания от 0 до 3.
Показания к исследованию
- Определение экспрессии PR, ER, Ki67, HER-2 при раке молочной железы используется для выбора тактики назначения адъювантной терапии.
Адъювантная терапия – лекарственная терапия, которая назначается в дополнение к хирургическому и лучевому методам лечения и направлена на снижение риска рецидива болезни.
План адъювантной лекарственной терапии основывается на принадлежности опухоли к одному из молекулярно-биологических подтипов и стадии заболевания. (“Практические рекомендации по лекарственному лечению инвазивного рака молочной железы”, 2019 г.
Требования к оформлению направительного бланка:
В направительном бланке обязательны к заполнению следующие поля:
- Название направляющего учреждения;
- Код направляющего учреждения;
- Ф.И.О. врача, направившего материал на исследование, его контактный телефон;
- Ф.И.О. пациента;
- Пол пациента;
- Дата рождения пациента;
- Дата направления образца в CMD;
- Время и дата получения биопсийного (операционного) материала;
Кроме перечисленных выше требований, в направительном бланке указывают:
- Количество и номера отправляемых для исследования стекол;
- Количество и номера отправляемых для исследования парафиновых блоков;
- Способ получения биопсийного (операционного) материала;
- Время и дата получения материала;
- Клинический диагноз;
- Код по МКБ;
- Первично вынесенное патогистологическое заключение с обязательным указанием номера;
- Клинические данные;
- Информация о специфической терапии (лекарственное, лучевое, оперативное и др., дозы, сроки);
- Для исследования материала опухолей, вторичных или пограничных процессов указать локализацию, распространенность опухоли и ее стадию;
- При исследовании материала больных с онкогематологическими заболеваниями указать данные гемограммы, миелограммы, биохимических, молекулярно-биологических и молекулярно-генетических исследований;
По возможности приложите ксерокопию гистологического заключения.

- Как возникает рак молочной железы?
- Типы рака молочной железы
- Причины и факторы риска
- Симптомы рака молочной железы
- Самостоятельная диагностика рака груди
- Диагностика
- Стадии рака молочной железы
- Лечение рака молочной железы
- Прогноз при раке молочной железы
Как возникает рак молочной железы?
Рак груди развивается так же, как и любая другая злокачественная опухоль в организме. Одна или несколько клеток железистой ткани в результате произошедшей в них мутации начинают аномально быстро делиться. Из них образуется опухоль, способная прорастать в соседние ткани и создавать вторичные опухолевые очаги — метастазы.
Мутации, которые приводят к РМЖ, бывают наследственными и приобретенными .
Распространенными наследственными генетическими причинами рака молочной железы становятся мутации в генах BRCA1 и BRCA2. Носительницы мутации BRCA1 имеют риск заболеть раком молочной железы 55–65%, а носительницы BRCA2 — 45%. Такие генетические дефекты передаются по наследству от родителей детям, они становятся причиной рака молочной железы примерно в 15% случаев.
Намного чаще опухоль возникает из-за приобретенных мутаций: они возникают в клетках молочной железы и не передаются по наследству. Например, в 20% случаев увеличено количество копий гена, кодирующего HER2 — белок-рецептор, который находится на поверхности клеток и стимулирует их размножение.
Типы рака молочной железы
Злокачественные опухоли груди делятся на два типа: протоковые и железистые. Протоковый рак молочной железы встречается чаще. Он может быть внутриэпителиальным (in situ) и инвазивным. У внутриклеточного протокового рака молочной железы более благоприятный прогноз, он редко дает метастазы и излечивается в 98% случаев. Инвазивный же вариант опухоли склонен к бесконтрольному росту и генерализации процесса.
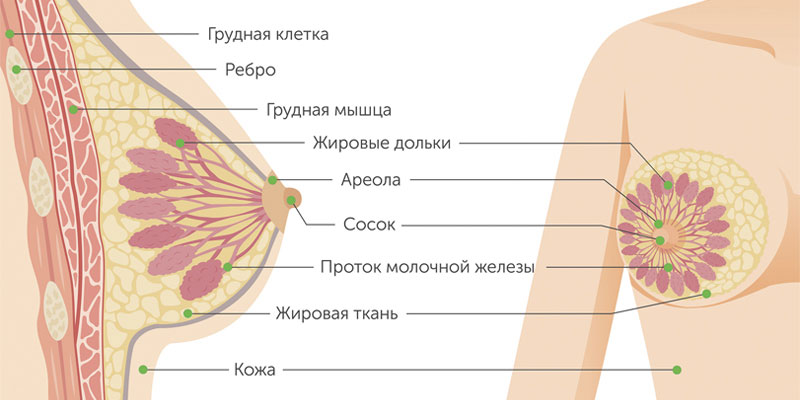
Железистый рак молочной железы может быть дольковым (инвазивная лобулярная карцинома) или произрастать из других клеток железистой ткани. Для долькового рака нередко характерен мультицентричный рост. Скорость увеличения в размерах и сроки метастазирования форм узлового рака груди зависят от степени дифференцировки опухоли.
Причины и факторы риска
К сожалению, полной информации о причинах возникновения рака молочной железы у ученых пока нет. Существует список факторов риска, влияющих на вероятность появления опухоли, однако у некоторых болезнь диагностируют при отсутствии этих факторов, другие же остаются здоровыми при наличии сразу многих из них. Тем не менее, ученые все же связывают развитие рака груди с определенными обстоятельствами, наиболее часто предваряющими его появление. К ним относятся:
- Возраст. Большинство случаев РМЖ приходятся на женщин в возрасте 55 лет и старше.
- Наследственность. Если РМЖ диагностирован у кого-то из близких родственников, риск повышается вдвое.
- Рак молочной железы в анамнезе.
- Повышенная плотность ткани молочной железы по результатам маммографии.
- Некоторые доброкачественные новообразования в молочной железе.
- Раннее начало менструаций — до 12 лет.
- Поздняя менопауза — после 55 лет.
- Отсутствие детей или поздние (после 35 лет) первые роды.
- Воздействие радиации, например, в ходе лучевой терапии, проводимой для лечения другого типа рака.
- Курение и злоупотребление алкоголем. Если женщина ежедневно потребляет 28–42 г этилового спирта, ее риски повышаются на 20%.
- Лишний вес и низкая физическая активность.
- Использование гормональных препаратов: оральные контрацептивы, заместительная гормональная терапия в постменопаузе.
- Травмы молочных желез.
- Сахарный диабет.
- Работа по графику с ночными сменами.
Симптомы рака молочной железы
На ранних стадиях рак молочной железы, как правило, никак клинически не проявляется. Чаще всего опухоль обнаруживается самими больными или выявляется случайно при проведении профилактических исследований.
Пациентки обычно жалуются на наличие пальпируемого образования, выделения из соска. Боль является редким симптомом рака грудной железы, однако болевой синдром может выйти на первый план на этапе генерализации процесса, в особенности при распространении метастазов в кости.
Довольно часто выявляются такие признаки рака груди, как появление асимметрии вследствие изменения размеров пораженной железы. Уменьшение, смещение кверху, деформация и сморщивание молочной железы может наблюдаться при скиррозной (фиброзной) форме опухоли. Напротив, увеличивается грудь на стороне поражения при быстром росте образования или из-за отека, который формируется по причине нарушенного оттока лимфы.
При распространении новообразования в подкожную клетчатку могут наблюдаться изменения кожи. При этом выявляются следующие симптомы рака молочной железы:
Иногда, при распространении опухоли на поверхность кожи могут наблюдаться такие признаки рака груди, как покраснение и изъязвление. Наличие этих симптомов говорит о запущенности процесса.
Изменения соска тоже могут определяться, но только на поздних стадиях. При этом имеют место такие симптомы рака грудной железы, как:
- Симптом Форга — на стороне поражения сосок находится выше, чем на здоровой стороне.
- Симптом Краузе — сосок утолщен, складки ареолы заметно выражены.
Такой признак рака молочной железы, как патологические выделения, является довольно редким, но в ряде случаев может быть единственным симптомом, который выявляется при осмотре. Часто выделения носят кровянистый характер, реже встречаются серозные и гнойные.
Также были выделены особые формы рака груди, которые проявляются типичной симптоматикой. К ним относятся:
- Отечно-инфильтративная форма, для которой характерно увеличение и отечность железы, мраморный цвет кожи, выраженная гиперемия.
- Маститоподобная. Данный вид рака груди проявляется уплотнением пораженной груди, повышением температуры тела.
- Рожистоподобная форма, при которой на коже выявляются очаги (иногда появляются изъязвления), которые внешне напоминают рожистое воспаление.
- Панцирная форма характеризуется наличием множественных узлов, за счет которых происходит сморщивание и деформация железы.
- Рак Педжета — поражает сосок и ареолу. При данной разновидности наблюдают утолщение соска, изменение кожи в виде покраснения и уплотнения, образование корок и чешуек.
Иногда люди, интересуясь по каким признакам можно распознать наличие опухоли молочной железы, по ошибке ищут симптомы рака грудины. Данное название является неверным, так как грудина является центральной плоской костью грудной клетки и даже при метастазировании злокачественного образования груди практически никогда не поражается.
Самостоятельная диагностика рака груди
Самостоятельно проверять грудь на наличие узелков или каких-либо других изменений стоит раз в месяц после менструации. Домашнюю диагностику удобнее всего проводить, принимая ванну или находясь под душем. О любых изменениях, которые удалось обнаружить, стоит как можно быстрее рассказать врачу.
Порядок проведения самообследования молочных желез:
- Разденьтесь выше пояса и встаньте перед зеркалом.
- Поднимите руки вверх и заведите их за голову. Внимательно осмотрите грудь. Повернитесь правым, левым боком.
- Ощупайте молочные железы в положении стоя сложенными указательным, средним и безымянным пальцем. Начинайте с верхней наружной части груди и двигайтесь по часовой стрелке.
- Сожмите сосок двумя пальцами. Проверьте, выделяется ли из него что-нибудь.
- Снова ощупайте молочные железы — теперь в положении лежа.
70% случаев рака молочной железы выявляются пациентами самостоятельно в результате самообследования груди.
Диагностика
Диагностика рака молочной железы начинается с беседы. На этом этапе для врача важно оценить жалобы женщины и выяснить, встречались ли случаи рака молочной железы в её семье, если да — насколько часто. Это помогает заподозрить наследственную форму рака, связанную с мутациями в генах BRCA1, BRCA2, NBS1, CHECK, TP53.
Далее врач осматривает, ощупывает молочные железы, проверяет, нет ли в них узлов и уплотнений, не увеличены ли лимфатические узлы в подмышечной, надключичной и подключичной областях.
После осмотра врач может направить женщину на маммографию — рентгенографию молочной железы. Показаниями к этому исследованию являются: уплотнения в молочной железе, изменения со стороны кожи, выделение крови из соска, а также любые другие симптомы, которые могут указывать на злокачественную опухоль. Также для диагностики рака молочной железы назначают ультразвуковое исследование. Маммография и УЗИ являются взаимодополняющими методами, каждый из них имеет свои преимущества:
Маммография
УЗИ молочных желез
Позволяет обнаружить патологические изменения за 1,5–2 года до появления симптомов.
При кровянистых выделениях из соска можно провести дуктографию — рентгенографию с контрастированием молочных протоков. Это помогает получить дополнительную полезную информацию.
Высокая чувствительность — точная диагностика до 90% случаев рака.
Возможность обнаружить микрокальцинаты до 0,5 мм.
Безопасность — нет воздействия на организм рентгеновскими лучами.
Хорошо подходит при высокой плотности ткани молочной железы, у молодых женщин (до 35–45 лет).
Позволяет отличать кисты (полости с жидкостью) от плотных опухолей.
Позволяет оценить состояние регионарных лимфатических узлов.
Хорошо подходит для контроля положения иглы во время биопсии.
Магнитно-резонансная томография — высокоинформативный метод диагностики злокачественных опухолей молочной железы. Ее применяют при лобулярном раке, когда неинформативны маммография и УЗИ, а также для оценки размеров и расположения опухоли, что помогает определиться с тактикой хирургического лечения. МРТ может применяться для скрининга у женщин-носительниц аномальных генов, связанных с повышенным риском рака молочной железы, при отягощенном семейном анамнезе.
О роли биопсии в диагностике рака молочной железы рассказывает врач Европейской клиники Портной С.М.:

В лаборатории проводят цитологическое и гистологическое исследование, то есть оценивают строение отдельных клеток и ткани. В настоящее время доступны молекулярно-генетические исследования: они помогают выявить мутации, за счет которых произошло злокачественное перерождение, и подобрать оптимальную противоопухолевую терапию.
Биопсия позволяет выяснить, является ли опухоль злокачественной, а также определить ее тип и стадию. Кроме того, исследование биопсийного материала дает ответ на вопрос, является ли опухоль гормонозависимой , что также влияет на схему лечения.
После того как рак диагностирован, важно определить его стадию и понять, насколько сильно он распространился в организме. Для этого применяют следующие исследования:

Стадии рака молочной железы
Стадирование при раке молочной железы опирается на общепринятую систему TNM. Буква T в этой аббревиатуре обозначает размер первичной опухоли:
Буквой N обозначают наличие метастазов в регионарных лимфатических узлах. N0 — очаги в лимфатических узлах отсутствуют. N1, N2 и N3 — поражение разного количества лимфатических узлов.
Буква M обозначает наличие отдаленных метастазов. Рядом с ней может быть указана одна из двух цифр: M0 — нет отдаленных метастазов, M1 — отдаленные метастазы имеются.
В зависимости от значений T, N и M, выделяют пять основных стадий рака молочной железы (внутри некоторых из них есть подстадии):
- Стадия 0: рак на месте.
- Стадия I: опухоль в молочной железе диаметром до 2 см.
- Стадия II: опухоль в молочной железе диаметром до 5 см и более, могут быть метастазы в подмышечных лимфоузлах на стороне поражения.
- Стадия III: опухоль в молочной железе до 5 см и более, может прорастать в грудную стенку или в кожу, имеются очаги в регионарных лимфатических узлах.
- Стадия IV: опухоль может быть любых размеров, не имеет значения, поражены ли регионарные лимфоузлы. Если обнаруживают отдаленные метастазы, всегда диагностируют рак четвертой стадии.
Лечение рака молочной железы
Стратегия лечения рака молочной железы должна подбираться индивидуально для каждой пациентки с учетом таких факторов, как тип опухоли, стадия, чувствительность новообразования к гормональной терапии. Берется во внимание и общее состояние больной. Если опухоль обнаружена на ранних стадиях и выбрана правильная тактика ведения пациентки, то шанс полностью вылечить рак груди является весьма высоким.
Выберите врача-онколога и запишитесь на приём:

Пластический хирург, онколог-маммолог, доктор медицинских наук
Читайте также:

