Сполуки сульфуру з хлором
Атом Сульфуру (подібно до Хлору) утворює дві такі сполуки( явище неорганічної ізомерії):
H2S – сірководень, гідроген сульфід
H2S – сульфідна кислота, сірководнева кислота.
Сірководень
Хімічні властивості сірководню
1.реакція горіння:
А) повне окиснення:
Б) неповне окислення: (якісна реакція на сірководень –при неповному згорянніутворюється жовтий наліт сірки на внесеному в полум´я холодному предметі)
2. реакція з галогенами:
Cульфідна кислота
H2S – це слабка кислота(двоосновна) .
Хімічні властивості сульфідної кислоти
І. Загальні властивості як кислоти:
1. реакція дисоціація (cтупінчасто):
2. реакція з металами до Н:
З. реакція з оксидами металів:
4. реакція з лугами (утворюютькислу і середню сіль, бо двоосновна кислота):
ІІ. Якісна реакція:
1.Якісною реакцією на сульфідну кислоту і її солі є Pb(NO3)2, при цьому утворюється чорний осад PbS:
Добування H2S
1. У промисловостіодержують реакцією:
2. У лабораторії одержують реакцією солей (сульфідів) з сильною кислотою:
Застосування сульфідної кислоти
1. для виявлення різних металів;
2. для виробництва сульфатної кислоти.
Оксигеновмісні сполуки Сульфуру
Оксиди Сульфуру
Атом Сульфуру утворює два оксиди:
1. S +4 O2 – сульфур (IV) оксид (сірчистий газ);
2. S +6 O3 - сульфур (VІ) оксид.
SO2 і SO3 - кислотні оксиди
За фізичними властивостями :
SO3 – це рідина,бурхливо розчиняється у воді, розчиняється в концентрованій Н2SO4, утворюючи олеум.
Хімічні властивості оксидів
І. Загальні властивості як кислотних оксидів
1. реакція з водою:
2. реакція з лугами: (можуть утворюватися і кислі солі)
SO2 + NaОH = NaНSO3 натрій гдрогенсульфіт
SO3 + NaОH = NaНSO4 натрій гідрогенсульфат
ІІ. Характерні реакції.
1.реакція окиснення (тільки для SO2 ):
Добування оксидів Сульфуру
І. SO2
1. У промисловості: S + О2 = SO2
2. У лабораторії із сульфітів металів з сильними кислотами:
II. SO3
1. Тільки у промисловості реакцією:
Затосування оксидів Сульфуру
І. SO2
1. для одержання сульфатної кислоти;
2. для дезинфекції зерносховищ;
3. для відбілювання соломи, вовни, а також знебарвлення кольору квіток.
II. SO3
1.для виробництва сульфатної кислоти;
2. для одержання олеуму - 65%(розчин SO3 у 100% сульфатній кислоті)
Сульфітна кислота
H2S +4 O3 – це слабка кислота. Для неї характерні хімічні властивості як загальні властивості кислоти (подібно як сульфідна), тільки при звичайних умовах вона розкладається:
Cульфатна кислота(Сірчана кислота)
H2S +6 O4 - це найсильніша із всіх відомих кислот і кислота-окисник(є ще HNO3).
Хімічні властивості сульфатної кислоти
І. Загальні властивості як кислоти:
1. реакція дисоціація (cтупінчасто):
2. реакція з оксидами металів:
3. реакція з лугами (утворюютькислу і середню сіль, бо двоосновна кислота):
4. реакція з солями, утвореними слабкими кислотами:
ІІ. Специфічні реакції:
Сульфатна кислота виступає кислотою-окисником , бо має найвищий позитивний С.О. +6 і як кислота-окисник найкраще проявляє себе в реакціях з металами.
1. реакція з металами:
А) концентрована H2SO4 (при нагріванні)взаємодієз металами до Н і після Н, крім благородних, утворюючи сульфат металу, SO2 і воду.
S +6 + 2е = S + 4 1 - реакція відновлення
Cu 0 - 2е = Cu +2 1 – реакція окиснення
Cu 0 - відновник.
При звичайних умовах концентрованаH2SO4 не взаємодієз такимиметалами: Fe, Ni, Cr і Al, а при нагріванні, подібно як металами концентрована H2SO4:
S +6 + 2е = S + 4 3 - реакція відновлення
Fe 0 - 3е = Fe +3 2 – реакція окиснення
Fe 0 - відновник.
Виняток:Концентрована H2SO4 може взаємодіяти з активними металами ,
утворюючи сульфат металу , S або H2S і воду :
Б) розведена H2SO4 взаємодієз металами тільки до Н,утворюючисіль і водень:
2. якісною реакцією на сульфатну кислоту і її солі є Ва(NO3)2 або BaCl2, при цьому утворюється білий кристалічний осад BaSO4:
3. Реакція обвуглення органічних сполук: від більшості органічних сполук концентрована сульфатна кислота відщеплює воду (гігроскопічність), утворюючи вугілля:
Добування сульфатної кислоти
Одержують сульфатну кислоту тільки у промисловості за схемою:
Застосування сульфатної кислоти
1. при виробництві бензину і ДП;
2. для одержання мінеральних добрив;
3. для добування солей(мідний і залізний купорос);
4. як електроліт в акумуляторах машин.
Природні сполуки Сульфуру
1. S - природна сірка;
2. FeS2 – пірит, сірчаний або залізний колчедан;
3. H2S - сірководень (міститься у деяких природних мінеральних водах);
Тема 20. Нітроген і Фосфор та їх сполуки.
Нітроген та його сполуки.
Нітроген і Фосфор та їх сполуки використовуються в основному людиною як мінеральні добрива (азотні і фосфорні).
Нітроген знаходиться у V-А групі, на зовнішньому шарі в нього 5 електронів, найвища С.О. - +5, а найнижча - -3.
Атом Нітрогену у формулах речовин має такі С.О.: -3, 0, +1, +2, +3,+4,+5.
Атом Нітрогену подібно як галогени утворюють тільки одну просту речовину – азот – N2.
Азот
За фізичнимивластивостямиазот – це газ,без запаху,без смаку,трохи розчинний у воді (1:0,02), не отруйний, але не підтримує ні дихання, ні горіння (78% азоту в повітрі.)
Хімічні властивості азоту
N 0 2 – малоактивний, бо містить аж три спільні париелектронів між двома атомами N.
1. реакція з металами(тільки активними і при високих температурах):
2. реакція з неметалами (при високих температурах):
2000 0 С (або електричний розряд чи блискавка)
Теоретична частина
Оксиген і Сульфурє елементами VI-групи періодичної системи (загальна назва халькогени). У атомів цих елементів на зовнішньому енергетичному рівні знаходиться по 6 електронів (s 2 p 4 ). Цим пояснюється їх схожість хімічних властивостей. Усі халькогени в сполуках з Гідрогеном і металами виявляють ступінь окиснення -2, а в сполуках з Оксигеном і іншими активними неметалами - +4, +6. Для Оксигену, як і для Флуору, не типовий ступінь окиснення, який дорівнює номеру групи. Він виявляє ступінь окиснення -2 а в сполуках з Флуором – +2 і +1. Сполуки халькогенів з Гідрогеном відповідають формулі Н2Е: Н2О, Н2S, H2Se, H2Te. При взаємодії з водою утворюють кислоти.
Халькогени утворюють однакові форми сполук з оксигеном (ЕО2 і ЕО3). Їм відповідають кислоти такого типу: Н2ЕО3 і Н2ЕО4. Зі зростанням порядкового номера елемента сила цих кислот зменшується. Всі вони виявляють окисні властивості.
Кисень в лабораторних умовах одержують розкладом бертолетової солі чи калій перманганату:
Кисень сполучається з багатьма елементами, особливо при нагріванні з утворенням оксидів (з металами – основних, з неметалами – кислотних):
Безпосередньо кисень не взаємодіє з галогенами, інертними газами, благородними металами. Вільний кисень виявляє окисну дію по відношенню до цілого ряду сполук:
Кисень є головним окисником органічних сполук при спалюванні природного газу, нафтопродуктів, в реакціях синтезу оргаічних сполук:
Відома алотропна видозміна кисню – озон О3. Він утворюється в природі при електричних розрядах, під впливом енергії ультрафіолетових і космічних променів. За хімічними властивостями озон – сильний окисник, реагує з усіма металами, за винятком золота і металів платинової групи:
Вільний кисень бере участь у процесах, що відбуваються в ґрунті і обу-мовлюють його родючість. Наприклад, за його участю відбувається міне-ралізація (гниття) рослинних і тваринних залишків, а складні органічні речовини перетворюються у більш прості (NH3, CO2, H2O).
Сульфур зустрічається в природі як у самородному стані, так і у вигляді різноманітних сполук. Найбільш поширені сполуки Сульфуру з різними металами. Багато з них є цінними рудами: свинцевий блиск, цинкова обманка, мідний блиск. Із сполук Сульфуру в природі поширені також сульфати.
Сірка з воднем утворює декілька сполук, найголовнішою з яких є гідроген сульфід H2S – безбарвний газ з запахом тухлих яєць. H2S – горючий газ. Продуктами горіння можуть бути як сірка, так і сульфур (IV) оксид:
Водний розчин гідроген сульфіду називається сульфідною кислотою. H2S – слабка двоосновна кислота. Багато солей цієї кислоти мають яскраве забарвлення (CuS – чорний; HgS – червоний; ZnS – білий) і використовуються в аналітичній хімії.
Сульфур з Оксигеном утворює два кислотних оксиди: сульфур (IV) оксид SO2 та сульфур (VI) оксид SO3. При взаємодії з водою ці оксиди утворюють відповідні кислоти:
Н2SO3 – кислота середньої сили, яка існує лише у розчині. Оскільки Сульфур в SO2 і сульфітах знаходиться у проміжному стані оксинення (+4), ці сполуки мають окисно-відновну подвійність з більш вираженими відновними властивостями:
Концентрована сульфатна кислота H2SO4 – один із найбільш сильних окисників. Взаємодія цієї кислоти з металами залежить від її концентрації. Метали, які стоять у ряду напруг до Гідрогену, із розбавленої сульфатної кислоти витісняють водень:
Концентрована сульфатна кислота розчиняє майже усі метали незалежно від положення їх у ряду напруг (крім золота і платини). Як продукти відновлення при цьому виділяються сульфур (IV) оксид, вільна сірка чи гідроген сульфід, сіль, вода.
Концентрована сульфатна кислота при взаємодії з малоактивними металами відновлюється до сульфур (IV) оксиду:
Концентрована сульфатна кислота окиснює і деякі неметали:
У хімічній промисловості сульфатна кислота використовується для отримання фосфатних та нітратних мінеральних добрив, пластичних мас, штучного волокна, лікарських препаратів та вибухових речовин.
Cульфур – важливий біогенний елемент. Він входить до складу сульфурвмісних білків, які приймають участь в багатьох біохімічних процесах, що включають перенесення електронів під час фотосинтезу, а також фіксацію азоту за участю важливого ферменту цього процесу – нітрогенази. У сільськогосподарській практиці використовується захід гіпсування грунтів – внесення гіпсу CaSO4 × 2H2O для усунення надлишкової лужності солонців та солончаків. Сульфур входить до складу мінеральних добрив, що використовуються у формі сульфатів. Більшість мікродобрив, наприклад, CuSO4 × 5H2O, MnSO4 × 5H2O, ZnSO4 × 5H2O, вносять у грунт у вигляді сульфатних добавок до фосфатних і азотних добрив.
Хлор – елемент VIIА-групи періодичної системи елементів Д.І. Менделеєва. Атоми цього елементу має на зовнішньому енергетичному рівні 7 електронів у стані s 2 p 5 . Для завершення зовнішнього енергетичного рівню він приєднує один електрон (ступінь окиснення -1). Таку ступінь окиснення Хлор має у сполуках з Гідрогеном та металами. Атом Хлору маже виявляти і позитивні ступені окиснення: +1, +3, +5, +7. Хлор відноситься до типових неметалів, це сильний окисник. У промисловості його отримують електролізом водного розчину натрій хлориду, в лабораторії – діючи сильним окисником (HMnO4, KClO4, MnO2) при температурі на концентровану хлоридну кислоту:
Хлор належить до поширених елементів, але у вільному стані в природі він не зустрічається. Це зеленувато-жовтий газ з різким запахом. В хімічному відношенні він дуже активний і поступається за активністю лише Фтору. Він сполучається майже з усіма металами:
а також з неметалами:
Хлор виявляє окисну дію не лише по відношенню до природних речовин, але може окиснювати і складні речовини, що мають відновні властивості, а також органічні сполуки:
З киснем, азотом та благородними газами хлор безпосередньо не сполучається. При взаємодії з воднем він утворює гідроген хлорид HCl – безбарвний газ з різким запахом, який не горить і не підтримує горіння. В лабораторії гідроген хлорид отримують дією сульфатної кислоти на NaCl:
Водний розчин HCl називається хлоридною (соляною) кислотою. Соляна кислота є сильною одноосновною кислотою і взаємодіє з усіма металами, що знаходяться в ряду напруг металів до Гідрогену:
Її солі – хлориди – майже усі добре розчинні у воді.
Хлор утворює декілька сполук з Оксигеном – оксидів та оксигеновмісних кислот. В цих сполуках Хлор має позитивні ступені окиснення:
| Ступінь окиснення Хлору | Формула кислоти | Назва кислоти |
| +1 | HClO | гіпохлоритна |
| +3 | HСlO2 | хлоритна |
| +5 | HСlO3 | хлоратна |
| +7 | HСlO4 | перхлоратна |
Порівнння властивостей оксигеновмісних кислот Хлору, свідчить про те, що зі збільшенням ступеня окиснення Хлору стійкість його оксигено-вмісних кислот зростає внаслідок збільшення кількості електронів, що беруть участь в утворенні зв’язків:
збільшення стійкості та сили кислот
Вміст хлору у мінеральній частині грунту і сухій біомасі рослин складає 0,01 %. Рослини засвоюють хлор з грунтових розчинів у вигляді хлорид-іонів Cl - . Ці іони приймають участь у підтриманні фізіологічно необхідної наповненості клітин водою (осмотичний тиск). Деякі солі хлоридної кислоти використовуються у сільському господарстві: КCl – калійне добриво; ВаCl2 ∙ 2Н2О – інсектицид; HgCl2 – сулема, отрута для протравлювання насіння.
Експериментальна частина
Дослід 9.2..1. Якісна реакція на іон хлору
У три пробірки налити по 3-4 краплі розчинів наступних хлоридів: у першу – калій хлориду, у другу – барій хлориду, у третю – ферум (III) хлориду. В кожну пробірку додати по 2 краплі розчину аргентум нітрату. Порівняти результати спостережень у всіх трьох пробірках. Що між ними спільного? Скласти рівняння реакцій, що відбулися.
У всі пробірки додати по 1-3 краплі концентрованого розчину амоніаку і розмішати. Що відбувається з осадом? Чому осад у третій пробірці не розчинився? Що сталося з його кольором?
Додати у кожну пробірку по 1-3 краплі концентрованої нітратної кислоти. Які зміни відбуваються? Що можна сказати про поведінку аргентум хлориду в амоніаку у кислому середовищі?
Дослід 9.2.2. Взаємодія хлоридної кислоти з металами
У три пробірки помістити: у першу – 1-3 гранули цинку, у другу – трохи залізних стружок, у третю – мідних стружок. В кожну пробірку додати розведеної хлоридної кислоти і спостерігати, які з цих металів взаємодіють із хлоридною кислотою. Скласти рівняння реакцій, що відбулися.
Дослід 9.2.3. Окисні властивості пероксиду водню
У пробірку внести5 крапель розчину KI i 3 краплі розчину Н2О2. Чи змінився колір розчину ? Яка відбулася реакція ? Випробувати розчин на наявність йоду за допомогою 1-2 крапель розчину крохмалю.
Дослід 9.2.4. Обвуглювання паперу сульфатною кислотою
Візьміть скляну паличку і напишіть що-небудь на білому папері розведеною сульфатною кислотою. Висушіть написане, високо тримаючи папір над полум’ям пальника. Спочатку на папері майже не видно написаного, а згодом на білому фоні чітко виступають чорні літери. Поясніть причину цього явища.
9.3. Контрольні запитання
| 1. | Хімія Сульфуру та його основних сполук. Гідроген сульфід. Використання сполук Cульфуру для виробництва сільськогосподарських препаратів. |
| 2. | Закінчити рівняння реакцій, вказати умови їх проведення, якщо вони відрізняються від звичайних (нагрівання, каталізатори, тиск і т.ін.): Cl2 + KOH ® KBr + H2SO4(конц) ® Zn + H2SO4(конц) ® |
| 3. | Роль галогенів в живих організмах. Особливості електронної будови атомів галогенів. Хімія Хлору. Взаємодія хлору з металами і неметалами. Гідроген хлорид і хлоридна кислота. |
| 4. | Закінчити рівняння реакцій, вказати умови їх проведення, якщо вони відрізняються від звичайних (нагрівання, каталізатори, тиск і т.ін.): P + H2SO4(конц) ® Cl2 + H2O ® H2S + I2 ® |
| 5. | Оксиди та оксигенвмісні кислоти хлору. Застосування хлору у сільському господарстві. |
| 6. | Закінчити рівняння реакцій, вказати умови їх проведення, якщо вони відрізняються від звичайних (нагрівання, каталізатори, тиск і т.ін.): H2S + O2 ® Cl2 + H2S ® Na2O2 + H2SO4 ® H2S + H2SO3 ® |
ЛАБОРАТОРНА РОБОТА № 10
ХІМІЯ D-ЕЛЕМЕНТІВ. ХІМІЧНІ ВЛАСТИВОСТІ СПОЛУК
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ ГРУПИ (ХАЛЬКОГЕНИ)
§ 28. Сполуки Сульфуру(ІV)
Усвідомлення змісту цього параграфа дає змогу:
характеризувати склад сульфур(І V ) оксиду, сульфітної кислоти та її солей, фізичні та хімічні властивості, добування і практичне значення;
визначати сульфіт-іони в розчинах;
складати рівняння реакцій та схеми електронного балансу відповідних хімічних реакцій.
Найбільше значення серед сполук Сульфуру зі ступенем окиснення +4 має сульфур( IV ) оксид, або сірчистий газ SO 2, якому відповідає сульфітна кислота H 2 SO 3. M ( SO 2) = 64; M ( H 2 SO 3) = 82.
У цих сполуках Сульфур утворює чотири ковалентні полярні зв’язки з атомами Оксигену (мал. 41).

Мал. 41. Молекула SO 2 : а — модель, б — просторова будова; молекула H 2 SO 3 : в — модель, г — просторова будова
- Поясніть здатність атома Сульфуру утворювати чотири ковалентні зв’язки і набувати позитивного ступеня окиснення +4.
Поширеність у природі. Значна кількість сірчистого газу викидається в атмосферу під час виверження вулканів. У деяких місцях сірчистий газ виділяється з тріщин земної кори. Нещодавно вчені встановили, що атмосфера одного із супутників Юпітера практично повністю складається з сірчистого газу вулканічного походження.
Фізичні властивості. Сульфур(І V ) оксид має молекулярну кристалічну ґратку. Це газ без кольору, з різким запахом, важчий за повітря. За температури -10 °С він зріджується й утворює безбарвну рідину, яка розчиняє гуму і деякі пластмаси. Добре розчиняється у воді (за н.у. в одному об’ємі води розчиняється 40 об’ємів SO 2 ).
Фізіологічна дія. Сульфур(І V ) оксид дуже токсична речовина. При вмісті в атмосфері лише 0,3 % він спричиняє бронхіт чи пневмонію, а при збільшенні вмісту — навіть смерть.
Сірчистий газ є одним з основних забруднювачів атмосфери антропогенного походження. Саме цей оксид вважається найбільш шкідливим для людини, бо погіршує загальний стан здоров’я і позначається на тривалості життя.
Добування. У промисловості сульфур ( IV ) оксид одержують спалюванням сірки, випалюванням сульфідних руд, наприклад піриту:

У лабораторії сульфур ( IV ) оксид добувають взаємодією сульфатної кислоти з масовою часткою H 2 SO 4 70 % із кристалічними сульфітами. Колбу Вюрца наповнюють великими грудками натрій сульфіту, з крапельної лійки добавляють сульфатну кислоту. Газ, що утворюється внаслідок розкладу нестійкої H SO , збирають у посудину витісненням повітря:

Хімічні властивості. Сульфур( IV ) оксид — кислотний оксид, ангідрид сульфітної кислоти — розчиняється у воді з утворенням розчину сульфітної кислоти:
SO 2 + H 2 O - H 2 SO 3
Рівновага зміщена вліво, утворюються гідрати змінного складу SO 2 • nH 2 O . Сульфітна кислота — нестійка сполука, легко розкладається на сірчистий газ і воду, тому існує тільки у водних розчинах. Належить до електролітів середньої сили. Як двохосновна кислота дисоціює ступінчасто з утворенням гідрогенсульфіт-іонів HSO - та сульфіт-іонів SO |-:

У водних розчинах сульфітної кислоти існує рівновага:

Відповідно до ступінчастої дисоціації утворює кислі солі — гідрогенсульфіти NaHSO 3 і середні — сульфіти Na 2 SO 3.
Сульфур( IV ) оксид і сульфітна кислота взаємодіють: з основними та амфотерними оксидами із утворенням солей:
SO2 + СаО = СаSO3; SO2 + ZnO = ZnSO3
H2SO3 + CaO = CaSO3 + H2O; H2SO3 + ZnO = ZnSO3+ H2O
з основами із утворенням солей:
SO2 + 2NaOH = Na2SO3+ H2O
H2SO3 + 2NaOH = Na2SO3+ 2H2O
Сульфітна кислота взаємодіє з розчинами солей:

- Для реакцій за участю електролітів напишіть рівняння в йонних формах.
Якісна реакція на сульфітну кислоту та її солі. Реактивом на сульфіт-іон 
є катіон Гідрогену Н+, тобто будь-яка сильна кислота.
Сульфітна кислота, що утворюється в ході реакції, розкладається з виділенням сірчистого газу, який визначають за характерним запахом і зміною кольору зволоженого лакмусового паперу:

- Напишіть хімічне і повне йонне рівняння реакцій.
Окисно-відновні властивості сполук Сульфуру(IV). Проміжний ступінь окиснення Сульфуру +4 у сульфур ( IV ) оксиді, сульфітній кислоті та сульфітах зумовлює їх участь в окисно-відновних процесах як окисника або відновника.

Так, відновні властивості сполуки Сульфуру ( IV ) виявляють в реакціях з сильнішими окисниками: киснем, галогенами, калій перманг a н a том:


- Складіть схеми електронного балансу цих реакцій.
Окиснювальні властивості сполук Сульфур ( IV ) виявляються в реакціях з сильними відновниками: 
Ілюстрацією окиснювальних властивостей сульфур(І V ) оксиду є його реакція з сірководнем, яка відбувається у вулканічних газах (мал. 42):


Мал. 42. Сірка на схилі вулкана
Утворення сірки досить легко спрогнозувати, бо окисником і відновником є один елемент — Сульфур, який у продукті реакції матиме проміжний ступінь окиснення відносно ступеня окиснення в реагентах.
У даному випадку це єдиний можливий варіант ступеня окиснення
Сульфуру — 
Аналогічно взаємодіє з сірководнем і сульфітна кислота:

- Складіть схеми електронного балансу.
Реакцію взаємодії сірчистого газу з сірководнем застосовують для добування сірки із сірководню, виділеного з супутніх нафтових газів. Сірчистий газ для реакції добувають спалюванням частини сірководню.
Застосування сполук Сульфуру(І V ). Окиснення сульфур ( IV ) оксиду до сульфур( IV ) оксиду є проміжним, але обов’язковим етапом добування сульфатної кислоти.
Сірчистий газ SO 2 і солі сульфітної кислоти натрій гідрогенсульфіт NaHSO 3 та натрій сульфіт Na 2 SO 3 застосовують як м’які окисники для вибілювання паперу, соломи, вовни та шовку, кукурудзяного борошна. Іноді ця реакція може бути оборотною, і колір, наприклад соломи, через деякий час відновлюється.
Сірчистий газ знищує багато мікроорганізмів. Тому його використовують як дезинфікуючий засіб в овочесховищах, для знищення плісняви в бродильних чанах, захисту плодових рослин від хвороб і шкідників. Окрім того, його застосовують як консервант для зберігання овочів та фруктів.
Коротко про головне
Сполуками Сульфуру( IV ) є сульфур( IV ) оксид S О2 — сірчистий газ, сульфітна кислота H 2 SO 3 та її солі: середні — сульфіти Na 2 SO 3, кислі — гідрогенсульфіти NaHSO 3. Сульфур( IV ) оксид — речовина молекулярної будови, що зумовлює її фізичні властивості; дуже отруйна.
Сульфітна кислота — нестійка сполука, тому існує тільки в розчині. Електроліт середньої сили. Як двохосновна кислота дисоціює ступінчасто з утворенням гідрогенсульфіт-іонів HSO -3 та сульфіт-іонів SO 3-.
Сульфур ( IV ) оксид і сульфітна кислота виявляють типові кислотні властивості. Як сполуки, що містять Сульфур з проміжним ступенем окиснення, залежно від властивостей іншого реагенту виявляють відновні (при взаємодії з сильнішими окисниками) або окиснювальні (при взаємодії з сильнішими відновниками) властивості. Реактивом на сульфіт-іон SO 23- є катіон Гідрогену (Н+) у складі будь-якої сильної кислоти. Ознака реакції — виділення сірчистого газу, який розпізнають за характерним запахом і почервонінням вологого лакмусового паперу. Застосування сполук Сульфуру(І V ) зумовлене їх окиснюваль- ними (вибілювальна і дезинфікуюча дії) і відновними (добування сульфур( V І) оксиду) властивостями.
1) Кисень утворюється в результаті розкладання деяких солей:

пероксидів: 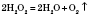
оксидів важких металів: 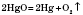
2) Озон утворюється зі звичайного кисню під дією електричного розряду (розряд блискавки, робота електротрансформаторів) або ультрафіолетового випромінювання (сонячне світло, робота ксерокса), а також у процесах, що супроводжуються виділення атомарного Оксигену (розклад пероксидів).
3) Сірку добувають в самородному стані; також її добувають:
при неповному розкладанні сірководню:
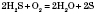
із сульфідів металів:
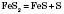
в реакціях відновлення сірки із сульфур(IV) оксиду:

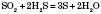
Хімічні властивості кисню.
Кисень — сильний окисник.
1) Взаємодія з металами:
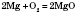
2) Взаємодія з неметалами:
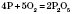
3) Горіння складних речовин:

4) Окиснення складних речовин (цей процес не належить до горіння):
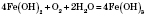
Хімічні властивості сірки.
1) При взаємодії з неметалами сірка виявляє окисні й відновлювальні властивості.
Із простими речовинами, утвореними більш електронегативними елементами (Оксигеном, Фтором, Хлором, Бромом), сірка виступає в ролі відновника.
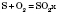
— сульфур(IV) оксид
Із простими речовинами, утвореними менш електронегативними елементами, сірка виступає в ролі окисника:
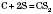
— карбон(VI) сульфід
Бінарні сполуки сульфуру, в яких вона виявляє ступінь окиснення –2, називаютьсульфідами.
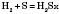
— гідроген сульфід (сірководень)
2) Взаємодія з металами.
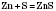
— цинк сульфід;
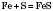
— ферум(ІІ) сульфід.
Усі сульфіди, крім HgS, утворюються при нагріванні. Із ртуттю сірка взаємодіє вже при кімнатній температурі:

— меркурій(II) сульфід.
Ця властивість використовується в лабораторіях для видалення розлитої ртуті, пари якої дуже токсичні.
Застосування кисню. Кисень використовується для інтенсифікації процесів горіння (наприклад, при виплавці сталі), підвищення температури горіння (при зварюванні), як окисник в інших реакціях, у медицині.
Озон має дезинфікуючу відбілюючу дію. Головне застосування озону — знезаражування водопровідної води.
Застосування сірки. Сірка застосовується для одержання сульфатної кислоти, вулканізації каучуку, боротьби із сільськогосподарськими шкідниками, одержання сірників, пороху. У медицині виготовляють сірчані мазі для лікування шкірних хвороб.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Читайте также:

