Экг при раке сердца

Структура статьи
- Рак и сердечно-сосудистые заболевания
- Сердечно-сосудистый риск у онкологического больного
- Механизмы развития сердечно-сосудистых заболеваний у онкологических пациентов
- Определение кардиотокисчности и методы ее диагностики
- Онкологические больные с имеющимися заболеваниями сердца и сосудов
- Перспективы онко-кардиологии
Ежегодно в мире регистрируется до 13 млн новых случаев онкологических заболеваний. Рак одна из основных причин смертности, уступая первенство лишь сердечно-сосудистым заболеваниям (ССЗ). Тем не менее ситуация меняется: благодаря ранней диагностике и применению более эффективных методов лечения, смертность от злокачественных новообразований проявляет устойчивую тенденцию к снижению. Современная химио- и лучевая терапия в комплексе с оперативной онкологией позволяют сохранять жизнь и работоспособность больных в течение десятилетий.
Рак и сердечно-сосудистые заболевания
Ситуация изменилась настолько, что при успешном лечении, прогноз заболевания нередко определяется не столько основным заболеванием, сколько сопутствующей патологией – в первую очередь, болезнями сердца и сосудов. ССЗ обычно выявляются в возрастной группе от 45 лет и старше. В преклонном возрасте теми или иными заболеваниями сердца страдают более половины населения.
С учётом того, что население земного шара неуклонно стареет, рост хронических заболеваний, таких как рак и сердечно-сосудистые заболевания во всем мире и в нашей стране, неизбежен. При этом, что характерно, повышается вероятность одновременного выявления двух заболеваний у одного пациента во множестве клинических случаев. Это не только статистическая вероятность, но и, возможно, следствие влияния так называемых факторов риска развития злокачественной опухоли и болезней сердца.
С учетом актуальности проблемы в последние годы появилось новая специальность кардиоонкология или онкокардиология. Последний термин предпочтителен, т.к. подчеркивает причинно-следственную связь поражения ССЗ при онкологическом заболевании.
Так, в США 5-летняя выживаемость больных впервые установленным диагнозом рак составляет 67%, а среди детей с онкологическими заболеваниями 7-летняя выживаемость и того более – 75%. Из тех, кто не выживает в этот период онкологическое заболевание является причиной смертности только у половины, тогда как у трети больных смерть наступает вследствие сердечно-сосудистых причин.
Примечательно, что сердечно-сосудистая смертность в данной группе значительно выше, чем в аналогичной возрастной группе, не получающей лечения по поводу рака. Это означает, что и само онкологическое заболевание, и методы его лечения повышают вероятность развития тяжелых заболеваний сердца и сосудов. Это вторая причина, по которой рак может быть причинно связан с ССЗ.
Третья причина – тромбозы и эмболии. Рак нередко ассоциирован с гиперкоагуляцией, с венозными и артериальными тромбозами. Некоторые противоопухолевые препараты также могут стимулировать тромбообразование. Лучевая терапия и некоторые химитерапевтические препараты, в свою очередь, могут привести к нарушению эндотелия сосудов, тромбоообразованию в сосудах малого и крупного диаметра.
Четвертая причина, по которой кардиологи должны внимательно следить за больными это повреждение сердца, обозначаемое термином кардиотоксичность. Химиотерапевтические препараты должны избирательно подавлять рост раковых клеток. Но избирательность эта весьма относительна. Убивая раковые клетки, например, при опухоли молочной железы или новообразованиях средостения, они вызывают повреждение кардиомиоцитов.
Сердечно-сосудистый риск у онкологического больного
Кардиотоксические эффекты появляются в виде нарушения сократительной функции сердца, ишемии миокарда, аритмиями и блокадами. Лучевая терапия также способствует ускорению атеросклероза и проявлению ИБС , развитию перикардита.
Несмотря на то, что рак молочной железы, рак яичка, лимфома Ходжкина, и многие другие виды рака успешно вылечиваются на ранним стадиях, проблемы с сердцем, возникающие на фоне лечения рака, сокращают ожидаемую продолжительность и качество жизни этих больных. Предварительное исследования сердечно-сосудистого статуса больных и тщательное кардиологическое наблюдение пациентов повышенного сердечно-сосудистого риска до, во время и после химиотерапии имеют крайне важное значение. Это и регулярные осмотры пациентов, динамическое наблюдение, ЭКГ , УЗИ сердца , некоторые специальные анализы, и при необходимости, радиоизотопные исследования сердца.
Кардиотоксичность, при лечении рака, наблюдаются не у всех пациентов. Есть некоторые факторы, которые определяют этот риск. Первый из них связан с типом, дозой и способом введения химиотерапевтических препаратов и применением (либо не применением) лучевой терапии. Например, некоторые химиотерапевтические препараты могут вызвать застойную сердечную недостаточность у каждого четвертого пациента, а есть препараты, которые могут привести к гипертонии 50% пациентов.
Поражение сердца проявляются также аритмиями и блокадами сердца, инфарктом миокарда и перикардитом. Интересно отметить, что вышеперечисленные осложнения могут наблюдаться как во время лечения, так и много лет спустя после проведения химио- и лучевой терапии. Нередко больные, перенесшие химиотерапию, проходят повторные курсы после длительного перерыва. Это группа повышенного риска сердечно-сосудистых осложнений.
Второй группой факторов, определяющих риск развития сердечных заболеваний в результате применения лекарственных средств являются: возраст пациента, наличие факторов риска сердечно-сосудистых заболеваний или уже существующее заболевание. Серьезные проблемы с сердцем, при применении курса лечения рака чаще развиваются у больных, перенесших инфаркт миокарда, с сердечной недостаточностью, гипертонией, поражениями клапанов и аритмиями. Такие заболевания должны быть определены до начала курса лечения рака.
Механизмы развития сердечно-сосудистых заболеваний у онкологических пациентов
Подавление роста раковых клеток химиотерапевтическими препаратами и лучевой терапией - основа лечения рака. Однако химиотерапевтические препараты не обладают абсолютной избирательностью действия. Подавляя раковые клетки, они подавляют регенерацию клеток миокарда (классический пример доксорубицин и антрациклины) вызывая снижение сократительной функции сердца. Замещение поврежденных кардиомиоцитов и рост новых клеток – основной механизм компенсации сердца для предотвращения сердечной недостаточности. При лучевой терапии наряду с прицельным облучением опухоли, в той или иной степени поражаются и другие органы и ткани, в особенности те, которые расположены в непосредственной близости к объекту воздействия. Ряд препаратов (5-фторурацил, капецитибин) напрямую влияют на функцию эндотелия, вызывая тромбозы эпикардиальных коронарных артерий, артерий мелкого калибра. Происходит обеднение сосудистого рисунка.
Некоторые из химиотерапевтических препаратов (бевацизумаб, сунитиниб) могут вызывать как снижение сократимости, так и эндотелиальную дисфункцию. Для лечения некоторых видов опухолей лучевая терапия неизбежна. Облучение при опухолях молочной железы (в особенности левой), опухолей средостения, легких, сердце часто попадает в зону лучевого воздействия. В этом случае, из-за нарушения целостности эндотелия, развивается перикардит и перикардиальный выпот, поражение клапанов сердца, укоренное развитие коронарных и каротидных стенозов. Прямое воздействие облучения на сердце может привести к нарушениям проводимости сердца, блокадам и аритмиям.
По времени наступления различают острую и хроническую кардиотоксичность.
Острая кардиотоксичность (в пределах 1 недели) происходит из-за повреждения кардиомиоцитов, отложения продуктов распада, воспалительных инфильтратов, интерстициального отека.
Хроническая кардиотоксичность (в течение 1 года и более) является следствием вакуолизации клеток из-за разрушения мембран и митохондрий, разрушения органелл, гибели клеток, снижения количества миофибрилл, дезориентации миокардиальных волокон.
Как острая, так и хроническая кардиотоксичность развивается по сложным механизмам. Лечение рака, как правило, подразумевает одновременное применение препаратов с различным механизмом действия и нередко комбинируется с лучевой терапией. Считается, что на ранних этапах лечения нарушения сократительной функции сердца носят функциональный характер.
На ранних стадиях функциональные повреждения могут быть устранены, сердечную недостаточность можно предупредить. Но если диагноз поставлен через 6 месяцев после развития такого повреждения, застойная сердечная недостаточность становится необратимой. По этой причине онкологи должны быть осведомлены о начале нарушения функционального состояния сердца и работать в связке с кардиологами.
Определение кардиотокисчности и методы ее диагностики
На сегодняшний день нет единого, общепринятого определения кардиотоксичности. О кардиотоксичности говорят тогда, когда фракция выброса левого желудочка на фоне химиотерапии равна или ниже 55%. Наиболее часто кардиотоксичность определяется как снижение фракции выброса левого желудочка на 5% при наличии симптомов сердечной недостаточности или при отсутствии симптомов - в случае снижения фракции выброса левого желудочка на 10%.
Исходя из этого, точность измерения фракции выброса приобретает принципиально важное значение. Исследование сократимости ЛЖ с помощью многокадровой синхронизированной изотопной вентрикулографии (MUGA) точный, воспроизводимый, хорошо зарекомендовавший себя метод. Несмотря на очевидные плюсы, методика не общедоступна, а главное, связана с дополнительной радиационной нагрузкой для больного с раком. Сказанное в равной степени справедливо и для мультиспиральной контрастной компьютерной томографии ( МСКТ ).
Двухмерная эхокардиография ( ЭхоКГ ) – незаменимый метод исследования сократительной функции сердца. Данная методика безвредна для пациента, ее можно применять многократно, у постели больного. Поэтому ЭхоКГ давно стала основным методом в оценке сократимости ЛЖ. Но, к сожалению, воспроизводимость данных ЭхоКГ невысока. Методика субъективна, поэтому вариабельнасть оценки разными исследователями весьма значительна.
Контрастная эхокардиография значительно облегчает оценку функции ЛЖ, повышает ее точность. В последние годы все чаще применяется 3-х мерная ЭхоКГ, точность которой выше, чем рутинного 2-х мерного исследования. Еще более перспективным, более ранним и чувствительным методом диагностики оказалось изучение растяжимости сердца.
Это перспективная методика ранней оценки изменений сократимости сердца, до того, как фракция выброса левого желудочка начинает снижаться. Метод выгодно отличается хорошей воспроизводимостью, минимальной вариабельностью при оценке разными исследователями. Существенным недостатком всех ультразвуковых методик является то, что она не всегда применима. Идеальные для анализа изображения можно получить не у каждого больного. Особенности конституции, заболевания легких, послеоперационные рубцы и лучевая терапия порой значительно ухудшают ультразвуковую визуализацию сердца.
Самым надежным (и самым точным) методом оценки фракции выброса ЛЖ, в последние годы, становится магнитно-резонансная томография сердца ( МРТ ). МРТ идеально подходит для изучения сократительной функции сердца у онкологического больного. Она позволяет одновременно выявить поражения клапанов сердца, отличить воспалительное поражения миокарда от рубцового. Но методика имеет свои ограничения и недостатки. Она мало применима для больных страдающих сердечной недостаточностью, клаустрофобией. МРТ сердца дорогостоящее исследование, ее невозможно выполнить у постели больного.
Из лабораторных исследований для больного, получающего химиотерапию важное значение приобретают маркеры повреждения миокарда, такие как Тропонины и маркёр сердечной недостаточности - предсердный натриуретический гормон. Показано, что даже небольшое повышение уровня Тропонинов после химиотерапии коррелирует с развитием сердечной недостаточности в будущем. Повышение уровня предсердного натриуретического гормона, с другой стороны, во-первых, позволяет дифференцировать одышку и слабость сердечного происхождения от несердечных причин, а с другой стороны, позволяет контролировать эффективность лечения сердечной недостаточности.
Онкологические больные с имеющимися заболеваниями сердца и сосудов
При этом борьба с раком не прекращается, уменьшая вероятность сопутствующего поражения сердца и увеличивая сердечно-сосудистый резерв, онкологи могут максимально радикально бороться с опухолью. Для такого сотрудничества, наиболее важным является создание надежной связи между онкологами и кардиологами.
Перспективы онко-кардиологии
Онкология и в частности химиотерапия, стремительно развивающиеся области медицины. Появляются новые препараты и протоколы лечения больных с раковыми заболеваниями. Разработка и внедрение алгоритмов наблюдения сердечно-сосудистой системы при клинических испытаниях I-III фазы с целью раннего распознавания потенциально неожиданных сердечных эффектов может стать важной частью будущих научных исследований.
В ближайшие годы ожидается разработка новых стратегий для раннего распознавания и лечения известных побочных эффектов лечения рака, таких как гипертония, бессимптомная дисфункция ЛЖ. Это включает в себя и совершенствование имеющихся технологий визуализации сердца и дальнейшую разработку, и внедрение новых методик, а также изучения роли сердечно-сосудистых биомаркеров в лечения рака.
Реабилитация онкологических больных, наблюдение над их приверженностью к сложной многокомпонентной терапии, психологическая реабилитация очень важные и мало изученные проблемы.
С невероятным ростом терапии рака и повышением осведомленности онкологов о часто неожиданных осложнениях со стороны сердечно-сосудистой системы, роль кардиолога в онкологии возрастает. Онкокардиология будет играть все более важную роль в содействии знаний в этой области и реализации его результатов в клинической практике.
Онко-кардиология интегральная специальность, цель которой не потерять больного от сердечно-сосудистых осложнений при успешном лечении онкологического заболевания. Несмотря на то, что проблема очевидна, в мире всего лишь несколько ведущих центров, которые успешно занимаются проблемами онко-кардиологии. На сегодня нет общепринятых стандартов и рекомендаций, которым следовали бы специалисты. Многое открывается буквально в ежедневном режиме.
Для осуществления этой задачи необходимо тесное взаимодействие между онкологом, химиотерапевтом, кардиологом, реаниматологом, клиническим фармакологом, специалистами по реабилитации.
Давид ДУНДУА, доктор медицинских наук, профессор Главный кардиолог Центра эндохирургии и литотрипсии (Москва)
а) Первичные саркомы сердца. Первичные саркомы сердца - наиболее часто встречающиеся (95%) первичные злокачественные опухоли сердца. Они происходят из мезенхимных клеток. Обследуя больных в связи с подозрением на первичную саркому сердца, всегда необходимо также исключить метастазы экстракардиальной опухоли, исходящей из костей скелета или ретроперитонеума. Метастазы саркомы в сердце наблюдаются в 60 раз чаще, чем первичные саркомы сердца. Из клинических проявлений следует отметить затруднение дыхания, боль в груди, симптомы тампонады сердца, реже наблюдаются эмболии, обмороки или внезапная сердечная смерть. Саркому сердца в 75% случаев удается диагностировать с помощью двумерной ЭхоКГ.
Диагностике помогает наличие одновременно выпота в полости перикарда. Для установления диагноза можно выполнить также КТ или МРТ. Роль чреспищеводной ЭхоКГ особенно значительна при локализации опухоли в предсердии. Дифференциальная диагностика с миксомой предсердия упрощается в случае, когда опухоль инфильтрирует стенку желудочка. Присутствие очагов обызвествления наблюдается как в саркомах, так и в миксомах, поэтому данный признак не используется для проведения дифференциальной диагностики.
1. Ангиосаркомы. Ангиосаркомы - наиболее часто встречающиеся саркомы сердца у взрослых. Они локализуются преимущественно в правом предсердии. Часто в опухолевый процесс вовлекается перикард, но нередки также случаи, когда опухолевая инфильтрация распространяется на полые вены и на трехстворчатый клапан. Средний возраст больных с саркомой сердца составляет 40 лет. У мужчин ангиосаркомы встречаются чаще, чем у женщин. Прогноз жизни при ангиосаркоме весьма неблагоприятный. После установления диагноза продолжительность жизни больных составляет лишь 3-4 мес., и изменить прогноз удается лишь путем ранней диагностики ангиосаркомы и радикального ее иссечения.
2. Злокачественная фиброгистиоцитома. Злокачественная фиброгистиоцитома является второй по частоте саркомой, поражающей сердце. Средний возраст больных, в котором опухоль диагностируют, у мужчин и женщин одинаков и составляет 44 года. Ведущим симптомом в клинической картине является застой в легких. Более чем у 90% больных злокачественная фиброгистиоцитома локализуется на задней стенке левого предсердия. С помощью ЧПЭ локализацию опухоли удается установить точнее.
3. Редкие первичные саркомы сердца. К редким первичным саркомам сердца относятся остеосаркома, лейомиосаркома, фибросаркома, миксосаркома, рабдомиосаркома, синовиальная саркома и липосаркома. Во многих случаях при внутриполостной локализации саркому приходится дифференцировать от миксомы сердца; диагностика в таких случаях облегчается, если опухоль инфильтрирует стенку пораженной камеры сердца.
4. Саркома Капоши. Саркому Капоши, поражающую сердце, выявляют на аутопсии примерно у 12-28% больных СПИДом. Она обычно составляет часть диссеминированного Капоши-синдрома. Инфильтрация эпикарда и перикарда бывает выражена в меньшей степени, чем миокарда. Инфильтрация перикарда часто ведет к угрожающей жизни больного тампонаде сердца или перикардиальной констрикции.
Описаны также случаи саркомы Капоши сердца и перикарда у больных после трансплантации того или иного органа, получающих иммуносупрессивную терапию.
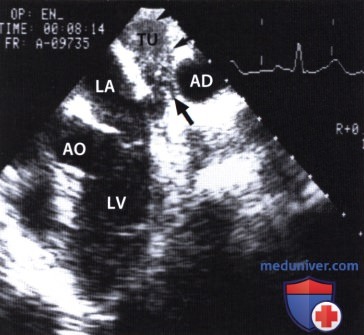
ЧПЭ вдоль длинной оси сердца: злокачественная фиброгистиоцитома (TU) между левым предсердием (LA) и нисходящей аортой (AD). LV - левый желудочек, АО - корень аорты. 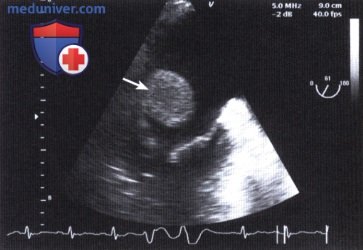
ЧПЭ вдоль длинной оси сердца: метастазы бронхогенного рака легкого (стрелка) в левое предсердие. 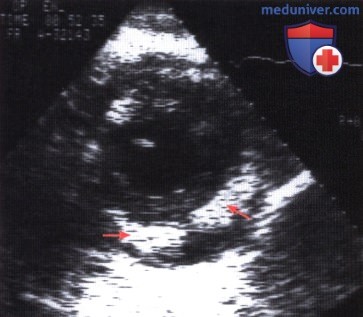
Трансторакальная ЭхоКГ, зарегистрированная из левой парастернальной позиции по короткой оси: опухоль, имеющая неправильные очертания (стрелки) и окруженная жидкостью, скопившейся в полости перикарда.
б) Первичные лимфомы сердца. Первичные лимфомы сердца составляют примерно 5% злокачественных опухолей сердца и относятся к гематологическим новообразованиям этого органа. Локализуются они в основном интраперикардиально. Первичные лимфомы сердца встречаются очень редко и в основном у больных, получающих антидепрессанты после трансплантации органа, и у больных СПИДом. Уточнение локализации опухоли и контроль за лечением осуществляют с помощью ЧПЭ, МРТ и КТ. По своей чувствительности МРТ превосходит ЭхоКГ.
Лейкозные инфильтраты. Лейкозная инфильтрация может распространиться также на сердце. В 37% случаев у больных с острым лейкозом были выявлены лейкозные инфильтраты, легче диагностировать, если они распространяются и на перикард.
в) Метастатическое поражение сердца. Поражение сердца метастазами наблюдается как при раке, так и при саркомах и мезотелиоме. Метастатическое поражение сердца до середины 1990-х годов выявляли лишь у 0,2-6% больных с указанными опухолями. Повышение эффективности лечения первичных опухолей и связанное с этим увеличение продолжительности жизни больных привели к тому, что в настоящее время частота случаев метастатического поражения сердца достигает 10%. Поражение сердца метастазами по данным аутопсий наблюдается у 15% больных с далекозашедшими формами злокачественной опухоли.
1. Пути распространения опухолевого процесса. Вовлечение сердца в опухолевый процесс может происходить путем непосредственного прорастания злокачественной опухоли с соседних органов и тканей, заноса опухолевых клеток лимфогенным и гематогенным путем, а также вдоль полых вен и реже через легочные вены.
- К опухолям, которые могут непосредственно прорастать в сердце, относятся тимома и рак пищевода.
- Гематогенное метастазирование в сердце характерно для таких опухолей, как меланома, саркомы и гипернефромы, в то время как лимфогенное метастазирование в сердце чаще наблюдается при эпителиальных злокачественных опухолях.
- Распространение через нижнюю полую вену (интракавитарный путь метастазирования) характерно для меланомы, опухолей сердца, в том числе опухоли Вильямса, гипернефромы, опухоли мозгового вещества надпочечников, рака печени, миометрия.
2. Клинические симптомы. К симптомам, свидетельствующим о поражении сердца метастазами, относятся затрудненное дыхание, выпот в полости перикарда и в плевральной полости, синдром верхней полой вены, а также нарушение ритма сердца. В 8-32% случаев поражения сердца метастазами причина смерти бывает связана с опухолевой инфильтрацией сердца. Причиной смерти бывают, в частности, тампонада сердца, разрыв сердца, тяжелая сердечная недостаточность, сдавление синусового узла, эмболия коронарных артерий.
3. Локализация. В 20-30% случаев метастазами поражаются правые отделы сердца, в 10-33% случаев - левые отделы, а в 30-35% случаев поражение охватывает все сердце. При бронхогенном раке легкого и при раке молочной железе выявляют преимущественно метастазы в перикард и опухолевую инфильтрацию миокарда, реже наблюдается поражение эндокарда (внутриполостное поражение). У больных с саркомой и меланомой миокард бывает поражен метастазами примерно в половине случаев.
4. Двумерная эхокардиография. Для выявления метастатического поражения сердца выполняют двумерную ЭхоКГ, МРТ или КТ. При ЭхоКГ часто отмечается скопление жидкости в полости перикарда. В перикардиальной жидкости могут быть опухолевые массы, которые делают поверхность сердца неровной, иногда причудливой. Опухолевые массы могут нарушить функцию сдавливаемого ими отдела сердца, что можно выявить при ЭхоКГ. При опухолевой инфильтрации миокард имеет эхогенную зернистую структуру, однако объективно оценить этот признак очень трудно. Эпикард часто оказывается инфильтрированным метастазами. Пораженные опухолью участки миокарда имеют повышенную акустическую плотность и часто гипо- или акинетичны.
г) Карциноиды. Карциноидные опухоли, или карциноиды, содержат много 5-гидроксисеротонина, брадикинина и простагландинов. Карциноиды обычно образуются в желудочно-кишечном тракте, реже они поражают желчные пути, поджелудочную железу, бронхи, яички и яичники. Поражение сердца при карциноидной опухоли отмечается в 20-60% случаев. Клинически такое поражение проявляется, прежде всего, фиброэластозом клапанов правых отделов сердца и развитием клапанной недостаточности. При ЭхоКГ в таких случаях отмечаются утолщение створок трехстворчатого клапана и их ретракция вместе с подклапанными структурами. Поражение трехстворчатого клапана отмечается у 97% больных. При исследовании 74 больных у 88% имелось поражение трехстворчатого клапана, у 49% выявлен стеноз клапана легочной артерии, а у 81% - его недостаточность.
При ЭхоКГ у больных с карциноидным поражением сердца часто отмечалось расширение правого предсердия и правого желудочка. Поражение левых отделов сердца выявляют лишь в 7% случаев. Оно отмечается при карциноиде бронха или при открытом овальном окне. В этих случаях всегда бывают поражены и правые отделы сердца. Изменения в клапанах, связанные с карциноидной инфильтрацией, вызывают нарушение функции правых отделов сердца и, несмотря, в целом, на неблагоприятный прогноз, могут потребовать выполнения хирургического вмешательства. Редко наблюдающиеся метастазы карциноида в сердце выявить с помощью ЭхоКГ довольно легко, если их размер превышает 1 см. Поэтому у больных, у которых диагностирован карциноид, следует исключить метастазы в сердце.
Редактор: Искандер Милевски. Дата публикации: 11.1.2020












Электрокардиографические изменения при метастатических опухолях предсердий
Представлены 2 случая прижизненной диагностики вторичной опухоли левого предсердия при раке легкого и раке пищевода. Поражение миокарда было обусловлено инвазией первичной опухоли. В обоих наблюдениях на электрокардиограмме обнаружена депрессия сегмента PQ (PR), что может отражать опухолевое повреждение предсердия. Предложено рассматривать данный феномен в качестве электрокардиографического маркера вторичной неоплазии предсердий.
Вторичные злокачественные опухоли сердца встречаются значительно чаще первичных — у 0,4—18,3% от общего числа умерших онкологических больных [1—4]. Вероятность метастазирования в миокард наиболее высока при раке легкого, желудка, левой молочной железы, лимфоме [4—6]. Однако прижизненная диагностика вторичных неоплазий сердца затруднена и составляет лишь 8,5—10% от числа находок на аутопсии [4, 7]. Это объясняется преимущественно бессимптомным течением, отсутствием специфических клинических и инструментальных признаков. Вместе с тем в связи с широким использованием компьютерной и магнитно-резонансной томографии, с одной стороны, и увеличением продолжительности жизни больных раком — с другой, частота обнаружения вторичных опухолей сердца в последнее десятилетие увеличилась [3].
Приводим два клинических случая прижизненной диагностики опухолевого поражения миокарда предсердий, которое сопровождалось особыми изменениями на электрокардиограмме (ЭКГ).
Случай 1. Мужчина 49 лет, обратился в клинику в мае 1999 г. При поступлении предъявлял жалобы на умеренную одышку при ходьбе, сердцебиение, колющие длительные боли в области сердца, подъемы артериального давления (АД) до 180/110 мм рт.ст. Хронических заболеваний внутренних органов в анамнезе не отмечал. Курил в течение 20 лет. При аускультации легких справа дыхание везикулярное, слева — жесткое. Тоны сердца приглу шены, ритм правильный. Частота сердечных сокращений 90 уд/мин, АД 175/95 мм рт.ст.
У больного выявлены нормохромная анемия легкой степени, нейтрофильный лейкоцитоз (9,8×109/л), скорость оседания эритроцитов составила 58 мм/ч. На рент-генограмме грудной клетки определена картина центрального рака левого легкого с ателектазом. По данным фибробронхоскопии, левый главный бронх сужен инфильтративной опухолью. Гистологическое строение опухоли — плоскоклеточный рак без ороговения.
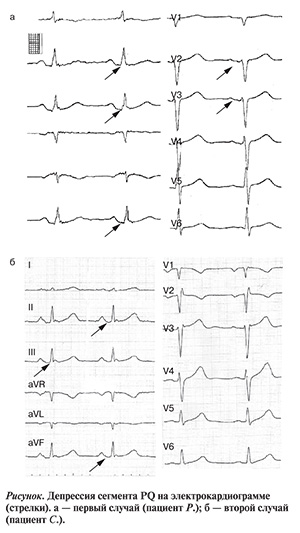
На ЭКГ от 22.05.99 синусовая тахикардия 94 в 1 минуту. Признаки перегрузки правых отделов. В отведениях II, III, aVF, V2—V4 отмечается депрессия сегмента PQ на 0,2 мВ, в aVL — его элевация на 0,1 мВ (см. рисунок, а). В этой связи для исключения перикардита и инфаркта предсердий у больного определена фракция МВ креатинфосфокиназы (КФК-МВ) крови, выполнена эхокардио-графия (ЭхоКГ). Уровень КФК-МВ составил 18 МЕ/л.
Результаты трансторакальной ЭхоКГ от 24.05.99: размер корня аорты 27 мм, левого предсердия — 42 мм, правого желудочка — 16 мм, толщина межжелудочковой перегородки 8 мм, задней стенки левого желудочка — 10 мм, конечный систолический размер – 31 мм, конечный диастолический размер — 51 мм, фракция выброса 69%, ударный объем (по допплер-ЭхоКГ) — 61 мл. Устье одной из легочных вен расширено до 1,7 см и выполнено эхогенной тканью, распространяющейся по задней стенке в полость левого предсердия в виде однородного опухолевидного образования 55×37×48 мм. Отмечено ускорение кровотока в устье пораженной вены до 2 м/с. Заключение: увеличение полости левого предсердия, прорастание опухоли в легочные вены, стенку и полость левого предсердия. На повторной ЭКГ через 4 нед вышеуказанные изменения сохранялись.
На основании имеющихся данных больному выставлен диагноз: рак левого главного бронха (плоскоклеточный неороговевающий) T4N2M0 стадия IIIБ. Ателектаз левого легкого. Прорастание в полость левого предсердия.
Случай 2. Мужчина 48 лет, поступил в клинику в августе 2012 г. с жалобами на затрудненное прохождение твердой пищи, общее недомогание, субфебрилитет, снижение массы тела на 10 кг. Курил 18 лет. Хронических заболеваний не было. Объективно: пациент пониженного питания, дыхание в легких везикулярное, тоны сердца приглушены, ритм правильный, частота сердечных сокращений 85 уд/мин, АД 113/80 мм рт.ст. Живот при пальпации мягкий, умеренно болезненный в эпигастрии. В общем анализе крови лейкоцитоз (9,5×109/л) с палочкоядерным сдвигом (6%). Показатели биохимического исследования крови и общего анализа мочи не изменены.
Данные фиброгастродуоденоскопии: просвет пищевода от 25 до 34 см стенозирован инфильтрирующей опухолью с циркулярным характером роста. В мазке, взятом с опухоли пищевода, цитологическая картина плоскоклеточного рака. Протокол гистологического исследования: в представленном материале строение плоскоклеточной карциномы G3. На мультиспиральной компьютерной томографии визуализируется опухоль средней и нижней трети пищевода с уровня бифуркации трахеи, 7×5 см в поперечнике, протяженностью до 9 см. Левый главный бронх сдавлен и деформирован. Нет жировой прослойки между опухолью и стенкой аорты, перикардом левого предсердия. 3аключение: опухоль пищевода с прорастанием стенки левого главного бронха. Не исключается инвазия стенки аорты и перикарда.
На ЭКГ от 4.09.12 регистрировался синусовый ритм 80 в минуту. Отмечены признаки увеличения обоих предсердий и неполная блокада правой ножки пучка Гиса.
В отведениях II, III, aVF выявлена депрессия сегмента PQ до 0,2 мВ (см. рисунок, б).
Данные трансторакальной ЭхоКГ от 12.09.12: створки аортального и митрального клапанов не изменены, левое предсердие увеличено до 39×60 мм, размер правого желудочка 38 мм, правого предсердия — 40×33 мм, толщина межжелудочковой перегородки 9 мм, задней стенки левого желудочка 9 мм, зон гипо- и акинезии не выявлено. Конечный систолический размер 28 мм, конечный диастолический размер — 43 мм, фракция выброса 64%, ударный объем 53 мл. Расчетное давление в правом желудочке 45 мм рт.ст. В полости левого предсердия визуализируется образование повышенной эхогенности с четкими слабоволнистыми контурами, малоподвижное, с гиперэхогенными включениями 60×37 мм. Заключение: признаки роста опухоли в левое предсердие, расширение левого предсердия, правых отделов сердца. Недостаточность трикуспидального клапана. Легочная гипертензия.
Пациенту выполнена паллиативная резекция пищевода 13.09.12. При ревизии диаметр опухоли достигал 8 см, она проросла через все слои пищевода, интимно прилежала к левому и правому главному бронху, не имела четких границ с адвентицией аорты и перикардом. Выявлены увеличенные параэзофагальные, парааортальные и бифуркационные лимфатические узлы. При гистологическом исследовании подтверждена карцинома пищевода.
Выставлен диагноз: рак среднегрудного отдела пищевода T4N2M1 стадия IV. Метастазы в параэзофагальные, бифуркационные, парааортальные лимфатические узлы. Опухолевый стеноз пищевода. Прорастание в полость левого предсердия.
Особенность представленных нами клинических наблюдений заключается в том, что прорастание опухоли в предсердие проявлялось на ЭКГ депрессией сегмента PQ. В первом случае, зафиксированном у больного раком легкого в 1999 г., депрессия PQ оказалась первым инструментальным признаком поражения сердца, что послужило поводом для дальнейшего обследования. Клинически вторичные опухоли сердца проявляются редко, как правило, в виде застойной сердечной недостаточности. Чаще превалируют симптомы первичной опухоли [8]. В нашем случае пациент ощущал боли в прекордиальной области, однако вряд ли это могло навести врача на мысль об опухолевом генезе кардиалгии ввиду малоспецифичности данного признака и близости первичного очага (рак левого легкого). Опухолевое повреждение не сопровождалось значимым подъемом уровня маркеров некроза миокарда, что подтверждает данные других авторов [9]. Кроме того, отсутствовала динамика выявленных на ЭКГ изменений. Это исключало инфаркт предсердий и перикардит.
Вторая аналогичная находка выявлена в 2012 г. у больного раком пищевода. Кардиалгия и физикальные признаки поражения сердца в данном случае отсутствовали. Однако по результатам ЭхоКГ отмечалась легочная гипертензия, вероятно, обусловленная опухолевым стенозом устья легочных вен. При этом поражение миокарда было верифицировано уже на другом, более современном уровне — с помощью ультразвукового сканера экспертного класса и мультиспиральной компьютерной томографии, а также интраоперационно. В обоих случаях имелась инвазия левого предсердия опухолью, анатомически близко расположенной к сердцу. Поздняя диагностика запущенного рака, к сожалению, не позволила провести радикальное лечение.
По ЭКГ вторичные опухоли сердца практически не диагностируются в силу неспецифичности изменений. Может отмечаться инфарктоподобная картина с элевацией сегмента ST без закономерной для инфаркта миокарда динамики. Обнаруживаются нарушения ритма и проводимости, включая фибрилляцию предсердий [5, 9—11].
Депрессия сегмента PQ (PR) — относительно редкий электрокардиографический феномен. Он встречается при остром фибринозном перикардите и инфаркте предсердий [12]. Таким образом, депрессия PQ отражает нарушение реполяризации предсердий при воспалительном или ишемическом повреждении. В случае вторичного опухолевого поражения смещение PQ, вероятно, указывает на повреждение предсердий при прорастании миокарда опухолью. Следует отметить, что в доступной литературе мы встретили лишь два описания подобных изменений ЭКГ при опухолях сердца: аналогичный нашему случай инвазии миокарда у 61-летнего больного раком легкого [13] и наблюдение 56-летней женщины с доброкачественной фибромой предсердия [14]. Электрокардиографическая картина поражения предсердия при раке пищевода представлена нами впервые. Все это позволяет предположить, что депрессия сегмента PQ (PR) является не случайным феноменом и может рассматриваться как специфичный ЭКГ-маркер неоплазии предсердий.
Читайте также:

